хелвет травматин в форме раствора для инъекций 29 гр
Модель:
RUR 4423
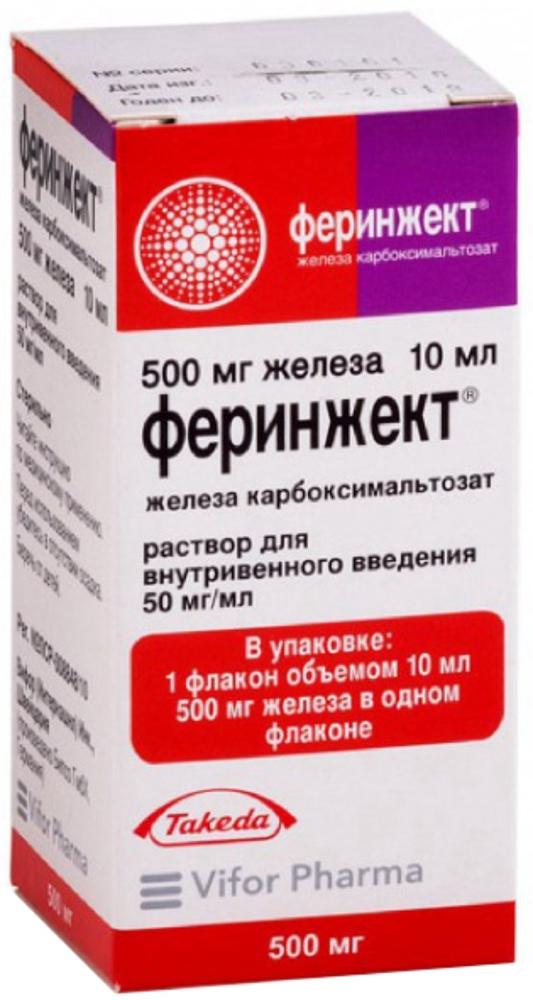
Показания железодефицитная анемия в том случае, когда пероральные препараты железа неэффективны или не могут быть использованы. Диагноз должен быть подтвержден лабораторными исследованиями. Противопоказания Противопоказания повышенная чувствительность к комплексу железа карбоксимальтозата, раствору железа карбоксимальтозата или любому из компонентов препарата; анемии, не связанные с дефицитом железа (например, другая микроцитарная анемия); симптомы перегрузки железом или нарушение утилизации железа; детский возраст до 14 лет. С осторожностью: У пациентов с нарушением функции печени железо можно применять парентерально только после тщательной оценки соотношения пользы и риска. Необходимо избегать парентерального применения железа у пациентов с нарушением функции печени в случае если перегрузка железом может ускорить течение заболевания, в особенности при поздней кожной порфирии. Во избежание перегрузки железом рекомендуется тщательный мониторинг содержания железа. Отсутствуют данные по безопасности применения у пациентов с хроническим заболеванием почек, находящихся на гемодиализе и получающих однократные дозы более 200 мг железа. Необходимо с осторожностью применять железо парентерально при острой и хронической инфекции, бронхиальной астме, экземе и атопической аллергии. Рекомендуется прекратить применение препарата Феринжект® у пациентов с текущей бактериемией. У пациентов с хронической инфекцией необходимо взвесить все риски и преимущества терапии, принимая во внимание угнетенный эритропоэз, вызванный хронической инфекцией. 1 мл препарата содержит до 5.5 мг натрия. Это необходимо учитывать для пациентов, находящихся на диете с ограничением натрия. Применение препарата Феринжект® не исследовалось у детей в возрасте до 14 лет. Беременность Данные по применению препарата при беременности отсутствуют. Применение препарата при беременности возможно только в случаях, когда потенциальная польза терапии для матери превышает риск для плода. Если польза от лечения препаратом Феринжект® меньше потенциального риска для плода, рекомендовано ограничиться терапией во II и III триместрах. Опыт применения препарата в период грудного вскармливания ограничен. Клинические исследования показали, что поступление железа из препарата Феринжект® в грудное молоко незначительно (менее 1%). Основываясь на ограниченных данных по применению у женщин, кормящих грудью, маловероятно, что препарат представляет опасность для детей, находящихся на грудном вскармливании. Применение и дозы Препарат следует вводить в/в (струйно или капельно) и путем прямого введения в венозный участок диализной системы. Перед применением следует осмотреть флаконы на наличие возможного осадка и повреждений. Можно использовать только однородный раствор без осадка. Феринжект® следует применять в отделениях, имеющих необходимое оснащение для оказания неотложной медицинской помощи в случае развития анафилактических реакций. Каждого пациента следует наблюдать на предмет развития признаков или симптомов реакций гиперчувствительности как минимум в течение 30 мин после каждого введения раствора железа карбоксимальтозата. В/в инфузия: Феринжект® можно вводить в/в капельно (инфузионно) в максимальной однократной дозе до 1000 мг железа (максимально до 20 мг железа/кг массы тела). Нельзя вводить в/в капельно (инфузионно) 1000 мг железа (20 мл препарата Феринжект®) более 1 раза в неделю. Непосредственно перед инфузионным введением препарат следует развести стерильным 0.9% раствором натрия хлорида для инъекций в соотношениях, указанных в таблице. Руководство по разведению препарата Феринжект® для инфузии Феринжект® Железо Кол-во стерильного 0.9% раствора натрия хлорида для инъекций Минимальное время введения >2 до 4 мл >100 до 200 мг 50 мл - >4 до 10 мл >200 до 500 мг 100 мл 6 мин >10 до < 20 мл >500 до 1000 мг 250 мл 15 мин Примечание: для сохранения стабильности препарата не разрешается разведение до концентрации менее 2 мг железа/мл. Побочные эффекты и передозировка Побочные эффекты: Передозировка: Симптомы: Феринжект® в количестве, превышающем потребности организма, может вызывать перегрузку железом, которая проявляется симптомами гемосидероза. Определение таких показателей обмена железа как ферритин сыворотки и процент насыщения трансферрина может помочь в диагностике чрезмерного отложения железа в организме. Лечение: если произошла кумуляция железа, необходимо проводить лечение в соответствии со стандартной медицинской практикой, например, можно рассмотреть применение хелатных средств для связывания железа. Взаимодействие с другими ЛС: Также как и любые другие парентеральные препараты железа, Феринжект® уменьшает всасывание железа из ЖКТ при одновременном применении с препаратами железа для приема внутрь. Поэтому, при необходимости, терапию пероральными препаратами железа следует начинать не ранее, чем через 5 дней после последней инъекции препарата Феринжект®. Фармацевтическая совместимость Феринжект® совместим только с 0.9% раствором натрия хлорида. Никакие другие в/в растворы и лекарственные вещества не следует вводить, поскольку существует потенциальный риск выпадения осадка и/или взаимодействия. Фармакологическое действие и фармакокинетика Препарат железа. Феринжект® содержит железо (III) в стабильной форме в виде комплекса железа, состоящего из многоядерного железа-гидроксидного ядра с углеводным лигандом. Из-за высокой стабильности комплекса существует только очень небольшое количество слабо связанного железа (также называемого лабильным или свободным железом). Комплекс создан, чтобы обеспечить контролируемый источник утилизируемого железа для транспортирующих железо и депонирующих железо белков организма (трансферрин и ферритин соответственно). Клинические исследования показали, что гематологический ответ и заполнение депо железа происходит быстрее после в/в введения препарата Феринжект® по сравнению с принимаемыми внутрь аналогами. Утилизация эритроцитами 59. Fe и 52. Fe из радиоактивно меченного препарата Феринжект® варьировала от 61% до 99%. После 24 дней у пациентов с дефицитом железа отмечалась утилизация радиоактивно меченного железа от 91% до 99%, и у пациентов с анемией почечного генеза утилизация радиоактивно меченного железа составляла от 61% до 84%. Фармакокинетика: Распределение Было показано, что 59 Fe и 52 Fe из препарата Феринжект® быстро выводились из крови и переносились в костный мозг, а также депонировались в печени и селезенке. После однократного в/в введения препарата Феринжект® в дозах от 100 мг до 1000 мг железа Cmax сывороточного железа от 37 мкг/мл до 333 мкг/мл достигалась спустя 15 мин-1.21 ч после инъекции соответственно. Vd центральной камеры практически полностью соответствует объему плазмы крови - около 3 л. Выведение После инъекции или инфузии железо быстро выводилось из плазмы. T1/2 составляет 7-12 ч. Среднее время нахождения препарата в организме составляло от 11 до 18 ч. Выведение железа почками практически не наблюдалось Особые указания Препарат не предназначен для в/м или п/к введения. Каждый флакон препарата Феринжект® предназначен только для однократного применения. Каждый флакон препарата Феринжект® предназначен только для однократного применения. Препарат Феринжект® следует назначать только тем пациентам, у которых диагноз анемии подтвержден соответствующими лабораторными данными. При парентеральном введении препаратов железа возможно развитие реакции повышенной чувствительности, включая анафилактоидные реакции, которые могут быть потенциально опасными для жизни, поэтому введение препарата Феринжект® следует производить при наличии средств для проведения сердечно-легочной реанимации. Если во время применения препарата возникают реакции гиперчувствительности или признаки непереносимости, необходимо немедленно прекратить лечение. Также сообщалось о реакциях гиперчувствительности после предшествующих неосложненных введений любых комплексов парентерального железа, в т.ч. железа карбоксимальтозата. Каждого пациента следует наблюдать на предмет развития нежелательных реакций в течение минимум 30 мин после каждого введения раствора железа карбоксимальтозата. Необходимо соблюдать осторожность при в/в введении препарата, чтобы не допустить проникновение препарата в околовенозное пространство, т.к. это может вызвать раздражение кожи и возможное длительное окрашивание тканей в месте введения в коричневый цвет. При проникновении лекарственного препарата в околовенозное пространство следует немедленно прекратить введение препарата. Влияние на способность управлять транспортными средствами: Отсутствуют данные о влиянии препарата на способность управлять транспортными средствами и механизмами. Однако некоторые побочные эффекты (в т.ч. головокружение, обморок, предобморочное состояние) могут влиять на способность к управлению транспортными средствами и механизмами. Пациентам, отмечающим у себя данные побочные эффекты, следует рекомендовать не управлять транспортными средствами и механизмами до полного исчезновения указанных симптомов. Условия хранения и отпуска из аптек Условия хранения:Препарат следует хранить в недоступном для детей месте, в оригинальной упаковке, при температуре не выше 30°C. Не замораживать. Отпуск из аптек: По рецепту Регистрационные данные Торговое название Феринжект® Международное непатентованное название:Железа карбоксимальтозат Форма выпуска:Раствор для в/в введения Состав: АТХ: B03AC Препараты железа для парентерального применения Регистрация: Лекарственное средство Фармгруппа: Антианемическое средство. Железа препарат. Информация предоставлена
Модель:
RUR 774
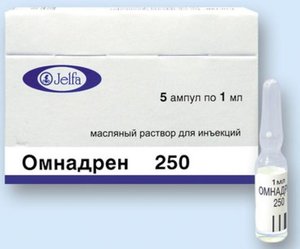
Показания заместительная терапия тестостероном при первичном или вторичном гипогонадизме у мужчин, когда дефицит тестостерона подтверждается клиническими симптомами и лабораторными тестами; позднее созревание; импотенция, вызванная дефицитом тестостерона; посткастрационный синдром; расстройства сперматогенеза. Противопоказания Противопоказания гиперчувствительность к действующим веществам (тестостерону пропионату, тестостерону фенилпропионату, тестостерону изокапроату и тестостерону деканоату) и/или к любому вспомогательному веществу препарата; аллергические реакции на арахис или сою; рак предстательной железы (диагностированный или подозрение на него); рак грудной железы (диагностированный или подозрение на него); возраст до 18 лет (в связи с отсутствием данных по эффективности и безопасности применение тестостерона в данной возрастной группе). С осторожностью: артериальная гипертензия, тромбофилические состояния, тяжелая степень печеночной, хронической почечной и сердечной недостаточности, ИБС (со склонностью к отекам); сахарный диабет, доброкачественная гипертрофия предстательной железы, эпилепсия, мигрень; синдром апноэ в анамнезе, а также такие факторы риска, как ожирение и хронические заболевания легких; возрасте старше 65 лет. Беременность Препарат Омнадрен® 250 не показан для применения у женщин, в связи с чем, его применение в период беременности и грудного вскармливания противопоказано. Применение тестостерона в период беременности может привести к вирилизации плода женского пола. Применение и дозы Препарат вводят в/м глубоко в ягодичную мышцу. Режим дозирования препарата зависит, как правило, от индивидуальной реакции пациента на терапию. Обычно вводят по 1 мл раствора 1 раз (1 инъекция) в 3 недели. Снижение прозрачности маслянистого раствора или появление "иголочек" не означает, что лекарственный препарат не годен. При нагревании ампулы в теплой воде - раствор становится прозрачным. Имеющиеся ограниченные данные не указывают на необходимость коррекции дозы препарата у пациентов пожилого возраста (старше 65 лет). Применение препарата не рекомендуется у детей и подростков в возрасте до 18 лет в связи с отсутствием клинических данных по эффективности и безопасности в данной возрастной группе. Побочные эффекты и передозировка Побочные эффекты:Частота нежелательных реакций была оценена в соответствии с классификацией систем и органов MedDRA следующим образом: очень часто ( 1/10), часто ( 1/100, < 1/10), нечасто ( 1/1000, < 1/100), редко ( 1/10 000, < 1/1000), очень редко (< 1/10 000), неизвестно (частота не может быть определена на основе имеющихся данных). Со стороны половых органов и молочной железы: частота неизвестна - гинекомастия (феминизация), приапизм, олигозооспермия, доброкачественная гиперплазия предстательной железы. Со стороны костно-мышечной системы: частота неизвестна - миалгия. Со стороны кожи и подкожных тканей: частота неизвестна - кожный зуд, акне, алопеция и себорея. Со стороны обмена веществ и питания: частота неизвестна - задержка соли и воды. Со стороны желудочно-кишечного тракта: частота неизвестна - тошнота. Со стороны печени и желчевыводящих путей: частота неизвестна - нарушение функции печени. Со стороны системы кроветворения: частота неизвестна - полицитемия. Со стороны сердечно-сосудистой системы: частота неизвестна - артериальная гипертензия. Нарушения психики: частота неизвестна - депрессия, изменение настроения, изменение либидо. Доброкачественные, злокачественные и не уточненные новообразования (включая кисты и полипы): частота неизвестна - рак предстательной железы. Лабораторные и инструментальные данные: часто - увеличение содержания гемоглобина и гематокрита, количества эритроцитов; частота неизвестна - снижение концентрации ЛПВП, ЛПНП и триглицеридов, увеличение концентрации ПСА. Общие расстройства и нарушения в месте введения: частота неизвестна - воспаление и боль в месте инъекции. Информирование о подозреваемых побочных реакциях Важно сообщать о подозреваемых побочных реакциях после применения лекарственного препарата. Это позволяет осуществлять постоянный мониторинг баланса пользы и риска, связанных с лекарственным препаратом. Медицинские работники должны сообщать о любых подозрительных побочных явлениях. Передозировка: Острая токсичность тестостерона низкая. Никаких специальных терапевтических мер при передозировке не требуется, за исключением отмены препарата или снижение его дозы. Взаимодействие с другими ЛС: Пероральные антикоагулянты При совместном применении с непрямыми пероральными антикоагулянтами производными кумарина тестостерон может увеличивать их действие, в связи с чем необходим частый мониторинг протромбинового времени и, при необходимости, снижение дозы антикоагулянтов. Инсулин и другие гипогликемические препараты Андрогены могут повышать толерантность к глюкозе и потребность пациента в инсулине или других гипогликемических препаратах, поэтому пациенты с сахарным диабетом должны периодически проводить контроль гликемии на фоне терапии тестостероном. АКТГ, ГКС Сопутствующее введение АКТГ или ГКС может вызвать усиление периферических отеков, особенно у пациентов с заболеваниями печени, сердца или склонностью к образованию отеков. Оксифенбутазон Андрогены увеличивают концентрацию оксифенбутазона при одновременном применении. Индукторы микросомальных ферментов печени Рифампицин, барбитураты, карбамазепин, салицилаты, фенитоин, примидон при одновременном применении могут снижать концентрацию тестостерона в плазме крови, что может потребовать коррекции его дозы. Ингибиторы микросомальных ферментов печени При одновременном применении могут повышать концентрацию тестостерона в плазме крови, что также может потребовать коррекцию его дозы. Андрогены могут снижать концентрацию тироксинсвязывающего глобулина, что в свою очередь приводит к снижению концентрации трийодтиронина (Т4); концентрация же свободного тироксина (Т3) не изменяется. Клинических проявлений дисфункции щитовидной железы не выявлено. Фармакологическое действие и фармакокинетика Омнадрен® 250 представляет собой смесь эфиров тестостерона, аналогичного природному мужскому гормону тестостерону, в масляном растворе. Тестостерон вырабатывается в мужских половых железах, в клетках Лейдига и является основным эндогенным гормоном необходимым для нормального роста и развития мужских половых органов и вторичных половых признаков у мужчин (рост и созревание предстательной железы, семенных пузырьков, полового члена и мошонки, развитие и распределение волос по мужскому типу, расширение гортани, изменение тембра голоса, изменения мускулатуры тела и распределение жира). У взрослых мужчин тестостерон необходим для функционирования яичек и придатка яичка, предстательной железы и семенных пузырьков, а также для поддержания либидо, хорошего самочувствия, эректильной функции. Лечение мужчин с гипогонадизмом препаратом Омнадрен® 250 приводит к клинически значимому повышению концентраций тестостерона, дигидротестостерона, эстрадиола и андростендиона в плазме, а также к снижению концентрации глобулина, связывающего половые гормоны (ГСПГ); концентрации ЛГ и ФСГ восстанавливаются до нормального значения. Лечение препаратом Омнадрен® 250 приводит к уменьшению симптомов дефицита тестостерона. Кроме того, увеличивается минеральная плотность костей и мышечная масса, у пациентов с ожирением происходит снижение массы тела. В процессе лечения нормализуются сексуальные функции, включая эректильную функцию и либидо. При применении препарата снижается концентрация в плазме крови ЛПВП, стимулируется выработка эритропоэтина в почках, повышается содержание гемоглобина и гематокрита, при этом не происходит клинически значимого изменения активности печеночных ферментов и ПСА. Препарат может вызвать увеличение размеров предстательной железы, при этом функциональных изменений не отмечается. У мужчин с гипогонадизмом и сопутствующим сахарным диабетом применение андрогенов улучшает чувствительность к инсулину и/или снижает концентрацию глюкозы в плазме крови. У женщин тестостерон оказывает антагонистическое действие на эстрогены, подавляет гипофизарные гонадотропины, подавляет лактацию. Фармакокинетика: Всасывание Препарат содержит 4 разных эфира тестостерона, каждый из которых имеет разную продолжительность действия. Эти эфиры гидролизуются до тестостерона, как только попадают в общий кровоток. Cmax тестостерона в плазме крови составляет 70 нмоль/л и достигается в течение 24-48 ч после инъекции препарата и возвращается к исходному значению через 21 день после введения препарата Омнадрен® 250. Тестостерона пропионат после инъекции сразу проявляет свое действие, продолжающееся на протяжении 24 ч. Тестостерона изокапроат и тестостерона фенилпропионат начинают оказывать свое действие через 24 ч, которое сохраняется приблизительно 2 недели. Тестостерона деканоат начинает действовать в период, когда прекращается действие тестостерона изокапроата и тестостерона фенилпропионата, и продолжается до 2 недель. Распределение В плазме крови тестостерон приблизительно на 98% связывается со специфической фракцией глобулинов, связывающих тестостерон и эстрадиол. Метаболизм и выведение Тестостерон биотрансформируется в печени до производных 17-кетостероидов, которые после связывания с глюкуроновой или серной кислотой выводятся почками, приблизительно на 90%. В то же время 6% введенной дозы выводится через кишечник в несвязанной форме. Особые указания Препарат Омнадрен® 250 предназначен исключительно для в/м инъекций. В случае болезненной эрекции введение лекарственного препарата следует прекратить. Медицинское обследование Концентрацию тестостерона следует контролировать в начале введения и регулярно во время лечения. Врачи должны корректировать дозу индивидуально, чтобы обеспечить концентрацию тестостерона при нормальной функции гонад. Определение концентрации тестостерона должно быть проведено до начала терапии препаратом, а также 1 раз в 3 месяца в течение первого года терапии, далее - 1 раз в год необходимо проводить пальцевое ректальное исследование предстательной железы и определение концентрации ПСА с целью исключения доброкачественной гиперплазии предстательной железы и субклинического рака предстательной железы. У пациентов, получающих длительную терапию андрогенами, необходимо регулярно контролировать следующие лабораторные параметры: гемоглобин и гематокрит, тесты функции печени и липидный профиль. Новообразования У пациентов с раком грудной железы и метастазами в кости развивается гиперкальциемия либо спонтанно (на фоне злокачественного новообразования), либо на фоне терапии андрогенами/анаболическими стероидами. У таких пациентов рекомендуется регулярный контроль концентрации кальция в плазме крови. В случае выявления гиперкальциемии введение тестостерона следует прекратить и провести соответствующее лечение. Терапия тестостероном может быть продолжена только после восстановления нормальной концентрации кальция в плазме крови. Тяжелая степень печеночной, хронической почечной и сердечной недостаточности, ИБС Лечение тестостероном может вызывать задержку натрия и воды в организме. В случае развития у таких пациентов серьезных осложнений, характеризующихся периферическими отеками при наличии или отсутствии хронической сердечной недостаточности, требуется прекращение терапии тестостероном. Артериальная гипертензия Тестостерон может вызвать повышение АД, поэтому препарат Омнадрен® 250 следует применять с осторожностью у пациентов с артериальной гипертензией. Нарушение свертываемости крови Следует проявлять осторожность при применении тестостерона у пациентов с тромбофилией, поскольку анализ пострегистрационных исследований показал наличие случаев тромбоза у этих пациентов во время лечения тестостероном. Следует учитывать риск развития кровотечений при в/м введении тестостерона пациентам с врожденными или приобретенными нарушениями свертываемости крови. Пожилые пациенты У пожилых пациентов наблюдается повышенный риск развития гиперплазии или рака предстательной железы. Перед и во время лечения следует проверить состояние предстательной железы и контролировать концентрацию ПСА. Существует ограниченный опыт в области безопасности и эффективности применения препарата Омнадрен® 250 у пациентов старше 65 лет. В настоящее время нет консенсуса относительно соответствующих возрасту рекомендованных показателей уровня тестостерона. Однако следует учитывать, что физиологическая концентрация тестостерона в сыворотке плазмы крови уменьшается с возрастом. Репродуктивная функция Применение препарата Омнадрен® 250 для терапии мужчин, особенно в высоких дозах, может привести к снижению репродуктивной функции, включая олигоспермию. Другие меры предосторожности Применение препарата у пациентов с наличием аллергии на арахис или сою противопоказано. Применение препарата у пациентов с эпилепсией и мигренью должно проводиться под тщательным медицинским наблюдением, т.к. возможно ухудшение течения заболеваний на фоне терапии. У пациентов с апноэ в анамнезе и доброкачественной гипертрофией предстательной железы препарат применяют с осторожностью. В случае развития нежелательных реакций, связанных с тестостероном, терапию препаратом Омнадрен® 250 следует прекратить и возобновить ее с более низкой дозы препарата. Влияние на способность управлять транспортными средствами: Применение препарата Омнадрен® 250 не оказывает влияния на способность к управлению транспортными средствами и механизмами. Условия хранения и отпуска из аптек Условия хранения:При температуре не выше 25°С. Хранить в недоступном для детей месте! Отпуск из аптек: По рецепту Регистрационные данные Торговое название Омнадрен® 250 Международное непатентованное название:Тестостерон. Форма выпуска:раствор для внутримышечного введения (масляный) в виде прозрачной, маслянистой жидкости светло-желтого цвета. Состав: 1 мл тестостерона пропионат 30 мг тестостерона фенилпропионат 60 мг тестостерона изокапронат 60 мг тестостерона деканоат 100 мг АТХ: Регистрация: Лекарственное средство Фармгруппа: андроген Информация предоставлена

Модель:
RUR 0
Состав Противопоказания Дозировка Показания к применению Взаимодействие с другими лекарственными средствами Передозировка Фармакологическое действие Беременность и кормление грудью Условия отпуска из аптек Побочные явления Особые указания Условия хранения Способ применения и дозы Информация Состав Активное вещество: Фенилэфрина гидрохлорид 10 мг Вспомогательные вещества: Глицерол безводный 60 мг Вода для инъекций до 1 мл Описание: Прозрачная бесцветная жидкость. Форма выпуска: Раствор для инъекций 10 мг/мл. По 1 мл в ампулы из бесцветного или окрашенного стекла. По 10 ампул в контурной ячейковой упаковке из пленки поливинилхлоридной или полиэтилентерефталатной с пленкой полимерной или фольгой алюминиевой лакированной или без пленки полимерной и фольги алюминиевой лакированной или в форме из картона с ячейками для укладки ампул. По 1 контурной ячейковой упаковке или форме из картона с 10 ампулами или 2 контурные ячейковые упаковки или формы из картона с 5 ампулами вместе с инструкцией по применению и скарификатором ампульным или без скарификатора ампульного в пачке из картона. Противопоказания Повышенная чувствительность к любому из компонентов препарата; заболевания, сопровождающиеся обструкцией выносящего тракта левого желудочка (тяжелый аортальный стеноз, гипертрофическая кардиомиопатия); феохромоцитома; артериальная гипертензия любой степени тяжести; фибрилляция желудочков; дефицит глюкозо-6-фосфатдегидрогеназы; порфирия; тиреотоксикоз; закрытоугольная глаукома; острый инфаркт миокарда; применение одновременно с ингибиторами моноаминооксидазы (МАО) и в течение 14 дней после прекращения терапии ингибиторами МАО; галотановый или циклопропановый наркоз; беременность и период грудного вскармливания; возраст до 18 лет. С осторожностью Ишемическая болезнь сердца (особенно после недавно перенесенного инфаркта миокарда), стенокардия, тромбоз коронарный, брыжеечных и других висцеральных или периферических сосудов, сахарный диабет, легочная гипертензия, желудочковые аритмии, окклюзивные заболевания сосудов: артериальная тромбоэмболия, атеросклероз, облитерирующий тромбангиит (болезнь Бюргера), болезнь Рейно, склонность сосудов к спазмам при отморожении, диабетический эндартериит, дисфункция щитовидной железы, метаболический ацидоз, гиперкапния, гипоксия, пожилой возраст, нарушения функции почек и/или печени, применение у пациентов с заболеваниями предстательной железы, у которых существует повышенный риск задержки мочи. Дозировка 10 мг/мл Показания к применению - Острая артериальная гипотензия. - Сосудистая недостаточность при передозировке вазодилататорами. - Шок (травматический, токсический). - Как вазоконстриктор при проведении местной анестезии. Взаимодействие с другими лекарственными средствами Фенилэфрин снижает антигипертензивный эффект диуретиков и гипотензивных средств, бета-адреноблокаторов (риск развития артериальной гипертензии и нарушений со стороны сердечно-сосудистой системы). Нейролептики, производные фенотиазида снижают гипертензивный эффект препарата. Ингибиторы МАО, окситоцин, алкалоиды спорыньи, трициклические антидепрессанты, метилфенидат, адреномиметики усиливают прессорный эффект и аритмогенное действие фенилэфрина. Бета-адреноблокаторы уменьшают кардиостимулирующую активность препарата. Применение препарата на фоне предшествующего применения резерпина может вызвать развитие гипертонического криза вследствие истощения запасов катехоламинов в адренергических окончаниях и повышение чувствительности к адреномиметикам. Ингаляционные анестетики (в том числе хлороформ, энфлуран, галотан, изофлуран, метоксифлуран) увеличивают риск возникновения тяжелых предсердных и желудочковых аритмий (в т.ч. фибрилляции желудочков), поскольку резко повышают чувствительность миокарда к симпатомиметикам. Эргометрин, эрготамин, метилэргометрин, окситоцин, доксапрам увеличивают выраженность вазоконстрикторного эффекта. Фенилэфрин снижает антиангинальный эффект нитратов, которые, в свою очередь, могут снижать прессорный эффект препарата и риск возникновения артериальной гипотензии (одновременное применение допускается в зависимости от достижения необходимого терапевтического эффекта). Тиреоидные гормоны увеличивают (взаимно) эффективность препарата и связанный с ним риск возникновения коронарной недостаточности (особенно при коронарном атеросклерозе). Прессорный эффект фенилэфрина гидрохлорида повышается у пациентов, получающих трициклические антидепрессанты. Фенилэфрин при одновременном применении с дигоксином или другими сердечными гликозидами повышает риск развития нарушений сердечного ритма и инфаркта миокарда. Применение препарата во время родов для коррекции артериальной гипотензии на фоне применения средств, стимулирующих родовую деятельность (вазопрессина, эрготамина, эргометрина, метилэргометрина), может стать причиной стойкого повышения АД в послеродовом периоде. Несовместимость: препарат нельзя смешивать с другими лекарственными средствами в одной емкости. Передозировка Симптомы: головная боль, значительное повышение артериального давления, рефлекторная брадикардия, желудочковая экстрасистолия, короткие пароксизмы желудочковой тахикардии, ощущение тяжести в голове и конечностях. При значительной передозировке могут возникать спутанность сознания, галлюцинации и судороги. Лечение: внутривенное введение альфа-адреноблокаторов короткого действия (фентоламин в дозе 5-60 мг внутривенно в течение 10-30 минут) и бета-адреноблокаторов (при нарушениях сердечного ритма). Фармакологическое действие Фармакологическая группа: Альфа-адреномиметик. Фармакодинамика: Фенилэфрин – альфа 1-адреностимулятор, незначительно влияющий на бета-адренорецепторы сердца; не является катехоламином, поскольку содержит лишь одну гидроксильную группу в ароматическом ядре. Вызывает сужение артериол и повышение артериального давления (АД) (с возможной рефлекторной брадикардией), но действует продолжительнее, поскольку меньше склонен к действию катехол-О-метилтрансферазы. Не вызывает увеличения минутного объема крови. После внутривенного введения действие препарата развивается сразу и продолжается в течение 5-20 мин. При подкожном и внутримышечном введении действие препарата начинается через 10-15 мин и продолжается в течение 1-2 ч после введения. Фармакокинетика: После внутримышечного введения быстро всасывается в системный кровоток. Объем распределения после однократного введения составляет 340 л. Связь с белками плазмы крови низкая. Практически полностью метаболизируется в печени моноаминоксидазой (без участия катехол-О-метилтрансферазы). Конечный период полувыведения составляет около 3 часов. Выводится почками в виде метаболитов. Беременность и кормление грудью Адекватных и строго контролируемых исследований применения препарата во время беременности и в период грудного вскармливания не проводилось. У животных на поздних сроках беременности фенилэфрин вызывал задержку роста плода и стимулировал раннее начало родов. Применение препарата во время беременности и в период грудного вскармливания противопоказано. Данные о выделении фенилэфрина в грудное молоко отсутствуют. При необходимости применения препарата в период лактации грудное вскармливание необходимо прекратить. Условия отпуска из аптек Отпускают по рецепту. Побочные явления По данным Всемирной организации здравоохранения нежелательные эффекты классифицированы в соответствии с их частотой развития следующим образом: очень часто (> 10 % назначений); часто (> 1 % и < 10 %); нечасто (> 0,1 % и < 1 %); редко (> 0,01 % и < 0,1 %); очень редко (< 0,01 %); частота неизвестна (недостаточно данных для оценки частоты развития). Со стороны сердечно-сосудистой системы: редко – повышение или снижение артериального давления, ощущение сердцебиения, брадикардия, тахикардия, желудочковые аритмии (особенно при применении в высоких дозах), стенокардия; частота неизвестна – отек легких, остановка сердца. Со стороны центральной нервной системы: очень редко – бессонница, нервозность, тремор, тревога, повышенная возбудимость, спутанность сознания, раздражительность и головная боль, головокружение, кровоизлияние в мозг, парестезия, слабость. Со стороны органа зрения: очень редко – боль в глазах, мидриаз. Со стороны мочевыделительной системы: очень редко – дизурия, задержка мочи. Со стороны пищеварительной системы: часто – тошнота, рвота; частота неизвестна – повышенное слюноотделение. Со стороны дыхательной системы: редко – диспноэ. Аллергические реакции: редко – кожная сыпь, крапивница. Прочие: бледность кожи лица, ощущение покалывания и похолодания конечностей, повышенное потоотделение, гипергликемия. В отдельных случаях возможны некроз и образование струпа при попадании в ткани или при подкожных инъекциях. Особые указания Во время лечения следует контролировать показатели электрокардиограммы, АД, минутного объема крови, кровообращение в конечностях и в месте инъекции. У пациентов с артериальной гипертензией в случае медикаментозного коллапса достаточно поддерживать систолическое АД на уровне, ниже обычного на 30-40 мм рт.ст. Резкое повышение АД, выраженная брадикардия или тахикардия, стойкие нарушения ритма сердца требуют прекращения лечения. Перед началом или во время терапии шока обязательна коррекция гиповолемии, гипоксии, ацидоза и гиперкапнии. Препарат применяют с осторожностью при артериальной гипертензии в малом круге кровообращения, гиповолемии, желудочковой аритмии. В пожилом возрасте снижается количество адренорецепторов, чувствительных к фенилэфрину. Влияние на способность управления транспортными средствами и механизмами В период лечения необходимо воздержаться от управления транспортными средствами и занятий потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций. Условия хранения При температуре не выше 25 °С. Хранить в недоступном для детей месте. Способ применения и дозы Препарат вводят внутривенно, подкожно или внутримышечно. При коллапсе разовая доза при внутривенном введении составляет 0,1-0,5 мл 1 % раствора. При внутривенном введении разовую дозу разводят в 20 мл 5 % раствора декстрозы (глюкозы) или 0,9 % раствора натрия хлорида и вводят струйно медленно. При необходимости (если систолическое АД снижается до 70-80 мм рт.ст.) введение повторяют. Интервал между повторными внутривенными введениями препарата должен составлять не менее 15 минут. Препарат разрешается вводить внутривенно капельно, для чего 1 мл 1 % раствора препарата разводят в 250-500 мл 5 % раствора декстрозы (глюкозы). Начальная скорость введения составляет 180 мкг в минуту; в дальнейшем скорость введения уменьшают до 30-60 мкг в минуту. При внутримышечном и подкожном введении разовая доза составляет 0,3-1,0 мл 1 % раствора препарата. При местной анестезии добавляют по 0,3-0,5 мл 1 % раствора препарата на 10 мл раствора анестетика. После продолжительной внутривенной инфузии дозу препарата необходимо уменьшать постепенно для предотвращения развития синдрома «отмены» (повторного снижения АД). Высшие дозы при внутримышечном и подкожном введении: разовая – 10 мг, суточная – 50 мг. Высшая доза при внутривенном введении: разовая – 5 мг, суточная – 25 мг. Информация Внешний вид товара может отличаться от изображённого на фотографии. Имеются противопоказания. Необходимо ознакомиться с инструкцией или проконсультироваться со специалистом
Модель:
RUR 123
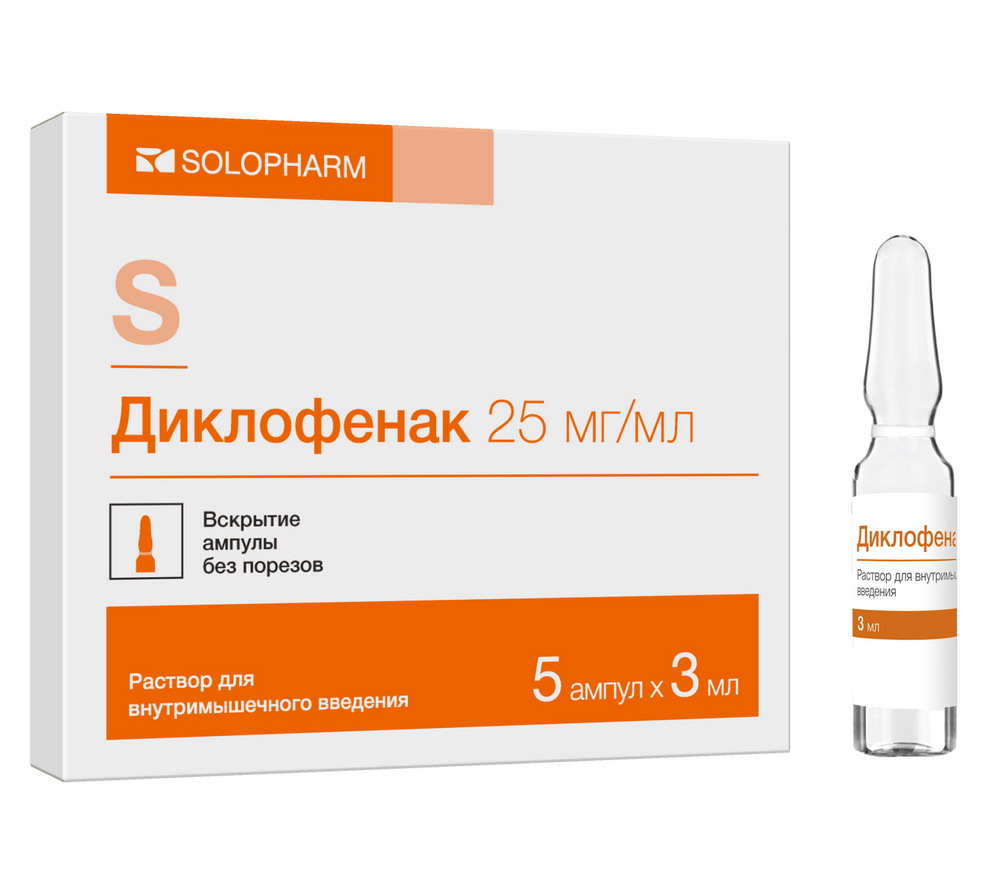
Состав Противопоказания Дозировка Показания к применению Взаимодействие с другими лекарственными средствами Передозировка Фармакологическое действие Беременность и кормление грудью Условия отпуска из аптек Побочные явления Особые указания Условия хранения Способ применения и дозы Информация Состав Активное вещество: 1 мл раствора содержит: Диклофенак натрия – 25 мг. Вспомогательные вещества: Маннитол – 6 мг пропиленгликоль – 200 мг бензиловый спирт – 40 мг натрия дисульфит – 0,6 мг натрия гидроксида раствор 1 М – до рН 7,8-8,8 вода для инъекций – до 1 мл. Описание: Прозрачная бесцветная или со слегка желтоватым оттенком жидкость с легким специфи- ческим запахом. Форма выпуска: Раствор для внутримышечного введения 25 мг/мл. По 3 мл в ампулы из полиэтилена низкой плотности или полипропилена, или в ампулы из бесцветного или окрашенного стекла. По 5 или 10 ампул из полиэтилена низкой плотности или полипропилена вместе с ин- струкцией по применению в пачке из картона. По 5 ампул из стекла в контурной ячейковой упаковке из пленки поливинилхлоридной с пленкой полимерной или с фольгой алюминиевой лакированной, или без пленки поли- мерной и фольги алюминиевой лакированной, или в (предварительно изготовленной) форме из картона с ячейками для укладки ампул. По 1 или 2 контурные ячейковые упаковки или формы из картона с ампулами из стекла вместе с инструкцией по применению и скарификатором ампульным, или без скарифика- тора ампульного в пачке из картона. Противопоказания Гиперчувствительность (в т.ч. к др. НПВП или вспомогательным компонентам), эрозивно- язвенные поражения желудочно-кишечного тракта (в фазе обострения), кровотечения из желудочно-кишечного тракта, воспалительные заболевания кишечника, выраженная пе- ченочная недостаточность, заболевания печени в острый период, выраженная почечная недостаточность (клиренс креатинина менее 30 мл/мин), гиперкалиемия, полный или не- полный синдром непереносимости ацетилсалициловой кислоты (риносинусит, крапивни- ца, полипы слизистой носа, бронхиальная астма, возникающая при приеме ацетилсалици- ловой кислоты или иного НПВП), нарушения кроветворения, нарушения гемостаза (в т.ч. гемофилия), беременность, детский возраст (до 18 лет), период лактации, период после проведения аортокоронарного шунтирования, при повышенном риске возникновения ар- териальных тромбозов и тромбоэмболий, хронической сердечной недостаточности, ише- мической болезни сердца, заболеваниях периферических артерий и цереброваскулярных заболеваниях. С осторожностью Артериальная гипертензия, отечный синдром, заболевания периферических артерий, дислипидемия, сахарный диабет, анемия, бронхиальная астма, дефекты системы гемоста- за, с риском сердечно-сосудистых тромбозов (в т.ч. инфарктов миокарда и инсультов), по- чечная недостаточность (клиренс креатинина 30-60 мл/мин), алкоголизм, эрозивно- язвенные заболевания желудочно-кишечного тракта вне обострения, инфекция Helicobacter pylori, дивертикулит, состояние после обширных хирургических вмешательств, инду- цируемая порфирия, пожилой возраст, курение, тяжелые соматические заболевания, си- стемные заболевания соединительной ткани, длительное использование нестероидных противовоспалительных средств. Следует соблюдать осторожность при применении у пациентов с сезонным аллергическим ринитом, отеком слизистой оболочки полости носа (в т.ч. с носовыми полипами), хрони- ческими инфекционными заболеваниями дыхательных путей (особенно ассоциированные с аллергическими ринитоподобными симптомами). Следует соблюдать особую осторожность при применении диклофенака у пациентов, по- лучающих препараты, увеличивающие риск желудочно-кишечных кровотечений: систем- ные глюкокортикостероиды (в т.ч. преднизолон), антикоагулянты (в т.ч. варфарин), антиа- греганты (в том числе ацетилсалициловая кислота, клопидогрел) или селективные инги- биторы обратного захвата серотонина (в том числе циталопрам, флуоксетин, пароксетин, сертралин). Дозировка 25 мг/мл Показания к применению Для кратковременного лечения болей различного генеза, умеренной интенсивности: заболевания опорно-двигательного аппарата (ревматоидный артрит, псориатиче- ский, ювенильный хронический артрит, анкилозирующий спондилоартрит; подаг- рический артрит, ревматическое поражение мягких тканей, остеоартроз перифери- ческих суставов и позвоночника (в том числе с радикулярным синдромом); люмбаго, ишиас, невралгия; альгодисменорея, воспалительные процессы органов малого таза, в т.ч. аднексит; посттравматический болевой синдром, сопровождающийся воспалением; послеоперационная боль. Препарат предназначен для симптоматической терапии, уменьшения боли и воспаления на момент использования, на прогрессирование заболевания не влияет. Взаимодействие с другими лекарственными средствами Повышает концентрацию в плазме дигоксина, метотрексата, препаратов лития и циклос- порина. Снижает эффект диуретиков, на фоне калийсберегающих диуретиков усиливает риск ги- перкалиемии; на фоне антикоагулянтов, тромболитических средств (алтеплаза, стрепто- киназа, урокиназа) – риск кровотечений (чаще из желудочно-кишечного тракта). Уменьшает эффекты гипотензивных и снотворных средств. Увеличивает вероятность возникновения побочных эффектов других нестероидных про- тивовоспалительных препаратов и глюкокортикостероидных средств (кровотечения в же- лудочно-кишечном тракте), токсичность метотрексата и нефротоксичность циклоспорина. Ацетилсалициловая кислота снижает концентрацию диклофенака в крови. Одновременное использование с парацетамолом повышает риск развития нефротоксиче- ских эффектов диклофенака. Уменьшает эффект гипогликемических средств. Цефамандол, цефоперазон, цефотетан, вальпроевая кислота и пликамицин увеличивают частоту развития гипопротромбинемии. Циклоспорин и препараты золота повышают влияние диклофенака на синтез простоглан- динов в почках, что повышает нефротоксичность. Одновременное назначение с этанолом, колхицином, кортикотропином, селективными ингибиторами обратного захвата серотонина, и препаратами зверобоя повышает риск раз- вития кровотечений в желудочно-кишечном тракте. Диклофенак усиливает действие препаратов, вызывающих фотосенсибилизацию. Препараты, блокирующие канальцевую секрецию, повышают концентрацию в плазме диклофенака, тем самым, повышая его токсичность. Диклофенак оказывает антипростагландиновое действие, поэтому не рекомендуется при- ем диклофенака в течение 8-12 дней после применения мифепристона. Передозировка Симптомы: Рвота, головокружение, головная боль, одышка, помутнение сознания, у детей – миоклонические судороги, тошнота, рвота, абдоминальная боль, кровотечения, нарушения функции печени и почек, угнетение дыхания, кома. Лечение: Симптоматическая терапия, форсированый диурез. Гемодиализ малоэффективен. Фармакологическое действие Фармакологическая группа: Нестероидный противовоспалительный препарат (НПВП). Код АТХ: М01АВ05. Фармакодинамика: Диклофенак обладает противовоспалительным, обезболивающим и жаропонижающим действием. Неизбирательно угнетая циклооксигеназу 1 и 2, нарушает метаболизм арахидоновой кислоты, уменьшает количество простогландинов в очаге воспаления. При рев- матических заболеваниях противовоспалительное и анальгизирующее действие диклофе- нака способствует значительному уменьшению выраженности боли, утренней скованно- сти, припухлости суставов, что улучшает функциональное состояние сустава. При трав- мах, в послеоперационном периоде диклофенак уменьшает болевые ощущения и воспали- тельный отек. Фармакокинетика: Всасывание После внутримышечного введения диклофенака его всасывание начинается немедленно. Максимальная концентрация в плазме (Сmax), среднее значение которой составляет около 2,5 мкг/мл (8 мкмоль/л), достигается примерно через 20 минут. Количество всасывающегося активного вещества находится в линейной зависимости от величины дозы препарата. Величина площади под кривой «концентрация-время» (AUC) после внутримышечного введения диклофенака примерно в 2 раза больше, чем после его перорального или ректального применения, поскольку в последних случаях около половины количества диклофенака метаболизируется при «первом прохождении» через печень. При последующих введениях препарата фармакокинетические показатели не изменяются. При условии соблюдения рекомендуемых интервалов между введениями препарата куму- ляции не отмечается. Распределение Связь с белками сыворотки крови – 99,7 %, преимущественно с альбуминами (99,4 %). Кажущийся объем распределения составляет 0,12-0,17 л/кг. Диклофенак проникает в синовиальную жидкость, где его максимальная концентрация достигается на 2-4 часа позже, чем в плазме крови. Кажущийся период полувыведения (Т1/2) из синовиальной жидкости составляет 3-6 часов. Через 2 часа после достижения мак- симальной концентрации в плазме крови, концентрация диклофенака в синовиальной жидкости выше, чем в плазме, и ее значения остаются более высокими на протяжении пе- риода времени, до 12 часов. Метаболизм Метаболизм диклофенака осуществляется частично путем глюкуронизации неизменной молекулы, но, преимущественно, посредством однократного и многократного гидрокси- лирования и метоксилирования, что приводит к образованию нескольких фенольных ме- таболитов (3-гидрокси, 4-гидрокси, 5-гидрокси, 4,5-дигидрокси- и 3-гидрокси-4- метоксидиклофенака), большинство из которых превращается в глюкуронидные конъюга- 3 ты. Два фенольных метаболита биологически активны, но в значительно меньшей степе- ни, чем диклофенак. В метаболизме препарата принимает участие изофермент CYP2C9. Выведение Общий системный плазменный клиренс диклофенака составляет 263 + 56 мл/мин. Конечный Т1/2 составляет 1-2 часа. Т1/2 4-х метаболитов, включая два фармакологически активных, так же непродолжителен и составляет 1-3 часа. Один из метаболитов, 3- гидрокси-4-метоксидиклофенак, имеет более длительный Т1/2, однако этот метаболит полностью неактивен. Около 60 % дозы препарата выводится через почки в виде глюкуроновых конъюгатов неизменного активного вещества, а также в виде метаболитов, большинство из которых тоже представляют собой глюкуроновые конъюгаты. В неизменном виде выводится менее 1 % диклофенака. Оставшаяся часть дозы препарата выводится в виде метаболитов с жел- чью. Фармакокинетика у отдельных групп пациентов Фармакокинетические параметры диклофенака у пожилых пациентов не изменяются. У пациентов с нарушением функции почек кумуляции неизменного активного вещества не отмечается при соблюдении рекомендованного режима дозирования. При клиренсе креатинина менее 10 мл/мин расчетные равновесные концентрации гидроксиметаболитов диклофенака примерно в 4 раза выше, чем у здоровых добровольцев, при этом метаболи- ты выводятся исключительно с желчью. У пациентов с хроническим гепатитом или компенсированным циррозом печени показа- тели фармакокинетики диклофенака аналогичны таковым у пациентов без заболеваний печени. Диклофенак проникает в грудное молоко. Беременность и кормление грудью Препарат противопоказан во время беременности (см. раздел "Противопоказания"). Ин- формация об использовании препарата Диклофенак во время беременности отсутствует. Диклофенак не следует принимать в период грудного вскармливания (см. раздел "Проти- вопоказания"). Диклофенак проникает в грудное молоко. Условия отпуска из аптек Отпускают по рецепту. Побочные явления Для оценки частоты развития нежелательных реакций диклофенака (различные лекар- ственные формы), использованы следующие градации: «очень часто» > 1/10; «часто» от >1/100 до < 1/10, «нечасто» от >1/1000 до < 1/100, «ред- ко» от >1/10000 до < 1/1000, «очень редко» от < 1/10000, включая отдельные случаи. Со стороны ЖКТ: Часто – эпигастральная боль, тошнота, рвота, диарея, диспепсия, метеоризм, анорексия, повышение активности аминотрансфераз; редко – гастрит, проктит, кровотечение из же- лудочно-кишечного тракта (ЖКТ) (рвота с кровью, мелена, диарея с примесью крови), яз- вы ЖКТ (с или без кровотечения или перфорации), гепатит, желтуха, нарушение функции печени; очень редко – стоматит, глоссит, эзофагит, неспецифический геморрагический колит, обострение язвенного колита или болезни Крона, запор, панкреатит, молниеносный гепатит, гепаторенальный синдром. Со стороны нервной системы: Часто – головная боль, головокружение; редко – сонливость; очень редко – нарушение чувствительности (в том числе парестезия), расстройства памяти, тремор, судороги, тре- вога, цереброваскулярные нарушения, асептический менингит, дезориентация, депрессия, бессонница, «кошмарные» сновидения, раздражительность, психические нарушения. Со стороны органов чувств: Часто – вертиго; очень редко – нарушение зрения (нечеткость зрительного восприятия, диплопиями), нарушения слуха, шум в ушах, нарушение вкусовых ощущений. Со стороны кожных покровов: Часто – кожная сыпь; редко – крапивница; очень редко – буллезные высыпания, эритема, в том числе мультиформная и синдром Стивенса-Джонса, синдром Лайелла, эксфолиатив- ный дерматит, зуд, выпадение волос, фотосенсибилизация, пурпура, в том числе аллерги- ческая. Со стороны мочеполовой системы: Очень редко – острая почечная недостаточность, гематурия, протеинурия, интерстициаль- ный нефрит, нефротический синдром, папиллярный некроз. Со стороны органов кроветворения: Очень редко – тромбоцитопения, лейкопения, гемолитическая и апластическая анемия, агранулоцитоз, эозинофилия. Со стороны дыхательной системы: Редко – бронхиальная астма (включая одышку), кашель, отек гортани; очень редко – пневмонит. Со стороны сердечно-сосудистой системы: Очень редко – сердцебиение, боль в груди, повышение артериального давления, васкулит, сердечная недостаточность, инфаркт миокарда. Аллергические проявления: Редко – анафилактические/анафилактоидные реакции, включая выраженное снижение ар- териального давления и шок; очень редко – ангионевротический отек (в том числе лица). Прочие: Часто – раздражение в месте инъекции; очень редко – абсцесс в месте введения; редко – отеки. Особые указания Для снижения риска развития нежелательных явлений следует использовать минимально эффективную дозу диклофенака минимально возможным коротким курсом. Длительная терапия диклофенаком и терапия с применением высоких доз может привести к возраста- нию риска развития серьезных сердечно-сосудистых тромботических осложнений (вклю- чая инфаркт миокарда и инсульт). Влияние на способность управления транспортными средствами и механизмами: Пациентам, страдающим головокружениями и другими нарушениями со стороны цен- тральной нервной системы, в период лечения следует воздерживаться от вождения и ра- боты с опасными механизмами. Условия хранения При температуре не выше 25 C. Хранить в недоступном для детей месте. Способ применения и дозы Вводится глубоко внутримышечно. Разовая доза для взрослых – 75 мг (1 ампула). При необходимости возможно повторное введение, но не ранее, чем через 12 часов. Длительность использования не более 2 дней, при необходимости далее переходят на пе- роральное, либо ректальное применение диклофенака. Информация Внешний вид товара может отличаться от изображённого на фотографии. Имеются противопоказания. Необходимо ознакомиться с инструкцией или проконсультироваться со специалистом
Модель:
RUR 580
Показания Эндокринные заболевания - Первичная и вторичная надпочечниковая недостаточность (при необходимости в сочетании с минералокортикостероидами, особенно в педиатрической практике). - Острая надпочечниковая недостаточность (может возникнуть необходимость в добавлении минералокортикостероидов). - Шок, являющийся следствием надпочечниковой недостаточности, или шок. при неэффективности симптоматической терапии, когда возможно наличие надпочечниковой недостаточности (если минералокортикостероидное действие нежелательно). - В предоперационном периоде, в случае тяжелой травмы или тяжелого заболевания, у больных с установленной или подозреваемой надпочечниковой недостаточностью. - Врожденная гиперплазия надпочечников. - Подострый тиреоидит. - Гиперкальциемия на фоне онкологического заболевания. 2. Ревматические заболевания (в качестве дополнительной терапии кратковременно для выведения из острого состояния или при обострении) - Посттравматический остеоартрит. - Синовит при остеоартрите. - Ревматоидный артрит, включая ювенильный ревматоидный артрит (в отдельных случаях может потребоваться поддерживающая терапия низкими дозами). - Острый и подострый бурсит. - Эпикондилит. - Острый неспецифический тендосиновит. - Острый подагрический артрит. - Псориатический артрит. - Анкилозирующий спондилоартрит. 3. Системные заболевания соединительной ткани (в период обострения или в отдельных случаях в качестве поддерживающей терапии) - Системная красная волчанка (и волчаночный нефрит)- Острый ревмокардит- Системный дерматомиозит (полимиозит)- Нодозный периартериит- Синдром Гудпасчера.4. Кожные болезни- Пузырчатка- Тяжелая мультиформная эритема (синдром Стивенса-Джонсона)- Эксфолиативный дерматит- Тяжелый псориаз- Герпетиформный буллезный дерматит- Тяжелый себорейный дерматит- Грибовидный микоз.5. Аллергические состоянии (в случае тяжелых или инвалидизирующих состояний, при которых неэффективна обычная терапия)- Бронхиальная астма- Контактный дерматит- Атопический дерматит- Сывороточная болезнь- Сезонные или круглогодичные аллергические риниты- Реакции повышенной чувствительности к лекарственным средствам- Посттрансфузионные реакции типа крапивницы- Острый неинфекционный отек гортани.6. Глазные болезни (тяжелые острые и хронические аллергические и воспалительные процессы с поражением глаз)- Глазная форма Herpes zoster- Ирит и иридоциклит- Хориоретинит- Диффузный задний увеит и хориоидит- Неврит зрительного нерва- Симпатическая офтальмия- Воспаление переднего сегмента- Аллергический конъюнктивит- Аллергические краевые язвы роговицы. - Кератит. 7. Заболевании желудочно-кишечного тракта (для выведения больного из критического состояния)- Язвенный колит- Регионарный энтерит.8. Болезни дыхательных путей- Симптоматический саркоидоз- Бериллиоз- Молниеносный и диссеминированный туберкулез легких в сочетании с соответствующей противотуберкулезной химиотерапией- Синдром Леффлера, не поддающийся терапии другими средствами- Аспирационный пневмонит.9. Гематологические заболевания- Приобретенная (аутоиммунная) гемолитическая анемия- Идиопатическая тромбоцитопеническая пурпура у взрослых (только В/В введение: в/м введение противопоказано)- Вторичная тромбоцитопения у взрослых- Эритробластопения (эритроцитарная анемия)- Врожденная (эритроидная) гипопластическая анемия.10. Онкологические заболевания (в качестве паллиативной терапии)- Лейкозы и лимфомы у взрослых- Острые лейкозы у детей- Для улучшения качества жизни больных с онкологическими заболеваниями в терминальной стадии.11. Отечный синдром- Для стимуляции диуреза и достижения ремиссии протеинурии у больных с нефротическим синдромом без уремии.12. Нервная система- Отек головного мозга, обусловленный опухолью - первичной или метастатической, и/или связанный с хирургической или лучевой терапией- Обострения рассеянного склероза. - Острые травматические повреждения спинного мозга. Лечение следует начинать в первые 8 часов после происшедшей травмы.13. Другие показания к применению- Туберкулезный менингит с субарахноидальным блоком или при угрозе блока (в сочетании с соответствующей противотуберкулезной химиотерапией)- Трихинеллез с поражением нервной системы или миокарда- Трансплантация органов- Профилактика тошноты и рвоты, связанных с химиотерапией по поводу онкологических заболеваний. Применение у детей Применение препарата у детей в период роста возможно только по абсолютным показаниям и при особо тщательном наблюдении лечащего врача. Противопоказания Противопоказания - Системные микозы. - Повышенная чувствительность к любому компоненту препарата в анамнезе. - Введение препарата интратекально. - Введение препарата эпидурально. - Повреждение головного мозга вследствие черепно-мозговой травмы. - Идиопатическая тромбоцитопеническая пурпура (при внутримышечном применении препарата). - Одновременное применение живых или ослабленных вакцин с иммуносупрессивными дозами препарата СОЛУ-МЕДРОЛ. - Период грудного вскармливания. Не рекомендуется применять препарат у больных с острым и подострым инфарктом миокарда, так как применение препарата СОЛУ-МЕДРОЛ у них может привести к распространению очага некроза, замедлению формирования рубцовой ткани и. вследствие этого, к разрыву сердечной мышцы. Данный препарат содержит бензиловый спирт. Установлено, что бензоловый спирт может вызывать "синдром удушья" с летальным исходом у недоношенных новорожденных. Препарат не рекомендуется применять у новорожденных. С осторожностью: Язвенный колит, если существует угроза перфорации, абсцесса или другой гнойной инфекции: дивертикулит: при наличии свежих кишечных анастомозов: активная или латентная пептическая язва, язвенная болезнь желудка и двенадцатиперстной кишки: паразитарные и инфекционные заболевания вирусной, грибковой или бактериальной природы, ветряная оспа, корь, стронгилоидоз, активный или латентный туберкулез, опоясывающий лишай: почечная недостаточность, вторичная недостаточность коры надпочечников: артериальная гипертензия: остеопороз, миастения gravis: гипотиреоз, сахарный диабет: судорожный синдром: аллергические реакции (бронхоспазм) в анамнезе на введение метилпреднизолона: острый психоз: глаукома: у пациентов с тромбоэмболическими осложнениями в настоящее время или имеющих предрасположенность к развитию этих осложнений. Следует избегать применения препарата у пациентов с болезнью Иценко-Кушинга. У пациентов с хронической сердечной недостаточностью СОЛУ-МЕДРОЛ следует применять с осторожностью и только в случае абсолютной необходимости. У пациентов с поражением глаз, вызванным вирусом простого герпеса. СОЛУ-МЕДРОЛ также следует применять с осторожностью, поскольку это может привести к перфорации роговицы. Препарат следует применять с осторожностью у пожилых пациентов в связи с повышенной опасностью развития остеопороза и артериальной гипертензии. У детей (особенно в случае длительной терапии) препарат СОЛУ-МЕДРОЛ необходимо применять с осторожностью. Беременность В ряде исследований на животных показано, что введение высоких доз метилпреднизолона самкам может приводить к возникновению пороков развития у плода. Однако, в ряде клинических исследований показано, что применение метилпреднизолона во время беременности, по-видимому, не вызывает врожденных аномалий. Так как адекватные исследования применения метилпреднизолона натрия сукцината у человека не проводились, этот препарат следует применять во время беременности только после тщательной оценки соотношения польза-риск для матери и плода. В случае отмены препарата во время беременности после длительной терапии необходимо постепенно снизить дозу. Метилпреднизолон легко проникает через плаценту. В одном ретроспективном исследовании выявлено увеличение случаев рождения детей с низкой массой тела у матерей, получавших метилпреднизолон. Риск рождения детей с низкой массой тела у людей зависит от дозы препарата и может быть минимизирован с помощью снижения дозы. Дети, рожденные от матерей, которые получали высокие дозы препарата СОЛУ-МЕДРОЛ во время беременности, должны тщательно обследоваться с целью выявления возможных симптомов гипофункции надпочечников. Хотя надпочечниковая недостаточность редко встречается у новорожденных, матери которых получали ГКС во время беременности. Влияние метилпреднизолона на течение и исход родов неизвестно. Отмечались случаи развития катаракты у новорожденных, матери которых принимали метилпреднизолон во время беременности. Метилпреднизолон проникает в грудное молоко в количествах, которые могут вызвать задержку роста и взаимодействие с эндогенными ГКС, поэтому при необходимости назначения препарата СОЛУ-МЕДРОЛ в период грудного вскармливания кормление грудью следует прекратить. Бензиловый спирт, применяемый в качестве растворителя, проникает через плаценту. Применение и дозы СОЛУ-МЕДРОЛ можно вводить в виде в/в или в/м инъекции или в виде в/в инфузии, но при неотложных состояниях начинать лечение предпочтительно с в/в инъекции. Детям следует вводить более низкие дозы (но не менее 0,5 мг/кг/сутки), однако при выборе дозы в первую очередь учитывают тяжесть состояния и реакцию больного на терапию, а не возраст и массу тела. В КАЧЕСТВЕ ДОПОЛНИТЕЛЬНОЙ ТЕРАПИИ ПРИ УГРОЖАЮЩИХ ЖИЗНИ СОСТОЯНИЯХ 30 мг/кг массы тела в/в в течение не менее 30 мни. Введение этой дозы можно повторять каждые 4-6 ч в течение не более 48 ч. ПУЛЬС-ТЕРАПИЯ при лечении заболеваний, при которых эффективна кортикостероидная терапия, при обострениях заболевания и/или при неэффективности стандартной терапии. ТАБЛИЦЪ Указанные выше дозы следует вводить в течение не менее 30 мин, и введение можно повторить, если в течение недели после проведения лечения не было достигнуто улучшения, или если этого требует состояние больного. ОНКОЛОГИЧЕСКИЕ ЗАБОЛЕВАНИЯ В ТЕРМИНАЛЬНОЙ СТАДИИ - ДЛЯ УЛУЧШЕНИЯ КАЧЕСТВА ЖИЗНИ 125 мг/сут в/в ежедневно в течение до 8 недель. ПРОФИЛАКТИКА ТОШНОТЫ И РВОТЫ, СВЯЗАННЫХ С ХИМИОТЕРАПИЕЙ ПО ПОВОДУ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ При химиотерапии препаратами, обладающими незначительным или средневыраженным рвотным действием, вводят 250 мг в/в в течение не менее 5 мин за один час до введения химиотерапевтического препарата, в начале химиотерапии, а также после се окончания. Для усиления эффекта с первой дозой препарата СОЛУ-МЕДРОЛ можно вводить препараты хлорфенотиазина. При химиотерапии препаратами, обладающими выраженным рвотным действием, вводят 250 мг в/в в течение не менее 5 мин в сочетании с соответствующими дозами метоклопрамида или бутирофенона за один час до введения химиотерапевтического препарата, затем по 250 мг в/в в начале химиотерапии и после ее окончания. ОСТРЫЕ ТРАВМАТИЧЕСКИЕ ПОВРЕЖДЕНИЯ СПИННОГО МОЗГА Лечение необходимо начинить в первые 8 час после травмы. Рекомендуется в/в болюсное введение в течение 15 мин 30 мг/кг массы тела, затем сделать перерыв на 45 мин, а потом проводить непрерывную инфузию в дозе 5,4 мг/кг/ч в течение 23 ч (если лечение начато в первые 3 ч после травмы) или 47 ч (если лечение начато в первые 3-8 ч после травмы). Препарат следует вводить при помощи инфузионного насоса в изолированную вену. ПРИ ДРУГИХ ПОКАЗАНИЯХ начальная доза составляет 10 - 500 мг в/в в зависимости от характера заболевания. Для краткого курса при тяжелых острых состояниях могут потребоваться более высокие дозы. Начальную дозу, не превышающую 250 мг, следует вводить в/в в течение не менее 5 мин, дозы свыше 250 мг вводят в течение не менее 30 мин. Последующие дозы вводят в/в или в/.м. при этом длительность интервалов между введениями зависит от реакции больного на терапию и от его клинического состояния. ПРИГОТОВЛЕНИЕ РАСТВОРОВ Препараты для парентерального введения по возможности следует проверять визуально на предмет изменения цвета или появления частиц.а) Двухъемкостный Флакон Act-0-Vial 1. Нажмите на пластиковый активатор, чтобы растворитель перелился в нижнюю емкость.2. Осторожно покачивайте флакон до тех пор, пока лиофилизат не растворится.3. Удалите пластиковый диск, прикрывающий центр пробки.4. Обработайте поверхность пробки антисептиком.5. Проколите иглой центр пробки так, чтобы был виден кончик иглы. Переверните флакон и отберите шприцем необходимое количество раствора.б) ФлаконС соблюдением асептики введите растворитель во флакон с лиофилизатом. Используйте только специальный растворитель.в) Приготовление растворов для внутривенной инфузии Приготовьте раствор, как указано выше. Препарат может быть также введен в виде разведенных растворов, полученных путем смешивания исходного раствора препарата с 5 % водным раствором декстрозы, с физиологическим раствором, е 5 % раствором декстрозы в 0,45 % или 0,9 % растворе хлорида натрия. Приготовленные растворы физически и химически стабильны в течение 48 час. Побочные эффекты и передозировка Побочные эффекты: Следующие нежелательные реакции были отмечены при введении препарата СОЛУ-МЕДРОЛ способами, которые противопоказаны(интратекальное/эпидуральное): арахноидит, нарушении функции желудочно-кишечного тракта/мочевого пузыря, головная боль, менингит, парапарез/параплегия, судороги, нарушения чувствительности. Нарушения со стороны водно-электролитного обмена: задержка натрия, задержка жидкости, повышенное выведение калия, гипокалиемический алкалоз. Нарушения со стороны крови и лимфатической системы: лейкоцитоз. Нарушения со стороны сердечно-сосудистой системы: повышение или снижение артериального давления: нарушения ритма сердца(аритмии, брадикардия, тахикардия): хроническая сердечная недостаточность (у пациентов с предрасположенностью): отек легких: гипертрофическая кардиомиопатия у недоношенных детей: обморок: тромбоз, тромбоэмболия (в том числе тромбоэмболия легочной артерии): васкулит: тромбофлебит: у больных с острым и подострым инфарктом миокарда - распространение очага некроза, замедление формирования рубцовой ткани, что может привести к разрыву сердечной мышцы. Имеются сообщения о нарушениях ритма сердца и/или развитии циркуляторного коллапса, и/или об остановке сердца после быстрого в/в введения высоких доз метилпреднизолона (более 0,5 г, введенных в течение менее 10 мин). Во время и после в/в введения высоких доз метилпреднизолона также отмечались случаи брадикардии, однако они необязательно зависели от скорости или длительности инфузии. Нарушения со стороны опорно-двигательного аппарата: остеонекроз, миопатия, мышечная слабость, остеопороз, патологические переломы, мышечная атрофия, нейропатическая артропатия, артралгия, миалгия, компрессионные переломы позвонков, асептический некроз эпифизов трубчатых костей, разрывы сухожилий, в особенности Ахиллова сухожилия. Нарушения со стороны желудочно-кишечного тракта: пептическая язва свозможным прободением и кровотечением, желудочное кровотечение, панкреатит, эзофагит (в том числе, язвенный), перфорация стенки кишечника, боль в животе, напряжение брюшной стенки, диарея, диспепсия, метеоризм, тошнота, рвота, упорная икота. Нарушения со стороны печени и желчевыводящих путей: гепатит*, повышение активности аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (ACT) и щелочной фосфатазы в плазме крови. Обычно эти изменения незначительны, не связаны с какими-либо клиническими синдромами и обратимы после прекращения лечения. Нарушения со стороны кожных покровов: ангионевротический отек, атрофия кожи, стрии, петехии и экхимозы, снижение пигментации кожи, гиперпигментация, гирсутизм, сыпь, эритема, кожный зуд, крапивница, акне, медленное заживление ран, реакции в месте введения, истончение волос на голове, аллергический дерматит. Нарушения со стороны обмена веществ: метаболический ацидоз, повышение аппетита (может привести к повышению массы тела), повышенное потоотделение, проявление латентного сахарного диабета, гипокалиемия. Нарушения со стороны нервной системы: эпидуральный липоматоз, повышение внутричерепного давления с отеком диска зрительного нерва (доброкачественная внутричерепная гипертензия), судороги, парестезии, амнезия, головокружение, головная боль, вертиго. Нарушения со стороны психики: расстройства мышления, аффективные расстройства (включая, лабильность настроения, депрессивное настроение, состояние эйфории, лекарственная зависимость, суицидальное мышление): психотические нарушения (включая, манию, делюзии, галлюцинации, шизофрению или ее обострение), спутанность сознания, нарушение психики, тревога, изменение личности, быстрая смена настроения, неадекватное поведение, бессонница, раздражительность. Нарушения со стороны эндокринной системы:нарушения менструального цикла, синдром Иценко-Кушинга, гипопитуитаризм, развитие синдрома "отмены" ГКС, снижение толерантности к глюкозе, повышение потребности в инсулине или пероральных гипогликемических препаратах у пациентов с сахарным диабетом, задержка роста и процесса окостенения у детей(преждевременное закрытие эпифизарных зон роста), липоматоз. Лабораторные показатели: повышение концентрации мочевины в плазме крови, дислипидемия, повышение концентрации кальция в моче, гипокальциемия. Нарушения со стороны органа зрения: хориоретинопатия, задняя субкапсулярная катаракта, повышение внутриглазного давления, глаукома, экзофтальм, вторичная грибковая или вирусная глазная инфекция, перфорация роговицы (при глазных проявлениях простого герпеса). Инфекционные и паразитарные заболевания: инфекционные заболевания, возникновение инфекций, вызванных условно-патогенными возбудителями, перитонит*. Нарушения со стороны иммунной системы: реакцииповышенной чувствительности(анафилактическая реакция, включая анафилаксию с наличием или без сосудистого коллапса, остановки сердца, бронхоспазма: анафилактоидная реакция), подавление реакций при проведении кожных проб. Прочие: периферические отеки, повышенная утомляемость, слабость, жжение и покалывание (особенно в области промежности после внутривенного введения), "стерильный абсцесс", увеличение или уменьшение подвижности и количества сперматозоидов. Сообщается, что у больных, получавших терапию метилпреднизолоном, отмечалась саркома Капоши. При отмене метилпреднизолона может наступить клиническая ремиссия. Имеются сообщения о развитии гепатита на фоне внутривенного введения препарата. Основным и тяжелым осложнением при заболеваниях органов ЖКТ (перфорации стенок желудка и кишечника, панкреатите) является перитонит (см. раздел "Особые указания"). Передозировка: Клинический синдром острой передозировки метилпреднизолоном не описан. Сообщения о случаях острой токсичности при передозировке метилпреднизолоном крайне редки. При хронической передозировке метилпреднизолоном могут наблюдаться симптомы синдрома Иценко-Кушинга. Специфического антидота не существует. Лечение симптоматическое. Метилпреднизолон выводится при диализе. Взаимодействие с другими ЛС**: Совместимость и стабильность растворов метилпреднизолона при в/в введении с другими лекарственными средствами, входящими в состав смесей для в/в введения, зависят от pH, концентрации, времени, температуры, а также от растворимости самого метилпреднизолона. Метилпреднизолон рекомендуется по возможности вводить отдельно от других лекарственных средств, в виде в/в болюсных инъекций, в/в капельной инфузии, или через дополнительную капельницу как второй раствор. Ингибиторы изофермента CYP3A4 - могут подавлять метаболизм метилпреднизолона, снижать сто клиренс и повышать концентрацию в плазме крови. В этом случае, чтобы избежать явлений передозировки, следует титровать дозу метилпреднизолона. Индукторы изофермента CYP3A4 - могут увеличивать клиренс метилпреднизолона. Это проявляется снижением концентрации метилпреднизолона в плазме крови, что может потребовать повышения дозы препарата для получения желаемого эффекта. Субстраты изофермента CYP3A4 - в присутствии другого субстрата изофермента CYP3A4 клиренс метилпреднизолона может меняться, что может потребовать соответствующей коррекции дозы метилпреднизолона. Существует вероятность того, что побочные явления, проявляющиеся при применении препаратов в виде монотерапии, могут возникать чаще при одновременном применении препаратов. Приведенные ниже примеры взаимодействия лекарственных средств могут иметь важное клиническое значение.ТАБЛИЦЪ Возможно подавление реакций при проведении кожных проб при применении препарата СОЛУ-МЕДРОЛ. Имеется риск развития артимий у пациентов на фоне гипокалиемии, принимающих сердечные гликозиды. Несовместимость Препараты, несовместимые с метилпреднизолоном в растворе, включают следующие: аллопуринол натрия, доксапрама гидрохлорид, тигециклин, дилтиазема гидрохлорид, глюконат кальция, векурония бромид, рокурония бромид, цизатракуриум бесилат, гликопирролат, пропофол. Фармакологическое действие и фармакокинетика Метилпреднизолои проникает через клеточные мембраны и образует комплексы со специфическими цитоплазматическими рецепторами. Затем эти комплексы проникают в клеточное ядро, связываются с ДНК (хроматином) и стимулируют транскрипцию мРНК и последующий синтез различных ферментов, чем и объясняется эффект метилпреднизолона при системном применении. Метилпредиизолон не только оказывает существенное воздействие на воспалительный процесс и иммунный ответ, но также влияет на углеводный, белковый и жировой обмен. Кроме того, он влияет на сердечнососудистую систему, скелетные мышцы и центральную нервную систему. Большинство показаний к применению метилпреднизолона обусловлено его противовоспалительными, иммунодепрессивными и противоаллергическими свойствами. Благодаря этим свойствам достигаются следующие терапевтические эффекты: - уменьшение количества иммуноактивных клеток вблизи очага воспаления: - уменьшение вазодилатации: - стабилизация лизосомальных мембран: - ингибирование фагоцитоза- уменьшение продукции простагландинов и родственных им соединений. Метилпредиизолон обладает сильным противовоспалительным действием, причем его активность превышает таковую преднизолона. а способность вызывать задержку воды и ионов натрия понижена по сравнению с преднизолоном. Метаболизм и механизм противовоспалительного действия метилпреднизолона натрия сукцината сходны с таковыми для метилпреднизолона. При парентеральном введении эквивалентных количеств биологическая активность обоих соединений одинакова. При в/в введении соотношение активности метилпреднизолона натрия сукцината и гидрокортизона натрия сукцината, рассчитанное по уменьшению числа эозинофилов, составляет не менее 4:1. Это хорошо коррелирует е данными но относительной активности метилпреднизолона и гидрокортизона при пероральном введении. Доза в 4 мг метилпреднизолона оказывает такое же глюкокортикостероидное (противовоспалительное) действие, как и 20 мг гидрокортизона. Метилпредиизолон обладает лишь незначительной минералокортикостероидной активностью (200 мг метилпреднизолона эквивалентны 1 мг дезоксикортикостерона). Метилпреднизолон обладает липолитической активностью, преимущественно распространяющейся па жировую клетчатку конечностей. Кроме того, метилпреднизолон проявляет липогенный эффект, который больше всего затрагивает область грудной клетки, шеи и головы. Все это приводит к перераспределению жирового депо в организме пациента. Метилпреднизолон оказывает катаболичсекос действие в отношении белков. Высвобождающиеся аминокислоты превращаются в процессе глюконеогенеза в печени в глюкозу и гликоген. Потребление глюкозы в периферических тканях снижается, что может привести к гипергликемии и глюкозурин, особенно у больных е риском развития сахарного диабета. Максимальная фармакологическая активность метилпреднизолона проявляется не на пике концентрации в плазме крови, а уже после него, следовательно, действие метилпреднизолона обусловлено в первую очередь его влиянием на активность ферментов. Фармакокинетика: При любом способе введения метилпреднизолона натрия сукцинат в значительной степени и быстро гидролизуется под действием холинэстераз с образованием активной формы - свободного метилпреднизолона. После в/в инфузии 30 мг/кг в течение 20 мин, или 1 г в течение 30-60 мин примерно через 15 мин достигается ник концентрации метилпреднизолона в плазме крови (около 20 мкг/мл). Спустя примерно 25 мин после в/в болюсного введения 40 мг метилпреднизолона достигается инк его концентрации в плазме крови, равный 42-47 мкг/100 мл. При в/м введении 40 мг через 120 мин достигается концентрация метилпреднизолона в плазме крови, равная 34 мкг/100 мл. При в/м введении достигается более низкое пиковое значение, чем при в/в введении. Средняя максимальная концентрация в плазме крови (Сmах) достигается через 1 ч после в/м введения 40 мг метилпреднизолона натрия сукцината и составляет 454 нг/мл. Через 12 ч концентрация метилпреднизолона в плазме крови снижается до 31,9 нг/мл, а через 18 ч - метилпреднизолон в крови не обнаруживается. Сравнение площадей под кривой "концентрация-время" указывает на одинаковую эффективность действия при в/в и в/м введении эквивалентных доз метилпреднизолона натрия сукцината. После в/м введения препарат присутствует в плазме крови в течение более длительного периода, чем после в/в введения, если введено эквивалентное количество метилпреднизолона. Принимая во внимание механизм действия метилпреднизолона, можно считать, что эти различия имеют минимальное клиническое значение. Клинический эффект обычно наблюдается через 4-6 ч после введения. При лечении бронхиальной астмы первые положительные результаты выявляются уже через 1-2 ч. Фармакотерапевтическое действие сохраняется даже тогда, когда концентрация метилпреднизолона в плазме крови уже не определяется. Длительность противовоспалительной активности метилпреднизолона примерно равна длительности подавления гипоталамо-гипофизарно-надпочечниковой (ГГН) системы. Распределение. Метилпреднизолон активно распределяется в ткани организма, проходит через гематоэнцефалический барьер и выделяется в грудное молоко. Объем распределения равен приблизительно 1,4 мл/кг. Связь метилпреднизолона с белками плазмы крови (альбумином и кортикостероид-связывающим глобулином) - примерно 40 - 90 %. Метаболизм метилпреднизолона осуществляется в печени, преимущественно с помощью изофермента CYP3A4. и этот процесс качественно сходен с метаболизмом кортизола. Основными метаболитами являются 20β-гидроксиметилпреднизолон и 20β-гидрокси-6ɑ-метилпреднизолон. Как и многие другие субстраты изофермента CYP3A4, метилпреднизолон может также являться субстратом АТФ-связанных транспортных белков Р-гликопротеина, влияющих на распределение в тканях и взаимодействие с другими лекарственными средствами. Метилпреднизолон является субстратом изофермента CYP3A4. Изофермент CYP3A4 является основным изоферментом в наиболее распространенном подсемействе изоферментов CYP в печени взрослого человека. Этот изофермент катализирует бета-гидроксилирование стероидов - основной этап 1 фазы метаболизма как эндогенных, так и синтетических ГКС. Многие другие соединения также являются субстратами изофермента CYP3A4, некоторые из них (также как и другие препараты) влияют на метаболизм метилпреднизолона с помощью индукции или ингибирования изофермента CYP3A4 (см. раздел "Взаимодействие с другими лекарственными средствами"). Выведение. Период полувыведения (Т1/2) метилпреднизолона натрия сукцината из плазмы крови составляет 2,3-4 ч и, вероятно, не зависит от пути введения. Общий клиренс 5-6 мл/мин/кг. Метилпреднизолон - ГКС с промежуточной продолжительностью действия. Его Т1/2 из организма человека составляет 12-36 ч. За счет внутриклеточной активности выявляется выраженное различие между Т1/2 метилпреднизолона из плазмы крови и Т1/2 из организма в целом. Метаболиты выводятся в основном почками, как в несвязанной форме, гак и в форме глюкуронидов и сульфатов, которые образуются преимущественно в печени и частично - в почках. После в/в введения метилпреднизолона, меченного углеродом 14С, 75 % общей радиоактивности выводится почками в течение 96 ч, 9 % выводится через кишечник в течение 5 дней и 20 % обнаруживается в желчи. Особые указания Поскольку осложнения терапии препаратом СОЛУ-МЕДРОЛ зависят от величины дозы и длительности лечения, то в каждом конкретном случае на основании анализа соотношения риск/польза принимают решение о необходимости такого лечения, а также определяют длительность лечения и частоту приема- С целью лучшего контроля состояния пациента следует применять наименьшую дозу препарата СОЛУ-МЕДРОЛ . При достижении эффекта при возможности следует постепенно уменьшить дозу до поддерживающей или прекратить лечение- В виду опасности развития аритмии, применение препарата СОЛУ-МЕДРОЛ в высоких дозах следует проводить в условиях стационара, оснащенного необходимым оборудованием (электрокардиографом, дефибриллятором)- При наступлении длительной спонтанной ремиссии лечение следует прекратить- При длительном лечении пациенту следует проходить регулярное обследование (рентгенография органов грудной клетки, концентрация глюкозы в плазме крови через 2 часа после еды, общий анализ мочи, артериальное давление, контроль массы тела, желательно проведение рентгенологического или эндоскопического обследования при наличии в анамнезе язвенных заболеваний желудочно-кишечного тракта)- Следует тщательно контролировать рост и развитие детей, находящихся на длительной терапии препаратом СОЛУ-МЕДРОЛ. Задержка роста может наблюдаться у детей, получающих длительную ежедневную, разделенную на несколько доз, терапию. Длительное ежедневное применение препарата у детей возможно только по абсолютным показаниям. Применение препарата через день может уменьшить риск развития данного побочного эффекта или позволит избежать его вовсе- Дети, получающие длительную терапию препаратом СОЛУ-МЕДРОЛ, находятся в группе повышенного риска развития внутричерепной гипертензии- Применение высоких доз метилпреднизолона может приводить к развитию панкреатита у детей- Лекарственно-индуцированное поражение печени (например, острый гепатит) может быть результатом внутривенной пульс-терапии метилпреднизолоном (обычно в дозе 1 мг/сут). Первые признаки острого гепатита могут развиться через несколько недель или позднее. Разрешение данного нежелательного явления отмечалось после отмены терапии- Больные, получающие препараты, подавляющие иммунную систему более восприимчивы к инфекциям, чем здоровые лица. Например, ветряная оспа и корь могут иметь более тяжелое течение, вплоть до летального исхода, у неиммунизированных детей или у взрослых, получающих препарат СОЛУ-МЕДРОЛ- Хотя контролируемые клинические исследования показали, что метилпреднизолон эффективно ускоряет процесс выздоровления при обострении рассеянного склероза, не установлено, что метилпреднизолон влияет на исход и на патогенез данного заболевания. Исследования также показали, что для достижения значимого эффекта необходимо вводить достаточно высокие дозы метилпреднизолона- Сообщалось о случаях развития тяжелых осложнений при введении метилпреднизолона интратекально или эпидурально- Имеются сообщения о развитии эпидурального липоматоза у пациентов, получающих метилпреднизолон. Обычно при длительной терапии высокими дозами- В связи с тем, что выявлено увеличение летальности через 2 недели или 6 месяцев после травмы головного мозга у пациентов, которым проводилась терапия метилпреднизолоном, по сравнению с плацебо, системные ГКС, в том числе препарат СОЛУ-МЕДРОЛ, не показаны и не должны применяться для лечения повреждения головного мозга, обусловленного травмой. Причинная связь летальных исходов с применением метилпреднизолона натрия сукцината не установлена- На фоне терапии препаратом СОЛУ-МЕДРОЛ может увеличиваться восприимчивость к инфекциям, некоторые инфекции могут протекать в стертой форме, кроме того, могут развиваться новые инфекции. Кроме того, снижается способность организма к локализации инфекционного процесса. Развитие инфекций, вызываемых различными патогенными организмами, такими как вирусы, бактерии, грибы, простейшие или гельминты, которые локализуются в различных системах организма человека, может быть связано с применением препарата СОЛУ-МЕДРОЛ, как в качестве монотерапии, так и в сочетании с другими иммунодепрессантами, воздействующими на клеточный иммунитет, гуморальный иммунитет или на функцию нейтрофилов. Эти инфекции могут протекать нетяжело, однако, в ряде случаев возможно тяжелое течение и даже летальный исход. Причем чем более высокие дозы препарата применяются, тем выше вероятность развития инфекционных осложнений- Больным, получающим иммуносупрессивные дозы метилпреднизолона, противопоказано введение живых или живых ослабленных вакцин, но можно вводить убитые или инактивированные вакцины, однако реакция на введение таких вакцин может быть снижена или даже отсутствовать. Больным, получающим лечение препаратом СОЛУ-МЕДРОЛ в дозах, не оказывающих иммунодепрессивного действия, по соответствующим показаниям может проводиться иммунизация- Применение препарата СОЛУ-МЕДРОЛ при активном туберкулезе следует ограничить случаями молниеносного и диссеминированного туберкулеза, когда препарат С

Модель:
RUR 747
ОБЩАЯ ХАРАКТЕРИСТИКА ЛЕКАРСТВЕННОГО ПРЕПАРАТА 1. НАИМЕНОВАНИЕ ЛЕКАРСТВЕННОГО ПРЕПАРАТА Ксалатан, 0,005 %, капли глазные. 2. КАЧЕСТВЕННЫЙ И КОЛИЧЕСТВЕННЫЙ СОСТАВ Действующее вещество: латанопрос Каждый 1 мл раствора содержит 50 мкг латанопроста. Вспомогательные вещества, наличие которых надо учитывать в составе лекарственного препарата: бензалкония хлорид (см. раздел 4.4.). Полный перечень вспомогательных веществ приведен в разделе 6.1. 3. ЛЕКАРСТВЕННАЯ ФОРМА Капли глазные. Прозрачный бесцветный раствор. 4. КЛИНИЧЕСКИЕ ДАННЫЕ 4.1. Показания к применению Снижение повышенного внутриглазного давления (ВГД) у взрослых и детей в возрасте старше 1 года с открытоугольной глаукомой или повышенным офтальмотонусом. 4.2. Режим дозирования и способ применения Режим дозирования По одной капле в пораженный глаз один раз в день. Оптимальный эффект достигается при применении препарата вечером. Не следует осуществлять инстилляцию препарата чаще, чем 1 раз в день, поскольку показано, что более частое введение снижает гипотензивный эффект. При пропуске дозы лечение продолжают по обычной схеме. Особые группы пациентов Дети Латанопрост применяют у детей в той же дозе, что и у взрослых. Данные о применении препарата у недоношенных (гестационный возраст 36 недель) отсутствуют. Данные у детей возрастом до 1 года сильно ограничены. Способ применения Как при применении любых глазных капель, с целью снижения возможного системного эффекта препарата сразу после инстилляции каждой капли рекомендуется в течение 1 минуты надавливать на нижнюю слезную точку, расположенную у внутреннего угла глаза 1 на нижнем веке. Эту процедуру необходимо выполнять непосредственно после инстилляции. Перед инстилляцией необходимо снять контактные линзы и установить их не раньше, чем через 15 минут после введения (см. раздел 4.4). Если препарат планируется применять в составе комплексной терапии с другими глазными каплями, интервал между инстилляциями должен составлять не менее 5 минут. 4.3. Противопоказания Гиперчувствительность к действующему веществу или к любому из вспомогательных веществ, указанных в разделе 6.1. Возраст до 1 года (эффективность и безопасность не установлены). 4.4. Особые указания и меры предосторожности при применении Латанопрост может постепенно изменить цвет глаз за счет увеличения содержания коричневого пигмента в радужке. До начала лечения пациентов следует проинформировать о возможном необратимом изменении цвета глаз. Применение лекарственного препарата на одном глазу может вызвать необратимую гетерохромию. Такое изменение цвета глаз преимущественно отмечалось у пациентов с неравномерно окрашенными радужками, а именно: каре-голубыми, серо-карими, желто-карими и зелено-карими. В исследованиях латанопроста потемнение, как правило, начиналось в течение первых 8 месяцев лечения, редко - в течение второго или третьего года и не отмечалось по истечении четырех лет лечения. Прогрессирование пигментации радужки снижалось со временем и стабилизировалось через 5 лет. Данные об усилении пигментации в течение 5 лет отсутствуют. В открытом 5-летнем исследовании безопасности латанопроста у 33 % пациентов развивалась пигментация радужки (см. раздел 4.8). В большинстве случаев изменение цвета радужки было незначительным и, зачастую, клинически не выявлялось. Частота встречаемости колебалась от 7 до 85 % у пациентов с неодинакового цвета радужками, преобладая у пациентов с желто-карими радужками. Изменения у пациентов с равномерно окрашенными радужками голубого цвета не наблюдались, в редких случаях изменения отмечались при равномерно окрашенных радужках серого, зеленого и карего цвета. Изменение цвета глаз обусловлено увеличением содержания меланина в стромальных меланоцитах радужки, а не увеличением числа самих меланоцитов. В типичных случаях коричневая пигментация появляется вокруг зрачка и концентрически распространяется на периферию радужки. При этом вся радужка или ее части приобретают карий цвет. После отмены терапии дальнейшая пигментация не отмечалась. По имеющимся клиническим данным изменение цвета не было связано с какими-либо симптомами или патологическими нарушениями. Препарат не оказывает влияние на невусы и лентиго радужной оболочки. Согласно результатам 5-летних клинических исследований, накопления пигмента в склеро-роговичной трабекулярной сети или иных отделах передней камеры глаза не отмечено. Показано, что потемнение радужки не приводит к нежелательным клиническим последствиям, поэтому применение латанапроста при возникновении такого потемнения можно продолжить. Тем не менее, такие пациенты должны находиться под регулярным наблюдением и, в зависимости от клинической ситуации, лечение может быть прекращено. Опыт применения латанопроста в терапии закрытоугольной и врожденной глаукомы, пигментной глаукомы, открытоугольной глаукомы у пациентов с псевдофакией ограничен. Отсутствуют сведения о применении латанопроста в лечении вторичной глаукомы вследствие воспалительных заболеваний глаз и неоваскулярной глаукомы. Латанопрост не оказывает влияние на величину зрачка. В связи с отсутствием опыта применения латанопроста в терапии острого приступа закрытоугольной глаукомы следует с осторожностью применять препарат у таких пациентов. В связи с тем, что сведения о применении латанопроста в послеоперационном периоде экстракции катаракты ограничены, следует соблюдать осторожность при применении препарата у этой категории пациентов. Следует соблюдать осторожность при применении латанопроста пациентами с герпетическим кератитом в анамнезе. При остром герпетическом кератите, а также в случае наличия анамнестических сведений о хроническом рецидивирующем герпетическом кератите, особенно связанным с приемом аналогов простагландина F2α необходимо избегать назначения латанопроста. Макулярный отек, в том числе кистозный, отмечался в период терапии латанопростом преимущественно у пациентов с афакией, псевдофакией, разрывом задней капсулы хрусталика, или у пациентов с факторами риска развития кистозного макулярного отека (в частности, при диабетической ретинопатии и окклюзии вен сетчатки). Следует соблюдать осторожность при применении латанопроста пациентами с афакией, псевдофакией с разрывом задней капсулы хрусталика или переднекамерными интраокулярными линзами, а также пациентами с известными факторами риска развития кистозного отека макулы. Следует соблюдать осторожность при применении латанопроста пациентами с факторами риска развития ирита/увеита. Опыт применения латанопроста пациентами с бронхиальной астмой ограничен, но в ряде случаев в пострегистрационном периоде отмечались обострение течения астмы и/или появление одышки. Следует соблюдать осторожность при применении латанопроста у этой категории пациентов (см. также раздел 4.8). Отмечались случаи потемнения кожи периорбитальной области, которые у ряда пациентов носили обратимый характер при продолжении терапии латанопростом. Латанопрост может вызывать постепенные изменения ресниц и пушковых волос, такие как удлинение, утолщение, усиление пигментации, увеличение густоты или изменение направления роста ресниц. Изменения ресниц были обратимы и проходили после прекращения терапии. В состав препарата входит бензалкония хлорид, который может вызывать раздражение глаз и обесцвечивать контактные линзы. При применении препарата пациентами, носящими контактные линзы, необходимо снять их перед инстилляцией и снова вставить не ранее, чем через 15 минут. У пациентов с сопутствующими заболеваниями роговицы и синдромом «сухого» глаза бензалкония хлорид может вызывать развитие точечной и/или язвенной кератопатии. Требуется контроль состояния роговицы таких пациентов в ходе лечения препаратом. Дети Сведения об эффективности и безопасности применения латанопроста у детей младше года ограничены. Отсутствует опыт применения препарата у недоношенных детей (гестационный возраст менее 36 недель). Сведения о безопасности долгосрочного применения латанопроста у детей отсутствуют. При первичной врожденной глаукоме у детей от 0 до 3 лет стандартным методом лечения остается хирургическое вмешательство (гониотомия/ трабекулотомия). 4.5. Взаимодействие с другими лекарственными препаратами и другие виды взаимодействия Сообщалось о случаях парадоксального повышения ВГД после одновременного офтальмологического применения двух аналогов простагландина. Одновременное применение двух или более простагландинов, аналогов простагландинов или производных простагландинов не рекомендуется. Фармацевтически несовместим с глазными каплями, содержащими тиомерсал - преципитация (см. раздел 6.2). Дети Исследования взаимодействий проводились только у взрослых пациентов. 4.6. Фертильность, беременность и лактация Беременность Безопасность применения латанопроста во время беременности у человека не установлена. Латанопрост может оказывать токсические эффекты на течение беременности, плод и новорожденного. Применение во время беременности противопоказано. Лактация Латанопрост и его метаболиты могут проникать в грудное молоко. Применение во время грудного вскармливания противопоказано. При необходимости применения препарата грудное вскармливание необходимо прекратить. Фертильность Влияние латанопроста на мужскую и женскую фертильность в исследованиях на животных не обнаружено (см. раздел 5.3). 4.7. Влияние на способность управлять транспортными средствами и работать с механизмами Ксалатан оказывает умеренное влияние на способность управлять транспортными средствами и работать с механизмами. Как и при применении других офтальмологических лекарственных препаратов, возможно временное нарушение зрения; до его восстановления управлять транспортными средствами или работать с механизмами не рекомендуется. 4.8. Нежелательные реакции Резюме профиля безопасности Большая часть нежелательных реакций затрагивает систему органа зрения. В 5-летнем открытом исследовании безопасности латанопроста пигментация радужной оболочки развилась у 33 % пациентов (см. раздел 4.4). Другие нежелательные реакции со стороны органа зрения были в основном кратковременными и возникали во время введения препарата. У некоторых пациентов со значительным повреждением роговицы регистрировались очень редкие случаи кальцификации роговицы в связи с применением фосфатосодержащих глазных капель. Прочие особые популяции Дети В двух краткосрочных клинических исследованиях ( 12 недель) с участием 93 (25 и 68) пациентов детского возраста профиль безопасности был сопоставим с таковым у взрослых; новых нежелательных явлений выявлено не было. Краткосрочные профили безопасности в различных популяциях детского возраста были также сопоставимы (см. раздел 5.1). Нежелательные эффекты, которые наблюдались чаще у пациентов детского возраста, чем у взрослых: ринофарингит и лихорадка. Сообщение о подозреваемых нежелательных реакциях Важно сообщать о подозреваемых нежелательных реакциях после регистрации лекарственного препарата с целью обеспечения непрерывного мониторинга соотношения «польза - риск» лекарственного препарата. Медицинским работникам рекомендуется сообщать о любых подозреваемых нежелательных реакциях лекарственного препарата через национальные системы сообщения о нежелательных реакциях государств – членов Евразийского экономического союза. Российская Федерация Федеральная служба по надзору в сфере здравоохранения Адрес: 109074, Москва, Славянская площадь, д.4, стр.1 Тел./ Факс: +7 (495) 624-80-90 Эл. почта:[email protected] https://roszdravnadzor.gov.ru Республика Казахстан РГП на ПХВ «Национальный центр экспертизы лекарственных средств и медицинских изделий» Комитета медицинского и фармацевтического контроля Министерства здравоохранения Республики Казахстан Адрес: г. Астана, 010000, район Байконыр, ул. А. Иманова, 13 Тел: +7 (7172) 78-99-02 Эл. почта:[email protected] https://www.ndda.kz/ Республика Беларусь Республиканское унитарное предприятие «Центр экспертиз и испытаний в здравоохранении» Министерства здравоохранения Республики Беларусь Адрес: 220037, г. Минск, Товарищеский пер. 2а Тел./ Факс: +375 (17) 242-00-29 Эл.почта:[email protected],[email protected] http://www.rceth.by Республика Армения «Научный центр экспертизы лекарств и медицинских технологий им. академика Э. Габриеляна» АОЗТ Адрес: Ереван 0051, пр. Комитаса 49/5 Тел: +374 (10) 23-16-82, 23-08-96, +374 (60) 83-00-73 Эл. почта:[email protected] http://www.pharm.am Кыргызская Республика Департамент лекарственных средств и медицинских изделий при Министерстве здравоохранения Кыргызской Республики Адрес: 720044, г. Бишкек, ул. 3-я Линия, 25 Тел: +996 (312) 21-05-08 Эл. почта:[email protected] http://www.pharm.kg 4.9. Передозировка Симптомы Помимо раздражения глаз и конъюнктивальной инъекции, других офтальмологических эффектов при передозировке препаратом Ксалатан выявлено не было. Лечение При случайном приеме препарата Ксалатан внутрь следует учитывать следующую информацию: Один флакон содержит 125 мкг латанопроста. Более 90 % дозы метаболизируется после первого прохождения через печень. Внутривенная инфузия в дозе 3 мкг/кг у здоровых добровольцев не вызывала каких-либо симптомов, однако при введении дозы 5,5–10 мкг/кг наблюдались тошнота, боль в животе, головокружение, повышенная утомляемость, приливы и чрезмерное потоотделение. У обезьян введение латанопроста путем внутривенной инфузии в дозах до 500 мкг/кг не оказывало существенного влияния на сердечно-сосудистую систему. У обезьян внутривенное введение латанопроста сопровождалось временным бронхоспазмом. Однако у пациентов с бронхиальной астмой средней степени тяжести введение латанопроста в глаза в дозе, в 7 раз превышающей клиническую дозу препарата Ксалатан, не вызывало бронхоспазма. В случае передозировки препаратом Ксалатан лечение должно быть симптоматическим. 5. ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА 5.1. Фармакодинамические свойства Фармакотерапевтическая группа: противоглаукомное средство - простагландина F2α аналог синтетический. Код АТХ: S01EE01 Механизм действия Действующее вещество латанопрост представляет собой аналог простагландина F2, является селективным агонистом простаноидных рецепторов FP, который снижает ВГД, усиливая отток внутриглазной жидкости. У человека ВГД начинает снижаться примерно через 3 – 4 часа после введения препарата; максимальный эффект достигается через 8 – 12 часов. Снижение ВГД сохраняется не менее 24 часов. Исследования на животных и у человека показывают, что основным механизмом действия является увеличение увеосклерального оттока, кроме того, человека также описано небольшое повышение пропускной способности оттока (снижение сопротивления оттоку). Клиническая эффективность и безопасность Опорные исследования показали, что Ксалатан эффективен при использовании в качестве монотерапии. Кроме того, в клинических исследованиях оценивали применение препарата в составе комбинированной терапии. Это, среди прочего, исследования, демонстрирующие эффективность латанопроста в комбинации с антагонистами бета-адренергических рецепторов (тимололом). Краткосрочные исследования (1 или 2 недели) свидетельствуют в пользу того, что действие латанопроста аддитивно при его применении в комбинации с агонистами адренергических рецепторов (дипивалил эпинефрином), пероральными ингибиторами карбоангидразы (ацетазоламид) и, по крайней мере частично, аддитивно при его применении с агонистами холинергических рецепторов (пилокарпином). Клинические исследования показали, что латанопрост не оказывает существенного действия на выработку внутриглазной жидкости. Не было выявлено какого-либо действия латанопроста на гематоофтальмический барьер. У обезьян и в клинических дозах латанопрост оказывает лишь незначительное влияние на внутриглазное кровообращение, если вообще оказывает. Однако при местном применении могли развиваться легкая или умеренная конъюнктивальная или эписклеральная гиперемия. По данным флюоресцентной ангиографии длительное местное лечение латанопростом обезьян после экстракапсулярной экстракции катаракты не оказывало никакого влияния на кровеносные сосуды сетчатки. При краткосрочном применении у пациентов с псевдофакией латанопрост не способствовал просачиванию флуоресцеина в задний сегмент глаза. При применении латанопроста в клинических дозах значимого фармакологического воздействия на сердечно-сосудистую и дыхательную системы не наблюдалось. Дети Эффективность препарата Ксалатан у пациентов детского возраста 18 лет продемонстрирована в 12-недельном двойном слепом клиническом исследовании, в котором латанопрост сравнивали с тимололом у 107 пациентов с внутриглазной гипертензией и детской глаукомой. Новорожденные должны были иметь гестационный возраст не менее 36 недель. Пациенты были рандомизированы для получения либо латанопроста в дозировке 50 мкг/мл один раз в сутки, либо тимолола 0,5 % (или тимолола 0,25 % для пациентов младше 3 лет) два раза в сутки. Первичной конечной точкой оценки эффективности было среднее снижение ВГД относительно исходного уровня через 12 недель лечения. Среднее снижение ВГД было аналогичным в 2 группах терапии (латанопрост и тимолол). Во всех исследуемых возрастных группах (от 0 до &amp;amp;lt; 3 лет, от 3 до &amp;amp;lt;12 лет и от 12 до 18 лет) среднее снижение ВГД после 12 недель лечения в группе латанопроста было таким же, как и в группе тимолола. Тем не менее, данные по эффективности латанопроста в возрастной группе от 0 до &amp;amp;lt; 3 лет получены только для 13 пациентов, а для 4 пациентов, которые представляли возрастную группу от 0 до &amp;amp;lt; 1 года, соответствующей эффективности не было продемонстрировано. Данные по применению у недоношенных детей (гестационный возраст менее 36 недель) отсутствуют. Аналогичным образом, снижение ВГД у пациентов с первичной врожденной глаукомой (ПВГ) было одинаковым в 2 группах терапии (латанопрост и тимолол). Схожие результаты наблюдались в другой подгруппе (не первичная врожденная глаукома, например: ювенильная открытоугольная глаукома, афакическая глаукома). Снижение ВГД, наблюдавшееся после первой недели лечения (см. таблицу), сохранялось в течение 12 недель исследования, так же, как и у взрослых. 5.2. Фармакокинетические свойства Абсорбция Латанопрост (молекулярная масса 432,58) представляет собой изопропиловый эфир и является пролекарством, которое само по себе неактивно, но после гидролиза до кислоты латанопрост приобретает биологическую активность. Пролекарство хорошо всасывается через роговицу и, полностью гидролизованным при прохождении через нее, попадает во внутриглазную жидкость. Распределение Исследования у человека показывают, что концентрация во внутриглазной жидкости достигает максимума примерно через два часа после местного применения. После местного применения у обезьян латанопрост в основном распределяется в переднем сегменте глаза, конъюнктиве и веках. Лишь незначительная часть препарата достигает заднего сегмента глаза. Биотрансформация и элиминация В глазу латанопрост в форме кислоты практически не подвергается метаболическому превращению. Метаболизм осуществляется главным образом в печени. Период полувыведения из плазмы крови у человека составляет около 17 минут. В исследованиях на животных первичные метаболиты, 1,2-динор и 1,2,3,4-тетранор-метаболиты, обладали лишь слабой биологической активностью или не обладали вообще, и в основном выводились с мочой. Дети Проведено открытое фармакокинетическое исследование по изучению концентраций кислоты латанопроста в плазме крови у 22 взрослых пациентов и 25 пациентов детского возраста (в возрасте от рождения до &amp;amp;lt; 18 лет) с внутриглазной гипертензией и глаукомой. Пациенты всех возрастных групп получали лечение латанопростом в дозировке 50 мкг/мл, по одной капле ежедневно в каждый глаз в течение минимум 2 недель. Системное воздействие кислоты латанопроста у детей в возрасте от 3 до &amp;amp;lt; 12 лет было примерно в 2 раза выше, чем у взрослых пациентов, а у детей в возрасте младше 3 лет - в 6 раз выше, чем у взрослых; при этом сохранялся широкий диапазон безопасности в отношении возникновения системных нежелательных эффектов (см. раздел 4.9). Среднее время до достижения пиковой концентрации в плазме крови во всех возрастных группах составило 5 минут после введения дозы. Средний период полувыведения из плазмы крови был коротким (&amp;amp;lt; 20 минут) и одинаковым у детей и взрослых, благодаря чему накопления кислоты латанопроста в системном кровотоке при равновесном состоянии не наблюдалось. 5.3. Данные доклинической безопасности Офтальмологическую и системную токсичность латанопроста исследовали у разных видов животных. В целом, латанопрост хорошо переносится с высоким запасом безопасности, системная токсичность по крайней мере в 1000 раз превышает клиническую дозировку для местного применения. Внутривенное введение высоких доз латанопроста, приблизительно в 100 раз превышающих клиническую дозу/кг массы тела, обезьянам без анестезии, вызывало увеличение частоты дыхания. Это, вероятно, отражает кратковременный бронхоспазм. В исследованиях на животных сенсибилизирующих свойств латанопроста не наблюдалось. Токсических эффектов у кроликов и обезьян, получавших дозы не более 100 мкг/глаз/сут. (клиническая доза составляет около 1,5 мкг/глаз/сут.), не наблюдалось. Однако у обезьян латанопрост вызывал усиление пигментации радужной оболочки. Механизм усиления пигментации, по-видимому, заключается в стимуляции выработки меланина в меланоцитах радужной оболочки без пролиферативных изменений. Это изменение цвета радужной оболочки может быть необратимым. В исследованиях хронической офтальмологической токсичности применение латанопроста в дозе 6 мкг/глаз/сут. также вызывало увеличение глазной щели. Этот эффект обратим и наблюдается при дозах, превышающих уровень клинической дозы. У человека этот эффект не наблюдался. Тест на обратные мутации у бактерий, тест на генетические мутации у мышей и микроядерный тест у мышей дали отрицательные результаты для латанопроста. В исследовании&amp;amp;nbsp;in vitro&amp;amp;nbsp;на лимфоцитах человека наблюдались хромосомные аберрации. О подобных эффектах сообщалось и для простагландина F2 - простагландина природного происхождения, что свидетельствует о том, что это эффекты фармацевтического класса. Другие исследования мутагенности&amp;amp;nbsp;in vitro/in vivo&amp;amp;nbsp;по оценке влияния на репаративный синтез ДНК у крыс дали отрицательные результаты и показали, что латанопрост не обладает мутагенной токсичностью. Исследования канцерогенности у мышей и крыс дали отрицательные результаты. В исследованиях на животных не было продемонстрировано влияния латанопроста на репродуктивную функцию самцов или самок. В исследовании эмбриотоксичности на крысах эмбриотоксического действия латанопроста при внутривенных дозах 5, 50 и 250 мкг/кг/сут. не наблюдалось. Однако у кроликов латанопрост вызывал гибель эмбрионов при дозах 5 мкг/кг/сут. или выше. Доза 5 мкг/кг/сут. (что примерно в 100 раз выше клинической дозы) вызывала существенную эмбриофетальную токсичность, которая характеризовалась повышенной частотой возникновения поздних резорбций и выкидышей, а также пониженной массой плодов при рождении. Признаки тератогенных эффектов отсутствовали. 6. ФАРМАЦЕВТИЧЕСКИЕ СВОЙСТВА 6.1. Перечень вспомогательных веществ Натрия хлорид Бензалкония хлорид Натрия дигидрофосфат моногидрат Натрия гидрофосфат безводный Вода для инъекций 6.2. Несовместимость Исследования in vitro показали, что при смешивании глазных капель, содержащих тиомерсал, с препаратом Ксалатан происходит образование осадка. При использовании таких лекарственных препаратов глазные капли следует закапывать с интервалом не менее 5 минут. 6.3. Срок годности (срок хранения) 3 года. Вскрытый флакон использовать в течение 4-х недель. 6.4. Особые меры предосторожности при хранении Хранить при температуре от 2 до 8 °С в защищенном от света месте. Вскрытый флакон хранить при температуре не выше 25 °С. 6.5. Характер и содержание первичной упаковки По 2,5 мл раствора (глазных капель) во флаконе (полиэтилен низкой плотности) c наконечником-капельницей (линейный полиэтилен низкой плотности или линейный полиэтилен средней плотности) и завинчивающимся и предохранительным колпачками (полиэтилен высокой плотности) без резьбы с контролем первого вскрытия; по 1 или 3 флакона с инструкцией по применению (листком-вкладышем) в картонной пачке. На лицевой стороне картонной пачки, с целью контроля первого вскрытия, наносится перфорированная строчка, напоминающая очертание полуколец; боковые поверхности пачки плотно склеиваются при упаковке препарата. Примечание: контроль первого вскрытия обеспечивается прикреплением предохранительного колпачка к корпусу флакона пластиковыми перемычками. Не все размеры упаковки могут быть представлены на рынке. 6.6. Особые меры предосторожности при уничтожении использованного лекарственного препарата или отходов, полученных после применения лекарственного препарата и другие манипуляции с препаратом Весь неиспользованный лекарственный препарат или отходы следует утилизировать в соответствии с местными требованиями. 7. ДЕРЖАТЕЛЬ РЕГИСТРАЦИОННОГО УДОСТОВЕРЕНИЯ Виатрис Спешиалти Эл. ЭлСи Коллинз Ферри Роуд, 3711, Моргантаун, Западная Вирджиния 26505, США +1 724-514-1800 www.viatris.com Viatris Specialty LLC 3711 Collins Ferry Road, Morgantown, WV 26505, USA +1 724-514-1800 www.viatris.com 7.1. Представитель держателя регистрационного удостоверения Претензии потребителей направлять по адресу: Российская Федерация ООО «Виатрис» 125315, г. Москва, Ленинградский проспект, д. 72, к. 4, 2-й этаж, пом. 9, ком. 1 Телефон: (+7) 495 130 05 50 Факс: (+7) 495 130 05 51 Электронная почта:[email protected] Республика Беларусь Представительство общества с ограниченной ответственностью «MEDA Pharmaceuticals Switzerland GmbH» (Швейцарская Конфедерация) 220039, Республика Беларусь, Минск, ул. Воронянского 7А, офис 905 Телефон: +375 17 377 43 12 Электронная почта:[email protected] Республика Казахстан Представительство «МЕДА Фармасьютикалз Швейцария ГмбХ» 050051, Казахстан, г. Алматы, пр. Достык 97, офис 8 Телефон: +7 727 2641794 Электронная почта:[email protected] Республика Армения 0012, Армения, Ереван, ул. Комитас 7/4, оф. 12 Телефон: +374 44 838833 Электронная почта:[email protected];[email protected] Кыргызская Республика 7200028, Кыргызская Республика, Бишкек, 7 микрорайон, д. 49, оф.11 Телефон: +996 559 777 147 Электронная почта:[email protected];[email protected]
Модель:
RUR 0
Бренд Тизин Международное непатентованное название Ксилометазолин Состав В 1 мл раствора содержится: действующее вещество: ксилометазолина гидрохлорид 1 мг (0,1%); количество активного компонента в одной дозе для 0,1 % – 0,14 мг ксилометазолина гидрохлорида; вспомогательные вещества: глицерол – 8,5 мг, сорбитол – 5 мг, натрия дигидрофосфата дигидрат – 4 мг, натрия хлорид – 3 мг, натрия фосфата дигидрат – 0,628 мг, натрия гиалуронат – 0,2 мг, вода для инъекций – до 1 мл. Возраст с 6 лет Показания к применению • уменьшение отечности слизистой оболочки носа при рините, в том числе аллергическом рините, орз с явлениями ринита, поллинозе. • облегчение отхождения выделений из носа при параназальном синусите и воспалении среднего уха, вызванном простудой. • подготовка пациентов к диагностическим манипуляциям в носовых ходах. «тизин® эксперт», cпрей назальный дозированный 0,05 % предназначен для детей в возрасте от 2 до 6 лет. «тизин® эксперт», cпрей назальный дозированный 0,1 % предназначен для взрослых и детей старше 6 лет. Способ применения и дозы Взрослые и дети старше 6 лет - 0,1 % • До 3-х раз в сутки вводят по одной дозе препарата в виде 0,1 % дозированного спрея в каждую ноздрю. Доза зависит от индивидуальной чувствительности пациента и клинического эффекта. Дети в возрасте 2–6 лет - 0,05 % • Если не назначено иное, то использовать по одной дозе препарата в виде 0,05 % дозированного спрея в каждую ноздрю 1–2 раза в сутки. Ксилометазолин в виде дозированного спрея не следует применять более 5–7 дней, если врач не рекомендовал иную длительность лечения. После завершения терапии препарат можно назначать повторно только через несколько дней. По поводу длительности применения у детей всегда советуйтесь с врачом. В случае хронического ринита препарат «Тизин® Эксперт» 0,05 % и 0,1 % можно применять только под контролем врача, учитывая риск атрофии слизистой оболочки носа. Способ применения. Снять защитный колпачок. Перед первым применением несколько раз нажать на распылительную насадку (рис. 1) до появления равномерного облачка «тумана». Флакон готов к дальнейшему использованию. При применении нажать один раз (рис.2). Препарат вдыхать через нос. По возможности держать флакон-распылитель вертикально. Не распылять горизонтально или вниз. После употребления флакон закрыть колпачком. Код АТХ R01AA07 Дозировка (концентрация) 0,1% Лекарственная форма спрей назальный дозированный Описание лекарственной формы Прозрачный или слегка опалесцирующий, бесцветный или слегка желтоватого цвета раствор. Действующие вещества Ксилометазолина гидрохлорид 1 мг (0,1%); количество активного компонента в одной дозе для 0,1% – 0,14 мг ксилометазолина гидрохлорида. Вспомогательные вещества Глицерол – 8,5 мг, сорбитол – 5 мг, натрия дигидрофосфата дигидрат – 4 мг, натрия хлорид – 3 мг, натрия фосфата дигидрат – 0,628 мг, натрия гиалуронат – 0,2 мг, вода для инъекций – до 1 мл. Фармакологическая группа противоконгестивное средство – вазоконстриктор Фармакодинамика Ксилометазолин (производное имидазола) — альфа-адреностимулятор, сужает кровеносные сосуды слизистой оболочки полости носа, устраняя отек и гиперемию слизистой оболочки. Облегчает носовое дыхание при ринитах. В состав препарата входят неактивные компоненты - гиалуроновая кислота (в форме натрия гиалуроната), глицерол и сорбитол, которые являются увлажнителями, позволяющими препарату уменьшать симптомы раздражения и сухости слизистой оболочки носа. Действие наступает через 2 мин после применения и продолжается в течение 12 часов. Фармакокинетика При местном применении практически не абсорбируется, концентрации в плазме настолько малы, что их невозможно определить современными аналитическими методами. У человека фармакокинетические исследования не проводились. Противопоказания • Повышенная чувствительность к любому из компонентов препарата; • атрофический ринит, тиреотоксикоз; • новорожденные и дети в возрасте до 2 лет (для спрея назального дозированного 0,05 %); дети в возрасте до 6 лет (для спрея назального дозированного 0,1 %); • пациенты с тяжелыми сердечно-сосудистыми заболеваниями (например, ишемической болезнью сердца, стенокардией, тахикардией, артериальной гипертензией, выраженным атеросклерозом); • пациенты с хирургическими вмешательствами на мозговых оболочках в анамнезе; • пациенты, получающие ингибиторы моноаминооксидазы (МАО) или другие препараты, способные вызвать повышение артериального давления; • пациенты с повышенным внутриглазным давлением, особенно с закрытоугольной глаукомой; • состояние после транссфеноидальной гипофизэктомии. Применение при беременности и в период кормления грудью Ксилометазолин не следует применять во время беременности, так как воздействие этого препарата на плод в клинических исследованиях не изучалось. Препарат не следует применять во время кормления грудью, так как неизвестно, выводится ли активное вещество с грудным молоком. Пациентам, которым следуют принимать с осторожностью В следующих случаях «Тизин® Эксперт» можно применять, только тщательно взвесив пользу и риск лечения: • пациенты с повышенной чувствительностью к адренергическим препаратам, сопровождающейся бессонницей, головокружением, аритмией, тремором, повышением артериального давления; • пациенты с феохромоцитомой; • пациенты с эндокринными заболеваниями (например, гипертиреозом, сахарным диабетом); • пациенты с гиперплазией предстательной железы; • пациенты с порфирией. Побочное действие Дыхательные пути «Тизин® Эксперт» может вызвать преходящее легкое раздражение носа (жжение) у восприимчивых людей, чихание. Часто (>1–0,01%–

Модель:
RUR 1098
ОБЩАЯ ХАРАКТЕРИСТИКА ЛЕКАРСТВЕННОГО ПРЕПАРАТА 1. НАИМЕНОВАНИЕ ЛЕКАРСТВЕННОГО ПРЕПАРАТА Ксалаком, 0,005 % + 0,5 %, капли глазные. 2. КАЧЕСТВЕННЫЙ И КОЛИЧЕСТВЕННЫЙ СОСТАВ Действующие вещества: латанопрост + тимолол. 1 мл раствора содержит 0,050 мг латанопроста и 6,83 мг тимолола малеата, что эквивалентно 5 мг тимолола. Вспомогательные вещества, наличие которых надо учитывать в составе лекарственного препарата: бензалкония хлорид (в виде 50% раствора). Полный перечень вспомогательных веществ приведен в разделе 6.1. 3. ЛЕКАРСТВЕННАЯ ФОРМА Капли глазные. Прозрачный, бесцветный, практически не содержащий видимых частиц раствор. 4. КЛИНИЧЕСКИЕ ДАННЫЕ 4.1. Показания к применению Снижение повышенного внутриглазного давления (ВГД) у пациентов с открытоугольной глаукомой или глазной гипертензией при недостаточной эффективности монотерапии отдельными компонентами препарата. 4.2. Режим дозирования и способ применения Режим дозирования Взрослые (в том числе лица пожилого возраста). Рекомендуемая терапия: по одной капле в пораженный(-ые) глаз(а) 1 раз в сутки. В случае пропуска одной дозы следует продолжать лечение, применяя следующую дозу согласно графику. Нельзя закапывать более одной капли в пораженный глаз в сутки. Дети Безопасность и эффективность препарата Ксалаком у детей в возрасте от 0 до 18 лет не установлены. Данные отсутствуют. Способ применения Перед закапыванием глазных капель контактные линзы необходимо снять, а через 15 минут их можно снова надеть (см. раздел 4.4). Если пациент одновременно использует другие офтальмологические препараты местного применения, то их следует применять с интервалом не менее 5 минут. При перекрытии носослезного канала или закрывании век на 2 минуты системное всасывание снижается. Это может приводить к ослаблению системных побочных эффектов и повышению местной активности. 4.3. Противопоказания • гиперчувствительность к действующим веществам или к любому из вспомогательных веществ, указанных в разделе 6.1; • реактивное заболевание дыхательных путей, в том числе бронхиальная астма или бронхиальная астма в анамнезе, тяжелая хроническая обструктивная болезнь легких; • синусовая брадикардия, синдром слабости синусового узла, синоатриальная блокада, атриовентрикулярная блокада II-III степени без контроля искусственного водителя ритма, клинически выраженная сердечная недостаточность, кардиогенный шок. 4.4. Особые указания и меры предосторожности при применении Препарат Ксалаком следует применять не чаще одного раза в день, так как более частое введение латанопроста приводит к ослаблению снижающего ВГД эффекта. При пропуске одной дозы, следующую дозу следует вводить в обычное время. Если пациент одновременно использует другие глазные капли, то их следует применять с интервалом по крайней мере 5 минут. В состав препарата Ксалаком входит бензалкония хлорид, который может абсорбироваться контактными линзами. Имеются сообщения о развитии точечной кератопатии и/или токсической язвенной кератопатии, а также на фоне применения бензалкония хлорида может возникнуть раздражение глаз и обесцвечивание мягких контактных линз. Рекомендуется тщательный мониторинг состояния пациентов, применяющих Ксалаком часто или длительно, у которых отмечается сухость слизистой оболочки глаз или состояния, повреждающие роговицу. Перед закапыванием капель контактные линзы необходимо снять и снова установить их через 15 минут. Латанопрост Изменение содержания коричневого пигмента Латанопрост может вызывать постепенное увеличение содержания коричневого пигмента в радужке. Как и при применении латанопроста в виде глазных капель, при применении препарата Ксалаком увеличение пигментации радужки отмечали в 16-20 % случаев среди всех пациентов, получавших Ксалаком в течение года (оценка на основании фотографий). Изменение цвета глаз обусловлено увеличением содержания меланина в стромальных меланоцитах радужки, а не увеличением числа самих меланоцитов. В типичных случаях коричневая пигментация появляется вокруг зрачка и концентрически распространяется на периферию радужки. При этом вся радужка или ее части приобретают коричневый цвет. В большинстве случаев изменение цвета является незначительным и может не быть установлено клинически. Усиление пигментации радужной оболочки одного или обоих глаз наблюдается, главным образом, у пациентов со смешанным цветом радужки, содержащим в основе коричневый цвет. Препарат не оказывает влияния на невусы и лентиго радужной оболочки; накопления пигмента в трабекулярной сети или в передней камере глаза не отмечено. При определении степени пигментации радужки в течение более 5 лет не выявлено нежелательных последствий усиления пигментации даже при продолжении терапии латанопростом. У пациентов степень снижения ВГД была одинаковой вне зависимости от наличия или отсутствия усиления пигментации радужки. Следовательно, лечение латанопростом можно продолжать и в случаях усиления пигментации радужки. Такие пациенты должны находиться под регулярным наблюдением и, в зависимости от клинической ситуации, лечение может быть прекращено. Усиление пигментации радужки обычно наблюдается в течение первого года после начала лечения, редко – в течение второго или третьего года. После четвертого года лечения этот эффект не наблюдался. Скорость прогрессирования пигментации со временем снижается и стабилизируется через 5 лет. В более отдаленные сроки эффекты повышенной пигментации радужки не изучались. После прекращения лечения усиления коричневой пигментации радужки не отмечалось, однако изменение цвета глаз может оказаться необратимым. У пациентов, применяющих капли только в один глаз, возможно развитие гетерохромии, которая также может быть необратимой. Изменения ресниц и пушковых волос В связи с применением латанопроста описаны случаи потемнения кожи век, которое может быть обратимым. Латанопрост может вызвать постепенные изменения ресниц и пушковых волос, такие как удлинение, утолщение, усиление пигментации, увеличение густоты и изменение направления роста ресниц. Изменения ресниц являются обратимыми и проходят после прекращения лечения. Тимолол При местном применении β-адреноблокаторов могут наблюдаться такие же нежелательные реакции, как и при их системном применении. Пациентов с тяжелыми заболеваниями сердца в анамнезе следует постоянно наблюдать с целью своевременного выявления симптомов сердечной недостаточности. При местном применении тимолола могут возникнуть следующие реакции со стороны сердца и системы дыхания: прогрессирование стенокардии Принцметала, а также периферических и центральных циркуляторных нарушений, гипотензия, сердечная недостаточность с летальным исходом, тяжелые реакции со стороны дыхательной системы, в т.ч. бронхоспазм с летальным исходом у больных бронхиальной астмой, брадикардия. Перед проведением обширного хирургического вмешательства следует обсудить целесообразность постепенной отмены β-адреноблокаторов. Препараты этой группы нарушают способность сердца к ответной реакции на рефлекторную β-адренергическую стимуляцию, что может повысить риск при общем наркозе. Описаны случаи затяжного тяжелого снижения артериального давления во время наркоза и трудности при восстановлении и поддержании сердечных сокращений. Во время операции эффекты β-адреноблокаторов могут быть ликвидированы с помощью достаточных доз агонистов адренорецепторов. Лекарственные средства с β-адреноблокирующим эффектом могут заблокировать системный агонистический эффект, например эпинефрина. Необходимо предупредить анестезиолога о том, что пациент получает тимолол. β-адреноблокаторы могут усилить гипогликемическое действие противодиабетических средств и маскировать симптомы и проявления гипогликемии. Их следует применять с осторожностью у больных со спонтанной гипогликемией или сахарным диабетом (особенно лабильного течения), получающих инсулин или гипогликемические средства для приема внутрь. Терапия β-адреноблокаторами может маскировать некоторые основные симптомы и проявления гипертиреоза. Резкое прекращение лечения может вызвать обострение этого заболевания. При лечении β-адреноблокаторами у больных с атопией или тяжелыми анафилактическими реакциями на различные аллергены в анамнезе возможно усиление ответа при повторном контакте с этими аллергенами. При этом эпинефрин в обычных дозах, применяющихся для купирования анафилактических реакций, может оказаться неэффективным. В редких случаях тимолол вызывал усиление мышечной слабости у пациентов с миастения gravis или миастеническими симптомами (например, диплопией, птозом, генерализованной слабостью). При применении средств, снижающих ВГД, описаны случаи отслойки сосудистой оболочки после фильтрационных процедур – фистулизирующих операций (трабекулэктомия и ее модификации, синусотомия с диатермотрабекулоспазисом, непроникающая глубокая склерэктомия и другие фистулизирующие операции, которые создают новые или стимулируют существующие пути оттока внутриглазной жидкости). С осторожностью Воспалительная, неоваскулярная, закрытоугольная глаукома, открытоугольная глаукома в сочетании с псевдофакией, пигментная глаукома (из-за отсутствия достаточного опыта применения препарата); афакия, псевдофакия с разрывом задней капсулы хрусталика, пациенты с известными факторами риска макулярного отека (при лечении латанопростом описаны случаи развития макулярного отека, в том числе цистоидного); герпетическим кератитом в анамнезе; атриовентрикулярная блокада I степени (β-адреноблокаторы отрицательно влияют на время проведения импульса в сердечной мышце); нарушения периферического кровообращения (например, тяжелые формы синдрома Рейно или болезни Рейно). Следует избегать применения препарата Ксалаком у пациентов с активной формой герпетического кератита и рецидивирующим герпетическим кератитом, особенно связанным с приемом аналогов простагландина F2α. Тимолол следует с осторожностью применять у пациентов с хронической обструктивной болезнью легких и только в случаях, когда потенциальная польза от применения препарата для пациента превышает риск. С осторожностью следует применять Ксалаком у пациентов с заболеваниями роговицы, так как препарат может вызвать сухость слизистой оболочки глаз. 4.5. Взаимодействие с другими лекарственными препаратами и другие виды взаимодействия Взаимодействие препарата Ксалаком с другими препаратами специально не изучалось. При применении препарата Ксалаком у пациентов, получающих β-адреноблокатор внутрь, возможно более выраженное снижение ВГД или усиление системных проявлений β-адреноблокаторов, поэтому одновременное местное применение двух и более β-адреноблокаторов не рекомендуется. При одновременном закапывании в глаза двух аналогов простагландинов описано парадоксальное повышение ВГД, поэтому одновременное применение двух и более простагландинов, их аналогов или производных не рекомендуется. При одновременном применении тимолола с эпинефрином иногда развивался мидриаз. При сочетании тимолола с перечисленными ниже препаратами возможно аддитивное действие со снижением артериального давления и/или выраженной брадикардии: • блокаторы «медленных» кальциевых каналов; • средства, вызывающие снижение содержания катехоламинов, или β-адреноблокаторы; • антиаритмические средства (в том числе амиодарон); • сердечные гликозиды; • гуанетидин. Сообщалось об усилении действия системных β-адреноблокаторов (например, снижение частоты сердечных сокращений, депрессия) при одновременном применении ингибиторов изофермента CYP2D6 (например, хинидина, флуоксетина, пароксетина) и тимолола. β-адреноблокаторы могут усилить гипогликемическое действие гипогликемических лекарственных средств. При внезапной отмене клонидина отмечается повышение артериального давления. Данная реакция может усиливаться при одновременном применении с β-адреноблокаторами. 4.6. Фертильность, беременность и лактация Адекватных контролируемых исследований у беременных женщин не проводилось. При проведении эпидемиологических исследований при применении β-адреноблокаторов внутрь не было отмечено случаев пороков развития плода, однако риск задержки внутриутробного развития был повышен. Кроме того, выявляли симптомы β-адреноблокирующего действия (такие как, брадикардия, снижение артериального давления, нарушение дыхательной функции и гипогликемия) у новорожденных, матери которых во время беременности принимали β-адреноблокаторы. В случае, если беременная женщина получала терапию β-адреноблокаторами, следует проводить тщательный мониторинг состояния новорожденного в первые дни после рождения. В связи с этим применение препарата Ксалаком во время беременности возможно только в тех случаях, когда ожидаемая польза для матери превышает потенциальный риск для плода или ребенка. Латанопрост и его метаболиты могут выделяться в грудное молоко. Тимолол, при применении в форме глазных капель, также обнаруживали в грудном молоке. Учитывая риск развития серьезных нежелательных реакций у новорожденных, находящихся на грудном вскармливании, а также важность применения препарата для матери, следует либо прекратить грудное вскармливание, либо отменить препарат. 4.7. Влияние на способность управлять транспортными средствами и работать с механизмами Применение глазных капель может вызвать преходящее затуманивание зрения. Пока этот эффект не исчезнет, пациентам не следует управлять автомобилем или пользоваться сложной техникой. 4.8. Нежелательные реакции Резюме профиля безопасности Большая часть нежелательных реакций, связанных с латанопростом, затрагивает систему органов зрения. По данным, полученным в результате проведения дополнительной фазы опорных исследований препарата Ксалаком, у 16–20 % пациентов происходило усиление пигментации радужной оболочки, которое может быть необратимым. В открытом 5-летнем исследовании безопасности латанопроста пигментация радужной оболочки развилась у 33 % пациентов (см. раздел 4.4). Другие нежелательные реакции со стороны органа зрения были в основном кратковременными и возникали во время введения дозы препарата. У тимолола наиболее серьезные побочные реакции имеют системный характер и включают брадикардию, аритмию, застойную сердечную недостаточность, бронхоспазм и аллергические реакции. Как и в случае других офтальмологических препаратов для местного применения, тимолол после всасывания попадает в систему кровообращения. В результате могут возникать такие же нежелательные эффекты, как и при приеме системных бета-адреноблокаторов. Частота возникновения системных нежелательных лекарственных реакций после местного применения на глазах ниже, чем при системном введении. Перечисленные нежелательные реакции включают реакции, которые характерны для всего класса офтальмологических бета-адреноблокаторов. Резюме нежелательных реакций Частота нежелательных реакций представлена по следующей классификации: Очень частые 10 % Частые 1 % и <10 % Нечастые 0,1 % и <1 % Редкие 0,01 % и <0,1 % Очень редкие <0,01 % Нарушения со стороны органа зрения: очень частые - усиление пигментации радужки, катаракта; частые: нарушение зрения, блефарит, конъюнктивит, поражения конъюнктивы (фолликулы, папиллярные реакции конъюнктивы, точечные кровоизлияния и др.), поражения роговицы (эрозии, пигментация, кератит, точечный кератит и др.), нарушения рефракции, гиперемия конъюнктивы, раздражение глаза (в том числе, ощущение жжения и зуд в глазах), боль в глазах, фотофобия, выпадение полей зрения, повышенное слезообразование; нечастые: гипертрихоз (изменение ресниц и пушковых волос, удлинение, утолщение, усиление пигментации, увеличение густоты и изменение направления роста ресниц); неизвестно: изменения рефракции. Инфекционные и паразитарные заболевания: частые - синусит, инфекции верхних отделов дыхательных путей и другие инфекции. Нарушения со стороны обмена веществ и питания: частые - сахарный диабет, гиперхолестеринемия. Нарушения со стороны психики: частые - депрессия. Нарушения со стороны нервной системы: частые - головная боль. Нарушения со стороны сердечно-сосудистой системы: частые - повышение артериального давления. Нарушения со стороны кожи и подкожных тканей: частые - сыпь, кожный зуд и изменения кожи (раздражение, дерматохалазион и др.), заболевания кожи. Нарушения со стороны скелетно-мышечной и соединительной ткани: частые - артрит. Ниже перечислены другие нежелательные явления, которые наблюдались при монотерапии отдельными компонентами препарата Ксалаком (помимо указанных выше). Латанопрост: Нарушения со стороны органа зрения: раздражение глаз (чувство жжения, ощущение песка в глазах, зуд, покалывание и ощущение инородного тела); преходящие точечные эрозии эпителия роговицы*, отек век, кератит, точечный кератит*; отек роговицы*, удлинение, утолщение, увеличение числа и усиление пигментации ресниц и пушковых волос; ирит/увеит*; макулярный отек (у пациентов с афакией, у пациентов с псевдофакией с разрывом задней капсулы хрусталика или у пациентов с факторами риска развития макулярного отека), в т.ч. цистоидный*; трихиаз*; затуманенное зрение*, фотофобия*, изменения в периорбитальной области и век, приводящие к углублению борозды верхнего века*, периорбитальный отек, кисты радужной оболочки*. Нарушения со стороны сердечно-сосудистой системы: обострение стенокардии у пациентов с ишемической болезнью сердца, стенокардия, нестабильная стенокардия, ощущение сердцебиения. Нарушения со стороны кожи и подкожных тканей: кожная сыпь, зуд*, потемнение кожи век и местные кожные реакции на веках. Нарушения со стороны нервной системы: головокружение. Нарушения со стороныдыхательной системы, органов грудной клетки и средостения: астма (в том числе острые приступы или обострение заболевания у пациентов с бронхиальной астмой в анамнезе)*, одышка*. Нарушения со стороны скелетно-мышечной и соединительной ткани: миалгия*, артралгия*. Общие расстройства и нарушения в месте введения: неспецифические боли в груди*. Инфекции: герпетический кератит. *Побочные реакции, зарегистрированные в постмаркетинговый период. Тимолол (в форме глазных капель): Нарушения со стороны иммунной системы: системные аллергические реакции, в том числе анафилаксия, ангионевротический отек, анафилактические реакции, крапивница, кожный зуд, локализованная и генерализованная сыпь. Нарушения со стороны обмена веществ и питания: анорексия, скрытые симптомы гипогликемии у больных сахарным диабетом. Нарушения со стороны психики: изменения поведения и психические расстройства, в том числе спутанность сознания, галлюцинации, тревога, дезориентация, нервозность, потеря памяти, бессонница, депрессия и ночные кошмары. Нарушения со стороны нервной системы: ишемия головного мозга, острые нарушения мозгового кровообращения, головокружение, усиление симптомов миастении gravis, парестезия, сонливость, головная боль, обморок. Нарушения со стороны органа зрения: цистоидный макулярный отек, снижение чувствительности роговицы; симптомы и признаки раздражения глаз (например, ощущение жжения, зуд, ощущение песка в глазах, повышенное слезотечение, покраснение), блефарит, кератит, затуманенность зрения, сухость слизистой оболочки глаз, эрозии роговицы, отслойка сосудистой оболочки после фильтрационных хирургических вмешательств; птоз, нарушения зрения, в том числе изменение рефракции и диплопия. Нарушения со стороны органа слуха и лабиринтные нарушения: шум в ушах. Нарушения со стороны сердца: аритмия, брадикардия, атриовентрикулярная блокада, сердечная недостаточность, хроническая сердечная недостаточность, остановка сердца, блокада внутрисердечной проводимости, ощущение сердцебиения, прогрессирование стенокардии. Нарушения со стороны сосудов: перемежающаяся хромота, похолодание рук и ног, снижение артериального давления, синдром Рейно. Нарушения со стороны дыхательной системы, органов грудной клетки и средостения: бронхоспазм (в основном, у больных с предшествующими бронхоспастическими заболеваниями), кашель, одышка, заложенность носа, отек легких и дыхательная недостаточность. Нарушения со стороны желудочно-кишечного тракта: диарея, сухость слизистой оболочки полости рта, нарушение вкусовых ощущений, диспепсия, тошнота, рвота, боль в области живота, ретроперитонеальный фиброз. Нарушения со стороны кожи и подкожных тканей: алопеция, псевдопемфигоид, кожная сыпь, псориазоподобная сыпь или обострение псориаза. Нарушения со стороны скелетно-мышечной и соединительной ткани: системная красная волчанка и миалгия. Нарушения со стороны половых органов и молочной железы: снижение либидо, импотенция, нарушение сексуальной функции и болезнь Пейрони. Общие расстройства и нарушения в месте введения: астения/утомляемость, боль в груди, отеки. У некоторых пациентов со значительным повреждением роговицы регистрировались очень редкие случаи кальцификации роговицы в связи с применением фосфатосодержащих глазных капель. Сообщение о подозреваемых нежелательных реакциях Важно сообщать о подозреваемых нежелательных реакциях после регистрации лекарственного препарата с целью обеспечения непрерывного мониторинга соотношения «польза–риск» лекарственного препарата. Медицинским работникам рекомендуется сообщать о любых подозреваемых нежелательных реакциях лекарственного препарата через национальные системы сообщения о нежелательных реакциях государств – членов Евразийского экономического союза. Российская Федерация Федеральная служба по надзору в сфере здравоохранения Адрес: 109074, Москва, Славянская площадь, д.4, стр.1 Тел./ Факс: +7 (495) 624-80-90 Электронная почта: [email protected] Сайт в информационно-телекоммуникационной сети «Интернет»: https://roszdravnadzor.gov.ru Республика Казахстан РГП на ПХВ «Национальный центр экспертизы лекарственных средств и медицинских изделий» Комитета медицинского и фармацевтического контроля Министерства здравоохранения Республики Казахстан Адрес: г. Астана, 010000, район Байконыр, ул. А. Иманова, 13 Тел./Факс: +7 (7172) 78-98-28 Электронная почта: [email protected] Сайт в информационно-телекоммуникационной сети «Интернет»: https://www.ndda.kz/ Республика Беларусь Республиканское унитарное предприятие «Центр экспертиз и испытаний в здравоохранении» Министерства здравоохранения Республики Беларусь Адрес: 220037, г. Минск, Товарищеский пер. 2а Телефон: + 375 (17) 231-85-14 Факс: + 375 (17) 252-53-58 Электронная почта: [email protected], [email protected] Сайт в информационно-телекоммуникационной сети «Интернет»: http://www.rceth.by 4.9. Передозировка Ниже приведена информация о передозировке компонентами препарата: Латанопрост Помимо раздражения глаз и гиперемии конъюнктивы, другие нежелательные изменения со стороны органа зрения при передозировке латанопроста не известны. При случайном приеме латанопроста внутрь следует учитывать следующую информацию: один флакон с 2,5 мл раствора содержит 125 мкг латанопроста. Более 90 % латанопроста метаболизируется при первом прохождении через печень. Внутривенная инфузия в дозе 3 мкг/кг у здоровых добровольцев не вызывала каких-либо симптомов, однако при введении дозы 5,5-10 мкг/кг наблюдались тошнота, боль в животе, головокружение, утомляемость, «приливы» и потливость. Данные симптомы разрешаются через 4 часа после прекращения инфузии. У больных бронхиальной астмой средней степени тяжести введение латанопроста в глаза в дозе, в 7 раз превышающей терапевтическую, не вызывало бронхоспазма. Тимолол Описаны случаи непреднамеренной передозировки глазных капель тимолола, в результате чего наблюдались системные эффекты, сходные с таковыми при системном применении β-адреноблокаторов: головокружение, головная боль, одышка, брадикардия, бронхоспазм и остановка сердца (см. раздел 4.8). В исследовании in vitro было показано, что при диализе тимолол легко выводится из плазмы или цельной крови. У больных с почечной недостаточностью тимолол диализировался хуже. В случае передозировки проводят симптоматическое лечение. 5. ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА 5.1. Фармакодинамические свойства Фармакотерапевтическая группа: противоглаукомное средство комбинированное (простагландина F2α аналог синтетический + β-адреноблокатор) Код АТХ: S01ED51 Механизм действия В состав препарата Ксалаком входят два активных компонента - латанопрост и тимолол. Механизм снижения повышенного внутриглазного давления (ВГД) у этих компонентов различен, что обеспечивает дополнительное снижение ВГД по сравнению с эффектом, достигающимся при применении каждого из этих компонентов в виде монотерапии. Латанопрост - аналог простагландина F2α - является селективным агонистом рецепторов простаноида FP и снижает ВГД за счет увеличения оттока водянистой влаги, главным образом, увеосклеральным путем, а также через трабекулярную сеть. Установлено, что латанопрост не оказывает существенного влияния на продукцию водянистой влаги и проницаемость гематоофтальмического барьера. В течение краткосрочного лечения латанопрост не вызывает просачивания флюоресцина в задний сегмент глаза при псевдофакии. При применении в терапевтических дозах латанопрост не оказывает значимого фармакологического эффекта на сердечно-сосудистую и дыхательную системы. Тимолол - неселективный β 1- и β 2-адреноблокатор, который не обладает значимой внутренней симпатомиметической активностью, не оказывает прямого угнетающего влияния на миокард или местного анестезирующего (мембраностабилизирующего) эффекта. Блокада β-адренорецепторов вызывает снижение сердечного выброса у здоровых людей и больных с заболеваниями сердца. У больных с тяжелым нарушением функции миокарда β-адреноблокаторы могут ингибировать стимулирующий эффект симпатической нервной системы, необходимый для адекватной работы сердца. Блокада β-адренорецепторов в бронхах и бронхиолах приводит к увеличению сопротивления дыхательных путей под влиянием парасимпатической нервной системы. Подобный эффект может оказаться опасным для больных бронхиальной астмой и другими бронхоспастическими заболеваниями (см. разделы 4.3 и 4.4). Применение тимолола в виде глазных капель вызывает снижение повышенного и нормального ВГД независимо от наличия или отсутствия глаукомы. Повышенное ВГД является основным фактором риска глаукоматозного выпадения полей зрения. Чем выше ВГД, тем выше вероятность глаукоматозного выпадения полей зрения и повреждения зрительного нерва. Точный механизм снижения ВГД под действием тимолола не установлен. Результаты тонографии и флюрофотометрии свидетельствуют о том, что основной механизм действия может быть связан с уменьшением образования водянистой влаги. Однако в некоторых исследования отмечено также небольшое увеличение оттока. Кроме того, возможен также механизм угнетения увеличенного синтеза циклической АМФ, вызванного эндогенной β-адренергической стимуляцией. Не отмечено какого-либо влияния тимолола на проницаемость гематоофтальмического барьера. Действие комбинации латанопроста и тимолола начинается в течение часа, а максимальный эффект наблюдается в течение 6-8 часов. При многократном применении адекватное снижение ВГД сохраняется в течение 24 ч после введения. 5.2. Фармакокинетические свойства Фармакокинетических взаимодействий между латанопростом и тимололом не установлено, хотя через 1-4 часа после применения комбинированного препарата концентрация кислоты латанопроста в водянистой влаге была примерно в два раза выше, чем при монотерапии. Латанопрост: Всасывание Латанопрост, являясь пролекарственной формой, всасывается через роговицу, где происходит его гидролиз до биологически активной кислоты. Установлено, что концентрация в водянистой влаге достигает максимума примерно через два часа после местного применения. Распределение Объем распределения составляет 0,16 0,02 л/кг. Кислота латанопроста определяется в водянистой влаге в течение первых 4 часов, а в плазме – только в течение первого часа после местного применения. Метаболизм Латанопрост подвергается гидролизу в роговице под действием эстераз с образованием биологически активной кислоты. Кислота латанопроста, поступающая в системный кровоток, метаболизируется, в основном, в печени путем β-окисления жирных кислот с образованием 1,2-динор- и 1,2,3,4-тетранор-метаболитов. Выведение Кислота латанопроста быстро выводится из плазмы – период полувыведения (t 1/2) = 17 мин. Плазменный клиренс составляет 0,40 л/ч/кг. Системный клиренс составляет примерно 7 мл/мин/кг. После местного применения глазных капель системная биодоступность кислоты латанопроста составляет 45 %. Связь с белками плазмы крови составляет 87 %. Метаболиты выводятся, в основном, почками: после местного применения с мочой выводится примерно 88 % введенной дозы. Тимолол: Концентрация тимолола в водянистой влаге достигает максимума примерно через 1 час после применения глазных капель. Часть дозы подвергается системному всасыванию, и максимальная концентрация в плазме, составляющая 1 нг/мл, достигается через 10-20 минут после применения препарата по одной капле в каждый глаз один раз в сутки (300 мкг/сут). Период полувыведения тимолола из плазмы составляет около 6 часов. Тимолол активно метаболизируется в печени. Метаболиты, а также некоторое количество неизмененного тимолола, выводятся с мочой. 5.3. Данные доклинической безопасности Профили безопасности в отношении глаз и всего организма отдельных компонентов препарата хорошо изучены. Не наблюдалось нежелательных офтальмологических или системных эффектов у кроликов, которым местно вводили фиксированную комбинацию или одновременно вводили офтальмологические растворы латанопроста и тимолола. Фармакологические, генотоксические исследования безопасности и исследования канцерогенности каждого компонента не выявили каких-либо особых рисков для человека. Латанопрост не оказывал влияния на заживление ран роговицы глаза кролика, тогда как тимолол ингибировал этот процесс в глазах кроликов и обезьян при введении чаще, чем 1 раз в сутки. Для латанопроста не выявлено влияния на репродуктивную функцию самцов и самок крыс и наличия тератогенного действия у крыс и кроликов. Не наблюдалось эмбриотоксического действия у крыс после внутривенного введения доз до 250 мкг/кг/сут. Однако латанопрост проявлял эмбриофетальную токсичность, которая характеризовалась повышенной частотой поздних резорбций и выкидышей и снижением массы плодов у кроликов при внутривенном введении дозы 5 мкг/кг/сут. (что приблизительно в 100 раз выше терапевтической дозы), а также более высоких доз. Тимолол не оказывал воздействия на репродуктивную функцию самцов и самок крыс и не демонстрировал наличие тератогенного потенциала у мышей, крыс и кроликов. 6. ФАРМАЦЕВТИЧЕСКИЕ СВОЙСТВА 6.1. Перечень вспомогательных веществ Бензалкония хлорид (в виде 50% раствора) Натрия гидрофосфат безводный Натрия дигидрофосфат моногидрат Натрия хлорид Вода для инъекций. 6.2. Несовместимость Исследования in vitro показали, что при смешивании глазных капель, содержащих тиомерсал, с препаратом происходит образование осадка. При использовании таких лекарственных препаратов одновременно с препаратом Ксалаком глазные капли следует закапывать с интервалом не менее 5 минут. Данный лекарственный препарат не следует смешивать с другими лекарственными препаратами, за исключением упомянутых в разделе 4.2. 6.3. Срок годности (срок хранения) 3 года. Вскрытый флакон использовать в течение 4-х недель. 6.4. Особые меры предосторожности при хранении При температуре от 2 до 8 °С в защищенном от света месте. Вскрытый флакон хранить при температуре не выше 25 °С. 6.5. Характер и содержание первичной упаковки По 2,5 мл раствора (глазных капель) во флаконе (полиэтилен низкой плотности) с завинчивающимся колпачком и предохранительным колпачком без резьбы с контролем первого вскрытия; по 1 флакону с инструкцией по применению (листком-вкладышем) в картонной пачке. На лицевой стороне картонной пачки, с целью контроля первого вскрытия, наносится перфорированная строчка, напоминающая очертание полуколец; боковые поверхности пачки плотно склеиваются при упаковке препарата. Примечание: контроль первого вскрытия обеспечивается прикреплением предохранительного колпачка к корпусу флакона пластиковыми перемычками. 6.6. Особые меры предосторожности при уничтожении использованного лекарственного препарата или отходов, полученных после применения лекарственного препарата и другие манипуляции с препаратом Перед использованием необходимо удалить предупреждающий несанкционированное вскрытие колпачок. 7. ДЕРЖАТЕЛЬ РЕГИСТРАЦИОННОГО УДОСТОВЕРЕНИЯ Виатрис Спешиалти Эл. ЭлСи Коллинз Ферри Роуд, 3711, Моргантаун, Западная Вирджиния 26505, США +1 724-514-1800 www.viatris.com Viatris Specialty LLC 3711 Collins Ferry Road, Morgantown, WV 26505, USA +1 724-514-1800 www.viatris.com 7.1. Представитель держателя регистрационного удостоверения Претензии потребителей направлять по адресу: Российская Федерация ООО «Виатрис» 125315, г. Москва, Ленинградский проспект, д. 72, к. 4, 2-й этаж, пом. 9, ком. 1 Телефон: +7 495 130 05 50 Факс: +7 495 130 05 51 Электронная почта: [email protected] www.viatris.com, www.viatris.ru Республика Беларусь Представительство общества с ограниченной ответственностью «MEDA Pharmaceuticals Switzerland GmbH» (Швейцарская Конфедерация) 220039, Республика Беларусь, Минск, ул. Воронянского 7А, офис 905 Телефон: +375 17 377 43 12 Электронная почта: [email protected] Республика Казахстан Представительство «МЕДА Фармасьютикалз Швейцария ГмбХ» 050051, Казахстан, г. Алматы, пр. Достык 97, офис 8 Телефон: +7 727 2641794 Электронная почта: [email protected]

Модель:
RUR 147
Бренд Тизин Международное непатентованное название Ксилометазолин Состав В 1 мл раствора содержится: действующее вещество: ксилометазолина гидрохлорид 0,5 мг (0,05%); количество активного компонента в одной дозе для 0,05 % – 0,035 мг ксилометазолина гидрохлорида; вспомогательные вещества: глицерол – 8,5 мг, сорбитол – 5 мг, натрия дигидрофосфата дигидрат – 4 мг, натрия хлорид – 3 мг, натрия фосфата дигидрат – 0,628 мг, натрия гиалуронат – 0,2 мг, вода для инъекций – до 1 мл. Возраст от 2 до 6 лет Показания к применению • уменьшение отечности слизистой оболочки носа при рините, в том числе аллергическом рините, орз с явлениями ринита, поллинозе. • облегчение отхождения выделений из носа при параназальном синусите и воспалении среднего уха, вызванном простудой. • подготовка пациентов к диагностическим манипуляциям в носовых ходах. «тизин® эксперт», cпрей назальный дозированный 0,05 % предназначен для детей в возрасте от 2 до 6 лет. «тизин® эксперт», cпрей назальный дозированный 0,1 % предназначен для взрослых и детей старше 6 лет. Способ применения и дозы Взрослые и дети старше 6 лет - 0,1 % • До 3-х раз в сутки вводят по одной дозе препарата в виде 0,1 % дозированного спрея в каждую ноздрю. Доза зависит от индивидуальной чувствительности пациента и клинического эффекта. Дети в возрасте 2–6 лет - 0,05 % • Если не назначено иное, то использовать по одной дозе препарата в виде 0,05 % дозированного спрея в каждую ноздрю 1–2 раза в сутки. Ксилометазолин в виде дозированного спрея не следует применять более 5–7 дней, если врач не рекомендовал иную длительность лечения. После завершения терапии препарат можно назначать повторно только через несколько дней. По поводу длительности применения у детей всегда советуйтесь с врачом. В случае хронического ринита препарат «Тизин® Эксперт» 0,05 % и 0,1 % можно применять только под контролем врача, учитывая риск атрофии слизистой оболочки носа. Способ применения. Снять защитный колпачок. Перед первым применением несколько раз нажать на распылительную насадку (рис. 1) до появления равномерного облачка «тумана». Флакон готов к дальнейшему использованию. При применении нажать один раз (рис.2). Препарат вдыхать через нос. По возможности держать флакон-распылитель вертикально. Не распылять горизонтально или вниз. После употребления флакон закрыть колпачком. Код АТХ R01AA07 Дозировка (концентрация) 0,05% Лекарственная форма спрей назальный дозированный Описание лекарственной формы Прозрачный или слегка опалесцирующий, бесцветный или слегка желтоватого цвета раствор. Действующие вещества Ксилометазолина гидрохлорид 0,5 мг (0,05%); количество активного компонента в одной дозе для 0,05% – 0,035 мг ксилометазолина гидрохлорида. Вспомогательные вещества Глицерол – 8,5 мг, сорбитол – 5 мг, натрия дигидрофосфата дигидрат – 4 мг, натрия хлорид – 3 мг, натрия фосфата дигидрат – 0,628 мг, натрия гиалуронат – 0,2 мг, вода для инъекций – до 1 мл. Фармакологическая группа противоконгестивное средство – вазоконстриктор Фармакодинамика Ксилометазолин (производное имидазола) — альфа-адреностимулятор, сужает кровеносные сосуды слизистой оболочки полости носа, устраняя отек и гиперемию слизистой оболочки. Облегчает носовое дыхание при ринитах. В состав препарата входят неактивные компоненты - гиалуроновая кислота (в форме натрия гиалуроната), глицерол и сорбитол, которые являются увлажнителями, позволяющими препарату уменьшать симптомы раздражения и сухости слизистой оболочки носа. Действие наступает через 2 мин после применения и продолжается в течение 12 часов. Фармакокинетика При местном применении практически не абсорбируется, концентрации в плазме настолько малы, что их невозможно определить современными аналитическими методами. У человека фармакокинетические исследования не проводились. Противопоказания • Повышенная чувствительность к любому из компонентов препарата; • атрофический ринит, тиреотоксикоз; • новорожденные и дети в возрасте до 2 лет (для спрея назального дозированного 0,05 %); дети в возрасте до 6 лет (для спрея назального дозированного 0,1 %); • пациенты с тяжелыми сердечно-сосудистыми заболеваниями (например, ишемической болезнью сердца, стенокардией, тахикардией, артериальной гипертензией, выраженным атеросклерозом); • пациенты с хирургическими вмешательствами на мозговых оболочках в анамнезе; • пациенты, получающие ингибиторы моноаминооксидазы (МАО) или другие препараты, способные вызвать повышение артериального давления; • пациенты с повышенным внутриглазным давлением, особенно с закрытоугольной глаукомой; • состояние после транссфеноидальной гипофизэктомии. Применение при беременности и в период кормления грудью Ксилометазолин не следует применять во время беременности, так как воздействие этого препарата на плод в клинических исследованиях не изучалось. Препарат не следует применять во время кормления грудью, так как неизвестно, выводится ли активное вещество с грудным молоком. Пациентам, которым следуют принимать с осторожностью В следующих случаях «Тизин® Эксперт» можно применять, только тщательно взвесив пользу и риск лечения: • пациенты с повышенной чувствительностью к адренергическим препаратам, сопровождающейся бессонницей, головокружением, аритмией, тремором, повышением артериального давления; • пациенты с феохромоцитомой; • пациенты с эндокринными заболеваниями (например, гипертиреозом, сахарным диабетом); • пациенты с гиперплазией предстательной железы; • пациенты с порфирией. Побочное действие Дыхательные пути «Тизин® Эксперт» может вызвать преходящее легкое раздражение носа (жжение) у восприимчивых людей, чихание. Часто (>1–0,01%–
Модель:
RUR 772
Лекарственная форма Порошок для приготовления раствора для внутривенного введения. Состав 1 флакон содержит: Дозировка 500 мг+100 мг: амоксициллин (в форме амоксициллина натрия) - 500 мг (530,1 мг), клавулановую кислоту (в форме клавуланата калия) - 100 мг (119,1 мг). Дозировка 1000 мг+200 мг: амоксициллин (в форме амоксициллина натрия) - 1000 мг (1060,2 мг), клавулановую кислоту (в форме клавуланата калия) - 200 мг (238,3 мг). Описание Порошок: от белого до светло-желтого цвета. Готовый к использованию раствор, разведенный 1:10 прозрачный, от бесцветного до темно-желтого цвета раствор. Фармакотерапевтическая группа Антибиотик - пенициллин полусинтетический + бета-лактамаз ингибитор. Код АТХ: J01CR02. Фармакологические свойства Фармакодинамика Механизм действия Амоксициллин - полусинтетический антибиотик широкого спектра действия, обладающий активностью против многих грамположительных и грамотрицательных микроорганизмов. Амоксициллин ингибирует один или несколько ферментов (часто называемых пенициллин- связывающими белками, ПСБ) в биосинтетическом пути метаболизма бактериального пептидогликана, который является неотъемлемым структурным компонентом клеточной стенки бактерий. Ингибирование синтеза пептидогликана приводит к ослаблению клеточной стенки, за которым, как правило, следует лизис клеток и гибель. В то же время, амоксициллин подвержен разрушению бета-лактамазами, и поэтому спектр активности амоксициллина не распространяется на микроорганизмы, которые продуцируют этот фермент. Клавулановая кислота - ингибитор бета-лактамаз, структурно родственный пенициллинам, обладает способностью инактивировать широкий спектр бета-лактамаз, обнаруженных у микроорганизмов, устойчивых к пенициллинам и цефалоспоринам. Клавулановая кислота обладает достаточной эффективностью в отношении плазмидных бета-лактамаз, которые чаще всего обуславливают резистентность бактерий, и не эффективна в отношении хромосомных бета-лактамаз I типа, которые не ингибируются клавулановой кислотой. Присутствие клавулановой кислоты в препарате защищает амоксициллин от разрушения ферментами – бета-лактамазами, что позволяет расширить антибактериальный спектр амоксициллина. Фармакокинетика Всасывание Ниже приведены результаты исследования фармакокинетики при внутривенном болюсном введении здоровым добровольцам амоксициллина и клавулановой кислоты в дозировке 500 мг + 100 мг (0,6 г) или 1000 мг + 200 мг (1,2 г) в течение 30 минут. Распределение При внутривенном введении комбинации амоксициллина с клавулановой кислотой терапевтические концентрации амоксициллина и клавулановой кислоты обнаруживаются в различных тканях и интерстициальной жидкости (в желчном пузыре, тканях брюшной полости, коже, жировой и мышечных тканях, синовиальной и перитонеальной жидкостях, желчи, гнойном отделяемом). Амоксициллин и клавулановая кислота обладают слабой степенью связывания с белками плазмы крови. Проведенные исследования показали, что с белками плазмы крови связывается около 13- 20 % каждого из компонентов препарата Амоксиклав®. В исследованиях на животных не было обнаружено кумуляции компонентов препарата Амоксиклав® в каком-либо органе. Амоксициллин, как и большинство пенициллинов, проникает в грудное молоко. В грудном молоке могут быть обнаружены также следовые количества клавулановой кислоты. За исключением возможности развития диареи или кандидоза слизистых оболочек полости рта, неизвестно никаких других негативных влияний амоксициллина и клавулановой кислоты на здоровье младенцев, вскармливаемых грудным молоком. Исследования репродуктивной функции у животных показали, что амоксициллин и клавулановая кислота проникают через плацентарный барьер. Однако не было выявлено негативного влияния на плод. Метаболизм 10-25 % от начальной дозы амоксициллина выводится почками в виде неактивного метаболита (пенициллоевой кислоты). Клавулановая кислота подвергается интенсивному метаболизму до 2,5-дигидро-4-(2-гидроксиэтил)-5-оксо-1Н-пиррол-3-карбоновой кислоты и 1-амино-4-гидрокси- бутан-2-она и выводится почками, через желудочно-кишечный тракт (ЖКТ), а также с выдыхаемым воздухом в виде диоксида углерода. Выведение Как и другие пенициллины, амоксициллин выводится, в основном, почками, тогда как клавулановая кислота - посредством как почечного, так и внепочечного механизмов. Примерно 60-70 % амоксициллина и 40-65 % клавулановой кислоты выводится почками в неизмененном виде в первые 6 ч после однократной болюсной инъекции препарата Амоксиклав® в дозировке 500 мг + 100 мг или 1000 мг + 200 мг. Одновременное введение пробенецида замедляет экскрецию амоксициллина, но не замедляет почечную экскрецию клавулановой кислоты. Фармакокинетика амоксициллина/клавулановой кислоты не зависит от пола пациента. Пациенты с нарушением функции почек Общий клиренс амоксициллина/клавулановой кислоты снижается пропорционально снижению почечной функции. Снижение клиренса более выражено для амоксициллина, чем для клавулановой кислоты, т.к. большая часть амоксициллина выводится почками. Дозы препарата при почечной недостаточности должны подбираться с учетом нежелательности кумуляции амоксициллина на фоне поддержания нормального уровня клавулановой кислоты. Пациенты с нарушением функции печени У пациентов с нарушением функции печени препарат применяют с осторожностью, необходимо проводить постоянный контроль функции печени. Оба компонента удаляются гемодиализом и незначительные количества - перитонеальным диализом. Показания к применению Препарат Амоксиклав® показан для лечения бактериальных инфекций, вызванных чувствительными к амоксициллину/клавулановой кислоте микроорганизмами: инфекции верхних дыхательных путей (включая инфекции ЛОР-органов), например, рецидивирующий тонзиллит, синусит, средний отит, обычно вызываемые Streptococcus pneumoniae, Haemophilus influenzae#, Moraxella catarrhalis# и Streptococcus pyogenes; инфекции нижних дыхательных путей, например, обострение хронического бронхита, долевая пневмония и бронхопневмония, обычно вызываемые Streptococcus pneumoniae, Haemophilus influenzae# и Moraxella catarrhalis#); инфекции мочеполового тракта, например, цистит, уретрит, пиелонефрит, инфекции женских половых органов, обычно вызываемые видами семейства Enterobacteriaceae# (преимущественно Escherichia coli#), Staphylococcus saprophyticus и видами рода Enterococcus, а также гонорея, вызываемая Neisseria gonorrhoeae#; инфекции кожи и мягких тканей, обычно вызываемые Staphylococcus aureus#, Staphylococcus pyogenes и видами рода Bacteroides#; в частности целлюлит, инфекции после укусов животных, тяжелый дентальный абсцесс с переходом в целлюлит. инфекции костей и суставов, например, остеомиелит, обычно вызываемый Staphylococcus aureus#; в этом случае может потребоваться более длительная терапия другие смешанные инфекции (например, септический аборт, послеродовой сепсис, интраабдоминальный сепсис) в рамках ступенчатой терапии. профилактика послеоперационных инфекций при хирургических вмешательствах на желудочно-кишечном тракте, органах малого таза, голове и шее, сердце, почках, желчевыводящих путях, а также при имплантации искусственных суставов. #отдельные представители указанного рода микроорганизмов продуцируют бета-лактамазу, что делает их нечувствительными к монотерапии амоксициллином. Чувствительность бактерий к комбинации амоксициллина/клавулановой кислоты варьирует в зависимости от региона с течением времени. Там, где это возможно, должны быть приняты во внимание локальные данные по чувствительности. В случае необходимости следует осуществлять сбор микробиологических образцов и проводить анализ на бактериологическую чувствительность. Противопоказания Гиперчувствительность к амоксициллину и другим пенициллинам, клавулановой кислоте, другим компонентам препарата; тяжелые реакции гиперчувствительности немедленного типа (например, анафилактические реакции) в анамнезе к другим бета-лактамным антибиотикам (например, цефалоспорины, карбапенемы или монобактамы); предшествующие эпизоды желтухи или нарушение функции печени при применении амоксициллина/клавулановой кислоты в анамнезе. С осторожностью При псевдомембранозном колите в анамнезе, заболеваниях желудочно-кишечного тракта, печеночной недостаточности, тяжелых нарушениях функции почек (клиренс креатинина менее 30 мл/мин), беременности, в период грудного вскармливания, при одновременном применении с антикоагулянтами. Применение при беременности и в период грудного вскармливания Беременность В исследованиях репродуктивной функции в доклинических исследованиях парентеральное введение препарата амоксициллин+клавулановая кислота не вызывало тератогенных эффектов. В единичном исследовании у женщин с преждевременным разрывом плодных оболочек было установлено, что профилактическая терапия препаратом может быть связана с повышением риска развития некротизирующего энтерколита у новорожденных. Амоксиклав® не рекомендуется применять во время беременности, за исключением тех случаев, когда ожидаемая польза применения для матери превышает потенциальный риск для плода. Грудное вскармливание За исключением возможности развития сенсибилизации, диареи или кандидоза слизистых оболочек полости рта, связанных с проникновением в грудное молоко следовых количеств действующих веществ этого препарата, никаких других нежелательных реакций у младенцев, находящихся на грудном вскармливании, не наблюдалось. Тем не менее, в период грудного вскармливания препарат Амоксиклав® применяют только в том случае, если предполагаемая польза для матери превышает потенциальный риск для плода и ребенка. В случае возникновения нежелательных реакций грудное вскармливание следует прекратить. Способ применения и дозы Режим дозирования устанавливается индивидуально в зависимости от возраста, массы тела, функции почек пациента, а также от степени тяжести инфекции. Лечение не должно продолжаться более 14 дней без пересмотра клинической ситуации. Препарат Амоксиклав® не предназначен для внутримышечного введения (вследствие нестабильности при концентрации, которую можно было бы вводить внутримышечно). Дозы приведены в расчете на содержание действующих веществ: амоксициллина и клавулановой кислоты. Каждые 30 мг препарата Амоксиклав® содержат 25 мг амоксициллина и 5 мг клавулановой кислоты. Внутривенно. Дети: Для детей с массой тела менее 40 кг дозу рассчитывают в зависимости от массы тела. Младше 3 месяцев с массой тела менее 4 кг – 30мг/кг каждые 12 ч. Младше 3 месяцев с массой тела более 4 кг – 30мг/кг каждые 8 ч. У детей в возрасте младше 3 месяцев препарат Амоксиклав® следует вводить только медленно инфузионно в течение 30-40 мин. Дети в возрасте от 3 месяцев до 12 лет: 30 мг/кг веса тела с интервалом 8 ч, в случае тяжелого течения инфекции - с интервалом 6 ч. Дети с нарушением функции почек Коррекция дозы основана на максимальной рекомендуемой дозе амоксициллина Пациентам с показателями клиренса креатинина (КК) выше 30 мл/мин коррекция дозы необязательна. Взрослые и дети старше 12 лет или массой тела более 40 кг: Дозы приведены в расчете на содержание действующих веществ: амоксициллина, клавулановой кислоты. 1,2 г препарата (1000 мг+200 мг) с интервалом 8 ч, в случае тяжелого течения инфекции - с интервалом 6 ч. Профилактические дозы при хирургических вмешательствах: 1,2 г при вводном наркозе (при продолжительности операции менее 1 часа). При продолжительности операции более 1 часа - по 1,2 г до 4 раз в течение суток. Для пациентов с почечной недостаточностью доза и/или интервал между введениями препарата должны быть скорректированы в зависимости от степени недостаточности. Поскольку 85 % препарата удаляется гемодиализом, в конце каждой процедуры гемодиализа необходимо вводить обычную дозу препарата Амоксиклав®. При перитонеальном диализе коррекция доз не требуется. Курс лечения составляет 5-14 дней. Продолжительность курса лечения определяется лечащим врачом. При уменьшении степени тяжести симптомов для продолжения терапии рекомендуется переход на пероральные формы препарата Амоксиклав®. Приготовление растворов для внутривенных инъекций Растворить содержимое флакона в воде для инъекций 600 мг (500 мг+100 мг) в 10 мл воды для инъекций или 1,2 г (1000 мг+200 мг) - в 20 мл (не более) воды для инъекций. Внутривенно вводить медленно (в течение 3-4 мин). Препарат Амоксиклав® должен вводиться в течение 20 мин после приготовления растворов для внутривенного введения. Приготовление растворов для внутривенных инфузий Для инфузионного введения препарата Амоксиклав® необходимо дальнейшее разведение: приготовленные растворы, содержащие 600 мг (500 мг+100 мг) или 1,2 г (1000 мг+200 мг) препарата, должны быть разведены в 50 мл или 100 мл инфузионного раствора соответственно. Продолжительность инфузии 30-40 мин. Раствор препарата Амоксиклав® нельзя смешивать с растворами декстрозы, декстрана или натрия гидрокарбоната. Следует использовать только прозрачные растворы. Приготовленные растворы не следует замораживать. Побочное действие Наиболее частыми нежелательными реакциями являются диарея, рвота и тошнота. По данным Всемирной организации здравоохранения (ВОЗ) нежелательные реакции классифицированы в соответствии с их частотой развития следующим образом: очень часто (более 1/10), часто (более 1/100, менее 1/10), не часто (более 1/1000, менее 1/100), редко (более 1/10000, менее 1/1000) и очень редко (менее 1/10000), частота неизвестна - по имеющимся данным установить частоту возникновения не представлялось возможным. Инфекционные и паразитарные заболевания часто: кандидоз кожи и слизистых оболочек; частота неизвестна: рост резистентности микроорганизмов. Нарушения со стороны органов кроветворения и лимфатической системы редко: обратимая лейкопения (включая нейтропению), тромбоцитопения; очень редко: эозинофилия, тромбоцитоз, анемия; частота неизвестна: обратимый агранулоцитоз, гемолитическая анемия, увеличение времени кровотечения и обратимое увеличение протромбинового времени. Нарушения со стороны иммунной системы частота неизвестна: ангионевротический отек, анафилактические реакции, аллергический васкулит, синдром, сходный с сывороточной болезнью. Нарушения со стороны нервной системы нечасто: головокружение, головная боль; очень редко: Судороги могут наблюдаться у пациентов с нарушением функции почек, а также у пациентов, получающих высокие дозы препарата. Бессонница, возбуждение, тревога, изменение поведения; частота неизвестна: асептический менингит, судороги. Нарушения со стороны сосудов редко: тромбофлебит (в месте введения). Нарушения со стороны желудочно-кишечного тракта часто: диарея; нечасто: тошнота, рвота, расстройство пищеварения; частота неизвестна: антибиотико-ассоциированный колит (включая псевдомембранозный и геморрагический колит). Нарушения со стороны кожи и подкожной жировой клетчатки нечасто: кожная сыпь, зуд, крапивница; редко: мультиформная экссудативная эритема; частота неизвестна: синдром Стивенса-Джонсона, токсический эпидермальный некролиз, буллезный эксфолиативный дерматит, острый генерализованный экзантематозный пустулез (AGEP) и лекарственная сыпь с эозинофилией и системной симптоматикой (DRESS-синдром). Нарушения со стороны мочевыделительной системы частота неизвестна: кристаллурия, интерстициальный нефрит. Нарушения со стороны печени и желчевыводящих путей нечасто: повышение активности «печеночных» трансаминаз (умеренное повышение аланинаминотрансферазы (АЛТ) и/или аспартатаминотрансферазы (АСТ) наблюдается у пациентов, получающих терапию бета-лактамными антибиотиками, однако его клиническая значимость неизвестна); очень редко: повышение активности щелочной фосфатазы, гипербилирубинемия; частота неизвестна: гепатит, холестатическая желтуха (отмечались при сопутствующей терапии другими пенициллинами и цефалоспоринами). Нежелательные реакции со стороны печени наблюдались, главным образом, у мужчин и пациентов пожилого возраста и могут быть связаны с длительной терапией. Данные нежелательные реакции очень редко наблюдаются у детей. Перечисленные признаки и симптомы обычно встречаются в процессе или сразу по окончании терапии, однако в отдельных случаях могут не проявляться в течение нескольких недель после завершения терапии. Нежелательные явления, как правило, являются обратимыми. Нежелательные явления со стороны печени могут быть тяжелыми, в исключительно редких случаях были сообщения о летальных исходах. Почти во всех случаях это были пациенты с серьезной сопутствующей патологией или пациенты, получающие одновременно потенциально гепатотоксичные препараты. Передозировка Сообщений о летальном исходе или возникновении угрожающих жизни побочных эффектов вследствие передозировки препарата нет. Симптомы Могут наблюдаться симптомы со стороны ЖКТ (боль в животе, диарея, рвота), и нарушения водно- электролитного баланса, возможны также тревожное возбуждение, бессонница, головокружение, в единичных случаях - судорожные припадки. Описана амоксициллиновая кристаллурия, в некоторых случаях приводившая к развитию почечной недостаточности (см. раздел «Особые указания»). Судороги могут возникать у пациентов с нарушением функции почек или у пациентов, получавших высокие дозы препарата. После внутривенного введения больших доз амоксициллина он может выпадать в осадок в мочевых катетерах. Поэтому должна осуществляться регулярная проверка проходимости мочевых катетеров. Лечение При передозировке пациент должен находиться под наблюдением врача. При наличии симптомов со стороны ЖКТ должна проводиться симптоматическая терапия, уделяя особое внимание нормализации водно-электролитного баланса. Амоксициллин и клавулановая кислота могут быть удалены из кровотока путем гемодиализа. Взаимодействие с другими лекарственными средствами Не рекомендуется совместное применение с пробенецидом. Пробенецид снижает канальцевую секрецию амоксициллина. Одновременное применение пробенецида может привести к повышению и пролонгированию концентрации амоксициллина в крови, но не клавулановой кислоты. Диуретики, аллопуринол, фенилбутазон, нестероидные противовоспалительные препараты (НПВП) и другие лекарственные средства, блокирующие канальцевую секрецию, повышают концентрацию амоксициллина (клавулановая кислота выводится в основном путем клубочковой фильтрации). Одновременное применение препарата Амоксиклав® и метотрексата повышает токсичность метотрексата. Бактериологические лекарственные средства (макролиды, хлорамфеникол, линкозамиды, тетрациклины, сульфаниламиды) оказывают антагонистическое действие. Уменьшает эффективность лекарственных средств, в процессе метаболизма которых образуется парааминобензойная кислота, этинилэстрадиол – риск развития кровотечений «прорыва». Повышает эффективность непрямых антикоагулянтов (подавляя кишечную микрофлору, снижает синтез витамина К и протромбиновый индекс). В некоторых случаях прием препарата может удлинять протромбиновое время, в связи с этим следует соблюдать осторожность при одновременном применении антикоагулянтов и препарата Амоксиклав®. Антикоагулянты непрямого действия и антибиотики пенициллинового ряда широко используют в практике; взаимодействия не были отмечены. Однако в литературе описаны случаи увеличения международного нормализованного отношения (МНО) у пациентов при одновременном применении аценокумарина или варфарина с амоксициллином. При необходимости одновременного применения с антикоагулянтами протромбиновое время или МНО должны тщательно контролироваться при назначении или отмене препарата, может потребоваться коррекция дозы антикоагулянтов. У пациентов, получавших микофенолата мофетил, после начала применения комбинации амоксициллина с клавулановой кислотой наблюдалось снижение концентрации активного метаболита - микофеноловой кислоты - до приема очередной дозы препарата приблизительно на 50 %. Изменения данной концентрации не могут точно отражать общие изменения экспозиции микофеноловой кислоты. Одновременное применение аллопуринола и амоксициллина может повышать риск возникновения кожных аллергических реакций. В настоящее время в литературе нет данных об одновременном применении комбинации амоксициллина с клавулановой кислотой и аллопуринола. При комбинации с рифампицином наблюдается взаимное ослабление антибактериального эффекта. Следует избегать одновременного применения с дисульфирамом. Препарат Амоксиклав® и аминогликозидные антибиотики физически и химически несовместимы. Одновременное применение амоксициллина и дигоксина может приводить к увеличению концентрации дигоксина в плазме крови. Препарат Амоксиклав® снижает эффективность пероральных контрацептивов. Фармацевтическая несовместимость Препарат Амоксиклав® не следует смешивать с препаратами крови, другими белок-содержащими жидкостями, такими как белковые гидролазы, или с внутривенными липидными эмульсиями. При одновременном применении с аминогликозидами антибиотики не следует смешивать в одном шприце или в одном флаконе для внутривенных жидкостей, поскольку в таких условиях аминогликозиды теряют активность. Избегать смешивания с растворами декстрозы, декстрана, натрия гидрокарбоната. Особые указания Перед началом лечения необходимо опросить пациента для выявления в анамнезе реакций гиперчувствительности на пенициллины, цефалоспорины или другие бета-лактамные антибиотики. Описаны серьезные, а иногда и летальные реакции гиперчувствительности на пенициллины (включая анафилактоидные и тяжелые кожные реакции). Риск возникновения таких реакций наиболее высок у пациентов, имеющих в анамнезе реакции гиперчувствительности на пенициллины и у пациентов с атопией. В случае возникновения аллергической реакции необходимо прекратить лечение препаратом Амоксиклав® и назначить соответствующую альтернативную терапию. При серьезных анафилактических реакциях следует незамедлительно ввести пациенту эпинефрин. Могут потребоваться также оксигенотерапия, внутривенное введение глюкокортикостероидов и обеспечение проходимости дыхательных путей, включая интубацию. В случае, если доказано, что инфекция вызвана микроорганизмами, чувствительными к амоксициллину, следует рассмотреть целесообразность перехода от комбинации амоксициллина с клавулановой кислотой к амоксициллину в соответствии с национальными рекомендациями. Данная форма препарата Амоксиклав® может быть неэффективна при наличии высокой вероятности устойчивости патогенных микроорганизмов к бета-лактамным антибиотикам, которая не опосредована чувствительностью бета-лактамаз к ингибированию клавулановой кислотой. Данная фармацевтическая форма может быть неэффективна при лечении инфекций, вызванных устойчивыми к пенициллину S. pneumoniae. При почечной недостаточности или при лечении высокими дозами препарата могут наблюдаться судороги. В случае подозрения на инфекционный мононуклеоз препарат Амоксиклав® не следует применять, поскольку у пациентов с этим заболеванием амоксициллин может вызывать кореподобную сыпь, что затрудняет диагностику заболевания. Прием аллопуринола во время лечения амоксициллином может повышать вероятность возникновения кожных аллергических реакций. Появление в начале лечения генерализованной эритемы, которая сопровождается пустулами, может быть симптомом острого генерализованного экзантематозного пустулеза. Это требует прекращения лечения, дальнейшее применение препарата противопоказано. Препарат Амоксиклав® следует с осторожностью применять у пациентов с признаками печеночной недостаточности. Об осложнениях со стороны печени сообщалось преимущественно у мужчин и пациентов пожилого возраста, они могут быть также связаны с длительным лечением. О таких случаях очень редко сообщалось при применении у детей. Во всех группах пациентов признаки и симптомы обычно появляются во время или вскоре после лечения, но в некоторых случаях могут отсутствовать вплоть до нескольких недель после прекращения лечения. Они обычно обратимы. Осложнения со стороны печени могут быть выраженными и в крайне редких случаях сообщалось о летальных исходах. Они почти всегда случались у пациентов с тяжелыми сопутствующими заболеваниями или в случае совместного применения лекарственных средств, потенциально влияющих на печень. Описаны случаи возникновения псевдомембранозного колита при приеме антибиотиков, степень тяжести которого может варьироваться от легкой до угрожающей жизни. Таким образом, важно его диагностировать у пациентов, у которых развивается диарея во время или после применения антибиотиков. Если диарея длительная или пациент испытывает спазмы в животе, лечение должно быть немедленно прекращено, и пациент должен быть обследован. Применение препаратов, тормозящих перистальтику кишечника, противопоказано. В целом, препарат Амоксиклав® переносится хорошо и обладает свойственной всем пенициллинам низкой токсичностью. При курсовом лечении необходимо проводить контроль за состоянием функции органов кроветворения, печени, почек. У пациентов, получающих комбинацию амоксициллина с клавулановой кислотой совместно с непрямыми (пероральными) антикоагулянтами, в редких случаях сообщалось об увеличении протромбинового времени. При совместном назначении непрямых (пероральных) антикоагулянтов с комбинацией амоксициллина с клавулановой кислотой необходим контроль соответствующих показателей. Для поддержания необходимого эффекта пероральных антикоагулянтов может потребовать коррекция их дозы. У пациентов с тяжелыми нарушениями функции почек требуется адекватная коррекция дозы или увеличение интервалов между дозированием в зависимости от показателей клиренса креатинина. Возможно развитие суперинфенкции за счет роста нечувствительной к комбинации амоксициллина с клавулановой кислотой микрофлоры, что требует соответствующего изменения антибактериальной терапии. У пациентов, имеющих повышенную чувствительность к пенициллинам, возможны перекрестные аллергические реакции с цефалоспориновыми антибиотиками. У женщин с преждевременным разрывом плодных оболочек было установлено, что профилактическая терапия комбинацией амоксициллина с клавулановой кислотой может быть связана с повышением риска развития некротизирующего колита у новорожденных. Амоксициллин и клавулановая кислота могут провоцировать неспецифическое связывание иммуноглобулинов и альбуминов с мембраной эритроцитов, что может быть причиной ложноположительной пробы Кумбса. У пациентов со сниженным диурезом очень редко возникает кристаллурия. Во время введения больших доз амоксициллина рекомендуется принимать достаточное количество жидкости и поддерживать адекватный диурез для уменьшения вероятности образования кристаллов амоксициллина. Препарат содержит калий. Информация для пациентов, соблюдающих диету с пониженным содержанием натрия: в каждом флаконе 600 мг (500 мг+100 мг) содержится 29,7 мг натрия. В каждом флаконе 1,2 г (1000 мг+200 мг) содержится 59,3 мг натрия. Количество натрия в максимальной ежедневной дозе превышает 200 мг. Лабораторные анализы: высокие концентрации амоксициллина дают ложноположительную реакцию на глюкозу мочи при использовании реактива Бенедикта или раствора Феллинга. Рекомендуется использовать ферментативные реакции с глюкозооксидазой. Были отмечены случаи положительных результатов теста с использованием ферментативного иммуноанализа Bio-Rad Laboratories Platelia Aspergillus у пациентов, получающих комбинацию амоксициллина с клавулановой кислотой, у которых впоследствии не было выявлено инфекции Aspergillus. Были отмечены перекрестные реакции с полисахаридами не-Aspergillus и полифуранами с ферментативным иммуноанализом Bio-Rad Laboratories Platelia Aspergillus. Поэтому следует соблюдать осторожность при интерпретации положительных результатов анализов у пациентов, получающих комбинацию амоксициллина с клавулановой кислотой, а также необходимо подтверждать их при помощи других диагностических методов. Влияние на способность управлять транспортными средствами, механизмами Из-за возможности развития побочных эффектов со стороны центральной нервной системы, таких как: головокружение, головная боль, судороги, во время лечения следует соблюдать осторожность при управлении автомобилем и занятиях другими видами деятельности, требующими концентрации внимания и быстроты психомоторных реакций. Форма выпуска Порошок для приготовления раствора для внутривенного введения 500 мг + 100 мг, 1000 мг + 200 мг. По 500 мг амоксициллина и 100 мг клавулановой кислоты или по 1000 мг амоксициллина и 200 мг клавулановой кислоты во флакон бесцветного стекла, закрытый резиновой пробкой и обжатый алюминиевым колпачком с пластмассовой крышкой. По 5 флаконов в картонную пачку вместе с инструкцией по применению. Срок годности 2 года. Не использовать препарат после истечения срока годности, указанного на упаковке! Условия хранения Хранить в защищенном от света месте при температуре не выше 25°C. Хранить в недоступном для детей месте. Условия отпуска Отпускают по рецепту

Модель:
RUR 3655
Показания У женщин: - индукция овуляции при бесплодии, обусловленном ановуляцией или нарушением созревания фолликулов: - подготовка фолликулов к пункции в программах контролируемой гиперстимуляции яичников (для методик вспомогательной репродукции): - поддержание фазы желтого тела. У мужчин: - гипогонадотропный гипогонадизм: - проведение функционального теста Лейдига для оценки функции яичек при гипогонадотропном гипогонадизме перед началом долгосрочного стимулирующего лечения. Противопоказания Противопоказания - Повышенная чувствительность к ХГЧ или к любому компоненту препарата: - гормонозависимые злокачественные опухоли половых органов и молочной железы в настоящее время или подозрение на них (рак яичника, рак молочной железы, рак матки у женщин и рак предстательной железы, карцинома грудной железы у мужчин): - органические поражения центральной нервной системы (ЦНС) (опухоли гипофиза, гипоталамуса): - тромбофлебит глубоких вен: - гипотиреоз: - надпочечниковая недостаточность: - гиперпролактинемия. У мужчин (дополнительно): - бесплодие, не связанное с гипогонадотропным гипогонадизмом. У женщин (дополнительно): - неправильное формирование половых органов, несовместимое с беременностью: - фиброзная опухоль матки, несовместимая с беременностью: - синдром гиперстимуляции яичников (СГЯ) в анамнезе: - синдром поликистозных яичников (СПКЯ): - первичная недостаточность яичников: - кровотечение или кровянистые выделения из влагалища неясной этиологии: - беременность и период грудного вскармливания. С осторожностью: У женщин, имеющих факторы риска тромбоза (тромбоз или тромбоэмболии в анамнезе, или у родственников 1-й степени родства, тяжелое ожирение (индекс массы тела >:30 кг/м 2) или врожденная или наследственная предрасположенность к тромбозам (включая резистентность к активированному протеину С, дефицит антитромбина III, дефицит протеина С, дефицит протеина S, гипергомоцистеинемия, антитела к фосфолипидам)). У мужчин с латентной или явной сердечной недостаточностью, нарушением функции почек, артериальной гипертензией, эпилепсией или мигренью (или при наличии этих состояний в анамнезе): у пациентов с бронхиальной астмой. Если у Вас одно из перечисленных заболеваний, перед приёмом препарата обязательно проконсультируйтесь с врачом. Беременность Применение препарата Гонадотропин хорионический во время беременности и грудного вскармливания противопоказано. Применение и дозы После добавления растворителя к лиофилизату восстановленный раствор гонадотропина хорионического вводится внутримышечно, медленно. Приготовленный раствор хранению не подлежит, поскольку дальнейшее сохранение стерильности раствора не гарантировано. Указанные дозировки являются приблизительными, лечение должно корректироваться врачом индивидуально в зависимости от необходимой реакции на введение препарата. У женщин: - при индукции овуляции при бесплодии, обусловленном ановуляцией или нарушением созревания фолликулов, обычно проводится одна инъекция гонадотропина хорионического в дозе от 5000 до 10000 ME для завершения лечения препаратами фолликулостимулирующего гормона: - при подготовке фолликулов к пункции в программах контролируемой гиперстимуляции яичников гонадотропин хорионический однократно вводят в дозировке 5000 ME - 10000 ME: - для поддержания фазы желтого тела может быть сделано от двух до трех повторных инъекций препарата в дозе от 1500 до 5000 ME каждая в течение 9 дней после овуляции или переноса эмбриона (например, на 3, 6 и 9 день после индукции овуляции). У мужчин: - при гипогонадотропном гипогонадизме - 1500 ME - 6000 ME 1 раз в неделю. В случае бесплодия возможно сочетание гонадотропина хорионического с дополнительным препаратом, содержащим фоллитропин (фолликулостимулирующий гормон) 2-3 раза в неделю. Курс лечения должен продолжаться не менее 3 месяцев, когда можно ожидать какое-либо улучшение сперматогенеза. Во время этого лечения необходимо приостановить заместительную, терапию тестостероном. Когда улучшение сперматогенеза достигнуто, для его поддержания достаточно в некоторых случаях изолированного применения гонадотропина хорионического: - при проведении функционального теста Лейдига в течение 3-х дней вводится гонадотропин хорионический в дозе 5000 ME внутримышечно в одно и то же время. На следующий день после последней инъекции проводится забор крови и исследуется уровень тестостерона. Если наблюдается его повышение от исходных значений на 30-50% или более, то проба оценивается как положительная. Предпочтительно комбинировать эту пробу с проведением в тот же день (следующий день после последней инъекции) еще одной спермограммы. Побочные эффекты и передозировка Побочные эффекты: Нарушения со стороны иммунной системы: в редких случаях может возникать генерализованная сыпь или лихорадка. Общие расстройства и нарушения в месте введения: при применении гонадотропина хорионического могут возникнуть реакции в месте инъекции, например, кровоподтёк, боль, покраснение, припухлость и зуд. В некоторых случаях сообщалось об аллергических реакциях, большая часть из которых проявлялась в виде боли и/или сыпи в месте инъекции: повышенная утомляемость. У женщин: Нарушения со стороны обмена веществ и питания: увеличение массы тела как признак тяжелого СГЯ: отеки. Нарушения психики: раздражительность, тревожность, депрессия. Нарушения со стороны нервной системы: головная боль. Нарушения со стороны сосудов: в редких случаях тромбоэмболические осложнения, связанные с комбинированной терапией ановуляторного бесплодия (в сочетании с фолликулостимулирующим гормоном), осложнившейся тяжелой формой СГЯ. Нарушения со стороны дыхательной системы, органов грудной клетки и средостения: гидроторакс при тяжелой форме СГЯ. Нарушения со стороны желудочно-кишечного тракта: боль в животе и диспептические симптомы, такие как тошнота и диарея, связанные с умеренным СГЯ: асцит при тяжелой форме СГЯ. Нарушения со стороны половых органов и молочной железы: болезненность молочных желез: СГЯ средней степени тяжести (размеры яичников более 5 см в диаметре) и тяжелой формы (большие кисты яичников, более 12 см в диаметре, склонные к разрыву). Клинические проявления СГЯ средней степени тяжести и тяжелой формы (диарея, чувство тяжести внизу живота, распирающие боли в животе, гемоперитонеум: тахикардия, снижение артериального давления: нарушения гемостаза, повышение активности печеночных трансаминаз: олигурия, острая почечная недостаточность, одышка, дыхательная недостаточность). У мужчин: Нарушения со стороны кожи и подкожных тканей: угри. Нарушения со стороны половых органов и грудной железы: лечение гонадотропином хорионическим спорадически может вызывать гинекомастию: гиперплазия предстательной железы, увеличение полового члена, повышенная чувствительность сосков грудных желез у мужчин. Если любые из указанных в инструкции побочных эффектов усугубляются, или Вы заметили любые другие побочные эффекты, не указанные в инструкции, сообщите об этом врачу. Передозировка: Гонадотропин хорионический характеризуется крайне низкой токсичностью. У женщин на фоне передозировки может возникнуть СГЯ тяжелой степени. Лечение проводится в условиях стационара. Принципы лечения СГЯ тяжелой степени: - контроль за функцией сердечно-сосудистой системы (ССС), дыхательной системы, печени, почек, электролитным и водным балансом (диурез, динамика веса, изменение окружности живота): контроль уровня гематокрита: кристаллоидные растворы внутривенно капельно (для восстановления и поддержания объёма циркулирующей крови (ОЦК)): - коллоидные растворы внутривенно капельно - 1,5-3 л/сутки (при сохранении гемоконцентрации) и стойкой олигурии: - гемодиализ (при развитии почечной недостаточности): - кортикостероидные, антипростагландиновые, антигистаминные препараты (для снижения проницаемости капилляров): - при тромбоэмболии - низкомолекулярные гепарины (фраксипарин, клексан): - плазмаферез - 1-4 сеанса с интервалом 1-2 дня (улучшение реологических свойств крови, нормализация кислотно-основного состояния (КОС) и газового состава крови, уменьшение размеров яичников): - парацентез и трансвагинальная пункция брюшной полости при асците. У мужчин возможно развитие гинекомастии: атрофия семенных канальцев (вследствие торможения продукции фолликулостимулирующего гормона (ФСГ) в результате стимуляции продукции андрогенов и эстрогенов): уменьшение количества сперматозоидов в эякуляте (при злоупотреблении препаратом). Длительное применение препарата может привести к усилению побочных эффектов. Взаимодействие с другими ЛС: При лечении бесплодия гонадотропин человеческий, применяемый в сочетании с препаратами человеческого менопаузного гонадотропина (МГЧ), может усилить симптомы гиперстимуляции яичников, наступившей в результате применения МГЧ. Необходимо избегать совместного применения препарата Гонадотропин хорионический с высокими дозами глюкокортикостероидов. Не отмечены другие взаимодействия с лекарственными средствами. Фармакологическое действие и фармакокинетика Гонадотропин хорионический человеческий (ХГЧ) - гонадотропный гормон, который продуцируется плацентой во время беременности, затем в неизмененном виде выводится почками. Для получения препарата экстрагируется из мочи и очищается. Необходим для нормального роста и созревания гамет у женщин и мужчин, а также для выработки половых гормонов. Оказывает гонадотропное действие, фолликулостимулирующее и лютеинизирующее. Лютеинизирующая активность преобладает над фолликулостимулирующей. Стимулирует развитие половых органов и вторичных половых признаков. У женщин препарат вызывает овуляцию и стимулирует синтез эстрогенов (эстрадиола) и прогестерона. У мужчин - стимулирует сперматогенез, продукцию тестостерона и дигидротестостерона. Фармакокинетика: После внутримышечного введения хорошо всасывается. Период полувыведения составляет 8 ч. Максимальная концентрация ХГЧ в плазме крови достигается через 4-12 часов. Период полувыведения гонадотропина хорионического составляет 29-30 ч, в случае ежедневных внутримышечных инъекций может наблюдаться кумуляция препарата. Гонадотропин хорионический выводится почками. Около 10-20% введенной дозы обнаруживается в моче в неизмененном виде, основная часть выводится в виде фрагментов β-цепи. Особые указания Применение гонадотропина повышает риск развития венозной или артериальной тромбоэмболии, поэтому необходимо оценить преимущества терапии экстракорпорального оплодотворения пациентам, попадающим в группу риска. Также следует отметить, что беременность сама по себе также сопровождается повышенным риском тромбоза. Повышается вероятность возникновения многоплодной беременности. Многоплодная беременность сопровождается повышенным риском для матери (осложненное течение беременности и родов, преждевременные роды) и для новорожденных (низкая масса тела, недоношенность и т.д.). Во время лечения препаратом и в течение 10 дней после прекращения лечения препарат Гонадотропин хорионический может оказывать, влияние на значения иммунологических тестов на концентрацию ХГЧ в плазме крови и моче, что может привести к ложноположительному результату теста на беременность. Перед началом применения препарата у женщин необходимо провести ультразвуковое исследование (УЗИ) органов малого таза для уточнения размеров и количества фолликулов: в процессе лечения - ежедневное контрольное УЗИ, определение концентрации эстрадиола в плазме крови, тщательное наблюдение за состоянием пациентки. В случае развития СГЯ лечение должно быть прекращено. У женщин с бесплодием, которым предложено лечение методами вспомогательных репродуктивных технологий (особенно, экстракорпоральное оплодотворение), часто встречается патология маточных труб, что может привести к повышению риска эктопической беременности, в связи с чем на ранних этапах беременности следует провести ультразвуковое исследование для уточнения локализации плодного яйца. Лечение пациентов мужского пола с помощью гонадотропина хорионического приводит к повышению продукции андрогенов, поэтому попадающие в группу риска пациенты должны находиться под строгим врачебным контролем, поскольку обострение болезни или рецидив иногда могут являться результатом повышенной продукции андрогенов. У мужчин препарат неэффективен при высоком содержании фолликулостимулирующего гормона. Длительное введение может привести к образованию антител к препарату. Влияние на способность управлять транспортными средствами: В период лечения необходимо воздерживаться от вождения автотранспорта и занятий потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций. Условия хранения и отпуска из аптек Условия хранения:В защищенном от света месте, при температуре не выше 20 °С. Хранить в местах, недоступных для детей. Отпуск из аптек: По рецепту Регистрационные данные Торговое название Гонадотропин хорионический Международное непатентованное название:Гонадотропин хорионический. Форма выпуска:лиофилизат для приготовления раствора для внутримышечного введения. Состав:На 1 флакон: активное вещество: гонадотропин хорионический 5000 ME: вспомогательные вещества: маннитол (маннит) 20,0 мг. АТХ: Регистрация: Лекарственное средство ЛС-002615 Фармгруппа: Лютеинизирующее средство. Дата регистрации: 04.05.2012. Окончание регстрации: . Описание:Лиофилизированный белый или почти белый порошок. Упаковка:Лиофилизат для приготовления раствора для внутримышечного введения, 5000 МЕ. По 5000 ME препарата во флаконах из трубки стеклянной. 5 флаконов с препаратом в контурной ячейковой упаковке из пленки поливинилхлоридной в комплекте с 5 ампулами по 1 мл растворителя (натрия хлорид, раствор для инъекций 9 мг/мл) в контурной ячейковой упаковке из пленки поливинилхлоридной вместе с инструкциями по применению препарата и растворителя, скарификатором или ножом ампульным в пачку из картона. При упаковке ампул с насечками, кольцами и точками надлома скарификаторы или ножи ампульные не вкладывают. Срок годности:3 года. Не использовать по истечении срока годности. Владелец рег.удостоверения:МОСКОВСКИЙ ЭНДОКРИННЫЙ ЗАВОД, ФГУП Производитель:МОСКОВСКИЙ ЭНДОКРИННЫЙ ЗАВОД, ФГУП. Представительство:МОСКОВСКИЙ ЭНДОКРИННЫЙ ЗАВОД ФГУП
Модель:
RUR 925
Показания Диабетическая полинейропатия:алкогольная полинейропатия. Противопоказания Противопоказания Гиперчувствительность к тиоктовой кислоте или другим компонентам препарата в анамнезе:возраст до 18 лет (эффективность и безопасность применения препарата не установлены):беременность, период грудного вскармливания (отсутствует достаточный опыт применения препарата). С осторожностью: Беременность Ввиду отсутствия достаточного клинического опыта применения препарата Берлитион® 600 при беременности и в период грудного вскармливания, его применение у соответствующей категории пациенток не рекомендуется. Применение и дозы Препарат предназначен для инфузионного введения.В начале лечения препарат Берлитион® 600 назначают внутривенно капельно в суточной дозе 600 мг (1 ампула). Перед применением содержимое 1 ампулы (24 мл) разводят в 250 мл 0,9 % раствора натрия хлорида и вводят внутривенно капельно, медленно, в течение не менее 30 мин. Из-за светочувствительности действующего вещества, раствор для инфузий готовят непосредственно перед применением. Приготовленный раствор необходимо защищать от воздействия света, например, с помощью алюминиевой фольги. Курс лечения препаратом Берлитион® 600 составляет 2-4 недели. В качестве последующей поддерживающей терапии применяют тиоктовую кислоту в пероральной форме в суточной дозе 300-600 мг. Продолжительность курса лечения и необходимость его повторения определяется врачом. Побочные эффекты и передозировка Побочные эффекты: Возможные побочные эффекты при применении препарата Берлитион® 600 приведены ниже по нисходящей частоте возникновения: часто ( 1/100, <: 1/10), нечасто ( 1/1000, <: 1/100), редко ( 1/10000, <: 1/1000), очень редко (<: 1 /10000), включая отдельные сообщения. Корреляции частоты возникновения побочных эффектов с полом или возрастом пациентов не наблюдается. Со стороны нервной системы:Очень редко: изменение или нарушение вкусовых ощущений, диплопия, судороги. Со стороны системы кроветворения:Очень редко: тромбоцитопатия, геморрагическая сыпь (пурпура), тромбофлебит. Со стороны обмена веществ:Очень редко: снижение концентрации глюкозы в плазме крови (из-за улучшения усвоения глюкозы). Сообщалось о жалобах, свидетельствующих о гипогликемическом состоянии (головокружение, потливость, головная боль и нарушение зрения). Со стороны иммунной системы:Очень редко: аллергические реакции, такие как кожная сыпь, крапивница, зуд, в единичных случаях - анафилактический шок. Местные реакции:Очень редко: чувство жжения в месте введения. Прочие: при быстром внутривенном введении наблюдались самопроизвольно проходящие повышение внутричерепного давления (чувство тяжести в голове) и затруднение дыхания. Передозировка: Симптомы: тошнота, рвота, головная боль.В тяжелых случаях: психомоторное возбуждение или помутнение сознания,генерализованные судороги, выраженные нарушения кислотно-щелочного равновесия, лактоацидоз, гипогликемия (вплоть до развития комы), острый некроз скелетных мышц, ДВС-синдром, гемолиз, подавление деятельности костного мозга, полиорганная недостаточность. Лечение: При подозрении на интоксикацию тиоктовой кислотой (например, введение более 80 мг тиоктовой кислоты на 1 кг массы тела) рекомендуется экстренная госпитализация и немедленное применение мер в соответствии с общими принципами, принятыми при случайном отравлении. Терапия симптоматическая. Лечение генерализованных судорог, лактоацидоза и других угрожающих жизни последствий интоксикации должно проводиться в соответствии с принципами современной интенсивной терапии. Специфического антидота нет. Гемодиализ, гемоперфузия или методы фильтрации с принудительным выведением тиоктовой кислоты не эффективны. Взаимодействие с другими ЛС: В связи с тем, что тиоктовая кислота способна образовывать хелатные комплексы с металлами, следует избегать одновременного назначения с препаратами железа. Одновременное применение препарата Берлитион® 600 с цисплатином снижает эффективность последнего.С молекулами сахаров тиоктовая кислота образует плохо растворимые комплексные соединения. Препарат Берлитион® 600 несовместим с растворами глюкозы, фруктозы и декстрозы, раствором Рингера, а также с растворами, реагирующими с дисульфидными и SH-группами. Препарат Берлитион® 600 усиливает гипогликемическое действие инсулина и гипогликемических средств для приема внутрь при одновременном применении. Этанол значительно снижает терапевтическую эффективность тиоктовой кислоты. Фармакологическое действие и фармакокинетика Тиоктовая (альфа-липоевая) кислота - эндогенный антиоксидант прямого (связывает свободные радикалы) и непрямого действия. Является коферментом реакций декарбоксилирования альфа-кетокислот. Способствует снижению концентрации глюкозы в плазме крови и увеличению концентрации гликогена в печени, также снижает инсулинорезистентность, участвует в регулировании углеводного и липидного обменов, стимулирует обмен холестерина. Благодаря своим антиоксидантным свойствам, тиоктовая кислота защищает клетки от повреждения их продуктами распада, уменьшает образование конечных продуктов прогрессирующего гликозилирования белков в нервных клетках при сахарном диабете, улучшает микроциркуляцию и эндоневральный кровоток, повышает физиологическое содержание антиоксиданта глутатиона. Способствуя снижению концентрации глюкозы в плазме крови, воздействует на альтернативный метаболизм глюкозы при сахарном диабете, снижает накопление патологических метаболитов в виде полиолов, и, тем самым, уменьшает отек нервной ткани. Благодаря участию в метаболизме жиров, тиоктовая кислота увеличивает биосинтез фосфолипидов, в частности, фосфоинозитидов, благодаря чему улучшает поврежденную структуру клеточных мембран: нормализует энергетический обмен и проведение нервных импульсов. Тиоктовая кислота устраняет токсическое влияние метаболитов алкоголя (ацетальдегида, пировиноградной кислоты), уменьшает избыточное образование молекул свободных кислородных радикалов, уменьшает эндоневральную гипоксию и ишемию, ослабляя проявления полинейропатии в виде парестезий, ощущения жжения, боли и онемения конечностей. Таким образом, тиоктовая кислота оказывает антиоксидантное, нейротрофическое действие, улучшает метаболизм липидов. Применение тиоктовой кислоты в виде этилендиаминовой соли позволяет уменьшить выраженность возможных побочных эффектов. Фармакокинетика: При внутривенном введении тиоктовой кислоты максимальная концентрация в плазме крови через 30 мин составляет около 20 мкг/мл, площадь под кривой "концентрация-время" - около 5 мкг/ч/мл. Обладает эффектом "первого прохождения" через печень. Образование метаболитов происходит в результате окисления боковой цепи и конъюгирования. Объем распределения - около 450 мл/кг. Общий плазменный клиренс - 10-15 мл/мин/кг. Выводится почками (80-90%), преимущественно в виде метаболитов. Период полувыведения - около 25 мин. Особые указания У пациентов с сахарным диабетом необходим постоянный контроль концентрации глюкозы в плазме крови, особенно на начальной стадии терапии препаратом Берлитион® 600. В некоторых случаях может возникнуть необходимость уменьшения дозы инсулина или гипогликемических средств для приема внутрь во избежание развития гипогликемии. Прием алкоголя снижает эффективность лечения препаратом Берлитион® 600, поэтому пациентам в период терапии препаратом Берлитион® 600 следует воздержаться от употребления алкоголя в течение всего курса лечения, а также, по возможности, в перерывах между курсами. При парентеральном применении возможно возникновение реакций гиперчувствительности. При появлении симптомов гиперчувствительности (зуд, недомогание) введение препарата следует немедленно прекратить. Растворителем для препарата Берлитион® 600 может служить только 0,9 % раствор натрия хлорида. Свежеприготовленный раствор для инфузий необходимо защищать от воздействия света, например, с помощью алюминиевой фольги. Защищенный от света раствор может храниться примерно в течение 6 часов. Влияние на способность управлять транспортными средствами: Влияние препарата Берлитион® 600 на быстроту психомоторных реакций и способность к восприятию или оценке ситуации специально не изучалось, поэтому в период лечения препаратом Берлитион® 600 следует соблюдать осторожность при управлении транспортными средствами и занятиях потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций. Условия хранения и отпуска из аптек Условия хранения:Хранить в защищенном от света месте при температуре не выше 25 °С. Не замораживать!Лекарственное средство хранить в недоступном для детей месте! Отпуск из аптек: По рецепту Регистрационные данные Торговое название Берлитион® 600 Международное непатентованное название:Тиоктовая кислота. Форма выпуска:концентрат для приготовления раствора для инфузий. Состав:Действующее вещество: тиоктовая кислота - 0,600 г. Вспомогательные вещества: этилендиамин -0,155 г, вода для инъекций - до 24 мл. АТХ: Регистрация: Лекарственное средство ЛП-001615 Фармгруппа: Метаболическое средство. Дата регистрации: 28.03.2012. Окончание регстрации: . Описание:Прозрачный зеленовато-желтый раствор. Упаковка:Концентрат для приготовления раствора для инфузий 25 мг/мл. По 24 мл препарата в ампулах темного стекла номинальной вместимостью 25 мл с белой меткой-указателем линии надлома и тремя полосками (зеленая - желтая - зеленая) в верхней части ампулы. По 5 ампул в пластиковых поддонах. По 1 поддону вместе с инструкцией по применению в картонной пачке. Срок годности:3 года. Не применять по истечении срока годности, указанного на упаковке. Владелец рег.удостоверения:Берлин-Хеми/Менарини Фарма, ГмбХ Производитель:HAMELN PHARMACEUTICALS, GmbH. Представительство:БЕРЛИН-ХЕМИ/МЕНАРИНИ ФАРМА ГмбХ. Информация предоставлена: Компанией ГЭОТАР - http://www.lsgeotar.ru/

Модель:
RUR 442
Показания В комплексной терапии следующих неврологических заболеваний:Нейропатическая боль, вызванная полинейропатией (в т.ч. диабетической и алкогольной):Невриты и невралгии: невралгия тройничного нерва,неврит лицевого нерва,межреберная невралгия,болевой синдром, вызванный заболеваниями позвоночника (люмбоишиалгия, плексопатия, корешковый синдром, вызванный дегенеративными изменениями позвоночника),опоясывающий герпес. Противопоказания Противопоказания Повышенная чувствительность к любому компоненту препарата. Детский возраст. С осторожностью: Беременность Беременность Применение препарата Нейробион не рекомендовано, в связи с отсутствием данных по применению при беременности. Лактация Витамины В1, В6 и В12 выводятся с грудным молоком, однако риск возникновения передозировки у новорожденного не установлен. В отдельных случаях прием высоких доз витамина В6 (>: 600 мг в день) может подавлять секрецию грудного молока. При необходимости приема препарата в период лактации, грудное вскармливание следует прекратить. Применение и дозы Препарат вводится внутримышечно (глубокие инъекции в ягодичную мышцу). Лечение рекомендуется начинать с внутримышечного введения 1 ампулы (3 мл) в сутки до снятия острых симптомов. После улучшения симптомов или в случаях умеренной тяжести заболевания: одна ампула 1-3 раза в неделю в течение 2-3 недель. Для поддерживающей терапии, для профилактики рецидива, или продолжения проводимого курса лечения рекомендуется препарат Нейробион в другой лекарственной форме (таблетки покрытые оболочкой). Продолжительность лечения определяется врачом. Побочные эффекты и передозировка Побочные эффекты: Частота побочных эффектов препарата расценивается следующим образом: Очень частые: 1/10 Частые: 1/100, <:1/10 Нечастые: 1/1000, <:1/100 Редкие: 1/10 000, <:1/1000 Очень редкие: <:1/10 000, включая отдельные сообщения Частота не установлена: не могут оцениваться при имеющихся данных. Нарушения со стороны нервной системы: Частота не установлена: длительное применение (>:6-12 месяцев) витамина В6 в суточной дозе >:50 мг может вызывать периферическую сенсорную нейропатию. Нарушения со стороны желудочно-кишечного тракта: Частота не установлена: тошнота, рвота, диарея, боль в животе. Нарушения со стороны иммунной системы: Очень редко: реакции гиперчувствительности, такие как потливость, тахикардия, кожные реакции (зуд, крапивница), анафилактический шок. Общие расстройства и нарушения в месте введения: Частота не установлена: реакции в месте введения. Передозировка: Витамины В1, В6 и В12 имеют широкий терапевтический диапазон. Симптомы передозировки не наблюдаются при применении препарата в рекомендуемых дозах и режиме. При внутривенном введении высоких доз витаминов в течение длительного времени (более 2 месяцев) могут наблюдаться симптомы интоксикации. Витамин B1: после введения дозы, превышающей рекомендованную более чем в 100 раз (>:10 г) наблюдались курареподобные ганглиоблокирующие эффекты, вызывающие нарушение проведения нервных импульсов. Витамин В6: длительное применение (>:6-12 месяцев) витамина В6 в суточной дозе >:50 мг может вызывать периферическую сенсорную нейропатию. Продолжительное применение витамина В6 в суточной дозе свыше 1 г в течение более чем 2 месяцев может вызывать нейротоксические эффекты. После введения более 2 г в сутки были описаны случаи гипохромной анемии и себорейного дерматита, нейропатии с атаксией, расстройства чувствительности, эпилептиформные припадки с изменениями на электроэнцефалограмме. Витамин В12: после парентерального введения высокой дозы наблюдались экзематозные кожные нарушения и доброкачественная форма акне. В случае появления вышеуказанных симптомов передозировки лечение препаратом следует отменить. При необходимости назначается симптоматическая терапия, в том числе десенсибилизирующая. Взаимодействие с другими ЛС: При одновременном применении пиридоксин может уменьшать противопаркинсоническое действие леводопы. Одновременное применение антагонистов пиридоксина (например, изониазид, гидралазин, пеницилламин или циклосерин) может увеличивать потребность в пиридоксине. "Петлевые" диуретики, например, фуросемид, могут блокировать канальцевую реабсорбцию, таким образом, усиливая экскрецию тиамина при длительном применении, что приводит к снижению содержания тиамина в крови. Не рекомендуется смешивать препарат с другими лекарственными средствами в одном шприце. Витамин В1 полностью разрушается при взаимодействии с растворами, содержащими сульфиты. Фармакологическое действие и фармакокинетика Препарат содержит комбинацию нейротропных витаминов группы В. Содержащиеся витамины: тиамин (В1), пиридоксин (В6) и цианокобаламин (В12) играют особую роль в качестве коферментов в промежуточном метаболизме, протекающем в центральной и периферической нервной системе. Особую роль в метаболических процессах нервной системы играет сочетанное действие витаминов В1, В6 и В12, что обосновывает их совместное применение. Комбинированное применение витаминов группы В ускоряет процессы регенерации поврежденных нервных волокон. Доказано, что эффективность комбинации превосходит эффективность отдельного компонента. Подобно другим витаминам, они являются незаменимыми питательными веществами, которые организм не способен синтезировать самостоятельно. Терапевтическое введение в организм витаминов В1 В6 и В12 восполняет часто существующее недостаточное поступление витаминов с пищей, что обеспечивает наличие в организме необходимых количеств коферментов. Терапевтическое применение этих витаминов при различных заболеваниях нервной системы направлено на то, чтобы, с одной стороны, компенсировать существующий дефицит (возможно из-за повышенной потребности организма, обусловленной непосредственно заболеванием) и, с другой стороны, чтобы стимулировать естественные механизмы, направленные на восстановление функции нервных тканей. Вместе с тем, непрямое анальгезирующее действие комплекса витаминов группы В оказывает благоприятный эффект на терапевтический результат. Фармакокинетика: Тиамин Период полувыведения составляет около 4 часов. В организме человека содержится около 30 мг тиамина. С учетом быстрого метаболизма он выводится через 4-10 дней. Пиридоксин В организме человека содержится около 40-150 мг пиридоксина. В сутки почками выводится 1,7-3,6 мг. Цианокобаламин Избыток цианокобаламина в основном накапливается в печени. Суточная потребность в витамине составляет 1 мкг. Скорость метаболизма цианокобаламина в сутки составляет 2,5 мкг, или 0,05% от количества, находящегося в печени. Из печени он выводится с желчью в кишечник и в значительной степени реабсорбируется при кишечно-печеночной циркуляции. Особые указания Препарат не следует вводить внутривенно. Клиническая картина, а также лабораторные анализы при фуникулярном миелозе или пернициозной анемии могут терять свою специфичность при введении витамина В12. Влияние на способность управлять транспортными средствами: Нейробион не оказывает влияния на способность к вождению автотранспорта и к управлению механизмами. Условия хранения и отпуска из аптек Условия хранения:При температуре не выше 8°С в защищенном от света месте. Хранить в недоступном для детей месте. Отпуск из аптек: По рецепту Регистрационные данные Торговое название Нейробион Международное непатентованное название:Пиридоксин + Тиамин + Цианокобаламин. Форма выпуска:Раствор для внутримышечного введения. Состав:3 мл раствора для внутримышечного введения содержат: Активные вещества: Тиамина гидрохлорид (витамин В1) - 100,0 мг Пиридоксина гидрохлорид (витамин В6) - 100,0 мг Цианокобаламин (витамин В12) - 1,0 мг Вспомогательные вещества: калия цианид 0,1 мг, натрия гидроксида раствор 1 М 73,0 мг, вода для инъекций до 3 мл. АТХ: Регистрация: Лекарственное средство ЛСР-004589/08 Фармгруппа: Витамины группы В. Дата регистрации: 17.06.2008. Окончание регстрации: . Описание:Прозрачный раствор красного цвета. Упаковка:Раствор для внутримышечного введения. По 3 мл препарата в ампулу из темного стекла типа I. На ампулу нанесена точка разлома и маркирующая полоска. По 3 ампулы в контурной ячейковой упаковке вместе с инструкцией по применению помещают в картонную пачку. Срок годности:3 года. Не применять после истечения срока годности, указанного на упаковке. Владелец рег.удостоверения:Мерк КГаА Производитель:MERCK, KGaA : MERCK KGaA &: Co. Werk Spittal. Представительство:Такеда Фармасьютикалс ООО
Модель:
RUR 2969
Показания Заболевания периферической нервной системы (неврит, полиневрит и полиневропатия, полирадикулопатии, миастения и миастенический синдром различной этиологии): бульбарные параличи и парезы: восстановительный период органических поражений центральной нервной системы, сопровождающихся двигательными нарушениями: комплексная терапия демиелинизирующих заболеваний: атония кишечника. Противопоказания Противопоказания Гиперчувствительность к любому из компонентов препарата, эпилепсия, экстрапирамидные заболевания с гиперкинезами, стенокардия, выраженная брадикардия, бронхиальная астма, непроходимость кишечника и мочевыводящих путей, вестибулярные расстройства, язвенная болезнь желудка или двенадцатиперстной кишки в стадии обострения, беременность и период лактации, детский возраст. С осторожностью: При язвенной болезни желудка и двенадцатиперстной кишки, тиреотоксикозе, заболеваниях сердечно-сосудистой системы, а также пациентам с обструктивными заболеваниями дыхательной системы в анамнезе или при острых заболеваниях дыхательных путей. Беременность Применение и дозы Подкожно или внутримышечно. Дозы и длительность лечения определяют индивидуально в зависимости от степени тяжести заболевания. Заболевания периферической нервной системы, миастения и миастенический синдром: подкожно и внутримышечно 5-15 мг 1-2 раза в день. Курс лечения составляет 1-2 месяца. При необходимости лечение можно повторить несколько раз с перерывом между курсами в 1-2 месяца. Для профилактики миастенических кризов или при тяжелых нарушениях нервно-мышечной проводимости вводят 15-30 мг раствора, затем лечение продолжают Нейромидином® в таблетированной форме, дозу можно увеличить до 20-40 мг (1-2 таблетки) 5-6 раз в день. Лечение и профилактика атонии кишечника: начальная доза - 10-15 мг в течение 1-2 недель. Доза препарата может быть повышена до 30 мг в день. Побочные эффекты и передозировка Побочные эффекты: Вызванные возбуждением м-холинорецепторов: слюнотечение, усиленное потоотделение, сердцебиение, тошнота, диарея, желтуха, брадикардия, боль в эпигастрии, усиленное выделение секрета бронхов, судороги. Слюнотечение и брадикардию можно уменьшить м-холиноблокаторами (атропин и др.). Реже, после применения более высоких доз, наблюдались головокружение, головная боль, рвота, общая слабость, сонливость, кожно-аллергические реакции (зуд, сыпь). В этих случаях уменьшают дозу или кратковременно (на 1-2 дня) прерывают прием препарата. Указанные побочные эффекты наблюдаются менее чем у 10% больных. Передозировка: Симптомы: снижение аппетита, бронхоспазм, слезотечение, усиленное потоотделение, сужение зрачков, нистагм, усиление перистальтики желудочно-кишечного тракта, спонтанная дефекация и мочеиспускание, рвота, желтуха, брадикардия, нарушения внутрисердечной проводимости, аритмии, снижение артериального давления, беспокойство, тревога, возбуждение, чувство страха, атаксия, судороги, кома, нарушения речи, сонливость и общая слабость. Лечение: применяют симптоматическую терапию, используют м-холиноблокаторы. атропин, циклодол, метацин и др. Взаимодействие с другими ЛС: Нейромидин® усиливает седативный эффект в комбинации со средствами, угнетающими центральную нервную систему. Действие и побочные эффекты усиливаются при совместном применении с другими ингибиторами холинэстеразы и М-холиномиметическими средствами. У больных с миастенией увеличивается риск развития холинергического криза, если применять Нейромидин® одновременно с другими холинергическими средствами. Возрастает риск развития брадикардии, если β-адреноблокаторы применялись до начала лечения препаратом Нейромидин®. Препарат можно применять в комбинации с церебролизином. Алкоголь усиливает побочные эффекты препарата. Фармакологическое действие и фармакокинетика Нейромидин® - обратимый ингибитор холинэстеразы, непосредственно стимулирует проведение импульса в нервно-мышечном синапсе и в центральной нервной системе вследствие блокады калиевых каналов мембраны. Усиливает действие на гладкие мышцы не только ацетилхолина, но и адреналина, серотонина, гистамина и окситоцина. Нейромидин® обладает следующими фармакологическими эффектами: - улучшает и стимулирует нервно-мышечную передачу: - улучшает проводимость в периферической нервной системе, нарушенное вследствие травм, воспалений, воздействия местных анестетиков, некоторых антибиотиков, калия хлорида и др: - усиливает сократимость гладкомышечных органов под влиянием агонистов ацетилхолиновых, адреналиновых, серотониновых, гистаминовых и окситоциновых рецепторов, за исключением калия хлорида: - улучшает память. Препарат не оказывает тератогенного, эмбриотоксического, мутагенного, канцерогенного и иммунотоксического действий. Не влияет на эндокринную систему. Фармакокинетика: Препарат быстро всасывается после введения. Максимальная концентрация в крови достигается через 25-30 минут после введения. 40-55% активного вещества связывается с белками плазмы крови. Нейромидин® быстро поступает в ткани. Метаболизируется в печени. Элиминация препарата осуществляется через почки, а также экстраренально (через желудочно-кишечный тракт). Период полувыведения составляет 40 мин. Экскреция препарата Нейромидин® почками происходит главным образом путем канальцевой секреции, и только 1/3 препарата выделяется путем клубочковой фильтрации. После парентерального введения 34,8% дозы препарата выводится с мочой в неизмененном виде. Особые указания Влияние на способность управлять транспортными средствами: Во время лечения следует воздержаться от вождения автомобиля, а также занятий потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций. Условия хранения и отпуска из аптек Условия хранения:В защищенном от света и недоступном для детей месте, при температуре не выше 25 °С. Отпуск из аптек: По рецепту Регистрационные данные Торговое название Нейромидин® Международное непатентованное название:Ипидакрин. Форма выпуска:раствор для внутримышечного и подкожного введения. Состав:1 мл препарата содержит:действующее вещество: ипидакрина гидрохлорида моногидрат (в пересчете на ипидакрина гидрохлорид) 5 мг или 15 мг: вспомогательные вещества: кислота хлористоводородная концентрированная до pH 3,0, вода для инъекций до 1,0 мл. АТХ: Регистрация: Лекарственное средство П N014238/02 Фармгруппа: холинэстеразы ингибитор. Дата регистрации: 26.11.2007. Окончание регстрации: . Описание: Прозрачная, бесцветная жидкость. Упаковка:Раствор для внутримышечного и подкожного введения, 5 мг/мл и 15 мг/мл. По 1 мл препарата в ампулах нейтрального стекла (тип I). По 5 ампул в контурную ячейковую упаковку из пленки поливинилхлоридной. По 2 контурные ячейковые упаковки вместе с инструкцией по применению помещают в пачку из картона. Для препарата, произведенного на АО "СОФАРМА", Болгария: По 10 ампул в контурную ячейковую упаковку из пленки поливинилхлоридной. По 1 контурной ячейковой упаковке вместе с инструкцией по применению помещают в пачку из картона. Срок годности:2 года. Не использовать по окончании срока годности. Владелец рег.удостоверения:Олайнфарм, АО Производитель:Олайнфарм, АО: SOPHARMA, AD. Представительство:ОЛАЙНФАРМ АО
Модель:
RUR 44
Состав Противопоказания Дозировка Показания к применению Взаимодействие с другими лекарственными средствами Передозировка Фармакологическое действие Беременность и кормление грудью Условия отпуска из аптек Побочные явления Особые указания Условия хранения Способ применения и дозы Информация Состав Активное вещество: 1 мл раствора содержит: Тимолол-5,00 мг (в виде тимолола малеата-6,84 мг). Вспомогательные вещества: Бензалкония хлорид – 0,10 мг, Натрия дигидрофосфат дигидрат – 6,10 мг, Натрия гидрофосфат дигидрат – 15,16 мг, Вода для инъекций – до 1 мл. Описание: Прозрачная бесцветная или со слегка коричневатым оттенком жидкость. Форма выпуска: Капли глазные 0,5 %. По 5 мл во флакон с капельницей из полиэтилена низкой плотности и крышкой с контролем первого вскрытия или во флакон-капельницу из полиэтилена высокого давления в комплекте с крышкой навинчиваемой и пробкой-капельницей. По 1 или 3 флакона вместе с инструкцией по применению в пачке из картона. Противопоказания Бронхиальная астма, синусовая брадикардия, атриовентрикулярная блокада II и III степени без кардиостимулятора, декомпенсированная хроническая сердечная недостаточность, кардиогенный шок, тяжелая хроническая обструктивная болезнь легких, синдром слабости синусового узла, гиперчувствительность к компонентам препарата. С осторожностью Цереброваскулярная недостаточность, артериальная гипотензия, сахарный диабет, гипогликемия, легочная недостаточность, тиреотоксикоз, миастения, синоатриальная блокада, нарушение периферического кровообращения (в т.ч. синдром Рейно), беременность, одновременное назначение других бета-адреноблокаторов. Дозировка 0,5 % Показания к применению Повышенное внутриглазное давление (офтальмогипертензия), открытоугольная глаукома, глаукома на афактическом глазу и другие виды вторичной глаукомы, врожденная глаукома (при неэффективности других средств), в качестве дополнительного средства для снижения внутриглазного давления при закрытоугольной глаукоме (в комбинации с миотиками). Взаимодействие с другими лекарственными средствами Совместное использование препарата с глазными каплями, содержащими адреналин, может вызвать расширение зрачка. Специфическое действие препарата – снижение внутриглазного давления, которое может усилиться при одновременном использовании глазных капель, содержащих эпинефрин и пилокарпин. Два различных бета-адреноблокатора не следует закапывать в один и тот же глаз. Артериальная гипотензия и брадикардия могут усилиться при одновременном использовании препарата с антагонистами кальция, резерпином и системными бета-адреноблокаторами. Ингибиторы CYP2D6, такие как хинидин и циметидин, могут увеличить концентрацию тимолола в плазме. Одновременное применение с инсулином или пероральными противодиабетическими средствами может привести к гипогликемии. Тимолол усиливает действие миорелаксантов, поэтому необходима отмена препарата за 48 часов до планируемого хирургического вмешательства под общей анестезией. Эти данные могут относиться и к лекарственным препаратам, которые были применены незадолго до этого. Передозировка Возможно развитие системных эффектов, характерных для бета-адреноблокаторов: головокружение, головная боль, аритмия, брадикардия, бронхоспазм, тошнота и рвота, потеря сознания, гипотония, одышка, генерализованные судороги, кардиогенный шок, сердечная недостаточность и остановка сердца. При случайном приеме тимолола внутрь необходимо промывание желудка и прием активированного угля. Показано, что препарат не может быть удален из организма путем гемодиализа. При развитии брадикардии и брадиаритмии (при атриовентрикулярной блокаде II и III степени) рекомендовано внутривенное введение атропина сульфата в дозе от 0,25 до 2 мг; после частичного купирования брадикардии показано введение изопреналина. При труднокупируемой брадикардии следует рассмотреть вопрос об установке кардиостимулятора. При гипотонии рекомендован прием симпатомиметиков, таких, как допамин, добутамин, норадреналин. При отсутствии эффекта – введение глюкагона. При развитии острой сердечной недостаточности рекомендовано применение препаратов наперстянки и диуретиков, а также кислородотерапия, при неэффективности – внутривенное введение аминофиллина. Фармакологическое действие Фармакологическая группа: Противоглаукомное средство – бета-адреноблокатор. Фармакодинамика: Неселективный блокатор бета-адренорецепторов без симпатомиметической активности. Не обладает значимой внутренней симпатомиметической, прямо угнетающей миокард и местной анестезирующей (мембраностабилизирующей) активностью Блокада бета-адренорецепторов в бронхах и бронхиолах повышает сопротивляемость дыхательных путей, обусловленную отсутствием антагонизма к парасимпатомиметической активности. Такой эффект у пациентов с бронхиальной астмой или иными бронхоспастическими состояниями может представлять потенциальную опасность. Блокада бета-адренорецепторов снижает сердечный выброс как у здоровых субъектов, так и пациентов с заболеваниями сердца. У пациентов с тяжелым нарушением функции миокарда блокада бета-адренорецепторов может ослаблять стимулирующее влияние симпатической нервной системы, необходимое для поддержания адекватной функции сердца. При местном применении в виде глазных капель снижает как нормальное, так и повышенное внутриглазное давление за счет уменьшения образования внутриглазной жидкости. Повышенное внутриглазное давление является основным фактором риска в патогенезе развития характерных для глаукомы поражения зрительного нерва и сужения границ полей зрения. Не оказывает влияния на ширину зрачка и аккомодацию. Точный механизм снижения внутриглазного давления, обусловленного тимололом, не известен. Согласно данным тонографии и флуорометрии у человека, тимолол при местном применении понижает внутриглазное давление за счет уменьшения образования водянистой влаги и небольшого увеличения ее оттока. Снижая внутриглазное давление, не влияет на аккомодацию и размер зрачка, поэтому не происходит ухудшения остроты зрения; не снижает качество ночного зрения. Действие проявляется через 20 мин после закапывания. Максимальный эффект наблюдается через 1-2 ч. Продолжительность действия 24 ч. Фармакокинетика: Тимолол быстро проникает через роговицу в ткани глаза. После инстилляции во влаге передней камеры глаза максимальная концентрация (Сmax) в плазме крови достигается через 1-2 ч. В незначительном количестве попадает в системный кровоток путем абсорбции через конъюнктиву, слизистые оболочки носа и слезного тракта. Сmax тимолола в плазме крови составляет около 0,824 нг/мл и сохраняется до порога обнаружения в течении 12 ч. У новорожденных и маленьких детей Сmax тимолола существенно превышает Сmax в плазме крови взрослых. Период полувыведения (Т1/2) тимолола составляет 4,8 ч после местного применения. Метаболизм тимолола осуществляется изоферментом CYP2D6. Тимолол и образующиеся метаболиты в основном выводятся почками. Беременность и кормление грудью При беременности применяют с осторожностью только в случае, когда ожидаемый терапевтический эффект для матери превышает потенциальный риск для плода или ребенка. При необходимости применения препарата в период лактации грудное вскармливание следует прекратить. Условия отпуска из аптек Отпускают по рецепту. Побочные явления Нежелательные реакции, возникшие после приема внутрь тимолола и других бета-адреноблокаторов, могут расцениваться как потенциальные побочные реакции и для препаратов тимолола в лекарственной форме капли глазные. Нежелательные реакции, сведения о которых были получены в ходе клинических исследований и при постмаркетинговом наблюдении лекарственных препаратов тимолола в лекарственной форме капли глазные Частота побочных эффектов, выявленных как в ходе исследований, так и при постмаркетинговом наблюдении, оценивались следующим образом: очень часто (>1/10); часто (>1/100 до 1/1000 до 1/10000 до
Модель:
RUR 197
Показания Лечение острой гипокальциемии. Для уменьшения проницаемости капилляров при аллергических состояниях, нетромбоцитопенической пурпуре и экссудативных дерматозах, например, герпетиформном дерматите и зудящей сыпи вследствие применения некоторых лекарственных препаратов. Противопоказания Противопоказания Повышенная чувствительность к кальция глюконату и другим компонентам препарата, гиперкальциемия (в том числе у пациентов с гиперпаратиреозом, гипервитаминозом D, декальцинирующими злокачественными новообразованиями, почечной недостаточностью, остеопорозом, связанным с иммобилизацией, саркоидозом, молочно-щелочным синдромом (синдром Бернетта)), гиперкальциурия, интоксикация сердечными гликозидами, одновременное лечение сердечными гликозидами: для внутримышечного введения - детский возраст. С осторожностью: Дегидратация, электролитные нарушения (риск развития гиперкальциемии), диарея, синдром мальабсорбции, кальциевый нефроуролитиаз (в анамнезе), незначительная гиперкальциурия, умеренная хроническая почечная недостаточность, распространенный атеросклероз, гиперкоагуляция, у пациентов пожилого возраста, особенно при наличии одного или нескольких вышеназванных состояний, нефрокальциноз, патология сердечно-сосудистой системы, саркоидоз, хроническая сердечная недостаточность, одновременное лечение эпинефрином. Перед применением препарата необходимо проконсультироваться с врачом. Беременность Кальций проникает через плацентарный барьер, попадает в грудное молоко. Применение препарата при беременности и в период грудного вскармливания возможно только под строгим контролем сывороточной концентрации кальция, так как гиперкальциемия отрицательно влияет на плод и ребенка. Применение и дозы В норме концентрация общего кальция в сыворотке крови составляет 2,25-2,75 ммоль/л или 4,45-5,5 с. Экв/л. Терапия препаратом кальция глюконата направлена на восстановление нормальной концентрации кальция в плазме крови. Растворы, содержащие кальций, должны вводиться медленно с целью сведения к минимуму периферической вазодилатации и угнетения сердечной деятельности. Препарат перед введением нагревают до температуры тела. Препарат вводится глубоко внутримышечно или внутривенно медленно (в течение 2-3 минут), или капельно, для исключения возможности местного раздражения или некроза в случае попадания препарата в периваскулярные ткани. Внутривенные инъекции должны осуществляться под тщательным мониторингом частоты сердечных сокращений и электрокардиограммы, поскольку при слишком быстром введении кальция глюконата могут возникнуть брадикардия с вазодилатацией и аритмии. При внутривенном введении возможно чувство жара во всем теле, которое быстро проходит. Из-за риска местного раздражения внутримышечные инъекции следует выполнять только в том случае, если внутривенная инъекция невозможна. Внутримышечные инъекции необходимо выполнять достаточно глубоко в мышцу, предпочтительно в ягодичную область. Для пациентов, страдающих ожирением, должна быть выбрана более длинная игла для безопасного введения в мышцу, а не в жировые ткани. Если необходимы повторные инъекции, каждый раз следует менять место введения. Во время лечения необходимо тщательно контролировать концентрацию кальция в плазме крови, при введении в высоких дозах - дополнительно контролировать скорость экскреции кальция с мочой. Взрослым: глубоко внутримышечно, внутривенно медленно (в течение 2-3 мин) или капельно 5-10 мл 100 мг/мл (10 % раствора) ежедневно, через день или через 2 дня (в зависимости от характера заболевания и клинического состояния больного). Последующие дозы определяют в соответствии с концентрацией кальция в сыворотке крови. Детям до 18 лет: доза и способ введения зависят от степени развития гипокальциемии, характера и выраженности симптомов. Детям, в зависимости от возраста, препарат в концентрации 100 мг/мл (10 % раствор) вводится в следующих дозах: до 6 месяцев - 0,1-1 мл: 7-12 месяцев - 1-1,5 мл: 1-3 года - 1,5-2 мл: 4-6 лет - 2-2,5 мл: 7-14 лет - 3,5 мл: старше 14 лет - дозы как для взрослых. Детям нельзя вводить препарат внутримышечно из-за возможного развития некроза. Рекомендуется только медленная внутривенная инъекция или внутривенная инфузия после разведения, с целью достижения достаточно низких скоростей введения и для исключения возможности местного раздражения или некроза при случайном попадании препарата в периваскулярные ткани. Для внутривенной инфузии препарат разбавляют в соотношении 1:10 до концентрации 10мг/мл следующими растворами для инфузий: 0,9 % раствором натрия хлорида или 5 % раствором глюкозы. Скорость внутривенного введения не должна превышать 50 мг кальция глюконата в минуту. Разбавление следует проводить в асептических условиях. Пожилые пациенты: данные, указывающие на неблагоприятную переносимость кальция глюконата пожилыми пациентами, отсутствуют, однако возрастные изменения, такие как нарушения функции почек и замедление метаболизма, могут потребовать снижения дозы. Порядок работы с полимерной ампулой: - Взять ампулу и встряхнуть ее, удерживая за горлышко. - Вращающими движениями повернуть и отделить клапан. - Через образовавшееся отверстие немедленно соединить луер шприца с ампулой. - Набрать в шприц содержимое ампулы. - Надеть иглу на шприц. Побочные эффекты и передозировка Побочные эффекты: Частота возникновения побочных эффектов напрямую связана со скоростью введения и дозой кальция глюконата. При правильном введении частота их возникновения составляет 1/1000. Со стороны сердечно-сосудистой системы: снижение артериального давления, брадикардия, аритмия, вазодилатация, циркуляторный коллапс (в том числе с летальным исходом), "приливы" крови, чаще всего при быстром введении. Со стороны пищеварительной системы: тошнота, рвота, диарея. Общие нарушения: ощущение тепла, потливость. Нарушения в месте введения: при внутримышечном введении - боль или эритема ( 1/10, 1/100), при нарушении техники внутримышечного введения - инфильтрация в жировую ткань с последующим формированием абсцесса, уплотнением тканей и некрозом: при внутривенном введении - гиперемия кожи, ощущение жжения или боль с возможным развитием некроза тканей (при случайной периваскулярной инъекции). Сообщалось о случае кальцификации мягких тканей с последующим возможным поражением кожи и некрозом вследствие выхода кальция из сосуда в ткани. Передозировка: Симптомы гиперкальциемии: анорексия, тошнота, рвота, запор, боль в животе, полиурия, полидипсия, дегидратация, мышечная слабость, боль в костях, кальцификация почек, сонливость, гиперсомния, спутанность сознания, повышение артериального давления, в тяжелых случаях - аритмия (вплоть до остановки сердца) и кома. Лечение: направлено на снижение повышенной концентрации кальция в плазме крови. Начальная терапия включает регидратацию, при тяжелой гиперкальциемии может потребоваться введение 0,9 % раствора натрия хлорида внутривенно инфузионно для увеличения количества внеклеточной жидкости. Для снижения концентрации кальция в сыворотке крови может применяться кальцитонин. Фуросемид может применяться для повышения экскреции кальция, однако не следует применять "тиазидные" диуретики, поскольку они могут повышать абсорбцию кальция в почках. Гемодиализ или перитонеальный диализ проводится, если другие мероприятия не эффективны или при сохранении симптомов гиперкальциемии. Лечение передозировки проводят под тщательным контролем концентрации электролитов в сыворотке крови. Взаимодействие с другими ЛС: Наполняемый раствором кальция глюконата шприц не должен содержать остатков спирта этилового, так как в присутствии последнего кальция глюконат выпадает в осадок. Фармацевтически несовместим с карбонатами, салицилатами, сульфатами и цефтриаксоном (образует с ними нерастворимые или труднорастворимые соли кальция). Образует нерастворимые комплексы с антибиотиками тетрациклинового ряда, снижая антибактериальный эффект. Ослабляет действие блокаторов "медленных" кальциевых каналов (внутривенное введение кальция глюконата до или после приема верапамила уменьшает его гипотензивное действие, но мало влияет на его антиаритмический эффект). При одновременном применении с хинидином возможно замедление внутрижелудочковой проводимости и повышение токсичности хинидина. Не рекомендуется применение кальция глюконата во время лечения сердечными гликозидами (возможно усиление кардиотоксического действия сердечных гликозидов). При сочетании с тиазидными диуретиками может усиливать гиперкальциемию. Снижает эффект кальцитонина при гиперкальциемии. Снижает биодоступность фенитоина. Фармакологическое действие и фармакокинетика Препарат кальция восполняет дефицит ионов кальция, необходимых для осуществления процесса передачи нервных импульсов, сокращения скелетных и гладких мышц, деятельности миокарда, формирования костной ткани, свертывания крови. При внутривенном введении стимулирует симпатический отдел вегетативной нервной системы, усиливает выделение надпочечниками адреналина. Фармакокинетика: После парентерального введения кальция глюконат с током крови равномерно распределяется во всех тканях и органах. В плазме крови кальций находится как в связанной форме (в комплексе с белками и с анионами органических и неорганических кислот (бикарбонат, фосфат, лактат, цитрат кальция)), так и в свободной ионизированной форме. Проникает через плацентарный барьер, попадает в грудное молоко. Выводится из организма в основном почками. Особые указания Препарат перед введением нагревают до температуры тела. Препарат вводится глубоко внутримышечно или внутривенно медленно (в течение 2-3 минут), или капельно, для исключения возможности местного раздражения или некроза в случае попадания препарата в периваскулярные ткани. Внутривенные инъекции должны осуществляться под тщательным мониторингом частоты сердечных сокращений и электрокардиограммы, поскольку при слишком быстром введении кальция глюконата могут возникнуть брадикардия с вазодилатацией и аритмии. При внутривенном введении возможно чувство жара во всем теле, которое быстро проходит. Из-за риска местного раздражения внутримышечные инъекции следует выполнять только в том случае, если внутривенная инъекция невозможна. Внутримышечные инъекции необходимо выполнять достаточно глубоко в мышцу, предпочтительно в ягодичную область. Для пациентов, страдающих ожирением, должна быть выбрана более длинная игла для безопасного введения в мышцу, а не в жировые ткани. Если необходимы повторные инъекции, каждый раз следует менять место введения. Во время лечения необходимо тщательно контролировать концентрацию кальция в плазме крови, при введении в высоких дозах - дополнительно контролировать скорость экскреции кальция с мочой. При внутривенном введении кальция глюконата, в исключительных случаях, пациентам, получающим сердечные гликозиды, необходим контроль сердечной деятельности и должны быть обеспечены условия для неотложного лечения осложнений со стороны сердца (таких как выраженные аритмии). Соли кальция должны использоваться с осторожностью и только после тщательного определения показаний у пациентов с нефрокальцинозом, патологией сердечнососудистой системы, саркоидозом (болезнь Бека), у пациентов, получающих эпинефрин, у пожилых пациентов. Нарушение функции почек может быть связано с гиперкальциемией и вторичным гиперпаратиреозом. Поэтому пациентам с нарушением функции почек парентеральное введение кальция должно назначаться только после тщательного определения показателей, при этом необходимо контролировать кальциево-фосфатный баланс. При одновременном применении с другими лекарственными препаратами требуется наблюдение врача. Раствор использовать только если он прозрачен и ампула не повреждена. Препарат разводить непосредственно после вскрытия ампулы. При разведении препарата требуется строгое соблюдение правил асептики. С точки зрения микробиологической безопасности, разведенный препарат должен быть использован немедленно. Ампула только для одноразового использования. Исключение составляют разведения, приготовленные в контролируемых асептических условиях. После приготовления раствора сроки и условия его хранения до введения являются ответственностью пользователя и должны составлять не более 24 часов при температуре от 2 до 8 °С. Оставшиеся неиспользованными объемы препарата подлежат уничтожению. Влияние на способность управлять транспортными средствами: В период лечения препаратом необходимо соблюдать осторожность при выполнении потенциально опасных видов деятельности, требующих повышенной концентрации внимания и быстроты психомоторных реакций (управление транспортными средствами, работа с движущимися механизмами, работа диспетчера и оператора). Условия хранения и отпуска из аптек Условия хранения:Хранить при температуре не выше 25 °С. Хранить в недоступном для детей месте. Отпуск из аптек: По рецепту Регистрационные данные Торговое название Кальция глюконат-СОЛОфарм Международное непатентованное название:Кальция глюконат. Форма выпуска:раствор для внутривенного и внутримышечного введения. Состав:1 мл препарата содержит: Действующее вещество: Кальция глюконата моногидрат 94 мг Вспомогательные вещества: Кальция сахарат 5 мг Вода для инъекций до 1 мл. АТХ: Регистрация: Лекарственное средство ЛП-004435 Фармгруппа: Кальциево-фосфорного обмена регулятор. Дата регистрации: 29.08.2017. Окончание регстрации: . Описание:Прозрачная бесцветная или слабо окрашенная жидкость (с коричневатым оттенком жидкость). Упаковка:Раствор для внутривенного и внутримышечного введения 100 мг/мл. По 5 или 10 мл в ампулы (Политвист) из полиэтилена низкой плотности или полипропилена, соответствующего требованиям Европейской Фармакопеи к полиэтилену для парентеральных препаратов, со скручивающимся колпачком для безыгольного забора препарата, или в ампулы из бесцветного или окрашенного стекла. По 10 ампул из полиэтилена низкой плотности или полипропилена вместе с инструкцией по применению в пачке из картона. По 5 ампул из стекла в контурной ячейковой упаковке из пленки поливинилхлоридной или полиэтилентерефталатной с пленкой полимерной или фольгой алюминиевой лакированной или без пленки полимерной и фольги алюминиевой лакированной или в форме из картона с ячейками для укладки ампул. По 2 контурные ячейковые упаковки или формы из картона вместе с инструкцией по применению и скарификатором ампульным или без него в пачке из картона. Срок годности:3 года. Не применять после окончания срока годности! Владелец рег.удостоверения:ГРОТЕКС, ООО Производитель:ГРОТЕКС, ООО. Представительство