фреска из ного песка гусёнок

Модель:
RUR 260
ЮНЛАНДИЯ Набор для творчества Картина из цветного песка, Транспорт Товары для творчества

Модель:
RUR 228
ЮНЛАНДИЯ Набор для творчества Картина из цветного песка , В Африке Товары для творчества

Модель:
RUR 226
ЮНЛАНДИЯ Набор для творчества Картина из цветного песка, Единороги Товары для творчества

Модель:
RUR 847
№471 «Замок из песка» - шиммерный прозрачный оттенок для создания русалочьего маникюра. В новом сезоне не стоит бояться блестящего эффекта, нужно просто сиять!• Гель-лак самодостаточен и подходит в качестве эффектного дополнения в дизайне.• Идеальная плотная текстура, нанесение без просветов даже в 1 тонкий слой.• Консистенция средней вязкости, безупречное самовыравнивание и быстрая полимеризация. Не собирается от кутикулы и боковых валиков.• Благодаря полукруглой кисти, повторяющей анатомическую форму ногтевой пластины, материал наносится легко и ровно
Модель:
RUR 1696
Показания Тяжелые формы акне (узелково-кистозные, конглобатные акне или акне с риском образования рубцов). Акне, не поддающиеся другим видам терапии. Противопоказания Противопоказания Беременность, период кормления грудью (см. раздел "Беременность и период грудного вскармливания"), печеночная недостаточность, гипервитаминоз А, выраженная гиперлипидемия, сопутствующая терапия тетрациклинами. Повышенная чувствительность к препарату или его компонентам (в том числе к сое). Детский возраст до 12 лет. С осторожностью: Депрессия в анамнезе, сахарный диабет, ожирение, нарушение липидного обмена, алкоголизм. Беременность Беременность - абсолютное противопоказание для терапии препаратом Роаккутан. Если беременность возникает, несмотря на предостережения, во время лечения или в течение месяца после окончания терапии, существует очень большая опасность рождения ребенка с тяжелыми пороками развития. Изотретиноин - препарат с сильным тератогенным действием. Если беременность возникает в тот период, когда женщина перорально принимает изотретиноин (в любой дозе и даже непродолжительное время), существует очень большая опасность рождения ребенка с пороками развития. Роаккутан противопоказан женщинам детородного возраста, если только состояние женщины не удовлетворяет всем нижеперечисленным критериям: - у нее должна быть тяжелая форма акне, устойчивая к обычным методам лечения- она должна точно понимать и выполнять указания врача: - она должна быть информирована врачом об опасности наступления беременности в ходе лечения препаратом Роаккутан в течение одного месяца после него и срочной консультации при подозрении на наступление беременности: - она должна быть предупреждена о возможной неэффективности средств контрацепции: - она должна подтвердить, что понимает суть мер предосторожности: - она должна понимать необходимость и непрерывно использовать эффективные методы контрацепции в течение одного месяца до лечения препаратом Роаккутан, во время лечения и в течение месяца после его окончания (см. раздел "Взаимодействие с другими лекарственными средствами"): желательно использовать одновременно 2 различных способа контрацепции, включая барьерный: - у нее должен быть получен отрицательный результат достоверного теста на беременность в пределах 11 дней до начала приема препарата: тест на беременность настоятельно рекомендуется проводить ежемесячно во время лечения и через 5 недель после окончания терапии: - она должна начинать лечение препаратом Роаккутан только на 2-3 день следующего нормального менструального цикла: - она должна понимать необходимость обязательного посещения врача каждый месяц: - при лечении по поводу рецидива заболевания она должна постоянно пользоваться теми же эффективными методами контрацепции в течение одного месяца до начала лечения препаратом Роаккутан, во время лечения и в течение месяца после его завершения, а так же проходить тот же достоверный тест на беременность: - она должна полностью понимать необходимость мер предосторожности и подтвердить свое понимание и желание применять надежные методы контрацепции, которые ей объяснил врач. Использование противозачаточных средств по вышеприведенным указаниям во время лечения изотретиноином следует рекомендовать даже тем женщинам, которые обычно не применяют методов контрацепции из-за бесплодия (за исключением пациенток, перенесших гистерэктомию), аменореи или которые сообщают, что не ведут половую жизнь. Врач должен быть уверен, что: - у пациентки тяжелая форма акне (узелково-кистозные, конглобатные акне или акне с риском образования рубцов): акне, не поддающиеся другим видам терапии: - получен отрицательный результат достоверного теста на беременность до начала приема препарата, во время терапии и через 5 недель после окончания терапии: даты и результаты проведения теста на беременность необходимо документировать: - пациентка использует не менее 1, предпочтительно 2 эффективных метода контрацепции, включая барьерный метод, в течение одного месяца до начала лечения препаратом Роаккутан, во время лечения и в течение месяца после его окончания: - пациентка способна понимать и выполнять все вышеперечисленные требования по предохранению от беременности: - пациентка соответствует всем вышеперечисленным условиям. Тест на беременность В соответствии с существующей практикой, тест на беременность с минимальной чувствительностью 25 мМЕ/мл следует проводить в первые 3 дня менструального цикла: До начала терапии: - Для исключения возможной беременности до начала применения контрацепции результат и дата первоначального теста на беременность должны быть зарегистрированы врачом. У пациенток с нерегулярными менструациями время проведения теста на беременность зависит от сексуальной активности, его следует проводить через 3 недели после незащищенного полового акта. Врач должен проинформировать пациентку о методах контрацепции. - Тест на беременность проводят в день назначения препарата Роаккутан или за 3 дня до визита пациентки к врачу. Специалисту следует регистрировать результаты тестирования. Препарат может быть назначен только пациенткам, получающим эффективную контрацепцию не менее 1 месяца до начала терапии препаратом Роаккутан. Во время терапии: - Пациентка должна посещать врача каждые 28 дней. Необходимость ежемесячного тестирования на беременность определяется в соответствии с местной практикой и с учетом сексуальной активности, предшествующих нарушений менструального цикла. При наличии показаний тест на беременность проводится в день визита или за три дня до визита к врачу, результаты теста должны быть зарегистрированы. Окончание терапии: - Через 5 недель после окончания терапии проводится тест для исключения беременности. Рецепт на Роаккутан женщине, способной к деторождению, может быть выписан только на 30 дней лечения, продолжение терапии требует нового назначения препарата врачом. Рекомендуется тест на беременность, выписку рецепта и получение препарата проводить в один день. Выдачу препарата Роаккутан в аптеке следует осуществлять только в течение 7 дней с момента выписки рецепта. Чтобы помочь врачам, фармацевтам и больным избежать риска воздействия препарата Роаккутан на плод, компания-производитель создала "Программу предохранения от беременности", направленную на предупреждение о тератогенности препарата и подчеркивание абсолютно обязательного использования надежных мер контрацепции женщинами детородного возраста. Программа содержит следующие материалы: для врачей: - руководство для врача по назначению препарата Роаккутан женщинам - форму информированного согласия для пациентки - форма учета назначения препарата женщинам для пациента: - информационную брошюру для пациента - что нужно, знать о контрацепции - для фармацевта: - руководство для фармацевта по отпуску препарата Роаккутан. Полную информацию о тератогенном риске и строгом соблюдении мер по предотвращению беременности необходимо предоставлять как мужчинам, так и женщинам. Пациентам мужского пола. Существующие данные свидетельствуют о том, что у женщин экспозиция препарата, поступившего из семени и семенной жидкости мужчин, принимающих Роаккутан, не достаточна для появления тератогенных эффектов препарата Роаккутан. Мужчинам следует исключать возможность приема препарата другими лицами, особенно женщинами. Если, несмотря на принятые меры предосторожности, во время лечения препаратом Роаккутан или в течение месяца после его окончания беременность все же наступила, существует высокий риск очень тяжелых пороков развития плода (в частности, со стороны центральной нервной системы, сердца и крупных кровеносных сосудов). Кроме того, увеличивается риск самопроизвольных выкидышей. При возникновении беременности терапию препаратом Роаккутан прекращают. Следует обсудить целесообразность ее сохранения с врачом, специализирующимся на тератологии. Документально подтверждены тяжелые врожденные пороки развития плода у человека, связанные с назначением препарата Роаккутан, в том числе гидроцефалия, микроцефалия, пороки развития мозжечка, аномалии наружного уха (микротия, сужение или отсутствие наружного слухового прохода), микрофтальмия, сердечно-сосудистые аномалии (тетрада Фалло, транспозиция магистральных сосудов, дефекты перегородок), пороки развития лица (волчья пасть), вилочковой железы, патология паращитовидных желез. Поскольку изотретиноин обладает высокой липофильностью, весьма вероятно, что он попадает в грудное молоко. Из-за возможных побочных действий Роаккутан нельзя назначать кормящим матерям. Применение и дозы Стандартный режим дозирования Внутрь, во время еды один или два раза в день. Терапевтическая эффективность препарата Роаккутан и его побочные действия зависят от дозы и варьируют у разных больных. Это диктует необходимость индивидуального подбора дозы в ходе лечения. Лечение препаратом Роаккутан следует начинать с дозы 0.5 мг/кг в сутки. У большинства больных доза колеблется от 0.5 до 1.0 мг/кг массы тела в сутки. Больным с очень тяжелыми формами заболевания или с акне туловища могут потребоваться более высокие суточные дозы - до 2.0 мг/кг. Доказано, что частота ремиссии и профилактика рецидивов оптимальны при использовании курсовой дозы 120-150 мг/кг (на курс лечения), поэтому продолжительность терапии у конкретных больных меняется в зависимости от суточной дозы. Полной ремиссии акне часто удается добиться за 16-24 недели лечения. У больных, очень плохо переносящих рекомендованную дозу, лечение можно продолжить в меньшей дозе, однако проводить его дольше. У большинства больных акне полностью исчезают после однократного курса лечения. При явном рецидиве показан повторный курс лечения препаратом Роаккутан в той же суточной и курсовой дозе, как и первый. Поскольку улучшение может продолжаться вплоть до 8 недель после отмены препарата, повторный курс следует назначать не раньше окончания этого срока. Дозирование в особых случаях У больных с тяжелой почечной недостаточностью лечение следует начинать с меньшей дозы (например, 10 мг/сутки) и далее увеличивать до 1 мг/кг/сутки или максимально переносимой (но не более максимальной суточной дозы 1 мг/кг). Суточную дозу следует округлять в меньшую сторону до ближайшего меньшего количества целых капсул. Побочные эффекты и передозировка Побочные эффекты: Большинство побочных действий препарата Роаккутан зависят от дозы. Как правило, при назначении рекомендованных доз соотношение пользы и риска, учитывая тяжесть заболевания, приемлемо для больного. Обычно побочные действия носят обратимый характер после коррекции дозы или отмены препарата, но некоторые могут сохраняться после прекращения лечения. Симптомы, связанные с гипервитаминозом А: сухость кожи, слизистых оболочек, в т.ч. губ (хейлит), носовой полости (кровотечения), гортаноглотки (охриплость голоса), глаз (конъюнктивит, обратимое помутнение роговицы и непереносимость контактных линз). Кожа и ее придатки: сыпь, зуд, эритема лица/дерматит, потливость, пиогенная гранулема, паронихии, ониходистрофии, усиленное разрастание грануляционной ткани, стойкое истончение волос, обратимое выпадение волос, фульминантные формы акне, гирсутизм, гиперпигментация, фотосенсибилизация, фотоаллергия, легкая травмируемость кожи, шелушение кожи ладоней и подошв. В начале лечения может происходить обострение акне, сохраняющееся несколько недель. Костно-мышечная система: боли в мышцах с повышением активности креатинфосфоки- назы (КФК) в сыворотке или без него, боли в суставах, гиперостоз, артрит, обызвествление связок и сухожилий, уменьшение плотности костной ткани, преждевременное закрытие эпифизарных зон роста, другие изменения костей, тендиниты. Центральная нервная система и психическая сфера: нарушение поведения, депрессия, суицидальные попытки, суицид, психоз, чрезмерная утомляемость, головная боль, повышение внутричерепного давления ("псевдоопухоль головного мозга": головная боль, тошнота, рвота, нарушение зрения, отек зрительного нерва), судороги. Органы чувств: нарушение остроты зрения, светобоязнь, нарушение темновой адаптации (снижение остроты сумеречного зрения), нарушение цветовосприятия (проходящее после отмены препарата), лентикулярная катаракта, кератит, блефарит, конъюнктивит, раздражение глаз, ксерофтальмия, нарушение слуха на определенных звуковых частотах. Желудочно-кишечный тракт: тошнота, диарея, воспалительные заболевания кишечника (колит, илеит), кровотечения, сухость слизистой оболочки полости рта, кровотечение из десен, воспаление десен: панкреатит (особенно при сопутствующей гипертриглицеридемии выше 800 мг/дл), в том числе с фатальным исходом. Транзиторное и обратимое повышение активности печеночных трансаминаз, гепатит. Во многих этих случаях изменения не выходили за границы нормы и возвращались к исходным показателям в процессе лечения, однако в некоторых ситуациях возникала необходимость уменьшить дозу или отменить Роаккутан. Органы дыхания: бронхоспазм (чаще у больных с бронхиальной астмой в анамнезе). Система крови: анемия, снижение гематокрита, лейкопения, нейтропения,увеличение или уменьшение числа тромбоцитов, увеличение скорости оседания эритроцитов (СОЭ). Лабораторные показатели: гипертриглицеридемия, гиперхолестеринемия, гиперурикемия, снижение концентрации липопротеинов высокой плотности, гипергликемия. В ходе приема препарата Роаккутан были зарегистрированы случаи впервые выявленного сахарного диабета. У некоторых больных, особенно занимающихся интенсивной физической нагрузкой, описаны отдельные случаи повышения активности КФК в сыворотке. Иммунная система: местные или системные инфекции, вызванные грамположительными возбудителями (Staphylococcus aureus). Прочее: лимфаденопатия, гематурия, проте- инурия, васкулит (гранулематоз Вегенера, аллергический васкулит), системные реакции гиперчувствительности, гломерулонефрит, боль в спине. Постмаркетинговое наблюдение В ходе постмаркетингового наблюдения при применении препарата Роаккутан описаны случаи развития тяжелых кожных реакций, таких как мультиформная эритема, синдром Стивенса-Джонсона, токсический эпидермальный некролиз (см. также раздел "Особые указания"). При применении препарата Роаккутан, особенно у пациентов, совершавших интенсивные физические нагрузки, сообщалось о серьезных случаях рабдомиолиза, часто приводивших к госпитализации и в некоторых случаях - к фатальному исходу. Передозировка: В случае передозировки могут появиться признаки гипервитаминоза А. В первые несколько часов после передозировки может понадобиться промывание желудка. Взаимодействие с другими ЛС: Из-за возможного усиления симптомов гипервитаминоза А следует избегать одновременного назначения препарата Роаккутан и витамина А (ретинола), а также других пероральных ретиноидов. Поскольку тетрациклины также могут вызвать повышение внутричерепного давления, их применение в сочетании с препаратом Роаккутан противопоказано. Изотретиноин может ослабить эффективность препаратов прогестерона, поэтому не следует пользоваться контрацептивными средствами, содержащими малые дозы прогестерона. Сочетанное применение с местными кератолитическими или эксфолиативными препаратами для лечения акне противопоказано из-за возможного усиления местного раздражения. Фармакологическое действие и фармакокинетика Ретиноид для системной терапии угревой болезни Изотретиноин - стереоизомер полностью транс-ретиноевой кислоты (третиноина). Точный механизм действия препарата Роаккутан еще не выяснен, однако установлено, что улучшение клинической картины тяжелых форм акне связано с подавлением активности сальных желез и гистологически подтвержденным уменьшением их размеров. Кроме того, доказано противовоспалительное действие изотретиноина на кожу. Гиперкератоз клеток эпителия волосяной луковицы и сальной железы приводит к слущиванию корнеоцитов в проток железы и к закупорке последнего кератином и избытком сального секрета. За этим следует образование комедона и, в ряде случаев, присоединение воспалительного процесса. Роаккутан подавляет пролиферацию себоцитов и действует на акне, восстанавливая нормальный процесс дифференцировки клеток. Кожное сало - основной субстрат для роста Propionibacterium acnes, поэтому уменьшение образования кожного сала подавляет бактериальную колонизацию протока. Фармакокинетика: Поскольку кинетика изотретиноина и его метаболитов носит линейный характер, его концентрации в плазме в ходе терапии можно предсказать на основании данных, полученных после разового приема. Это свойство препарата также говорит о том, что он не влияет на активность печеночных ферментов, участвующих в метаболизме лекарственных средств. Всасывание Всасывание изотретиноина из желудочно-кишечного тракта колеблется. Абсолютная биодоступность изотретиноина не определялась, поскольку формы выпуска препарата для внутривенного применения у человека нет. Однако экстраполирование данных, полученных в эксперименте на собаках, позволяет предполагать довольно низкую и вариабельную системную биодоступность. У больных с акне максимальные концентрации в плазме (Смакс) в равновесном состоянии после приема 80 мг изотретиноина натощак составляли 310 нг/мл (диапазон 188-473 нг/мл) и достигались через 2-4 часа. Концентрации изотретиноина в плазме примерно в 1.7 раз выше концентраций в крови, вследствие плохого проникновения изотретиноина в эритроциты. Прием изотретиноина с пищей увеличивает биодоступность в 2 раза по сравнению с приемом натощак. Распределение Изотретиноин в сильной степени (99.9%) связывается с белками плазмы, главным образом с альбуминами, так что в широком диапазоне терапевтических концентраций содержание свободной (фармакологически активной) фракции препарата составляет менее 0.1% его общего количества. Объем распределения изотретиноина у человека не определялся, поскольку лекарственной формы для внутривенного введения не существует. Равновесные концентрации изотретиноина в крови (Смин ss) У больных с тяжелыми акне, принимавших по 40 мг препарата 2 раза в сутки, колебались от 120 до 200 нг/мл. Концентрации 4-оксо-изотретиноина у этих больных в 2.5 раза превышали таковые изотретиноина. Данных о проникновении изотретиноина в ткани у человека недостаточно. Концентрации изотретиноина в эпидермисе в два раза ниже, чем в сыворотке. Метаболизм После приема внутрь в плазме обнаруживаются три основных метаболита: 4-оксо- изотретиноин, третиноин (полностью транс-ретиноевая кислота) и 4-оксо-ретиноин. Главным метаболитом является 4-оксо-изотретиноин, плазменные концентрации которого в равновесном состоянии в 2.5 раза выше, чем концентрации исходного препарата: Обнаружены и менее значимые метаболиты, включающие также глюкурониды, однако установлена структура не всех метаболитов. Метаболиты изотретиноина обладают биологической активностью, подтвержденной в нескольких лабораторных тестах. Таким образом, клинические эффекты препарата у больных могут быть результатом фармакологической активности изотретиноина и его метаболитов. Поскольку in vivo изотретиноин и третиноин (полностью транс-ретиноевая кислота) обратимо превращаются друг в друга, метаболизм третиноина связан с метаболизмом изотретиноина. 20-30% дозы изотретиноина метаболизируется путем изомеризации. В фармакокинетике изотретиноина у человека существенную роль может играть энтерогепатическая циркуляция. Исследования метаболизма in vitro показали, что в превращении изотретиноина в 4-оксо- изотретиноин и третиноин участвуют несколько ферментов системы цитохрома Р450 (CYP). По-видимому, ни одна из изоформ при этом не играет доминирующей роли. Роаккутан и его метаболиты не оказывают существенного влияния на активность ферментов системы CYP. Выведение После приема внутрь радиоактивно меченного изотретиноина в моче и кале обнаруживается примерно одинаковое количество. Период полувыведения терминальной фазы для неизмененного препарата у больных с акне составляет в среднем 19 часов. Период полувыведения терминальной фазы для 4-оксо-изотретиноина, по-видимому, больше и равняется в среднем 29 часам. Изотретиноин относится к природным (физиологическим) ретиноидам. Эндогенные концентрации ретиноидов восстанавливаются примерно через 2 недели после окончания приема препарата Роаккутан. Фармакокинетика в особых клинических случаях Поскольку изотретиноин противопоказан при нарушении функции печени, данные о фармакокинетике препарата у этой группы больных ограничены. Почечная недостаточность не влияет на фармакокинетику изотретиноина. Особые указания Роаккутан должны назначать только врачи, предпочтительно дерматологи, имеющие опыт применения системных ретиноидов и знающие о риске тератогенности препарата. Пациентам как женского, так и мужского пола необходимо выдавать копию брошюры с информацией для пациента. Во избежание случайного воздействия препарата на организм других людей, у больных, которые получают или незадолго до этого (1 месяц) получали Роаккутан, нельзя брать донорскую кровь. Рекомендуется контролировать функцию печени и печеночные ферменты до лечения, через 1 месяц после его начала, а затем каждые 3 месяца или по показаниям. Отмечено преходящее и обратимое увеличение печеночных трансаминаз, в большинстве случаев в пределах.нор-мальных значений. Если активность печеночных трансаминаз превышает норму, необходимо уменьшить дозу препарата или отменить его. Следует определять также концентрацию липидов в сыворотке натощак до лечения, через 1 месяц после начала, а затем каждые 3 месяца или по показаниям. Обычно концентрации липидов нормализуются после уменьшения дозы или отмены препарата, а также при соблюдении диеты. Необходимо контролировать клинически значимое повышение концентрации триглицеридов, поскольку их подъем свыше 800 мг/дл или 9 ммоль/л может сопровождаться развитием острого панкреатита, возможно с летальным исходом. При стойкой гипертриглицеридемии или симптомах панкреатита Роаккутан следует отменить. В редких случаях у больных, получавших Роаккутан, описаны депрессия, психотическая симптоматика и очень редко - суицидальные попытки и суицид. Хотя их причинная связь с применением препарата не установлена, необходимо соблюдать особую осторожность у больных с депрессией в анамнезе и наблюдать всех пациентов на предмет возникновения депрессии в ходе лечения препаратом, при необходимости направляя их к соответствующему специалисту. Однако отмена препарата Роаккутан может не приводить к исчезновению симптомов и может потребоваться дальнейшее наблюдение и лечение у специалиста.В редких случаях в начале терапии отмечается обострение акне, которое проходит в течение 7-10 дней без коррекции дозы препарата. Через несколько лет после применения препарата Роаккутан для лечения дискератозов при общей курсовой дозе и продолжительности терапии, выше рекомендованных для терапии акне, развивались костные изменения, в том числе преждевременное закрытие эпифизарных зон роста, гиперостоз, кальцификация связок и сухожилий. Поэтому при назначении препарата любому больному, следует предварительно тщательно оценить соотношение возможной пользы и риска. Пациентам, получающим Роаккутан, рекомендуется использовать увлажняющие мазь или крем для тела, бальзам для губ для уменьшения сухости кожи и слизистых в начале терапии. В ходе постмаркетингового наблюдения при применении препарата Роаккутан описаны случаи развития тяжелых кожных реакций, таких как мультиформная эритема, синдром Стивенса-Джонсона, токсический эпидермальный некролиз. Данные явления могут носить серьезный характер и привести к потере трудоспособности, угрожающим жизни состояниям, госпитализации или фатальному исходу. Пациенты, получающие Роаккутан, нуждаются в тщательном наблюдении с целью выявления тяжелых кожных реакций и при необходимости решения вопроса об отмене препарата. На фоне приема препарата Роаккутан возможны боли в мышцах и суставах, увеличение активности КФК сыворотки крови, которые могут сопровождаться снижением переносимости интенсивной физической нагрузки. Следует избегать проведения глубокой химической дермоабразии и лечения лазером у больных, получающих Роаккутан, а также в течение 5-6 месяцев после окончания лечения из-за возможности усиленного рубцевания в атипичных местах и (реже) возникновения гипер- и гипопигментации. В ходе лечения препаратом Роаккутан и в течение 6 месяцев после него нельзя проводить эпиляцию с помощью аппликаций воска из-за риска отслойки эпидермиса, развития рубцов и дерматита. Поскольку у некоторых больных может наблюдаться снижение остроты сумеречного зрения, которое иногда сохраняется и после окончания терапии, больных следует информировать о возможности этого состояния, рекомендуя им соблюдать осторожность при вождении автомобиля в ночное время. Состояние остроты зрения нужно тщательно контролировать. Сухость конъюнктивы глаз, помутнения роговицы, ухудшение сумеречного зрения и кератит обычно проходят после отмены препарата. При сухости слизистой оболочки глаз можно использовать аппликации увлажняющей глазной мази или препарата искусственной слезы. Необходимо наблюдать больных с сухостью конъюнктивы на предмет возможного развития кератита. Больных, предъявляющих жалобы на зрение, следует направлять к офтальмологу и рассмотреть вопрос о целесообразности отмены препарата Роаккутан. При непереносимости контактных линз на время терапии следует использовать очки. Следует ограничивать воздействие солнечных и ультрафиолетовых лучей. При необходимости следует использовать солнцезащитный крем с высоким значением защитного фактора не менее 15 SPF (sun protection factor). Описаны редкие случаи развития доброкачественной внутричерепной гипертензии ("псевдоопухоль головного мозга"), в т.ч. при сочетанном применении с тетрациклинами. У таких пациентов следует немедленно отменить Роаккутан. При терапии препаратом Роаккутан возможно возникновение воспалительного заболевания кишечника. У больных с выраженной геморрагической диареей необходимо немедленно отменить Роаккутан. Описаны редкие случаи анафилактических реакций, которые возникали только после предшествующего наружного применения ретиноидов. Тяжелые аллергические реакции диктуют необходимость отмены препарата и тщательного наблюдения за больным. Больным из группы высокого риска (с сахарным диабетом, ожирением, хроническим алкоголизмом или нарушениями жирового обмена) при лечении препаратом Роаккутан может потребоваться более частый лабораторный контроль концентрации глюкозы и липидов. При наличии диабета или подозрении на него рекомендуется более частое определение гликемии. Попадание лекарственных препаратов в окружающую среду должно быть сведено к минимуму. Не допускается утилизация препарата Роаккутан с помощью сточных вод или вместе с бытовыми отходами. По возможности необходимо использовать специальные системы для утилизации лекарственных препаратов. Влияние на способность управлять транспортными средствами: В период лечения необходимо соблюдать крайнюю осторожность при управлении транспортными средствами и занятии другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций. Поскольку у некоторых больных может наблюдаться снижение остроты сумеречного зрения, которое иногда сохраняется и после окончания терапии, больных следует информировать о возможности этого состояния, рекомендуя им соблюдать осторожность при вождении автомобиля и работе с машинами и механизмами в ночное время. Условия хранения и отпуска из аптек Условия хранения:Хранить при температуре не выше 25°С в защищенном от света и влаги месте. Хранить в недоступном для детей месте. Отпуск из аптек: По рецепту Регистрационные данные Торговое название Роаккутан Международное непатентованное название:Изотретиноин. Форма выпуска:капсулы. Состав:Одна капсула 10 мг содержит: действующее вещество: изотретиноин - 10 мг: вспомогательные вещества: соевых бобов масло - 107.92 мг, воск пчелиный желтый - 7.68 мг, соевых бобов масло гидрогенизированное - 7.68 мг, соевых бобов масло частично гидрогенизированное - 30.72 мг: оболочка капсулы: глицерол 85% - 31.275 мг, желатин - 75.64 мг, Карион 83 (крахмал картофельный гидролизованный, маннитол, сорбитол) - 8.065 мг, краситель железа оксид красный (Е172) - 0.185 мг, титана диоксид (Е171)-1.185 мг: чернила для нанесения надписи на капсуле: шеллак, краситель железа оксид черный (Е172): допускается использование готовых чернил Opacode Black S-1-17823. Одна капсула 20 мг содержит: действующее вещество: изотретиноин - 20 мг: вспомогательные вещества: соевых бобов масло - 215.84 мг, воск пчелиный желтый - 15.36 мг, соевых бобов масло гидрогенизированное - 15.36 мг, соевых бобов масло частично гидрогенизированное - 61.44 мг: оболочка капсулы: глицерол 85% - 49.835 мг, желатин - 120.66 мг, Карион 83 (крахмал картофельный гидролизованный, маннитол, сорбитол) - 12.86 мг, краситель железа оксид красный (Е172) - 0.145 мг, титана диоксид (Е171) - 1.97 мг: чернила для нанесения надписи на капсуле: шеллак, краситель железа оксид черный (Е172): допускается использование готовых чернил Opacode Black S-l-17823. АТХ: Регистрация: Лекарственное средство П N013958/01 Фармгруппа: Средство лечения угревой сыпи. Дата регистрации: 01.10.2007. Окончание регстрации: . Описание:Капсулы 10мг: капсулы овальной формы, коричнево-красного цвета, непрозрачные: на поверхности капсулы надпись черными чернилами "ROA 10": содержимое капсулы - однородная суспензия от желтого до темно-желтого цвета. Капсулы 20 мг: капсулы овальной формы, одна половина коричнево-красного цвета, непрозрачная, другая половина белая, непрозрачная: на поверхности капсулы надпись черными чернилами "ROA 20": содержимое капсулы - однородная суспензия от желтого до темно- желтого цвета. Упаковка:Капсулы 10 мг и 20 мг. По 10 капсул в блистер ПВХ/ПЭ/ПВДХ/А1 или ПВХ/ПВДХ/А1 или ПВХ/А1. 3 или 10 блистеров вместе с инструкцией по применению помещают в картонную пачку. Срок годности:3 года. Препарат не следует использовать по истечении срока годности, указанного на упаковке. Владелец рег.удостоверения:Хоффманн-Ля Рош Лтд. Производитель:F. Hoffmann-La Roche, Ltd. Представительство:Ф. Хоффманн-Ля Рош Лтд

Модель:
RUR 355
Показания криптококкоз, включая криптококковый менингит и другие локализации данной инфекции (в т.ч. легкие, кожа), как у больных с нормальным иммунным ответом, так и у больных с различными формами иммуносупрессии (в т. ч. у больных СПИД, при трансплантации органов): препарат может использоваться для профилактики криптококковой инфекции у больных СПИДом:в генерализованный кандидоз, включая кандидемию, диссеминированный кандидоз и другие формы инвазивных кандидозных инфекций (инфекции брюшины, эндокарда, глаз, дыхательных и мочевых путей). Лечение может проводиться у больных со злокачественными новообразованиями, больных отделений интенсивной терапии, больных, проходящих курс цитостатической или иммуносупрессивной терапии, а также при наличии других факторов, предрасполагающих к развитию кандидоза: в кандидоз слизистых оболочек, в т.ч. полости рта и глотки (в т.ч. атрофический кандидоз полости рта, связанный с ношением зубных протезов), пищевода, неинвазивные бронхолегочные кандидозы, кандидурия, кандидозы кожи: профилактика рецидива орофарингеального кандидоза у больных СПИД: генитальный кандидоз: лечение вагинального кандидоза (острого и хронического рецидивирующего), профилактическое применение с целью уменьшения частоты рецидивов вагинального кандидоза (3 и более эпизодов в год): кандидозный баланит: профилактика грибковых инфекций у больных со злокачественными новообразованиями, которые предрасположены к таким инфекциям в результате химиотерапии цитостатиками или лучевой терапии:микозы кожи, включая микозы стоп, тела, паховой области: отрубевидный лишай, онихомикоз: кандидоз кожи:в глубокие эндемические микозы, включая кокцидиомикоз, паракокцидиомикоз, споротрихоз и гистоплазмоз у больных с нормальным иммунитетом. Противопоказания Противопоказания Одновременный прием терфенадина (на фоне многократного приема флуконазола в дозе 400 мг/сут и более) (см. раздел "Взаимодействие с другими лекарственными средствами"):Повышенная чувствительность к флуконазолу и другим компонентам препарата или близким по структуре азольным соединениям:Детский возраст до 3-х лет (для данной лекарственной формы):Период лактации (см. раздел "Применение при беременности и в период грудного вскармливания"):Одновременное применение с препаратами, увеличивающими интервал Q-Tиметаболизирующимися с помощью изоферменга CY3A4, такими как цизаприд, астемизол, эритромицин, пимозид и хинидин (см. раздел "Взаимодействие с другими лекарственными средствами"):Непереносимость лактозы, дефицит лактазы, глюкозо-галактозная мальабсорбция С осторожностью: - Нарушение показателей функции печени- Одновременный прием потенциально гепатотоксичных лекарственных средств- Алкоголизм- Проаритмогеиные состояния у пациентов с множественными факторами риска (органические заболевания сердца, нарушения электролитного баланса, одновременный прием лекарственных средств, вызывающих аритмии)- Нарушение функции почек- Появление сыпи на фоне применения флуконазола у больных с поверхностной грибковой инфекцией и инвазивными/системными грибковыми инфекциями- Одновременное применение терфеиадина и флуконазола в дозе менее 400 мг/сут. Беременность Адекватных и контролируемых исследований применения флукопазола у беременных женщин нс проводилось.В настоящее время нет доказательств влияния низких доз флукопазола (150 мг однократно для лечения вульвовагинального кан- дидоза) на повышение частоты неблагоприятных исходов беременности, а также взаимосвязи с возникновением каких-либо специфических пороков развития у ребенка. При применении высоких доз (400- 800 мг/сут) флукопазола описано несколько случаев множественных врожденных пороков у новорожденных, матери которых на протяжении большей части или всего первого триместра получали терапию флуконазолом. Применение препарата у беременных нецелесообразно, за исключением тяжелых или угрожающих жизни форм грибковых инфекций, если предполагаемая польза для матери превышает возможный риск для плода. Женщинам детородного возраста следует использовать средства контрацепции. Флуконазол находится в грудном молоке в такой же концентрации, как и в плазме, поэтому его назначение в период лактации противопоказано. Применение и дозы Внутрь. Взрослым при криптококковом менингите и криптококковых инфекциях других локализаций в первый день обычно назначают 400 мг (8 капсул по 50 мг), а затем продолжают лечение в дозе 200-400 мг 1 раз/сут. Продолжительность лечения при криптококковых инфекциях зависит от клинической эффективности, подтвержденной микологическим исследованием: при криптококковом менингите его обычно продолжают по крайней мере 6-8 недель. Для профилактики рецидива криптококкового менингита у больных СПИД, после завершения полного курса первичного лечения, флуконазол назначают в дозе 200 мг/сут в течение длительного периода времени. При кандидемии, диссеминированном кандидозе и других инвазивных кандидозных инфекциях доза обычно составляет 400 мг в первые сутки, а затем - по 200 мг. При недостаточной клинической эффективности доза препарата может быть увеличена до 400 мг/сут. Длительность терапии зависит от клинической эффективности. При орофарингеальном кандидозе препарат обычно назначают по 50-100 мг 1 раз/сут: продолжительность лечения - 7- 14 дней. При необходимости, у больных с выраженным снижением иммунитета лечение может быть более длительным. При атрофическом кандидозе полости рта, связанном с ношением зубных протезов, флуконазол обычно назначают по 50 мг 1 раз/сут в течение 14 дней в сочетании с местными антисептическими средствами для обработки протеза. При других локализациях кандидоза (за исключением генитального кандидоза), например при эзофагите, неинвазивном бронхолегочном поражении, кандидурии, кандидозе кожи и слизистых оболочек и т.д, эффективная доза обычно составляет 50-100 мг/сут при длительности лечения 14-30 дней. Для профилактики рецидивов орофарингеального кандидоза у больных со СПИД после завершения полного курса первичной терапии препарат может бьггь назначен по 150 мг 1 раз в неделю. При вагинальном кандидозе флуконазол принимают: ТАБЛИЦЪНекоторым больным может потребоваться более частое применение . При баланите вызванном Candida, флуконазол назначают однократно в дозе 150 мг внутрь. Побочные эффекты и передозировка Побочные эффекты: Со стороны желудочно-кишечного тракта: сухость слизистой оболочки полости рта, рвота, тошнота, диарея, запор, метеоризм, абдоминальные боли,Со стороны печени и желчевыводящих путей: редко - нарушение функции печени (желтуха, гепатит, гепатонекроз, гипербилирубипемия, повышение активности аланинаминотрансфсразы, аспартатаминотрансферазы, щелочной фосфатазы), гепатотоксичность, в некоторых случаях с летальным исходом, холесгаз, генатоцеллюлярное повреждение. Со стороны нервной системы: головная боль, головокружение, изменение вкуса, парестезия. бессонница, сонливость, тремор: редко - судороги. Со стороны кроен и лимфатической системы: анемия: редко - лейкопения, тромбоцитопения, иейтропения, агранулоцитоз. Со стороны сердечно-сосудистой системы: увеличение продолжительности интервала Q-T: мерцание, трепетание желудочков, аритмия желудочковая тахисистолическая типа "пируэт" (torsade de pointes). Со стороны кожных покровов: сыпь, алопеция, эксфолиативпые поражения кожи, включая синдром Стивенса-Джонсона и токсический эпидермальный некролиз, острый генерализованный экзантематозный пустулез, повышенное потоотделение, лекарственная сыпь. Со стороны обмена веществ: повышение концентрации холестерина и триглицеридов в плазме крови, гипокалиемия. Со стороны опорно-двигательного аппарата миалгия. Прочие: слабость, астения, повышенная утомляемость, лихорадка, повышенная потливость, вертиго: редко - нарушение функции почек. Передозировка: Симптомы: галлюцинации, параноидальное поведение. Лечение: симптоматическое, промывание желудка, форсированный диурез. Гемодиализ в течение 3 ч снижает концентрацию в плазме приблизительно на 50%. Взаимодействие с другими ЛС: Однократный или многократный прием флуконазола в дозе 50 мг не влияет на метаболизм феназона (Антипирина) при их одновременном приеме. Одновременное применение флуконазола со следующими препаратами противопоказано. Цизаприд. При одновременном применении флуконазола и цизаприда возможны нежелательные реакции со стороны сердца, в т. ч. аритмия желудочковая тахисистолическая типа "пируэт" (torsade dc pointes). Применение флуконазола в дозе 200 мг 1 раз в сутки и цизаприда в дозе 20 мг 4 раза в сутки приводит к выраженному увеличению плазменных концентраций цизаприда и увеличению интервала Q-T на ЭКГ. Терфенадин. При одновременном применении азольных противогрибковых средств и терфинадина возможно возникновение серьезных аритмий в результате увеличения интервала Q-T. При приеме флуконазола в дозе 200 мг/сут увеличения интервала Q-T не установлено. Однако применение флуконазола в дозах 400 мг/сут и выше вызывает значительное увеличение концентрации терфенадина в плазме крови. Одновременный прием флуконазола в дозах 400 мг/сут и более с терфенадином противопоказан (см. раздел "Противопоказания"). Лечение флуконазолом в дозах менее 400 мг/сут в сочетании с терфенадином следует проводить под тщательным контролем. Астемизол. Одновременное примене- ние флуконазола с астемизолом или другими препаратами, метаболизм которых осуществляется системой цитохрома Р450, может сопровождаться повышением сывороточных концентраций этих средств. Повышенные концентрации астемизола в плазме крови могут приводить к удлинению интервала Q-T и в некоторых случаях к развитию аритмии желудочковой тахисистолической типа "пируэт" (torsade dc pointes). Одновременное применение астемизола и флуконазола противопоказано. Пимозид. Несмотря па то, что не проводилось соответствующих исследований in vitro или in vivo, одновременное применение флуконазола и пимозида может приводить к угнетению метаболизма пимозида. В свою очередь повышение плазменных концентраций пимозида может приводить к удлинению интервала Q-T и в некоторых случаях развитию аритмии желудочковой тахисистолической типа "пируэт" (torsade de pointes). Одновременное применение пимозида и флуконазола противопоказано. Хинидин. Несмотря на то. что не проводилось соответствующих исследований in vitro или in vivo, одновременное применение флукоиазола и хинидина может также приводить к угнетению метаболизма хинидина. Применение хинидина связано с удлинением интервала Q-T и в некоторых случаях с развитием аритмии желудочковой тахисистоли- ческой типа "пируэт" (torsade dc pointes). Одновременное применение хинидина и флуконазола противопоказано. Эритромицин. Одновременное применение флуконазола и эритромицина потенциально приводит к повышенному риску развития кардиотоксичности (удлинение интервала Q-T, torsade de pointes) и, вследствие этого, внезапной сердечной смерти. Одновременное применение флуконазола и эритромицина противопоказано. Следует соблюдать осторожность и, возможно, корректировать дозы при одновременном применении следующих препаратов и флукоиазола:Гидрохлоротиазид. Одновременное многократное применение флукоиазола и гидрохлортиазида может привести к возрастанию концентрации флуконазола в плазме крови на 40 %. Эффект такой степени выраженности не требует изменения режима дозирования флуконазола у больных, получающих одновременно диуретики, однако врачу следует это учитывать. Рифампицин. Комбинация с рифампиципом приводит к снижению AUC (площади под кривой "концентрация-время") на 25 % и укорочению периода полувыведения флуконазола из плазмы на 20 %. Поэтому больным, получающим одновременно рифампицин, дозу флуконазола целесообразно увеличить. Флуконазол является мощным ингибитором нзофермента CYP2C9 и CYP2C19 цитохрома Р450 и умеренным ингибитором изофермента CYP3A4. Помимо перечисленных далее эффектов, существует риск повышения в плазме крови концентрации и других лекарственных средств, мстаболизируемых изоферментами CYP2C9, CYP2C19 и CYP3A4 при одновременном приеме с флуконазолом.В связи с этим, следует соблюдать осторожность при одновременном применении нижеперечисленных препаратов, а при необходимости подобных комбинаций пациенты должны находиться под тщательным медицинским наблюдением. Следует учитывать, что ингибирующий эффект флуконазола сохраняется в течение 4-5 дней после отмены препарата в связи с длительным периодом полувыведения. Алфентанил. Отмечается уменьшение кли- репса и объема распределения, увеличение периода полувыведения алфентанила. Возможно, это связано с ингибированием изофермента CYP3A4 флуконазолом. Может потребоваться коррекция дозы алфентанила. Амитриптилин, нортриптилин. Увеличение эффекта. Концентрацию 5-нортриптилина и/или S-амитриптилина можно измерить в начале комбинированной терапии с флуконазолом и через неделю после начала лечения. При необходимости следует корректировать дозу амитриптили- на/нортринтилина. Амфотспицин В. В исследованиях па мышах (в том числе, с иммуносупрессисй) были отмечены следующие результаты: небольшой аддитивный противогрибковый эффект при системной инфекции, вызванной С. albicans, отсутствие взаимодействия при внутричерепной инфекции, вызванной Cryptococcus neofonmms и антагонизм при системной инфекции, вызванной Л. fumigants. Клиническое значение данных результатов не ясно. При применении флуконазола и других противогрибковых средств (производных азола) с варфарином увеличивается про- тромбиновос время (в среднем на 12 %). Возможно развитие кровотечений (гематомы, кровотечения из носа и желудочно- кишечного тракта, гематурия, мелена). У пациентов, получающих кумариновые антикоагулянты, необходимо постоянно контролировать протромбиновое время в период терапии и в течение 8 дней после одновремепного- примепения. Также следует оценить целесообразность коррекции дозы варфарина. Азитромицин. При одновременном применении внутрь флуконазола в однократной дозе 800мг с азитромицином в однократной дозе 1200 мг выраженного фармакокинетического взаимодействия между обоими препаратами не установлено. Бензодиазепины. (короткого действия). После приема внутрь мидазолама, флуконазол существенно увеличивает концентрацию мидазолама и психомоторные эффекты, причем это влияние более выражено после приема флуконазола внутрь, чем при его применении внутривенно. При необходимости сопутствующей терапии бензодиазепинами пациентов, принимающих флуконазол, следует наблюдать с целью оценки целесообразности соответствующего снижения дозы бензодиазепина. При одновременном приеме однократной дозы триазолама, флуконазол увеличивает AUC триазолама приблизительно на 50 %, С max - на 25-50 % и период полувыведения на 25-50 % благодаря угнетению метаболизма триазолама. Может понадобиться коррекция дозы триазолама. Капбамазепин. Флуконазол угнетает метаболизм карбамазепина и повышает его сывороточную концентрацию па 30 %. Необходимо учитывать риск развития токсичности карбамазепина. Следует оценить необходимость коррекции дозы карбамазепина в зависимости от концентрации/эффекта. Блокаторы кальциевых каналов. Некоторые антагонисты кальциыевых каналов (нифедипин, исрадипин, амлодипин, верапамил и фелодипин) фелодипин) метаболизируются изоферментом CYP3A4. Флуконазол увеличивает системную экспозицию антагонистов кальциевых каналов. Рекомендован контроль побочных эффектов. Циклоспорин. Рекомендуется осуществлять контроль за концентрацией циклоспорина в крови у пациентов, получающих флуконазол, так как у больных с пересаженной ночкой прием флуконазола в дозе 200 мг/сут приводит к медленному увеличению концентрации циклоспорина в плазме. Однако при многократном приеме флуконазола в дозе 100 мг/сут изменения концентрации циклоспорина у реципиентов костного мозга не наблюдалось. Циклофосфамид. При одновременном применении циклофосфамида и флуконазола отмечается увеличение сывороточных концентраций билирубина и креатинина. Сочетание препаратов возможно е учетом риска данных нарушений. Фентанил. Имеется сообщение об одном летальном исходе, возможно связанном с одновременным приемом фентанила и флуконазола. Предполагается, что нарушения связаны с интоксикацией фентанилом. Было показано, что флуконазол значительно удлиняет время выведения фентанила. Следует учитывать, что повышение концентрации фентанила может привести к угнетению дыхательной функции. Галофантрин. Флуконазол может увеличивать концентрацию галофаитина в плазме крови в связи с ингибированием изофермента CYP3A4. При одновременном применении с флуконазолом, как и с другими противогрибковыми препаратами азолового ряда возможно развитие аритмии желудочковой тахисистолической типа "пируэт", поэтому совместное применение их не рекомендуется. Ингибиторы ГМК-КоА-редуктазы. При одновновременном применении флуконазола с ингибиторами ГМК-КоА-редуктазы, метаболизируемыми изоферментом CYP3A4 (такими как аторвастатин и симвастатин) или изоферментом CYP2D6 (флувастагин), риск развития миопатии и рабдомиолиза увеличивается. В случае необходимости одновременной терапии указанными препаратами, следует наблюдать пациентов с целью выявления симптомов миопатии и рабдомиолиза. Необходимо контролировать концентрацию креатининкиназы. В случае значительного увеличения концентрации креатининкиназы или если диагностируется или имеется подозрение на развитие миопатии или рабдомиолиза, терапию ингибиторами ГМК-КоА-редуктазы следует прекратить. Лозартан. Флукопазол угнетает метаболизм лозартана до его активного метаболита (Е-31 74), который отвечает за большую часть эффектов, связанных с антагонизмом ангиотензин-II рецепторов. Необходим регулярный контроль артериального давления. Метадон. Флукопазол может увеличивать плазменную концентрацию метадона. Может понадобиться коррекция дозы метадона/Нестероидные противовоспалительные препараты (НПВП). Cmax и AUC флурбипрофена увеличиваются на 23% и 81 % соот ветственно. Аналогично С max и AUC фармакологически активного изомера [S-(+)- ибупрофен] повышались на 15 % и 82 % соответственно при одновременном применении флуконазола с рацемическим ибупрофеном (400мг). При одновременном применении флуконазола в дозе 200 мг/сут и целекоксиба в дозе 200 мг Сmах и AUC целекоксиба увеличиваются на 68 % и 134 % соответственно. В данной комбинации возможно снижение дозы целекоксиба вдвое. Несмотря на отсутствие целенаправленных исследований флуконазол может увеличивать системную экспозицию других ИПВП, метаболизирусмых изоферментом CYP2C9 (напроксен, лорноксикам, мелоксикам. диклофенак). Может понадобиться коррекция дозы ИПВП. При одновременном применении ИПВП и флуконазола пациенты должны находиться под тщательным медицинским наблюдением с целью выявления и контроля нежелательных явлений и проявлений токсичности, связанных с НПВП. Пероральные контрацептивы. При одновременном применении комбинированного перорального контрацептива с флуконазолом в дозе 50 мг существенного влияния на уровень гормонов не установлено. При ежедневном приеме 200 мг флуконазола AUC этинил- эстрадиола и левоноргестрела увеличиваются на 40 % и 24 % соответственно. При приеме 300 мг флуконазола один раз в неделю AUC этинилэстрадиола и норэтиндрона возрастают на 24 % и 13 % соответственно. Таким образом, многократное применение флуконазола в указанных дозах вряд ли может оказать влияние на эффективность комбинированного перорального противозачаточного средства. Фенитоин. Одновременное применение флуконазола и фенитоина может привести к возрастанию концентрации фенитоина в плазме до клинически значимой степени. Поэтому при необходимости совместного применения этих препаратов нужно мониторировать концентрации фенитоина с коррекцией его дозы с целью поддержания уровня препарата в пределах терапевтического интервала. Преднизон. Имеется сообщение о развитии острой недостаточности коры надпочечников у пациента после трансплантации печени на фоне отмены флуконазола после трехмесячного курса терапии. Предположительно, прекращение терапии флуконазолом вызвало повышение активности изофермента CYP3A4, что привело к увеличенному метаболизму преднизона. Пациенты, получающие комбинированную терапию преднизоном и флуконазолом должны находиться под тщательным медицинским наблюдением при отмене приема флуконазола с целью оценки состояния коры надпочечников. Рифабутин. Имеются сообщения о взаимодействии флуконазола и рифабутина, сопровождавшегося повышением сывороточных концентраций последнего до 80 %. При одновременном применении флуконазола и рифабутина описаны случаи увеита. Необходимо тщательно наблюдать больных, одновременно получающих рифабутин и флуконазол. Саквинавир. AUC повышается приблизительно на 50 %. Сmax - на 55 %. Клиренс саквинавира уменьшается приблизительно па 50 % в связи с нгибированием печеночного метаболизма изофермента CYP3A4 и Р-гликопротсина. Может понадобиться коррекция дозы саквинавира. Сиролимус. Повышение концентрации сиролимуса в плазме крови предположительно в связи с ингибированием метаболизма сиролимуса через угнетение изофермента CYP3A4 и Р-гликопротеина. Данная комбинация может применяться с соответствующей коррекцией дозы сиролимуса в зависимости от эффекта/концентрации. Пероральные гипогликемические средства. Флуконазол увеличивает период полувыведения из плазмы пероральных гипогликемических средств - производных сульфонилмочевины (хлорпропамид, глибенкламид, глипизид, толбутамид). Совместное применение флуконазола и пероральных гипогликемических средств допускается, однако врач должен иметь в виду возможность развития гипогликемии. Необходим регулярный контроль глюкозы крови и, при необходимости, коррекция дозы препаратов сульфонилмочевины. Такролимус. Применение Флуконазола и такролимуса (внутрь) приводит к повышению сывороточных концентраций последнего в 5 раз за счет ингибирования метаболизма такролимуса, происходящего в кишечнике посредством изофермента CYP3A4. Значительных изменений фармакокинетики препаратов не отмечено при применении такролимуса внутривенно. Описаны случаи исфро- токсичиости. Больных, одновременно принимающих такролимус внутрь и флуконазол, следует тщательно наблюдать. Дозу такролимуса следует корректировать в зависимости от степени повышения его концентрации в крови. Теофиллин. При применении флуконазола в дозе 200 мг в течение 14 дней одновременно (или в комбинации) с теофиллином средняя скорость плазменного клиерснса теофиллина снижается на 18 %. При назначении флуконазола больным, принимающим тсофиллин в высоких дозах, или больным с повышенным риском развития токсического действия теофиллина, следует наблюдать за появлением симптомов передозировки теофиллина и, при необходимости, скорректировать терапию соответсвтующим образом. Алкалоид барвинка. Несмотря па отсутствие целенаправленных исследований, предполагается, что флуконазол может увеличивать концентрацию алкалоидов барвинка (например, винкристина и винбластина) в плазме крови и, таким образом, приводить к исйротоксичности, что, возможно, может быть связано с угнетением изофермента CYP3A4. Витамин А. Имеется сообщение об одном случае развития нежелательных реакций со стороны центральной нервной системы (ЦНС) в виде псевдоопухоли мозга при одновременном применении полностью трансретиноевой кислоты п флуконазола, которые исчезли после отмены флуконазола. Применение данной комбинации возможно, но следует помнить о возможности возникновения нежелательных реакций со стороны ЦНС. Зидовудин. У больных, получающих комбинацию флуконазола и зидовудина, наблюдается повышение Сmах и AUC зидовудина на 84 % и 74 % соответственно, которое вызвано снижением метаболизма последнего до его главного метаболита. До и после терапии с применением флуконазола в дозе 200 мг/сут в течение 15 дней больным СПИДом и ARC (комплекс, связанный со СПИДом) установлено значительное увеличение AUC зидовудина (20 %). Больных, получающих такую комбинацию, следует наблюдать с целью выявления побочных эффектов зидовудина. Вориконазол (ингибитор изофермента CYP2C9, CYP2C19 и CYP3A4). Одновременное применение вориконазола (по 400 мг 2 раза в сутки в первый день, затем по 200 мг два раза в сутки в течение 2,5 дней) и флуконазола (400 мг в первый день, затем по 200 мг в сутки в течение 4 дней), приводит к увеличению концентрации и AUC вориконазола на 57% и 79 % соответственно. Было показано, что данный эффект сохраняется при уменьшении дозы и/или кратности приема любого из препарато . Одновременное применение вориконазола и флуконазола не рекомендуется. Тофацитиниб: экспозиция тофацитиниба увеличивается при его совместном применении с препаратами, которые являются одновременно умеренными ингибиторами изо- ферменга CYP3A4 и мощными ингибиторами изофермента CYP2C19 (например, флуконазол). Возможно, может понадобиться коррекция дозы тофацитиниба. Исследования взаимодействия пероральных форм флуконазола при его одновременном приеме с пищей, циметидином, антацидами, а также после тотального облучения тела для подготовки к пересадке костного мозга показали, что эти факторы не оказывают клинически значимого влияния на всасывание флуконазола. Перечисленные взаимодействия установлены при многократном применении флукопазола: взаимодействия с лекарственными средствами в результате однократного приема флуконазола не известны. Врачам следует учитывать, что взаимодействие с другими лекарственными средствами специально не изучалось, но оно возможно. Фармакологическое действие и фармакокинетика Флуконазол, представитель класса триазольных противогрибковых средств, является селективным ингибитором синтеза стеролов в клетке грибов. Препарат эффективен при оппортунистических микозах, в т.ч. вызванных Candida spp, Cryptococcus neoformans, Microsporum spp, Trichophyton spp. Показана также активность флуконазола на моделях эндемичных микозов, включая инфекции, вызванные Blastomyces dermatitidis, Coccidiodes immitis и Histoplasma capsulatum. Фармакокинетика: После приема внутрь флуконазол хорошо всасывается, его биодоступность - 90%. Максимальная концентрация после приема внутрь, натощак 150 мг составляет 90% от содержания в. плазме при внутривенном введении в дозе 2,5 - 3,5 мг/л. Одновременный прием пищи не влияет на абсорбцию препарата, принятого внутрь. Концентрация в плазме достигает пика через 0.5-1.5 ч после приема, период полувыведения флуконазола составляет около 30 ч. Концентрации в плазме находятся в прямо пропорциональной зависимости от дозы. 90 % уровень равновесной концентрации достигается к 4-5 дню лечения препаратом (при приеме 1 раз/сут). Введение ударной дозы (в первый день), в 2 раза превышающей обычную суточную дозу, позволяет достичь уровень, соответствующий 90% равновесной концентрации, ко второму дню. Очевидный объем распределения приближается к общему содержанию воды в организме. Связывание с белками плазмы -11-12%. Флуконазол хорошо проникает во все биологические жидкости организма. Концентрации препарата в слюне и мокроте аналогичны его уровням в плазме. У больных грибковым менингитом содержание флуконазола в спинномозговой жидкости достигает 80% от уровня его в плазме.В роговом слое, эпидермисе, дерме и потовой жидкости достигаются высокие концентрации, которые превышают сывороточные. Флуконазол выводится в основном почками: примерно 80% введенной дозы выводится в неизмененном виде. Клиренс флуконазола пропорционален клиренсу креатинина. Метаболитов флуконазола в периферической крови не обнаружено. Особые указания В редких случаях применение флуконазола сопровождалось токсическими изменениями печени, в т.ч. с летальным исходом, главным образом у больных с серьезными сопутствующими заболеваниями. В случае гепатотоксических эффектов, связанных с флуконазолом, не отмечено явной зависимости их от общей суточной дозы, длительности терапии, пола, и возраста больного. Гепатотоксическое действие флуконазола обычно было обратимым: признаки его исчезали после прекращения терапии. При появлении клинических признаков поражения печени, которые могут быть связаны с флуконазолом, препарат следует отменить. Больные СПИД более склонны к развитию тяжелых кожных реакций при применении многих препаратов. В тех случаях, когда у больных с поверхностной грибковой инфекцией развивается сыпь и она расценивается как определенно связанная с флуконазолом, препарат следует отменить. При появлении сыпи у больных с инвазивными/системными грибковыми инфекциями, их следует тщательно наблюдать и отменить флуконазол при появлении буллезных изменений или многоформной эритемы. Необходимо соблюдать осторожность при одновременном приеме флуконазола с цизапридом, рифабутином или другими препаратами, метаболизирующимися системой цитохрома Р 450. Лечение необходимо продолжать до появления клиникогематологической ремиссии, так как преждевременное его превращение приводит к рецидивам. Влияние на способность управлять транспортными средствами: В связи с возможностью возникновения головокружения и других побочных эффектов. связанных с приемом препарата, в период лечения пациентам рекомендуется воздержаться от управления автотранспортом и занятиями другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания, быстроты психомоторных и двигательных реакций. Условия хранения и отпуска из аптек Условия хранения:При температуре от 15 °С до 25 °С.В недоступном для детей месте. Отпуск из аптек: Без рецепта Регистрационные данные Торговое название Флюкостат® Международное непатентованное название:Флуконазол. Форма выпуска:капсулы. Состав:активное вещество: флуконазол 50 мг или 150 мг:вспомогательные вещества: лактоза (сахар молочный) 49.40 мг или 147,40 мг, крахмал кукурузный 16,40 мг или 49.00 мг, кремния диоксид коллоидный (аэросил) 0,12 мг или 0.36 мг, магния стеарат 0.96 мг или 2,88 мг, натрия лаурилсульфат 0.12 мг или 0,36 мг: капсулы твердые желатиновые:(для дозировки 50 мг) корпус, титана диоксид (Е 171) - 3,0000 %. железа оксид красный (Е 172) - 0.0857%, желатин - до 100%: крышечка: титана диоксид (Е 171) - 2.0000%, железа оксид красный (Е 172) - 0.7286 %. желатин - до 100 %:(для дозировки 150 мг) корпус и крышечка: титана диоксид (Е 171)- 2.0000 %, желатин - до 100 %. АТХ: Регистрация: Лекарственное средство Р N001361/01 Фармгруппа: Противогрибковое средство. Дата регистрации: 31.03.2008. Окончание регстрации: . Описание:дозировка 50 мг: непрозрачные капсулы № 2, корпус светло-розового цвета, крышечка розовато-коричневого цвета: дозировка 150 мг: непрозрачные капсулы № 0, корпус и крышечка белого цвета Упаковка:Капсулы 50 мг и 150 мг. 7 капсул по 50 мг или 1, 2, 3, 6 капсул по 150 мг в контурной ячейковой упаковке. 1 контурная ячейковая упаковка по 7 капсул (для дозировки 50 мг) или 1 контурная ячейковая упаковка по 1, 2, 3 капсулы или 4 контурные ячейковые упаковки по 6 капсул (для дозировки 150 мг) вместе с инструкцией по применению в пачке из картона. Срок годности:3 года. Не использовать позже срока, указанного на упаковке. Владелец рег.удостоверения:ФАРМСТАНДАРТ-ЛЕКСРЕДСТВА, ОАО Производитель:ФАРМСТАНДАРТ-ЛЕКСРЕДСТВА, ОАО. Представительство
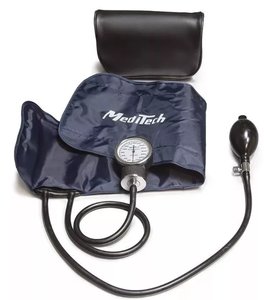
Модель:
RUR 794
Предназначен для профессионалов. Позволяет выбрать любой привычный стетоскоп для измерения артериаль-ного давления. Комплектуется мягким виниловым чехлом для удобства хранения Дополнительно к этой модели могут приобретаться манжеты разных размеров Характеристики Диапазон измерения давления 20-300 мм рт.ст. Погрешность измерения давления, мм рт.ст. в диапазоне 60-240 мм рт.ст. ±3 более 240 мм рт.ст. ±4 Цена деления шкалы 2 мм рт.ст. Комплектация сфигмоманометр, манжета с нагнетателем, инструкция на русском языке, чехол
Модель:
RUR 561
Показания Артериальная гипертензия (пациентам, которым показана комбинированная терапия). Противопоказания Противопоказания - Повышенная чувствительность к каптоприлу, любому другому компоненту препарата или другим ингибиторам АПФ, тиазидным диуретикам и другим производным сульфаниламида (возможны перекрестные аллергические реакции): - ангионевротический отек наследственный или идиопатический, в том числе в анамнезе на фоне приема ингибиторов АПФ: - аортальный стеноз: - митральный стеноз: - гипертрофическая обструктивная кардио-миопатия: - двусторонний стеноз почечных артерий, стеноз почечной артерии единственной почки: - трансплантация почки (в анамнезе): - хроническая сердечная недостаточность: - кардиогенный шок: - артериальная гипотензия: - тяжелая печеночная недостаточность (прекома или кома): - тяжелая почечная недостаточность (креатинин сыворотки крови более 1,8 мг/100 мл или клиренс креатинина менее 20-30 мл/мин, анурия): - первичный гиперальдостеронизм: - одновременное применение с алискиреном и алискиренсодержащими препаратами у пациентов с сахарным диабетом или нарушением функции почек (СКФ менее 60 мл/мин): - беременность: - период грудного вскармливания: - возраст до 18 лет (эффективность и безопасность не установлена): - непереносимость лактозы, дефицит лактазы и синдром глюкозо-галактозной мальабсорбции. С осторожностью: - Нарушения функции печени, прогрессирующие заболевания печени: - умеренная почечная недостаточность (клиренс креатинина 30-60 мл/мин): - протеинурия (более 1 г/сут): - гипокалиемия (не корригирующаяся лекарственными средствами): - гипонатриемия: - гиповолемия: - гиперкальциемия: - подагра, гиперурикемия: - системные заболевания соединительной ткани и другие аутоиммунные заболевания (в т.ч. системная красная волчанка, склеродермия, узелковый периартериит): - пожилой возраст (старше 65 лет): одновременное назначение лекарственных средств, подавляющих защитные реакции организма (глюкокортикостероиды, цитостатики, иммунодепрессанты), аллопури-нол, прокаинамид: - хирургическое вмешательство/общая анестезия, применение у пациентов негроидной расы, гемодиализ с использованием высокопрочных мембран (например, AN69®), десенсибилизирующая терапия, одновременное применение калийсберегающих диуретиков, препаратов калия, калийсодержащих заменителей и лития, острая миопия и вторичная закрытоугольная глаукома. Беременность Применение препарата Капозид® противопоказано во время беременности. Эпидемиологические данные, свидетельствующие о риске тератогенности после воздействия ингибиторов АПФ в I триместре беременности, не были убедительными, однако некоторое увеличение риска не может быть исключено. Если применение ингибитора АПФ считается необходимым, пациентки, планирующие беременность, должны быть переведены па альтернативную гипотензивную терапию, имеющую установленный профиль безопасности для применения во время беременности. Известно, что длительное воздействие ингибиторов АПФ на плод во II и III триместрах беременности может приводить к нарушению его развития (снижению функции почек, олигогидрамниону, замедлению оссификации костей черепа) и развитию осложнений у новорожденного (таких как, почечная недостаточность, артериальная гипотензия, гииеркалиемия). Если пациентка получала препарата Капозид® во время II и III триместра беременности, рекомендуется провести ультразвуковое исследование для оценки состояния костей черепа и функции почек плода. Применение гпдрохлоротиазида при беременности не рекомендуется, поскольку может ухудшить перфузию плаценты и вызван" желтуху плода/новорожденного, тромбоцитопению, нарушение водно- электролитного баланса и возможно, другие нежелательные реакции, наблюдавшиеся у взрослых. Применение ингибиторов АПФ во время беременности может вызывать нарушения развития (включая артериальную гипотензию, неонатальную гипоплазию костей черепа, анурию, обратимую или необратимую почечную недостаточность) и смерть плода. При установлении факта беременности применение препарата Капозид® следует прекратить как можно быстрее. Каптоприл и гидрохлоротиазид после приема внутрь кормящей женщиной обнаруживаются в грудном молоке. В связи с риском развития серьезных побочных реакций у ребенка, вызываемых обоими действующими веществами, следует прекратить грудное вскармливание или отменить терапию препаратом Капозид® у матери на период грудного вскармливания. Применение и дозы Внутрь, за 1 час до еды, по 1 таблетке 1 раз в сутки. Побочные эффекты и передозировка Побочные эффекты: Классификация ВОЗ нежелательных реакций по частоте возникновения: очень частые - более 1/10 (более 10 %), частые - более 1/100, но менее 1/10 (более 1 %, но менее 10 %), нечастые - более 1/1000, но менее 1/100 (более 0,1 %, но менее 1 %), редкие - более 1/10000, но менее 1/1000 (более 0,01 %, но менее 0,1 %), очень редкие- менее 1/10000 (менее 0,01 %), неизвестно - определить частоту встречаемости нежелательной реакции по имеющимся данным невозможно. Со стороны сердечно-сосудистой системы: нечастые - тахикардия или аритмия, боль в груди, стенокардия, ощущение сердцебиения, инфаркт миокарда, ортостатическая гипотензия, синкопэ, периферические отеки, выраженное снижение артериального давления, синдром Рейно, "приливы" крови к коже лица, бледность:очень редкие - остановка сердца, кардиогенный шок. Со стороны дыхательной системы: частые - сухой непродуктивный кашель, одышка:очень редкие - бронхоспазм, эозинофильный пневмонит, ринит, отек легких. Аллергические реакции: частые - кожный зуд, с высыпаниями или без них, иногда сопровождающийся лихорадкой и артралгией, высыпания на коже, алопеция:нечастые - сосудистый отек кожи и подкожной клетчатки:редкие - ангионевротический отек кишечника:очень редкие - крапивница, синдром Стивенса-Джонсона, мультиформная эритема, фоточувствительность, эритродермия, обратимые пемфигоидные реакции, буллезный пемфигус, эксфолиативный дерматит, аллергический альвеолит, эозинофильная пневмония, ангионевротический отек конечностей, лица, губ, слизистых оболочек, языка, глотки и гортани (в том числе с летальным исходом), пурпура. Со стороны центральной нервной системы: частые - сонливость, головокружение, бессонница:нечастые - головная боль, парестезия: редкие - атаксия:очень редкие - спутанность сознания, депрессия, нарушения мозгового кровообращения, включая инсульт и синкопе, нечеткость зрения. Со стороны органов кроветворения: очень редкие - нейтропения, агранулоцитоз, панцитопения, лимфаденопатия, эозинофилия, тромбоцитопения, анемия (включая апластическую и гемолитическую формы), повышение титра антинуклеарных антител, аутоиммунные заболевания. Со стороны пищеварительной системы: частые - тошнота, рвота, раздражение слизистой оболочки желудка, боли в брюшной полости, диарея, запор, нарушение вкуса, сухость слизистой оболочки полости рта, диспепсия: нечастые - анорексия: редкие - стоматит, афтозный стоматит:очень редкие - глоссит, язва желудка, панкреатит, гиперплазия десен, нарушение функции печени и холестаз (включая желтуху), повышение активности ферментов печени, гепатит (включая некроз), гиперби-лирубинемия. Со стороны опорно-двигательного аппарата:очень редкие - миалгия, артралгия, миастения. Со стороны мочевыделительной системы: нечастые - нарушения функции почек (включая почечную недостаточность), полиурия, олигурия, учащенное мочеиспускание:очень редкие - нефротический синдром: неизвестно - глюкозурия. Со стороны органов репродукции: очень редкие - импотенция, гинекомастия. Другие:нечастые - повышенная утомляемость, ощущение общего недомогания, астения: редкие - гипертермия. Лабораторные показатели: очень редкие - эозинофилия, протеинурия, гиперкалиемия, гипонатриемия (в том числе симптоматическая), повышенное содержание азота мочевины, билирубина и креатинина в крови, снижение гематокрита, снижение гемоглобина, лейкоцитов, тромбоцитов:неизвестно - гипокалиемия, гипохлоремиче-ский алкалоз, гиперурикемия, гипергликемия. Передозировка: Симптомы: резкое снижение артериального давления, шок, ступор, брадикардия, нарушения водно-электролитного баланса, почечная недостаточность, летаргия (которая может прогрессировать в кому в течение нескольких часов), не сопровождающаяся нарушением водно-электролитного баланса и вызывающая лишь незначительное подавление функций дыхания и сердца. Могут отмечаться раздражение слизистой и повышение сократительной активности желудочно-кишечного тракта. Лечение: применение мер для вывода из комы или состояния ступора, промывание желудка, введение адсорбентов и натрия сульфата в течение 30 минут после приема, введение 0,9 % раствора натрия хлорида или других плазмозамещающих растворов, гемодиализ. При брадикардии или выраженных вагусных реакциях - введение атропина. Может быть рассмотрено применение искусственного водителя ритма. Перитонеальный диализ неэффективен для выведения каптоприла из организма. Взаимодействие с другими ЛС: Каптоприл У пациентов, принимающих диуретические средства, особенно в начале терапии, а также в сочетании со ограничением приема пищевой соли (бессолевые диеты) или гемодиализом. может иногда наблюдаться избыточное снижение артериального давления, которое обычно происходит в течение 1-ого часа после приема первой назначенной дозы препарата Капозид®. Следует обеспечить контроль за состоянием пациента в течение I часа после приема первой дозы препарата. Если отмечается избыточное снижение артериального давления, следует уложить пациента, ноги приподнять и при необходимости назначить внутривенную инъекцию 0,9 % раствора хлорида натрия. Преходящее чрезмерное снижение артериального давления не является противопоказанием к дальнейшей терапии, которую можно продолжать после нормализации артериального давления при помощи увеличения объема циркулирующей крови. Вазодилататоры (например, нитроглицерин) в сочетании с препаратом Капозид® следует применять в самых низких эффективных дозах ввиду риска избыточного снижения артериального давления. Следует соблюдать осторожность при совместном назначении препарата Капозид® и лекарственных препаратов, оказывающих влияние на симпатическую нервную систему (например, ганглиоблокаторы, альфа- адреноблокаторы). При терапии препаратами, содержащими каптоирил, калийсберегающне диуретики (например, триамтерен, спнронолактон, амилорид, эплеренон), препараты калия, калиевые добавки, заменители пищевой соли (содержат значительные количества ионов калия) следует назначать только при доказанной гипокапиемни, так как их применение увеличивает риск развития гиперкалиемии. Препарат Капозид® повышает концентрацию дигоксина в плазме крови на 15-20 %, увеличивает биодоступность пропранолола. Риск развития иммунодепрессивного действия повышается при комбинированном применении с прокаинамидом, а также препаратами, блокирующими канальцевую секрецию (снижение количества лейкоцитов и гранулоцитов). Повышает нейротоксичность салицилатов, действие недеполяризующихся мпорелаксантов конкурентного типа действия, этанола. Уменьшает выведение хинидина, действие гипогликемических лекарственных средств для приема внутрь, норэпинефрина, эпинефрина и противоподагрических препаратов. Усиливает побочные эффекты сердечных гликозидов, особенно при одновременном назначении с препаратами, которые увеличивают выведение ионов калия и магния и/или задерживают ионы кальция (например, диуретики, гормоны коры надпочечников, слабительные, амфотерицин В, карбеноксолон, пенициллин G, салицилаты). Ингибиторы ЛПФ, включая каптоприл, могут потенцировать гипогликемический эффект инсулина и гипогликемических средств для приема внутрь, таких как производные сульфонилмочевины. Необходимо контролировать концентрацию глюкозы в крови в начале терапии препаратом Капозид®, и в случае необходимости корректировать дозу гипогликемического лекарственного препарата. Двойная блокада ренин-аигиотензин-альдостероновой системы (РЛЛС), вызванная одновременным приемом ингибиторов ЛПФ и антагонистов рецепторов к ангиотензину II пли алискирена и алискиренсодержащих препаратов, ассоциировалась с повышенной частотой развития побочных эффектов, таких как артериальная гипотензия, гиперкалиемия, снижение функции почек (включая острую почечную недостаточность). Гидрохлоротиазид Циметидин, замедляя метаболизм каптоприла в печени, повышает его концентрацию в плазме крови. Индометацин н другие нестероидные противовоспалительные препараты, включая ингибиторы циклооксигеназы-2, а также поваренная соль могут снижать антигипертензивное действие препарата, особенно при артериальной гипертензии, сопровождающейся низкой активностью ренина, а также снижать всасываемость гидрохлоротиазида. У пациентов с факторами риска (пожилой возраст, гпповолемия, одновременное применение диуретиков, нарушение функции ночек), одновременное применение нестероидных противовоспалительных препаратов (включая ингибиторы циклооксигеназы-2) и ингибиторов АПФ (включая каптоприл), может приводить к ухудшению функции почек, вплоть до острой почечной недостаточности. Обычно нарушения функции ночек в таких случаях бывают обратимыми. Следует периодически контролировать функцию почек у пациентов, принимающих препарат Капозид® и нестероидные противовоспалительные препараты. Может способствовать нарушению электролитного баланса, в частности развитию гипокалиемии при одновременном приеме с амфотернцином В, глюкокортикостероидамн, адренокортикотронным гормоном (АКТГ). Необходимо контролировать содержание калия в плазме крови. Гидрохлоротиазид может усиливать действие неденоляризующих миорелаксантов, средств для общей анестезии, применяемых в хирургии (например, тубокурарина хлорида и галламина триэтиодида, поэтому может потребоваться коррекция доз этих препаратов. Рекомендуются мониторинг и при возможности коррекция водно- электролитного баланса перед хирургическим вмешательством. Гидрохлоротиазид снижает эффект применяющихся в терапевтических целях прессорных аминов (например, норэпинефрина) в отношении артерий, однако, полностью не предотвращает его. Следует применять как можно более низкие дозы преанестетиков и анестетиков. Если возможно, гидрохлоротиазид следует отменить за неделю до хирургического вмешательства. Комбинация с нитратами, тиазидными диуретиками, верапамилом, бета адреноблокаторами и другими гипотензивными препаратами, ингибиторами моноаминооксидазы (МАО), ганглиоблокаторами, а также трициклическими антидепрессантами, снотворными и этанолом усиливает выраженность гипотензивного эффекта. При одновременном назначении ингибиторов АПФ с препаратами лития может иметь место замедление выведения ионов лития, повышение содержания лития в сыворотке крови и, как следствие, усиление повреждающего действия на сердце и центральную нервную систему (ЦНС). Кроме того, гидрохлоротиазид также увеличивает риск токсичности лития. При применении подобной комбинированной терапии следует проводить регулярный мониторинг содержания лития в сыворотке крови. Лекарственные средства, интенсивно связывающиеся с белками, усиливают диуретический эффект. Может потребоваться коррекция дозы антикоагулянтов для приема внутрь, пробенецида и сульфинпиразона, поскольку гидрохлоротиазид может подавлять их действие. Гидрохлоротиазид проявляет гиперурикемическое действие, поэтому может потребоваться коррекция доз антиурикозурических препаратов при одновременном применении. Диазоксид усиливает гипергликемическое, гиперурикурическое и антигипертензивное действие тиазидных диуретиков, поэтому следует контролировать концентрацию мочевой кислоты и глюкозы в сыворотке крови. При одновременном приеме гипогликемических средств для приема внутрь и инсулина может потребоваться повышение их доз, так как гидрохлоротиазид повышает концентрацию глюкозы в крови. При одновременном приеме метилдопы возможно развитие гемолиза эритроцитов. Колестирамин и колестипол могут задерживать или снижать всасываемость гидрохлоротиазида. Соли калия, калийсберегающне диуретики (триамтерен, амилорид и спиронолактон) и гепарин способствуют развитию гиперкалиемии. Действие метенамина может снижаться при совместном применении с гидрохлоротиазидом из-за повышения щелочной реакции мочи. Карбамазепин повышает риск развития симптоматической гипонатриемии при одновременном применении с гидрохлоротиазидом. При сочетанном применении солей кальции и тиазидных диуретиков, витамина Д и тиазидных диуретиков содержание кальция в сыворотке крови может повышаться в связи с замедлением его выведения. Необходим контроль содержания кальция в сыворотке крови и при необходимости коррекция его дозы. Фармакологическое действие и фармакокинетика Капозид® - комбинированный препарат, оказывающий гипотензивное и диуретическое действие. Каптоприл - ингибитор аигиотензинпрев- ращающего фермента (АПФ), уменьшает образование ангиотензина II из ангиотензина I, уменьшает выделение альдостерона, снижает общее периферическое сосудистое сопротивление (ОПСС), артериальное давление (АД), ноет- и преднагрузку. Расширяет артерии в большей степени, чем вены. Усиливает коронарный и почечный кровоток. При длительном применении уменьшается гипертрофия миокарда н стенок артерий резистентного типа. Каптоприл улучшает кровоснабжение ишемизированного миокарда: снижает агрегацию тромбоцитов. Гидрохлоротиазид - тиазидный диуретик средней силы, снижает реабсорбцию ионов натрия на уровне кортикального сегмента петли Гснле. Не влияет на кислотно- основное состояние (КОС). Понижает АД за счет изменения реактивности сосудистой стенкп, снижения прессорного влияния эндогенных сосудосуживающих веществ (адреналина, норадренапина) и усиления депрессорного влияния на вегетативные ганглии (в меньшей степени, за счет уменьшения объема циркулирующей крови (ОЦК)). Усиливает гипотензивный эффект каптоприла. Диуретический эффект отмечается спустя 2 часа и достигает максимума через 4 часа после приема внутрь. Действие продолжае тся в течение 6-12 часов. Эффективность и безопасность применения каптоприла у детей не установлены. В литературе описан ограниченный опыт применения каптоприла у детей. Дети, особенно новорожденные, могут быть более подвержены развитию гемодинамических побочных эффектов. Отмечались случаи развития чрезмерного, длительного и непредсказуемого повышения артериального давления, а также связанных с ним осложнений, включая олигурию и судороги. Фармакокинетика: Каптоприл При приеме внутрь быстро всасывается в желудочно-кишечном тракте, максимальная концентрация в плазме крови наблюдается спустя приблизительно 1 час после приема внутрь. Биодоступность каптоприла составляет 60-70%. Одновременный прием пищи замедляет всасывание каптоприла на 30-40 %. Связь с белками плазмы крови составляет 25-30 %. Период полувыведения 2-3 часа. Препарат выводится из организма преимущественно почками, до 50 % в неизмененном виде, остальная часть - в виде метаболитов. Гидрохлоротиазнд При приеме внутрь относительно быстро всасывается. Период полувыведения в плазме крови составляет от 5 до 15 часов при приеме натощак здоровыми добровольцами. Выведение почками, 95 % дозы - в неизмененном виде. Особые указания В начале лечения может наблюдаться чрезмерное снижение артериального давления, особенно у пациентов с хронической сердечной недостаточностью, тяжелой формой артериальной гипертензии (в т.ч. почечного генеза) и/или почечной недостаточностью. Перед началом лечения необходимо скомпенсировать дефицит ионов натрия и привести в норму объем циркулирующей крови (уменьшить дозу назначенных ранее диуретиков или, в отдельных случаях полностью их отменить), а также определить показатели функции почек. Необходим регулярный контроль содержания в плазме крови ионов калия и кальция (особенно у пациентов, получающих лечение сердечными гликозидами, глюкокортикостероидами, часто пользующихся слабительными, а также у пожилых пациентов), глюкозы, мочевой кислоты, липидов (холестерина и триглицеридов), мочевины и креатинина, активности "печеночных" ферментов. Особенно регулярный контроль за уровнем артериального давления и лабораторными показателями необходим в следующих случаях: у пациентов с почечной недостаточностью: пациентов с артериальной гипертензией тяжелого течения (в т.ч. почечного генеза): у пожилых пациентов (старше 65 лет): у пациентов с нарушениями водно- электролитного баланса и декомпенсированной хронической почечной недостаточностью: а также получающих одновременно аллопуринол, препараты лития, прокаинамид и лекарственные средства, снижающие иммунитет. При приеме ингибиторов ЛПФ отмечается характерный непродуктивный кашель, прекращающийся после отмены терапии ингиторами ЛПФ. У некоторых пациентов с заболеваниями почек, особенно с тяжелым стенозом почечной артерии, наблюдается увеличение концентраций азота мочевины и креатинина в сыворотке крови после снижения артериального давления. Это явление обычно обратимо, и наблюдается снижение концентрации азота мочевины и креатинина в сыворотке крови в случае отмены препарата. Может потребоваться снижение дозы препарата Капозид® и/или отмена диуретика. В некоторых случаях на фоне применения ингибиторов ЛПФ наблюдается повышение содержания калия в сыворотке крови. Риск развития гиперкалиемии при применении ингибиторов ЛПФ повышен у пациентов с почечной недостаточностью и сахарным диабетом, а также принимающих калийсберегающие диуретики, препараты калия или др. препараты, вызывающие увеличение содержания калия в крови (например, гепарин). Следует избегать одновременного применения калийсберегающнх диуретиков и препаратов калия. Кроме того, при применении ингибиторов АПФ одновременно с тиазидными диуретиками не исключен риск развития гипокалиемии, поэтому в таких случаях следует проводить регулярный мониторинг содержания калия в крови во время терапии. Следует соблюдать осторожность при приеме ингибиторов АПФ пациентами с митральным/аортальным стенозом/гипертрофической обструктивной кардиомиопатией: в случае кардиогенного шока и гемодинамически значимой обструкции - прием не рекомендован. Не рекомендуется применение двойной блокады ренин-ангиотензин-альдостероновой системы (РААС), вызванной одновременным приемом ингибиторов АПФ и антагонистов рецепторов к ангиотензину II пли алискирена и алискиренсодержащих препаратов, поскольку она ассоциировались с повышенной частотой развития побочных эффектов, таких как артериальная гипотензия. гпперкалиемия, снижение функции почек (включая острую почечную недостаточность). Если одновременное применение ингибиторов АПФ и АРАII (двойная блокада РААС) необходимо, то лечение должно проводиться под контролем врача и при осуществлении постоянного контроля функции почек, уровня электролитов в крови, а также артериального давления. Не рекомендуется совместное применение ингибиторов АПФ и антагонистов рецепторов к ангиотензину II у пациентов с диабетической нефропатией. При проведении гемодиализа у пациентов, получающих ингибиторы АПФ, следует избегать использования диализных мембран с высокой проницаемостью (например, AN69), поскольку в таких случаях повышается риск развития анафилактоидных реакций. Анафилактоидные реакции отмечались также у пациентов, которым проводилась процедура удаления липопротеинов низкой плотности (аферез) путем абсорбции с помощью декстран сульфата. Следует рассмотреть вопрос о применении либо гипотензивных препаратов другого класса, либо другого типа диализных мембран. В случае развития ангионевротического отека препарат отменяют и осуществляют тщательное медицинское наблюдение до полного исчезновения симптомов. Ангионевротический отек гортани может привести к летальному исходу. Если отек локализуется на лице, специального лечения обычно не требуется (для уменьшения выраженности симптомов могут быть применены антигистаминные препараты): в том случае, если отек распространится на язык, глотку или гортань и имеется угроза развития обструкции дыхательных путей, следует немедленно ввести эпинефрин (адреналин) подкожно (0,3-0,5 мл в разведении 1:1000). В редких случаях у пациентов после приема ингибиторов ЛПФ отмечался ангионевротический отек кишечника, который сопровождался болями в брюшной полости (с тошнотой и рвотой или без них), иногда - при нормальных значениях активности С-1-эстеразы и без предшествующего отека лица. Отек кишечника следует включить в спектр дифференциальной диагностики пациентов с жалобами на боли в брюшной полости при приеме ингибиторов АПФ. У представителей негроидной расы случаи развития ангионевротического отека отмечались с большей частотой по сравнению с представителями европеоидной расы. У двух пациентов, проходящих процедуру десенсибилизации ядом перепончатокрылых, на фоне приема каптоприла отмечены жизнеугрожающие анафилактоидные реакции. При временной отмене ингибитора ЛПФ у тех же пациентов удалось избежать анафилактоидных реакций. Следует соблюдать осторожность при проведении десенсибилизации у пациентов, принимающих ингибиторы АПФ. У пациентов с сахарным диабетом, получающих гипогликемические препараты (гипогликемические средства для приема внутрь или инсулин), следует тщательно контролировать уровень гликемии, особенно в течение первого месяца терапии ингибиторами АПФ. Ингибиторы АПФ менее эффективны у представителей негроидной, чем у пациентов европеоидной расы, что может быть связано с большей распространенностью низкой активности ренина у представителей негроидной расы. При проведении обширных хирургических вмешательств или при применении средств для общей анестезии, которые обладают гипотензивным эффектом, у пациентов, принимающих ингибиторы АПФ, может отмечаться избыточное снижение артериального давления. В этих случаях можно увеличить объем циркулирующей крови. В редких случаях при приеме ингибиторов АПФ отмечается синдром, начинающийся появлением холестатической желтухи, переходящей в молниеносный гепатонекроз, иногда с летальным исходом. Механизм развития данного синдрома неизвестен. Если у пациента, получающего терапию ингибиторами АПФ, развивается желтуха или отмечается выраженное повышение активности "печеночных" ферментов, следует прекратить лечение ингибиторами АПФ и установить наблюдение за пациентом. У пациентов, принимающих ингибиторы АПФ, отмечались нейтропения/агранулоцитоз, тромбоцитопения и анемия. У пациентов с нормальной функцией почек и в отсутствии других нарушений нейтропения встречается редко. Препарат Капозид® следует применять очень осторожно у пациентов с аутоиммунными заболеваниями соединительной ткани, у принимающих иммуносупрессоры, аллопуринол и прокаинамид, особенно при наличии имеющегося ранее нарушения функции почек. В связи с тем, что большинство летальных случаев нейтропения на фоне ингибиторов АПФ развивалось у таких пациентов, следует контролировать у них число лейкоцитов крови перед началом лечения, в первые 3 мес. - каждые 2 нед, затем - каждые 2 месяца. У всех пациентов следует ежемесячно контролировать число лейкоцитов в крови в первые 3 месяца после начала терапии, затем - каждые 2 месяца. Если число лейкоцитов ниже 4000/мкл, показано повторное проведение общего анализа крови, ниже 1000/мкл- прием препарата прекращают, продолжая наблюдение за пациентом. Обычно восстановление числа нейтрофилов происходит в течение 2-х недель после отмены каптоприла. В 13% случаях нейтропении отмечали летальный исход. Практически во всех случаях летальный исход отмечали у пациентов с заболеваниями соединительной ткани, почечной или сердечной недостаточностью, на фоне приема иммуносупрессоров или при сочетании обоих указанных факторов. При применении ингибиторов ЛПФ может отмечаться протеинурия, в основном у пациентов с нарушением функции почек, а также при применении высоких доз препаратов. В большинстве случаев протеинурия при приеме препарата каптоприла исчезала или степень ее выраженности уменьшалась в течение 6 месяцев независимо от того, прекращался прием препарата или нет. Показатели функции почек (концентрации азота мочевины в крови и креатинина) у пациентов с протеинурией почти всегда были в пределах нормы. У пациентов с заболеваниями почек следует определять содержание белка в моче перед началом лечения и периодически па протяжении курса терапии. При приеме тиазидных диуретиков были отмечены редкие случаи развития агранулоцитоза и угнетения функции костного мозга. Производные сульфонамида (включая гидрохлоротиазид) могут вызывать преходящую миопию и острую закрытоугольную глаукому, факторами риска являются аллергия на препараты сульфонилмочевины или пенициллин в анамнезе. Симптомы (резкое снижение остроты зрения, боль в глазном яблоке) обычно наблюдаются через несколько часов - несколько недель после начала лечения. При появлении симптомов следует немедленно прекратить прием препарата: при необходимости следует назначить препараты для коррекции внутриглазного давления. У всех пациентов, принимающих тиазидные диуретики, следует выявлять клинические признаки нарушения водно-электролитного баланса (гипонатриемия, гипохлоремический алкалоз, гипокалиемия). Особенно важно определять содержание электролитов в сыворотке крови и моче при сильной рвоте или при введении инфузионных растворов. Признаками нарушений водно- электролитного баланса могут быть сухость слизистой оболочки полости рта, жажда, слабость, летаргия, спутанность сознания, беспокойство, боли или судороги в мышцах, мышечная слабость, избыточное снижение артериального давления, олигурия, тахикардия, тошнота, рвота. Гипокалиемия может спровоцировать или усилить кардиотоксическое действие сердечных глюкозидов. Недостаток хлорид-ионов обычно слабо выражен и не требует коррекции. У пациентов с отеками при жаркой погоде может наблюдаться гипонатриемия, вызванная увеличением объема циркулирующей крови. Следует ограничить потребление жидкости. В случаях жизнеугрожающей гипонатриемии назначают прием пищевой соли. Во время терапии тиазидными диуретиками могут отмечаться гиперурикемия или обострение течения подагры: может также проявиться латентно протекающий сахарный диабет. Тиазидные диуретики могут вызывать снижение концентрации связанного йода в сыворотке крови без признаков нарушения функции щитовидной железы. На фоне приема тиазидных препаратов снижается степень экскреции кальция: отмечались случаи патологических изменений паращитовидных желез, сопровождающихся гиперкальциемией и гипофосфатемией. Перед контролем функции паращитовидных желез следует прекратить прием тиазидного диуретика. На фоне приема тиазидных препаратов отмечалось повышение степени экскреции магния, что может приводить к гипомагниемии. Препарат Капозид® может вызывать ложно-положительную реакцию при анализе мочи на ацетон и искажать результаты теста с бентиромидом. При появлении лихорадки, увеличения лимфатических узлов и/или признаков ларингита и/или фарингита необходимо немедленно определить число лейкоцитов. Прием тиазидных диуретиков может быть причиной положительного результата при проведении допинг-контроля. Влияние на способность управлять транспортными средствами: В период лечения необходимо соблюдать осторожность при вождении автотранспорта и занятии другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психоэмоциональных реакций. Условия хранения и отпуска из аптек Условия хранения:При температуре не выше 25 °С. Хранить в недоступном для детей месте. Отпуск из аптек: По рецепту Регистрационные данные Торговое название Капозид® Международное непатентованное название:Гидрохлоротиазид + Каптоприл. Форма выпуска:таблетки. Состав:Одна таблетка содержит: активные вещества: каптоприл в пересчете на 100% вещество - 50 мг, гидрохлоротиазид в пересчете на 100 % вещество - 25 мг: вспомогательные вещества: целлюлоза микрокристаллическая - 118,5 мг, крахмал прежелатинизированный (кукурузный) 30 мг, стеариновая кислота - 6 мг, магния стеарат - 0,3 мг. лактозы моногидрат - 70,2 мг. АТХ: Регистрация: Лекарственное средство П N014122/01 Фармгруппа: Гипотензивное комбинированное средство (ангиотензинпревращающего фермента ингибитор+диуретик)Дата регистрации: 30.06.2008 / 05.07.2017. Окончание регстрации: . Описание:Таблетки белого или белого с кремоватым оттенком цвета с сульфидоподобным запахом, овальные, двояковыпуклые с насечкой на одной стороне и выдавленным словом "SQUIBB" и цифрами"50/25" на другой стороне, имеющей скошенный край. Допускается легкая "мраморность". Упаковка:Таблетки 50 мг + 25 мг. По 14 таблеток в контурную ячейковую упаковку из пленки поливинилхлоридной и фольги алюминиевой.2 контурные ячейковые упаковки вместе с инструкцией по применению помещают в пачку из картона. Срок годности:3 года. Не применять препарат по истечении срока годности. Владелец рег.удостоверения:АКРИХИН ХФК, ОАО *Произ
Модель:
RUR 753
Показания Артериальная гипертензия (пациентам, которым показана комбинированная терапия амлодипином и рамиприлом в дозах, как в комбинации). Противопоказания Противопоказания Амлодипин Повышенная чувствительность к амлодипину и другим производным дигидропиридина: Тяжелая артериальная гипотензия (САД менее 90 мм рт. ст.), шок (включая кардиогенный): Обструктивный процесс, затрудняющий выброс крови из левого желудочка (например, клинически значимый стеноз аорты) Гемодинамически нестабильная сердечная недостаточность после инфаркта миокарда: Беременность: Период грудного вскармливания: Возраст до 18 лет (безопасность и эффективность не определены). Рамиприл Повышенная чувствительность к рамиприлу, другим ингибиторам ангиотензинпревращающего фермента (АПФ): Ангионевротический отек в анамнезе (наследственный или идиопатический, а также связанный с предшествующей терапией ингибиторами АПФ): Гемодинамически значимый стеноз почечных артерий (двусторонний или односторонний, в случае единственной почки): Артериальная гипотензия (систолическое артериальное давление (САД) <:90 мм.рт.ст.) или состояния с нестабильными показателями гемодинамики: Гемодинамически значимый стеноз аортального или митрального клапана, или гипертрофическая обструктивная кардиомиопатия: Первичный гиперальдостеронизм: Тяжёлая почечная недостаточность (КК<:20 мл/мин/1.73 м 2 площади поверхности тела) Гемодиализ (опыт клинического применения недостаточен): Беременность: Период грудного вскармливания: Нефропатия, лечение которой проводится глюкокортикостероидами (ГКС), нестероидными противовоспалительными препаратами (НПВП), иммуномодуляторами и/или другими цитотоксическими средствами (опыт клинического применения недостаточен): Декомпенсированная хроническая сердечная недостаточность (опыт клинического применения недостаточен): Возраст до 18 лет (опыт клинического применения недостаточен): Гемодиализ или гемофильтрация с применением некоторых мембран с отрицательно заряженной поверхностью, таких как высокопроточные мембраны из полиакрилнитрила (опасность развития реакций повышенной чувствительности): Апоферез липопротеинов низкой плотности (ЛПНП) с применением декстрана сульфата (опасность развития реакций повышенной чувствительности): Десенсибилизирующая терапия при реакциях повышенной чувствительности к ядам насекомых - пчел, ос: Острая стадия инфаркта миокарда у пациентов с такими заболеваниями как: - тяжелая сердечная недостаточность (IV функциональный класс по NYHA): - опасные для жизни желудочковые нарушения ритма сердца: - "легочное" сердце. Одновременное применение препаратов, содержащих алискирен, у пациентов с нарушением функции почек (КК менее 60 мл/мин) и пациентов с сахарным диабетом. Амлодипин+рамиприл Повышенная чувствительность к вспомогательным веществам, входящим в состав препарата: Беременность: Период грудного вскармливания: Почечная недостаточность: КК<:20 мл/мин на 1,73 м площади поверхности тела: Возраст до 18 лет (опыт клинического применения недостаточен). С осторожностью: С осторожностью применять комбинацию амлодипин+рамиприл при следующих заболеваниях и состояниях: - атеросклеротические поражения коронарных и церебральных артерий (опасность чрезмерного снижения АД): - повышение активности ренин-ангиотензин-альдостероновой системы (РААС), при котором при ингибировании АПФ имеется риск резкого снижения АД с ухудшением функции почек: - выраженная, особенно злокачественная АГ, - ХСН, особенно тяжелая или по поводу которой принимаются другие лекарственные средства (ЛС) с антигипертензивным действием, - гемодинамически значимый односторонний стеноз почечной артерии (при наличии обеих почек), - предшествующий прием диуретиков, - нарушения водно-электролитного баланса, снижение объема циркулирующей крови (ОЦК) (в том числе на фоне приема диуретиков, бессолевой диеты, диареи, рвоты, обильного потоотделения): - одновременное применение с препаратами, содержащими алискирен (при двойной блокаде РААС повышается риск резкого снижения АД, гиперкалиемии и ухудшения функции почек): - нарушения функции печени - недостаточность опыта применения: возможно как усиление, так и ослабление эффектов рамиприла: при наличии у пациентов цирроза печени с асцитом и отеками возможна значительная активация РААС: - нарушение функции почек (КК более 20 мл/мин.): - состояние после трансплантации почек: - системные заболевания соединительной ткани, в том числе системная красная волчанка, склеродермия, сопутствующая терапия препаратами, способными вызвать изменения в картине периферической крови (в том числе аллопуринолом, прокаинамидом) - возможно угнетение костномозгового кроветворения, развитие нейтропении или агранулоцитоза: - сахарный диабет - риск развития гиперкалиемии: - пожилой возраст - риск усиления антигипертензивного действия: - гиперкалиемия: - гипонатриемия: - ХСН неишемической этиологии III-IV функционального класса по классификации NYHA: - аортальный стеноз: - синдром слабости синусового узла: - митральный стеноз: - артериальная гипотензия: - единственная функционирующая почка: - реноваскулярная гипертензия: - одновременное применение дантролена, эстрамустина, калийсберегающих диуретиков и препаратов калия, калийсодержащих заменителей пищевой соли, препаратов лития: - хирургическое вмешательство/общая анестезия: - проведение гемодиализа с применением высокопроточных мембран (например, AN69®). Беременность Беременность Препарат противопоказан для применения, так как рамиприл может оказать неблагоприятное воздействие на плод: нарушение развития почек плода, снижение АД плода и новорожденных, нарушение функции почек, гиперкалиемия, гипоплазия костей черепа, олигогидрамнион, контрактура конечностей, деформация костей черепа, гипоплазия легких. Перед началом приема препарата у женщин детородного возраста следует исключить беременность. Если женщина планирует беременность, то лечение препаратом должно быть прекращено. В случае наступления беременности во время лечения препаратом следует как можно скорее прекратить его прием и перевести пациентку на прием других препаратов, при применении которых риск для ребенка будет наименьшим. Период грудного вскармливания Если лечение препаратом необходимо в период грудного вскармливания, оно должно быть прекращено (данные по выведению амлодипина и рамиприла с грудным молоком женщин отсутствуют). Фертильность Амлодипин У некоторых пациентов, получавших блокаторы кальциевых каналов, наблюдались обратимые биохимические изменения в головках сперматозоидов. Клинические данные недостаточны для оценки потенциального эффекта амлодипина на фертильность. Применение и дозы Применять Эгипрес внутрь, по 1 капсуле 1 раз в сутки, в одно и то же время, вне зависимости от приёма пищи. Доза препарата Эгипрес подбирается после ранее проведенного титрования доз отдельных компонентов препарата: рамиприла и амлодипина у пациентов с АЕ. Препарат Эгипрес с фиксированными дозами активных компонентов не может применяться для начальной терапии. Если больным необходима коррекция доз, то её следует проводить только с помощью титрации доз активных компонентов в монотерапии. Только после этого возможно применение препарата Эгипрес с фиксированными дозами активных компонентов в нижеприведенных комбинациях. При терапевтической необходимости доза препарата Эгипрес может быть изменена на основании индивидуального титрования доз отдельных компонентов: 2,5 мг амлодипина + 2,5 мг рамиприла или 5 мг амлодипина + 5 мг рамиприла или 5 мг амлодипина + 10 мг рамиприла или 10 мг амлодипина + 5 мг рамиприла или 10 мг амлодипина + 10 мг рамиприла. Эгипрес в дозе 10 мг амлодипина + 10 мг рамиприла является максимальной суточной дозой препарата, которую не рекомендуется превышать. Дозировки 10 мг амлодипина + 5 мг рамиприла (по амлодипину) и 5 мг амлодипина + 10 мг рамиприла (по рамиприлу) являются максимальными суточными дозами. Взрослые У пациентов, принимающих диуретики, препарат следует назначать с осторожностью, вследствие риска нарушения водно-электролитного баланса. У этих пациентов следует контролировать функцию почек и содержание калия в крови. Пациенты пожилого возраста и пациенты с почечной недостаточностью Выведение амлодипина и рамиприла и его метаболитов у пациентов пожилого возраста и пациентов с почечной недостаточностью замедлено. Поэтому у таких пациентов необходимо регулярно контролировать содержание креатинина и калия в плазме крови. Эгипрес может назначаться пациентам с КК равным или превышающем 60 мл/мин. При КК<:60 мл/мин, а также у пациентов с АГ, находящихся на гемодиализе, Эгипрес рекомендуется только пациентам, получавшим 2.5 мг или 5 мг рамиприла как оптимальную поддерживающую дозу по ходу титрования индивидуальной дозы. Нет необходимости титрования индивидуальной дозы амлодипина у пациентов с нарушением функции почек. Эгипрес противопоказан пациентам с КК<:20 мл/мин/1.73 м площади поверхности тела. Изменение концентрации амлодипина в плазме крови не коррелирует со степенью выраженности почечной недостаточности. Пациенты с печеночной недостаточностью Следует соблюдать осторожность при назначении препарата Эгипрес пациентам с печеночной недостаточностью из-за отсутствия рекомендаций по дозированию препарата у таких пациентов. Эгипрес рекомендуется только пациентам, получавшим 2.5 мг рамиприла как оптимальную поддерживающую дозу по ходу титрования индивидуальной дозы. Дети и подростки Эгипрес не следует назначать детям и подросткам до 18 лет из-за отсутствия данных об эффективности и безопасности применения рамиприла и амлодипина у данных групп пациентов как в виде монотерапии, так и в виде комбинированной терапии. Побочные эффекты и передозировка Побочные эффекты: Указанные ниже нежелательные эффекты даются в соответствии со следующими градациями частоты их возникновения по классификации ВОЗ: очень частые: более 1/10 (более 10%): частые: более 1/100 но менее 1/10 (более 1%, но менее 10%): нечастые: более 1/1000 но менее 1/100 (более 0,1%, но менее 1%): редкие: более 1/10000 но менее 1/1000 (более 0,01%, но менее 0,1%): очень редкие: менее 1/10000 (менее 0,01%). Амлодипин Со стороны ССС: часто - периферические отеки (лодыжек и стоп), ощущение сердцебиения: нечасто - чрезмерное снижение АД, ортостатическая гипотензия, васкулит: редко - развитие или усугубление СН: очень редко - нарушения ритма сердца (включая брадикардию, желудочковую тахикардию и мерцание предсердий), ИМ, боли в грудной клетке, мигрень. Со стороны опорно-двигательного аппарата и соединительной ткани: нечасто - артралгия, судороги мышц, миалгия, боль в спине, артроз: редко - миастения. Со стороны ЦНС и периферической нервной системы: часто - ощущение жара и приливов крови к коже лица, повышенная утомляемость, головокружение, головная боль, сонливость: нечасто - недомогание, обморок, повышенное потоотделение, астения, гипестезии, парестезии, периферическая нейропатия, тремор, бессонница, лабильность настроения, необычные сновидения, нервозность, депрессия, тревога: редко - судороги, апатия: очень редко - атаксия, амнезия, зарегистрированы отдельные случаи экстрапирамидного синдрома. Со стороны пищеварительной системы: часто - боль в брюшной полости, тошнота: нечасто - рвота, изменения режима дефекации (включая запор, метеоризм), диспепсия, диарея, анорексия, сухость слизистой оболочки полости рта, жажда: редко - гиперплазия десен, повышение аппетита: очень редко - гастрит, панкреатит, гипербилирубинемия, желтуха (обычно холестатическая), повышение активности "печеночных" трансаминаз, гепатит. Со стороны крови: очень редко - тромбоцитопеническая пурпура, тромбоцитопения, лейкопения. Метаболические нарушения: очень редко - гипергликемия. Со стороны дыхательной системы: нечасто - одышка, ринит: очень редко - кашель. Со стороны почек и мочевыводящих путей: нечасто - учащенное мочеиспускание, болезненное мочеиспускание, никтурия, импотенция: очень редко - дизурия, полиурия. Аллергические реакции: нечасто - кожный зуд, сыпь: очень редко - ангионевротический отек, мультиформная эритема, крапивница. Прочие: нечасто - алопеция, "звон" в ушах, гинекомастия, увеличение/снижение массы тела, нарушение зрения, диплопия, нарушение аккомодации, ксерофтальмия, конъюнктивит, боль в глазах, извращение вкуса, озноб, носовое кровотечение: редко - дерматит: очень редко - паросмия, ксеродермия, "холодный" пот, нарушение пигментации кожи. Рамиприл Со стороны сердца: нечасто - ишемия миокарда, включая развитие приступа стенокардии или ИМ, тахикардия, аритмии (появление или усиление), ощущение сердцебиения, периферические отеки. Со стороны сосудов: часто - чрезмерное снижение АД, нарушение ортостатической регуляции сосудистого тонуса (ортостатическая гипотензия), синкопальные состояния: нечасто - "приливы" крови к коже лица: редко - возникновение или усиление нарушений кровообращения на фоне стенозирующих сосудистых поражений, васкулит: частота неизвестна - синдром Рейно. Со стороны центральной нервной системы (ЦНС): часто - головная боль, ощущение "легкости" в голове: нечасто - головокружение, агевзия (утрата вкусовой чувствительности), дисгевзия (нарушение вкусовой чувствительности), парестезии (ощущение жжения): редко - тремор, нарушение равновесия: частота неизвестна - ишемия головного мозга, включая ишемический инсульт и преходящее нарушение мозгового кровообращения, нарушение психомоторных реакций, паросмия (нарушение восприятия запахов). Со стороны органа зрения: нечасто - нарушения зрения, включая нечеткость зрительного восприятия: редко - конъюнктивит. Нарушения со стороны органа слуха: редко - нарушения слуха, звон в ушах. Со стороны психики: нечасто - подавленное настроение, тревога, нервозность, двигательное беспокойство, нарушения сна, включая сонливость: редко - спутанность сознания: частота неизвестна - нарушение концентрации внимания. Со стороны дыхательной системы: часто - "сухой" кашель (усиливающийся по ночам и в положении лежа), бронхит, синусит, одышка: нечасто - бронхоспазм, включая утяжеление течения бронхиальной астмы, заложенность носа. Со стороны пищеварительной системы: часто - воспалительные реакции в желудке и кишечнике, расстройства пищеварения, ощущение дискомфорта в области живота, диспепсия, диарея, тошнота, рвота: нечасто - панкреатит, в т.ч. и с летальным исходом (случаи панкреатита с летальным исходом при приеме ингибиторов АПФ наблюдались крайне редко), повышение активности ферментов поджелудочной железы в плазме крови, интестинальный ангионевротический отек, боли в животе, гастрит, запор, сухость слизистой оболочки полости рта: редко - глоссит: частота неизвестна - афтозный стоматит (воспалительная реакция слизистой оболочки полости рта). Со стороны гепатобилиарной системы: нечасто - повышение активности "печеночных" ферментов и содержания конъюгированного билирубина в плазме крови: редко - холестатическая желтуха, гепатоцеллюлярные поражения: частота неизвестна - острая печеночная недостаточность, холестатический или цитолитический гепатит (летальный исход наблюдался крайне редко). Со стороны почек и мочевыводящих путей: нечасто - нарушение функции почек, включая развитие острой почечной недостаточности, увеличение выделения количества мочи, усиление ранее существовавшей протеинурии, повышение концентрации мочевины и креатинина в крови. Со стороны репродуктивной системы и молочных желез: нечасто - преходящая импотенция за счет эректильной дисфункции, снижение либидо: частота неизвестна - гинекомастия. Со стороны крови и лимфатической системы: нечасто - эозинофилия: редко - лейкопения, включая нейтропению и агранулоцитоз, уменьшение количества эритроцитов в периферической крови, снижение гемоглобина, тромбоцитопения: частота неизвестна - угнетение костно-мозгового кроветворения, панцитопения, гемолитическая анемия. Со стороны кожных покровов и слизистых оболочек: часто - кожная сыпь, в частности, макулопапулезная: нечасто - ангионевротический отек, в т.ч. и с летальным исходом (отек гортани может вызвать обструкцию дыхательных путей, приводящую к летальному исходу), кожный зуд, гипергидроз (повышенное потоотделение): редко - эксфолиативный дерматит, крапивница, онихолизис: очень редко - реакции фотосенсибилизации: частота неизвестна - токсический эпидермальный некролиз, синдром Стивенса-Джонсона, мультиформная эритема, пемфигус, утяжеление течения псориаза, псориазоподобный дерматит, пемфигоидная или лихеноидная (лишаевидная) экзантема или энантема, алопеция. Со стороны опорно-двигательного аппарата и соединительной ткани: часто - мышечные судороги, миалгия: нечасто - артралгия. Со стороны обмена веществ, питания и лабораторных показателей: часто - повышение содержания калия в крови: нечасто - анорексия, снижение аппетита: частота неизвестна - снижение концентрации натрия в крови, синдром неадекватной секреции анти- диуретического гормона. Со стороны иммунной системы, частота неизвестна - анафилактические или анафилактоидные реакции (при ингибировании АПФ увеличивается количество анафилактических или анафилактоидных реакций на яды насекомых), повышение титра антинуклеарных антител. Общие нарушения: часто - боли в груди, чувство усталости: нечасто - повышение температуры тела: редко - астения (слабость). Передозировка: Информация о передозировке препарата Эгипрес отсутствует. Амлодипин Симптомы: выраженное снижение АД с возможным развитием рефлекторной тахикардии и чрезмерной периферической вазодилатации (существует вероятность появления выраженной и стойкой артериальной гипотензии, в том числе с развитием шока и летального исхода). Лечение: Назначение активированного угля (особенно в первые 2 часа после передозировки), промывание желудка, придание возвышенного положения конечностям, активное поддержание функций ССС, мониторинг показателей работы сердца и легких, контроль за ОЦК и диурезом. Для восстановления тонуса сосудов и АД, если нет противопоказаний, может оказаться полезным применение сосудосуживающих препаратов. Используют внутривенное введение глюконата кальция. Амлодипин в значительной степени связывается с белками сыворотки крови, поэтому гемодиализ малоэффективен. Рамиприл Симптомы: чрезмерная периферическая вазодилатация с развитием выраженного снижения АД, шока: брадикардия или рефлекторная тахикардия, водно-электролитные нарушения, острая почечная недостаточность, ступор. Лечение: промывание желудка, назначение адсорбентов, натрия сульфата (по возможности в течение первых 30 мин). В случае выраженного снижения АД пациента следует уложить, ноги приподнять, активно поддерживать функции ССС: к терапии по восполнению ОЦК и восстановлению электролитного баланса дополнительно может быть добавлено введение альфа 1-адренергических агонистов (норэпинефрин, допамин) и ангиотензинамида. В случае рефрактерной к медикаментозному лечению брадикардии может потребоваться установка временного искусственного водителя ритма. При передозировке необходимо мониторировать содержание креатинина и электролитов в сыворотке крови. Рамиприлат плохо выводится из крови с помощью гемодиализа. Взаимодействие с другими ЛС: Амлодипин Можно ожидать, что ингибиторы ферментов микросомального окисления печени (эритромицин у молодых, дилтиазем у пожилых, кетоконазол, итраконазол, ритонавир) будут повышать концентрацию амлодипина в плазме крови, усиливая риск побочных эффектов, а индукторы ферментов микросомального окисления печени - уменьшать. При одновременном применении амлодипина с циметидином фармакокинетика амлодипина не меняется. Одновременный однократный прием 240 мл грейпфрутового сока и 10 мг амлодипина внутрь не сопровождается существенным изменением фармакокинетики амлодипина. В отличие от других блокаторов "медленных" кальциевых каналов (БМКК), не было обнаружено клинически значимого взаимодействия амлодипина (III поколение БМКК) при совместном применении с НПВП, особенно индометацином. Возможно усиление антиангинального и антигипертензивного действия БМКК при совместном применении с тиазидными и "петлевыми" диуретиками, верапамилом, ингибиторами АПФ, бета-адреноблокаторами и нитратами, а также повышение их антигипертензивного действия при совместном применении с альфа 1-адреноблокаторами, нейролептиками. Хотя при изучении амлодипина отрицательного инотропного эффекта обычно не наблюдали, тем не менее, некоторые БМКК могут усиливать выраженность отрицательного инотропного действия антиаритмических препаратов, вызывающих удлинение интервала QT (например, амиодарон и хинидин). При совместном применении БМКК с препаратами лития (для амлодипина данные отсутствуют), возможно усиление проявления их нейротоксичности (тошнота, рвота, диарея, атаксия, тремор, шум в ушах). Амлодипин не влияет in vitro на степень связывания с белками плазмы крови дигоксина, фенитоина, варфарина и индометацина. Однократный прием алюминий/магний-содержащих антацидов не оказывает существенного влияния на фармакокинетику амлодипина. Однократный прием 100 мг силденафила у больных эссенциальной гипертензией не оказывает влияния на параметры фармакокинетики амлодипина. Повторное применение амлодипина в дозе 10 мг и аторвастатина в дозе 80 мг не сопровождается значительными изменениями показателей фармакокинетики аторвастатина. При одновременном применении амлодипина с дигоксином у здоровых добровольцев содержание дигоксина в сыворотке и его почечный клиренс не изменяются. При однократном и повторном применении в дозе 10 мг амлодипин не оказывает существенного влияния на фармакокинетику этанола. Амлодипин не влияет на изменение протромбинового времени, вызванное варфарином. Амлодипин не вызывает значительных изменений фармакокинетики циклоспорина. Не рекомендуемые комбинации Одновременное применение дантролена (в/в введение), индукторов изоферментов системы цитохрома СУРЗА4 (например, рифампицин, препараты Зверобоя продырявленного) и ингибиторов изоферментов системы цитохрома СУРЗА4 (ингибиторы протеазы, противогрибковые препараты группы азолов, макролиды, например, эритромицин или кларитромицин, верапамил или дилтиазем). Рамиприл Противопоказанные комбинации Применение некоторых высокопроточных мембран с отрицательно заряженной поверхностью (например, полиакрилнитрильных мембран) при проведении гемодиализа или гемофильтрации: применение декстрана сульфата при аферезе ЛПНП - риск развития тяжелых анафилактических реакций. Нерекомендуемые комбинации С солями калия, калийсберегающими диуретиками (например, амилоридом, триамтереном, спиронолактоном) и другими препаратами (в том числе с антагонистами рецепторов ангиотензина II (АРА II), с триметопримом, такролимусом, циклоспорином) - возможно развитие гиперкалемии (при одновременном применении требуется регулярный контроль содержания калия в сыворотке крови). Комбинации, которые следует применять с осторожностью С антигипертензивными средствами (особенно диуретиками) и другими препаратами, снижающими АД (нитратами, трициклическими антидепрессантами, средствами для общей и местной анестезии, этанолом, баклофеном, алфузозином, доксазозином, празозином, тамсулозином, теразозином) - потенцирование антигипертензивного эффекта. При комбинации с диуретиками следует контролировать содержание натрия в сыворотке крови. Со снотворными, наркотическими и обезболивающими средствами - возможно более выраженное снижение АД. С вазопрессорными симпатомиметиками (эпинефрином, изопротеренолом, добутамином, допамином) - уменьшение антигипертензивного действия рамиприла, требуется регулярный контроль АД. С аллопуринолом, прокаинамидом, цитостатиками, иммунодепрессантами, системными ГКС и другими средствами, которые могут влиять на гематологические показатели - совместное применение увеличивает риск развития лейкопении. С солями лития - повышение содержания лития в сыворотке и усиление кардио- и нейротоксического действия лития. С гипогликемическими средствами для приема внутрь (производными сульфонилмочевины, бигуанидами), инсулином - в связи с уменьшением инсулинорезистентности под влиянием рамиприла возможно усиление гипогликемического эффекта этих препаратов, вплоть до развития гипогликемии. Одновременное применение препаратов, содержащих алискирен, у пациентов с сахарным диабетом и почечной недостаточностью (КК менее 60 мл/мин), а также с вилдаглиптином - в связи с увеличением частоты развития ангионевротического отека при одновременном применении с ингибиторами АПФ. Комбинации, которые следует принимать во внимание С НПВП (индометацин, ацетилсалициловая кислота) - возможно ослабление действия рамиприла, повышение риска нарушения функции почек и повышения содержания калия в сыворотке крови. С гепарином - возможно повышение содержания калия в сыворотке крови. С натрия хлоридом - ослабление антигипертензивного действия рамиприла и менее эффективное лечение симптомов ХСН. С этанолом - усиление симптомов вазодилатации. Рамиприл может усиливать неблагоприятное воздействие этанола на организм. С эстрогенами - ослабление антигипертензивного действия рамиприла (задержка жидкости). Десенсибилизирующая терапия при повышенной чувствительности к ядам насекомых - ингибиторы АПФ, включая рамиприл, увеличивают вероятность развития тяжелых анафилактических или анафилактоидных реакций на яды насекомых. Фармакологическое действие и фармакокинетика Амлодипин Амлодипин - производное дигидропиридина. Связываясь с дигидропиридиновыми рецепторами, блокирует "медленные" кальциевые каналы, ингибирует трансмембранный переход кальция внутрь клеток гладких мышц сосудов и сердца (в большей степени - в гладкомышечные клетки сосудов, чем в кардиомиоциты). Оказывает антигипертензивный и антиангинальный эффекты. Механизм антигипертензивного действия амлодипина обусловлен прямым расслабляющим влиянием на гладкие мышцы сосудов. Амлодипин уменьшает ишемию миокарда следующими двумя путями: - Расширяет периферические артериолы и, таким образом, снижает ОПСС (постнагрузку), при этом ЧСС практически не изменяется, что приводит к снижению потребления энергии и потребности миокарда в кислороде. - Расширяет коронарные и периферические артерии и артериолы как в нормальных, так и в ишемизированных зонах миокарда, что увеличивает поступление кислорода в миокард у пациентов с вазоспастической стенокардией (стенокардия Принцметала) и предотвращает развитие коронароспазма, вызванного курением. У пациентов с АГ суточная доза амлодипина обеспечивает снижение АД на протяжении 24 ч (как в положении на спине, так и стоя). Благодаря медленному началу действия, амлодипин не вызывает резкого снижения АД. У пациентов со стенокардией разовая суточная доза препарата увеличивает продолжительность выполнения физической нагрузки, задерживает развитие очередного приступа стенокардии и депрессии сегмента ST (на 1 мм) на фоне физической нагрузки, снижает частоту приступов стенокардии и потребность в нитроглицерине. Применение амлодипина у пациентов с ИБС У пациентов с заболеваниями ССС (включая коронарный атеросклероз с поражением от одного сосуда и до стеноза 3 и более артерий и атеросклероза сонных артерий), перенесших ИМ, чрезкожную транслюминальную ангиопластику коронарных артерий (ТЛП) или страдающих стенокардией) применение амлодипина предупреждает развитие утолщения интимы-медии сонных артерий, значительно снижает летальность от сердечнососудистых причин, ИМ, инсульта, ТЛП, аорто-коронарного шунтирования, приводит к снижению числа госпитализаций по поводу нестабильной стенокардии и прогрессирования ХСН, снижает частоту вмешательств, направленных на восстановление коронарного кровотока. Применение амлодипина у пациентов с СП. Амлодипин не повышает риск смерти или развития осложнений и смертельных исходов у пациентов с ХСН III-IV ФК по NYHA на фоне терапии дигоксином, диуретиками и ингибиторами АИФ. У пациентов с ХСН III-IV ФК по NYHA неишемической этиологии при применении амлодипина существует вероятность возникновения отека легких. Амлодипин не вызывает неблагоприятных метаболических эффектов, в том числе он не влияет на содержание показателей липидного профиля. Рамиприл Рамиприлат, образующийся при участии "печеночных" ферментов активный метаболит рамиприла, является длительно действующим ингибитором фермента дипептидилкарбоксипептидазы I (синонимы: ангиотензинпревращающий фермент (АИФ), кининаза II). В плазме крови и в тканях этот фермент кининаза II катализирует превращение ангиотензина I в активное сосудосуживающее вещество - ангиотензин II, а также способствует распаду брадикинина. Снижение образования ангиотензина II и ингибирование распада брадикинина приводит к расширению сосудов и снижению артериального давления (АД). Повышение активности калликреин-кининовой системы в крови и тканях обуславливает кардиопротективное и эндотелиопретективное действие рамиприла за счет активации простагландиновой системы и, соответственно, увеличения синтеза простагландинов (ПГ), стимулирующих образование оксида азота (N0) в эндотелиоцитах. Ангиотензин II стимулирует выработку альдостерона, поэтому прием рамиприла приводит к снижению секреции альдостерона и повышению содержания ионов калия в сыворотке. При снижении содержания ангиотензина II в крови устраняется его ингибирующее влияние на секрецию ренина по типу отрицательной обратной связи, что приводит к повышению активности ренина плазмы крови. Предполагается, что развитие некоторых нежелательных реакций (в частности, "сухого" кашля) связано с повышением активности брадикинина. У пациентов с артериальной гипертензией (АГ) прием рамиприла приводит к снижению АД в положении на спине и стоя, без компенсаторного увеличения частоты сердечных сокращений (ЧСС). Рамиприл значительно снижает общее периферическое сопротивление сосудов (ОПСС), практически не вызывая изменений в почечном кровотоке и скорости клубочковой фильтрации. Антигипертензивное действие начинает проявляться через 1-2 ч после приема внутрь разовой дозы препарата, достигая наибольшего значения через 3-6 ч, и сохраняется в течение 24 ч. При курсовом приеме антигипертензивный эффект может постепенно увеличиваться, стабилизируясь обычно к 3-4 неделе регулярного приема препарата и затем сохраняясь в течение длительного времени. Внезапное прекращение приема препарата не приводит к быстрому и значительному повышению АД (отсутствие синдрома "отмены"). У пациентов с АГ рамиприл замедляет развитие и прогрессирование гипертрофии миокарда и сосудистой стенки. У пациентов с хронической сердечной недостаточностью (ХСН) рамиприл снижает ОПСС (уменьшение постнагрузки на сердце), увеличивает емкость венозного русла и снижает давление наполнения левого желудочка (ЛЖ), что, соответственно, приводит к уменьшению преднагрузки на сердце. У этих пациентов при приеме рамиприла наблюдается увеличение сердечного выброса, фракции выброса и улучшение переносимости физической нагрузки. При диабетической и недиабетической нефропатии прием рамиприла замедляет скорость прогрессирования почечной недостаточности и время наступления терминальной стадии почечной недостаточности и, благодаря этому, уменьшает потребность в процедурах гемодиализа или трансплантации почки. При начальных стадиях диабетической или недиабетической нефропатии рамиприл уменьшает степень выраженности альбуминурии. У пациентов с высоким риском развития заболеваний сердечно-сосудистой системы (ССС) вследствие наличия сосудистых поражений (диагностированная ишемическая болезнь сердца (ИБС), облитерирующие заболевания периферических артерий в анамнезе, инсульт в анамнезе) или сахарного диабета с не менее чем одним дополнительным фактором риска (микроальбуминурия, АГ, увеличение содержания общего холестерина, снижение содержания холестерина липопротеинов высокой плотности (ЛПВП), курение) добавление рамиприла к стандартной терапии значительно снижает частоту развития инфаркта миокарда (ИМ), инсульта и смертности от сердечно-сосудистых причин. Кроме этого, рамиприл снижает показатели общей смертности, а также потребность в процедурах реваскуляризации, замедляет возникновение или прогрессирование ХСН. У пациентов с сердечной недостаточностью (СН), развившейся в первые дни острого инфаркта миокарда (ОИМ) (2-9 сутки), при приеме рамиприла, начиная с 3 по 10 сутки ОИМ, снижается риск показателя смертности (на 27%), риск внезапной смерти (на 30%), риск прогрессирования ХСН до тяжелой - III-IV функциональный класс (ФК) по классификации Нью-Йоркской ассоциации кардиологов (NYHA) - резистентной к терапии (на 27%), вероятность последующей госпитализации из-за развития СН (на 26%). В общей популяции пациентов, а также у пациентов с сахарным диабетом, как с АГ, так и с нормальными показателями АД, рамиприл значительно снижает риск развития нефропатии и возникновения микроальбуминурии. Фармакокинетика: Амлодипин После приема внутрь в терапевтических дозах амлодипин хорошо абсорбируется, время достижения максимальной концентрации в плазме крови (ТСmах) при пероральном приеме составляет 6-12 ч. Абсолютная биодоступность оставляет 64-80%. Vd составляет примерно 21 л/кг. Связь с белками плазмы крови составляет примерно 97,5%. Прием пищи не влияет на всасывание амлодипина. Препарат проникает через гематоэнцефалический барьер. Т1/2 из плазмы крови составляет около 35-50 ч, что соответствует назначению препарата один раз в сутки. У пациентов с печеночной недостаточностью и тяжелой ХСН Т1/2 увеличивается до 56-60 ч. Общий клиренс - 0,43 л/ч/кг. Стабильная Css (5-15 нг/мл) достигается через 7-8 дней постоянного приема амлодипина, он метаболизируется в печени с образованием неактивных метаболитов. 10% исходного препарата и 60% метаболитов выводится почками, а 20% - через кишечник. Выведение с грудным молоком неизвестно. В ходе гемодиализа амлодипин не удаляется. Применение у больных почечной недостаточностью Т1/2 из плазмы крови у больных с почечной недостаточностью увеличивается до 60 ч. Изменение концентрации амлодипина в плазме крови не коррелирует со степенью нарушения функции почек. Применение у пожилых пациентов У пожилых пациентов ТСmах и Сmах амлодипина практически не отличаются от таковых у более молодых пациентов. У пациентов пожилого возраста, страдающих ХСН, отмечена тенденция к снижению клиренса амлодипина, что приводит к увеличению AUC и Т1/2 до 65 ч. Рамиприл После приема внутрь рамиприл быстро всасывается из желудочно-кишечного тракта (ЖКТ) (50-60%). Прием пищи замедляет его абсорбцию, но не влияет на степень всасывания. Рамиприл подвергается интенсивному пресистемному метаболизму/активации (главным образом, в печени путем гидролиза), в результате которого образуется его единственный активный метаболит - рамиприлат, активность которого в отношении ингибирования АПФ примерно в 6 раз превышает активность рамиприла. Кроме этого, в результате метаболизма рамиприла образуется не обладающий фармакологической активностью дикетопиперазин, который затем подвергается конъюгации с глюкуроновой кислотой. Рамиприлат также глюкуронируется и метаболизируется до дикетопиперазиновой кислоты. Биодоступность рамиприла после приема внутрь колеблется от 15% (для дозы 2,5 мг) до 28% (для дозы 5 мг). Биодоступность рамиприлата после приема внутрь 2,5 мг и 5 мг рамиприла составляет приблизительно 45% (по сравнению с его биодоступностью после внутривенного введения в тех же дозах). После приема рамиприла внутрь максимальные концентрации в плазме крови (Стmах) рамиприла и рамиприлата достигаются через 1 и 2-4 ч, соответственно. Снижение концентрации рамиприлата в плазме крови происходит в несколько этапов: фаза распределения и выведения с периодом полувыведения (Т1/2) рамиприлата, составляющим приблизительно 3 ч, затем промежуточная фаза с Т1/2 рамиприлата, составляющим приблизительно 15 ч, и конечная фаза с очень низкой концентрацией рамиприлата в плазме крови и Т1/2 рамиприлата, составляющим приблизительно 4-5 дней. Эта конечная фаза обусловлена медленным высвобождением рамиприлата из прочной связи с рецепторами АПФ. Несмотря на продолжительную конечную фазу при однократном в течение суток приеме рамиприла внутрь в дозе 2,5 мг и более, равновесная плазменная концентрация (Css) рамиприлата достигается приблизительно через 4 дня лечения. При курсовом назначении препарата "эффективный" Т1/2 в зависимости от дозы составляет 13-17 ч. Связывание с белками плазмы крови приблизительно составляет для рамиприла 73%, а для рамиприлата - 56%. После внутривенного (в/в) введения объемы распределения (Vd) рамиприла и рамиприлата составляют приблизительно 90 и 500 л, соответственно. После приема внутрь меченного радиоактивным изотопом рамиприла (10 мг) 39% радиоактивности выводится через кишечник и около 60% - почками. После в/в введения рамиприла, 50-60% дозы обнаруживается в моче в виде рамиприла и его метаболитов. После в/в введения рамиприлата около 70% дозы обнаруживается в моче в виде рамиприлата и его метаболитов, иначе говоря, при в/в введении рамиприла и рамиприлата значительная часть дозы выводится через кишечник с желчью, минуя почки (50 и 30%, соответственно). После приема внутрь 5 мг рамиприла у пациентов с дренированием желчных протоков практически одинаковые количества рамиприла и его метаболитов выделяются почками и через кишечник в течение первых 24 ч после приема. Приблизительно 80-90% метаболитов в моче и желчи были идентифицированы как рамиприлат и метаболиты рамиприлата. Рамиприла глюкуронид и рамиприла дикетопиперазин составляют приблизительно 10-20% от общего количества, а содержание в моче неметаболизированного рамиприла составляет приблизительно 2%. При нарушениях функции почек с клиренсом креатинина (КК) менее 60 мл/мин выведение рамиприлата и его метаболитов почками замедляется. Это приводит к повышению концентрации рамиприлата в плазме крови, которая снижается медленнее, чем у пациентов с нормальной функцией почек. При приеме рамиприла в высоких дозах (10 мг) нарушение функции печени приводит к замедлению пресистемного метаболизма рамиприла до активного рамиприлата и более медленному выведению рамиприлата. У здоровых добровольцев и у пациентов с АГ после 2 недель лечения рамиприлом в суточной дозе 5 мг не наблюдается клинически значимого накопления рамиприла и рамиприлата. У пациентов с ХСН после 2 недель лечения рамиприлом в суточной дозе 5 мг отмечается 1,5-1,8-кратное увеличение концентраций рамиприлата в плазме крови и площади под фармакокинетической кривой концентрации вещества в плазме в зависимости от времени (AUC). У здоровых добровольцев пожилого возраста (65-76 лет) фармакокинетика рамиприла и рамиприлата существенно не отличается от таковой у молодых здоровых добровольцев. Особые указания Особые указания, относящиеся к рамиприлу и амлодипину, применимы к препарату Эгипрес. Особые указания, относящиеся к приему амлодипина При лечении АГ амлодипин может сочетаться с приемом тиазидных диуретиков, альфа- и бета-адреноблокаторов, ингибиторов АПФ, нитратов пролонгированного действия, сублингвальным нитроглицерином, НПВП, антибиотиками и гипогликемическими средствами для приема внутрь. При лечении стенокардии амлодипин можно назначать в комбинации с другими антиангинальными средствами, в том числе у пациентов, рефрактерных к лечению нитратами и/или бета-адреноблокаторами в адекватных дозах. Амлодипин не оказывает какого-либо неблагоприятного влияния на обмен веществ и липиды плазмы крови и может применяться при лечении пациентов с бронхиальной астмой, сахарным диабетом и подагрой. Амлодипин может быть применен и в тех случаях, когда пациент предрасположен к вазоспазму/вазоконстрикции. Пациентам с малой массой тела, невысокого роста и пациентам с выраженным нарушением функций печени может потребоваться меньшая дозировка. Во время лечения необходим контроль массы тела и наблюдение у стоматолога (для предотвращения болезненности, кровоточивости и гиперплазии десен). Особые указания, относящиеся к приему рамиприла Перед началом лечения рамиприлом необходимо устранить гипонатриемию и гиповолемию. Пациентам, ранее принимавшим диуретики, необходимо их отменить или, по крайней мере, снизить их дозу за 2-3 дня до начала приема рамиприла (в этом случае следует регулярно контролировать состояние пациентов с ХСН, в связи с возможностью развития у них декомпенсации при увеличении ОЦК). После приема первой дозы препарата, а также при увеличении его дозы и/или дозы диуретиков (особенно "петлевых"), необходимо обеспечить регулярное медицинское наблюдение за пациентом в течение не менее 8 ч для своевременного принятия соответствующих мер в случае чрезмерного снижения АД. Если рамиприл используется впервые или в высокой дозе у пациентов с повышенной активностью РААС, то у них следует регулярно контролировать АД, особенно в начале лечения, т.к. у этих пациентов имеется повышенный риск чрезмерного снижения АД. При злокачественной АГ и СН, в особенности в острой стадии ИМ, лечение с применением рамиприла следует начинать только в условиях стационара. У пациентов с ХСН прием препарата может привести к развитию выраженного снижения АД, которое в ряде случаев сопровождается олигурией или азотемией и редко - развитием острой почечной недостаточности. Следует соблюдать осторожность при лечении пожилых пациентов, т.к. они могут быть особенно чувствительны к ингибиторам АПФ: в начальной фазе лечения рекомендуется контролировать показатели функции почек. У пациентов, для которых снижение АД может представлять определенный риск (например, у пациентов с атеросклеротическим сужением коронарных или мозговых артерий), лечение должно начинаться под строгим медицинским наблюдением. Следует соблюдать осторожность при физической нагрузке и/или жаркой погоде из-за риска повышенного потоотделения и дегидратации с развитием артериальной гипотензии вследствие уменьшения ОЦК и снижения содержания натрия в крови. Во время лечения не рекомендуется употреблять алкоголь. Преходящая артериальная гипотензия не является противопоказанием для продолжения лечения после стабилизации АД. В случае повторного возникновения выраженной артериальной гипотензии следует уменьшить дозу или отменить препарат. У пациентов, получавших лечение ингибиторами АПФ, наблюдались случаи ангионевротического отека лица, конечностей, губ, языка, глотки или гортани. При возникновении отечности в области лица (губы, веки) или языка, либо нарушении глотания или дыхания, пациент должен немедленно прекратить прием препарата. Ангионевротический отек, локализующийся в области языка, глотки, или гортани (возможные симптомы: нарушение глотания или дыхания), может угрожать жизни и требует проведения неотложных мер по его купированию: подкожное введение 0,3-0,5 мг или внутривенное капельное введение 0,1 мг эпинефрина (под контролем АД, ЧСС и ЭКГ) с последующим применением ГКС (в/в, в/м, или внутрь): также рекомендуется внутривенное введение антигистаминных средств (антагонистов H1- и Н2-гистаминовых рецепторов), а в случае недостаточности инактиваторов фермента C1-эстеразы можно рассмотреть вопрос о необходимости введения в дополнение к эпинефрину ингибиторов фермента C1-эстеразы. Пациент должен быть госпитализирован, и наблюдение за ним должно проводиться до полного купирования симптомов, но не менее 24 ч. У пациентов, получавших ингибиторы АПФ, наблюдались случаи интестинального ангионевротического отека, который проявлялся болями в животе с тошнотой и рвотой или без них: в некоторых случаях одновременно наблюдался и ангионевротический отек лица. При появлении у пациента на фоне лечения ингибиторами АПФ вышеописанных симптомов следует при проведении дифференциального диагноза рассматривать и возможность развития у них интестинального ангионевротического отека. Лечение, направленное на десенсибилизацию к яду насекомых (пчелы, осы), и одновременный прием ингибиторов АПФ могут инициировать анафилактические и анафилактоидные реакции (например, снижение АД, одышку, рвоту, аллергические кожные реакции), которые могут иногда быть опасными для жизни. На фоне лечения ингибиторами АПФ реакции повышенной чувствительности на яд насекомых (например, пчел, ос) развиваются быстрее и протекают тяжелее. Если необходимо проведение десенсибилизации к яду насекомых, то ингибитор АПФ должен быть временно заменен соответствующим ЛС другого класса. При использовании ингибиторов АПФ были описаны опасные для жизни, быстро развивающиеся анафилактоидные реакции, иногда вплоть до развития шока во время проведения гемодиализа или плазмофильтрации с применением определенных высокопроточных мембран (например, полиакрилнитрильных мембран) (см. также инструкции производителей мембран). Необходимо избегать совместного использования рамиприла и такого рода мембран (например, для срочного гемодиализа или гемофильтрации). В данном случае предпочтительно применение других мембран или исключение приема ингибитора АПФ. Сходные реакции наблюдались при аферезе ЛПНП с применением декстрана сульфата. Поэтому данный метод не следует применять у пациентов, получающих ингибитор АПФ. У пациентов с нарушениями функции печени реакция на лечение препаратами рамиприла может быть или усиленной или ослабленной. Кроме этого, у пациентов с тяжелым циррозом печени с отеками и/или асцитом возможна значительная активация РААС, поэтому при лечении этих пациентов следует соблюдать особую осторожность. Перед хирургическим вмешательством (включая стоматологическое) необходимо предупредить хирурга/анестезиолога о применении ингибитора АПФ. Применение ингибитора АПФ у пациентов, подвергающихся обширному хирургическому вмешательству и/или общей анестезии, может привести к выраженному снижению АД, если используются средства для общей анестезии с гипотензивным действием. Это связано с блокированием образования ангиотензина II на фоне компенсаторного повышения активности ренина. В таком случае следует увеличить объем циркулирующей жидкости. Рекомендуется прекратить прием ингибитора АПФ за 24 часа до хирургического вмешательства. На основании результатов эпидемиологических исследований предполагается, что одновременный прием ингибиторов АПФ и инсулина, а также гипогликемических средств для приема внутрь может приводить к развитию гипогликемии. Наибольший риск развития наблюдается в течение первых недель комбинированной терапии, а также у пациентов с нарушением функции почек. У пациентов с сахарным диабетом требуется регулярный контроль гликемии, особенно во время первого месяца терапии ингибиторами АПФ. Рекомендуется вести тщательное наблюдение за новорожденными, которые подвергались внутриутробному воздействию ингибиторами АПФ, для выявления артериальной гипотензии, олигурии и гиперкалиемии. При олигурии необходимо поддержание АД и почечной перфузии путем введения соответствующих жидкостей и сосудосуживающих средств. У таких новорожденных имеется риск развития олигурии и неврологических расстройств, возможно, из-за снижения почечного и мозгового кровотока вследствие снижения АД, вызываемого ингибиторами АПФ. На фоне терапии ингибиторами АПФ может возникать "сухой" кашель. Кашель длительно сохраняется на фоне приема препаратов этой группы и исчезает после их отмены. При появлении у пациента "сухого" кашля следует помнить о возможном ятрогенном характере этого симптома. У пациентов негроидной расы чаще, чем у представителей других рас, на фоне приема ингибиторов АПФ развивается ангионевротический отек. Рамиприл, как и другие ингибиторы АПФ, возможно оказывает менее выраженное антигипертензивное действие у пациентов негроидной расы по сравнению с представителями других рас. Возможно, это различие обусловлено тем, что у пациентов с АГ негроидной расы чаще отмечается низкая активность ренина. Контроль лабораторных показателей до и во время лечения рамиприлом (до 1 раза в месяц в первые 3-6 мес лечения) включает: Контроль функции почек (определение содержания креатинина в сыворотке) При лечении ингибиторами АПФ в первые недели лечения и в последующем рекомендуется проводить контроль функции почек. Особенно тщательный контроль требуется пациентам с СН, нарушением функции почек, после трансплантации почек, пациентам с реноваскулярными заболеваниями, включая пациентов с гемодинамически значимым односторонним стенозом почечной артерии при наличии двух почек (у таких пациентов даже незначительное повышение уровня сывороточного креатинина может быть показателем снижения функции почек). Контроль содержания электролитов Рекомендуется регулярный контроль содержания калия в сыворотке крови. Особенно тщательный мониторинг содержания калия в сыворотке крови требуется пациентам с нарушениями функции почек, значимыми нарушениями водно-электролитного баланса, ХСН. Контроль гематологических показателей (содержание гемоглобина, количества лейкоцитов, эритроцитов, тромбоцитов, лейкоцитарная формула) Рекомендуется контролировать показатели общего анализа крови для выявления возможной лейкопении. Более регулярный мониторинг рекомендуется в начале лечения и у пациентов с нарушением функции почек, а также у пациентов с заболеваниями соединительной ткани или у пациентов, получающих одновременно другие ЛС, способные изменять картину периферической крови. Контроль количества лейкоцитов необходим для раннего выявления лейкопении, что особенно важно у пациентов с повышенным риском ее развития, а также при первых признаках развития инфекции. При выявлении нейтропении (число нейтрофилов меньше 2000/мкл) требуется прекращение лечения рамиприлом. При появлении симптоматики, обусловленной лейкопенией (например, лихорадки, увеличения лимфатических узлов, тонзиллита), необходим срочный контроль картины периферической крови. В случае появления признаков кровоточивости (мельчайших петехий, красно-коричневых высыпаний на коже и слизистых оболочках) необходим также контроль числа тромбоцитов в периферической крови. Определение активности "печеночных" ферментов, концентрации билирубина в крови При появлении желтухи или значимого повышения активности "печеночных" ферментов лечение рамиприлом следует прекратить и обеспечить врачебное наблюдение за пациентом. Влияние на способность управлять транспортными средствами: В период лечения препаратом рекомендуется воздерживаться от управления транспортными средствами и от занятий другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций (возможно головокружение, особенно в начале лечения, и у пациентов, принимающих диуретические ЛС, снижение концентрации внимания). После первой дозы, а также после значительного повышения дозы препарата не рекомендуется управлять транспортными средствами и работать с техническим оборудованием в течение нескольких часов. Условия хранения и отпуска из аптек Условия хранения:При температуре не выше 25 °С. Хранить в недоступном для детей месте. Отпуск из аптек: По рецепту Регистрационные данные Торговое название Эгипрес® Международное непатентованное название:Амлодипин + Рамиприл. Форма выпуска:капсулы. Состав:Состав на 1 капсулу: Действующие вещества: амлодипина безилат 3,475/6,95/6,95/13,9/13,9 мг (что соответствует амлодипина 2,5/5/5/10/10 мг) и рамиприл 2,5/5/10/5/10 мг. Вспомогательные вещества: кросповидон 10/20/40/40/40 мг, гипромеллоза 0,59/1,18/2,36/2,36/2,36 мг, целлюлоза микрокристаллическая 57,41/114,82/229,64/229,64/229,64 мг, глицерил дибегенат 1,025/2,05/4,1/4,1/4,1 мг. Состав твердой желатиновой капсулы (CONI-SNAP 3), код цвета крышки и основания 37350 (капсулы 2,5 мг+2,5 мг): краситель железа оксид красный (Е172), титана диоксид, желатин. Состав твердой желатиновой капсулы (CONI-SNAP 3), код цвета крышки и основания 51072 (капсулы 5 мг+5 мг): краситель бриллиантовый голубой (Е133), краситель красный очаровательный (Е129), титана диоксид, желатин. Состав твердой желатиновой капсулы (CONI-SNAP 0), код цвета крышки и основания: 51072/37350 (капсулы 5 мг+10 мг): крышка: титана диоксид, краситель бриллиантовый голубой (Е133), краситель красный очаровательный (Е129), желатин: основание: титана диоксид, краситель железа оксид красный (Е172), желатин. Состав твердой желатиновой капсулы (CONI-SNAP 0), код цвета крышки и основания: 33007/37350 (капсулы 10 мг+5 мг): крышка: титана диоксид, краситель азорубин (Е122), индигокармин (Е132), желатин: основание: титана диоксид, краситель железа оксид красный (Е172), желатин. Состав твердой желатиновой капсулы (CONI-SNAP 0), код цвета крышки и основания: 33007 (капсулы 10 мг+10 мг): краситель азорубин (Е122), индигокармин (Е132), титана диоксид, желатин. АТХ: Регистрация: Лекарственное средство ЛП-002402 Фармгруппа: гипотензивное средство комбинированное (ангиотензинпревращающего фермента ингибитор + блокатор "медленных" кальциевых каналов)Дата регистрации: 18.03.2014. Окончание регстрации: . Описание:Капсулы 2,5 мг+2,5 мг: Твердые желатиновые капсулы CONI-SNAP 3, самозакрывающиеся, с основанием и крышкой светло-розового цвета, содержащие смесь гранул и порошков белого или почти белого цвета, без или почти без запаха. Капсулы 5 мг+5 мг: Твердые желатиновые капсулы CONI-SNAP 3, самозакрывающиеся, с основанием и крышкой светло-бордового цвета, содержащие смесь гранул и порошков белого или почти белого цвета, без или почти без запаха. Капсулы 5 мг+10 мг: Твердые желатиновые капсулы CONI-SNAP 0, самозакрывающиеся, с основанием светло-розового цвета и крышкой светло-бордового цвета, содержащие смесь гранул и порошков белого или почти белого цвета, без или почти без запаха. Капсулы 10 мг+5 мг: Твердые желатиновые капсулы CONI-SNAP 0, самозакрывающиеся, с основанием светло-розового цвета и крышкой темно-бордового цвета, содержащие смесь гранул и порошков белого или почти белого цвета, без или почти без запаха. Капсулы 10 мг+10 мг: Твердые желатиновые капсулы CONI-SNAP 0, самозакрывающиеся, с основанием и крышкой темно-бордового цвета, содержащие смесь гранул и порошков белого или почти белого цвета, без или почти без запаха. Упаковка:Капсулы 2,5 мг+2,5 мг, 5 мг+5 мг, 5 мг+10 мг, 10 мг+5 мг, 10 мг+ 10 мг. По 7 или 10 капсул в блистере из комбинированной пленки "cold" (поли- амид/алюминиевая фольга УПВХ)//алюминиевая фольга. 4 или 8 блистеров (по 7 капсул) или 3 или 9 блистеров (по 10 капсул) в картонной пачке вместе с инструкцией по применению. Срок годности:3 года. Не использовать по истечении срока годности, указанного на упаковке. Владелец рег.удостоверения:Эгис Фармацевтический завод ОАО Производитель:EGIS PHARMACEUTICALS, Plc. Представительство:ЭГИС ЗАО фармацевтический завод
Модель:
RUR 2086
Показания Базисная терапия бронхиальной астмы, предусматривающая применение комбинированной терапии (ингаляционный ГКС + |32- адреномиметик длительного действия): у пациентов, симптомы заболевания которых недостаточно контролируются. Противопоказания Повышенная чувствительность к активным и вспомогательным веществам препарата. - Детский возраст до 18 лет. Беременность Отсутствует опыт применения пропелента ГФА-134а (норфлурана) или доказательства его безопасности во время беременности и в период грудного вскармливания у человека. Однако исследования по влиянию ГФА-134а на Применение и дозы Препарат Фостер предназначен для ингаляционного применения. Бронхиальная астма :Препарат Фостер не предназначен для первоначального лечения бронхиальной астмы. Подбор доз активных веществ, входящих в состав препарата Фостер, происходит индивидуально в зависимости от степени тяжести заболевания. Это необходимо учитывать не только при начале лечения комбинированными препаратами, но и при изменении их дозы. В том случае, если отдельным пациентам требуется иная комбинация доз активных веществ, чем таковая в препарате Фостер, им следует принимать соответствующие дозы (32- адреномиметиков и/или ГКС в отдельных ингаляторах. Беклометазона дипропионат в препарате Фостер характеризуется экстрамелкодисперсным распределением размеров частиц аэрозоля, что приводит к более выраженному эффекту, чем у беклометазона дипропионата в лекарственной форме с неэкстрамелкодисперсным распределением размеров частиц аэрозоля (так, 100 мкг беклометазона дипропионата с экстрамелкодисперсным распределением размеров частиц аэрозоля в препарате Фостер эквивалентны 250 мкг беклометазона дипропионата в лекарственной форме с неэкстрамелкодисперсным распределением размеров частиц аэрозоля). Поэтому общая суточная доза беклометазона дипропионата, применяемого в препарате Фостер, должна быть ниже, чем общая доза беклометазона дипропионата, применяемого в лекарственной форме с неэкстрамелкодисперсным распределением размеров частиц аэрозоля. Это следует принимать во внимание, когда пациент переводится с беклометазона дипропионата в лекарственной форме с неэкстрамелкодисперсным распределением размеров частиц аэрозоля на препарат Фостер: доза беклометазона дипропионата в препарате Фостер должна быть ниже, и следует проводить ее подбор в зависимости от индивидуальной потребности пациентов. Существуют два подхода для лечения бронхиальной астмы препаратом Фостер: регулярная терапия: препарат Фостер применяется в качестве регулярной терапии с применением дополнительно бронходилататора быстрого действия по потребности; регулярная терапия и применение по потребности для снятия симптомов астмы: препарат Фостер принимается в качестве регулярной терапии и в ответ на развитие симптомов астмы по потребности. Регулярная терапия Пациентам следует рекомендовать иметь при себе отдельный ингалятор с бронходилататором быстрого действия, которым они могут пользоваться для снятия симптомов астмы в любое время. Рекомендации по режиму дозирования для взрослых (18 лет и старше) По одной или две ингаляции два раза в сутки. Максимальная суточная доза составляет 4 ингаляции в сутки. Регулярная терапия и применение по потребности для снятия симптомов астмы. Пациенты принимают свою постоянную ежедневную дозу препарата Фостер и дополнительно принимают препарат Фостер по потребности для снятия симптомов астмы. Пациентам следует рекомендовать всегда иметь при себе препарат Фостер для снятия симптомов астмы. Рассмотреть вопрос о необходимости применения препарата Фостер в качестве регулярной терапии и по потребности для снятия симптомов астмы особенно следует у следующих пациентов: - у пациентов с неполностью контролируемой бронхиальной астмой и нуждающихся в препаратах для снятия симптомов астмы- у пациентов с обострением бронхиальной астмы в прошлом, потребовавшем медицинского вмешательства. Пациенты, которые часто принимают большое количество препарата Фостер по потребности для снятия симптомов астмы, нуждаются в тщательном наблюдении на предмет развития дозозависимых нежелательных эффектов. Рекомендации по режиму дозирования у пациентов в возрасте 18 лет и старше. Рекомендованная доза для регулярной терапии составляет 1 ингаляция 2 раза в сутки (одна ингаляция утром и вторая ингаляция вечером). В ответ на развитие симптомов астмы пациенты могут провести одну дополнительную ингаляцию препарата Фостер. Если через несколько минут симптомы сохраняются, следует провести вторую дополнительную ингаляцию препарата Фостер. Максимальная суточная доза составляет 8 ингаляций препарата Фостер. Пациентам, которым требуется частое применение ингаляций для снятия симптомов бронхиальной астмы, следует настоятельно рекомендовать обратиться к врачу. Следует переоценить тяжесть бронхиальной астмы у таких пациентов и пересмотреть их базисную терапию. Рекомендации по режиму дозирования для детей и подростков младше 18 лет. Отсутствует опыт применения препарата Фостер у детей и подростков младше 18 лет. Поэтому до получения дополнительных клинических данных его не рекомендуется применять у пациентов младше 18 лет. Состояние пациентов должно регулярно переоцениваться врачом, так как режим дозирования препарата Фостер поддерживается на оптимальном уровне и изменяется только по рекомендации врача. Доза должна титроваться до минимальной дозы, на фоне которой сохраняется оптимальный контроль над симптомами бронхиальной астмы. При достижении контроля над симптомами бронхиальной астмы можно рассмотреть вопрос в отношении постепенного уменьшения дозы препарата Фостер. В случае снижения дозы важным является регулярное обследование пациента. Следует применять наименьшую эффективную дозу препарата. При достижении полного контроля над симптомами бронхиальной астмы на фоне минимальной рекомендуемой дозы препарата, на следующем этапе можно попытаться перевести пациента на прием одного ингаляционного ГКС. Пациент должен быть предупрежден о необходимости ежедневного применения препарата Фостер, даже при отсутствии симптомов бронхиальной астмы.ХОБЛ :Рекомендации по режиму дозирования у взрослых (18 лет и старше) По две ингаляции 2 раза в сутки. Особые группы пациентов :Нет необходимости в специальном подборе дозы препарата для пациентов пожилого возраста. Нет данных о приеме препарата Фостер пациентами с почечной или печеночной недостаточностью (см. раздел "Фармакокинетика"). Инструкция по применению ингалятора :Врач или другой медицинский работник должны обучить пациента правильно пользоваться ингалятором и периодически проверять технику проведения ингаляции. Правильное пользование дозированным ингалятором является обязательным условием для успешного лечения. Пациенту следует рекомендовать внимательно прочитать инструкцию по применению и следовать имеющимся в ней рекомендациям. Перед первым использованием ингалятора или через 14 дней и более после перерыва в его использовании первую дозу необходимо распылить в воздух, чтобы убедиться, что он работает. Всегда, когда это возможно, пациенты должны проводить ингаляцию из ингалятора, находясь в вертикальном положении (стоя или сидя). Порядок проведения ингаляции 1. Возьмите ингалятор большим и указательным пальцами, как показано на рисунке.2. Снимите защитный колпачок с мундштука ингалятора и проверьте, что мундштук является чистым и не содержит инородных объектов. 3. Выдохните как можно медленнее и глубже. 4. Держите баллончик вертикально с его корпусом, направленным вверх, и охватите губами мунштук. Не захватывайте мундштук зубами. Сделайте долгий глубокий вдох через рот, в это же самое время произведя нажатие на торец баллончика указательным пальцем после начала вдоха. 5. После вдоха как можно дольше задержите дыхание, затем выньте мундштук изо рта и произведите медленный выдох. Не производите выдох в ингалятор. Для получения второй дозы, держа ингалятор в вертикальном положении, подождите около 30 секунд и затем повторите этапы с 3 по 5. После использования плотно закройте мундштук защитным колпачком. Внимание! Выполняя этапы 3 и 4, нельзя торопиться. Следует начинать вдох как можно медленнее, непосредственно перед нажатием на дозирующее устройство ингалятора. Если аэрозоль частично выходит из верхней части ингалятора или из уголков рта пациента, следует повторить последовательность операций, начиная с этапа 3. Пациентам со слабыми руками удобнее держать ингалятор двумя руками. Следовательно, верхнюю часть ингалятора нужно удерживать двумя указательными пальцами, а его нижнюю часть - двумя большими пальцами. После ингаляции необходимо прополоскать рот и глотку водой или почистить зубы (см. раздел "Особые указания"). Очистка ингалятора Пациентам следует рекомендовать внимательно прочитать инструкцию по применению для получения инструкций по очистке ингалятора. Для регулярной очистки ингалятора пациенты должны снять защитный колпачок с мундштука и протереть внутреннюю и внешнюю поверхность мундштука сухой тканью. Они не должны использовать воду или другие жидкости для очистки мундштука. Пациенты, которые испытывают затруднения в том, чтобы синхронизировать распыление аэрозоля и вдох, могут пользоваться спейсерным устройством Аэро. Чамбер Плюс®. Лечащий врач, фармацевт или медицинская сестра должны проинструктировать таких пациентов, как надо правильно пользоваться и ухаживать за ингалятором и спейсерным устройством и проверить их технику проведения ингаляции, чтобы гарантировать оптимальное поступление ингалируемого препарата в легкие. При использовании спейсерного устройства Аэро. Чамбер Плюс® оптимальная техника ингаляции достигается при проведении одного непрерывного медленного и глубокого вдоха через спейсер без задержки между нажатием на ингалятор и началом вдоха. Побочные эффекты и передозировка Препарат Фостер содержит беклометазона дипропионат и формотерола фумарат, и поэтому следует ожидать, что он может вызывать побочные эффекты, характерные для указанных компонентов. Нет данных о том, что их одновременное применение Фармакологическое действие и фармакокинетика Ингаляционные дозы препарата Фостер до 12 кумулятивных доз аэрозоля (общая доза беклометазона дипропионата 1200 мкг, формотерола 72 мкг) были изучены у пациентов с бронхиальной астмой. Кумулятивное лечении не вызывало нежелательных эффектов на жизненно-важные функции, и не наблюдалось ни серьезных, ни тяжелых нежелательных эффектов. Чрезмерно высокие дозы формотерола могут привести к эффектам, типичным для 2- адреномиметиков: тошнота, рвота, головная боль, тремор, сонливость, ощущение сердцебиения, тахикардия, желудочковые аритмии, удлинение QTc-интервала, метаболический ацидоз, гипокалиемия, гипергликемия. При появлении симптомов передозировки формотерола показано поддерживающее основные функции организма и симптоматическое лечение. В тяжелых случаях - госпитализация. Может быть рассмотрено применение кардиоселективных бета-адреноблокаторов при соблюдении крайней осторожности, так как применение бета-адреноблокаторов может вызвать бронхоспазм. Необходимо мониторирование содержания калия в плазме крови. Однократная ингаляция доз беклометазона дипропионата, значительно превышающих рекомендуемые дозы, может приводить к временному угнетению функции коры надпочечников. Обычно это не требует принятия каких-то экстренных мер, поскольку в большинстве случаев (по данным определения концентрации кортизола в плазме крови) нормальная функция надпочечников восстанавливается в течение нескольких дней. У таких пациентов следует продолжать лечение в дозе, достаточной для контроля над симптомами бронхиальной астмы. При хроническом приеме чрезмерных доз беклометазона дипропионата может проявиться его системное действие: может возникнуть значимое угнетение коры надпочечников вплоть до адреналового криза. Острый адреналовый криз проявляется гипогликемией, сопровождающейся спутанностью сознания и/или судорогами. К ситуациям, которые могут служить пусковыми факторами острого адреналового криза, относятся: травма, хирургическое вмешательство, инфекция или быстрое снижение дозы входящего в состав Фостера беклометазона. При хронической передозировке беклометазона дипропионата имеется риск угнетения функции коры надпочечников (см. раздел "Особые указания"). При хронической передозировке рекомендуется проводить контроль резервной функции коры надпочечников. Лечение следует продолжать в дозе, достаточной для достижения контроля над симптомами бронхиальной астмы. Препарат Фостер содержит беклометазона дипропионат и формотерол. Эти два активных вещества препарата с разными механизмами действия проявляют аддитивные эффекты в отношении снижения частоты обострений бронхиальной астмы. Применяемый ингаляционно в рекомендуемых дозах беклометазона дипропионат оказывает характерное для глюкокортикостероидов (ГКС) противовоспалительное действие на уровне дыхательных путей и легких, уменьшает выраженность симптомов бронхиальной астмы и частоту ее обострений, но при этом имеет меньшее количество побочных эффектов, чем ГКС системного действия. Формотерол является селективным агонистом 2-адренергических рецепторов, вызывающим расслабление гладкой мускулатуры бронхов у пациентов с обратимой обструкцией дыхательных путей. Бронходилатирующее действие после ингаляции разовой дозы формотерола наступает быстро (в течение 1-3 мин) и продолжается в течение 12 ч. Бронхиальная астма:Клиническая эффективность препарата Фостер при его применении в качестве регулярной терапии. Добавление формотерола к беклометазона дипропионату уменьшает выраженность симптомов бронхиальной астмы, улучшает показатели функции внешнего дыхания (ФВД) и уменьшает частоту обострений бронхиальной астмы. В ходе клинического исследования было показано, что эффект на ФВД препарата Фостер соответствует таковому при применении комбинации монопрепаратов беклометазона дипропионата и формотерола и превышает эффект на ФВД одного беклометазона дипропионата. Клиническая эффективность препарата Фостер при его применении в качестве регулярной и облегчающей терапии (Maintenance And Reliever Therapy - MART) В клиническом исследовании, проведенном у взрослых пациентов с неконтролируемой бронхиальной астмой средней и тяжелой степени тяжести, проводилось сравнение эффективности препарата Фостер, принимаемого в качестве регулярной терапии (I ингаляция 2 раза в сутки) и по потребности для снятия симптомов астмы (в обшей сложности до 8-ми ингаляций в сутки) и эффективности препарата Фостер, принимаемого в качестве регулярной терапии (1 ингаляция 2 раза в сутки) плюс применение сальбутамола по потребности. Было показано, что препарат Фостер при его применении для регулярной терапии и для снятия симптомов астмы достоверно увеличивал время до развития первого тяжелого обострения бронхиальной астмы (определяемого, как утяжеление течения бронхиальной астмы, приводящее к госпитализации или лечению в блоке интенсивной терапии, или к необходимости приема пероральных глюкокортикостероидов в течение более чем 3-х дней), по сравнению с применением препарата Фостер в качестве регулярной терапии плюс применение сальбутамола по потребности. Частота развития тяжелого обострения бронхиальной астмы на 1 пациенто/год была значительно и статистически достоверно ниже в группе пациетов, получавших препарат Фостер в качестве регулярной терапии и для снятия симптомов астмы по сравнению с группой пациентов, принимавших препарат Фостер в качестве регулярной терапии и сальбутамол при симптомах астмы (0,1476 против 0,2239, соответственно). Пациенты в группе применения препарата Фостер в качестве регулярной терапии и для снятия симптомов астмы достигали более значимого клинического улучшения в контроле над симптомами бронхиальной астмы. В обеих группах наблюдалось одинаковое уменьшение среднего количествва ингаляций препаратов для снятия симптомов астмы в сутки и процента пациентов, принимающих препараты для снятия симптомов астмы.В другом клиническом исследовании, проведенном у пациентов с бронхиальной астмой, при применении провокации бронхоспазма метахолином было показано, что однократная доза препарата Фостер в дозе 100/6 мкг обеспечивала быстрый бронходилатирующий эффект и быстрое уменьшение одышки, подобно таковому при применении сальбутамола в дозе 200 мкг. Хроническая обструктивная болезнь легких (ХОБЛ) У пациентов с тяжелой ХОБЛ (со средними значениями ОФВ1 [объема форсированного выдоха за первую секунду], составляющими 42-43 % от его расчетной нормы), препарат Фостер в дозе 100/6 мкг 2 раза в сутки вызывал улучшение показателя ОФВ, определяемого утром перед применением очередной ингаляционной дозы, сопоставимое с улучшением такового при применении фиксированной комбинации будесонид/формотерол (400/12 мкг 2 раза в сутки), и большую эффективность по сравнению с монотерапией формотеролом (12 мкг 2 раза в сутки). При применении препарата Фостер среднее количество обострений за год, определявшихся как стойкое усиление симптомов, требующее приема пероральных ГКС и/или антибиотиков, обращения в отделение неотложной помощи или госпитализации пациента, было подобным таковому при применении фиксированной комбинации будесонида и формотерола. В отношении частоты обострений ХОБЛ препарат Фостер не имел преимущества по сравнению с монотерапией формотеролом. Особые указания Маловерояно влияние препарата Фостер на способность управлять транспотными средствами и заниматься другими потенциально опасными видами деятельности. Блокаторы -адренергических рецепторов могут ослаблять или полностью нивелировать действие формотерола. Препарат Фостер не следует применять одновременно с -адреноблокаторами (включая глазные капли), за исключением вынужденных случаев. При совместном приеме препарата Фостер и других -адренергических лекарственных препаратов возможно усиление побочного действия формотерола, поэтому следует соблюдать осторожность, когда одновременно с формотеролом применяются теофиллин или другие -адренергические препараты. Совместное применение препарата Фостер и хинидина, дизопирамида, прокаинамида, фенотиазинов, антигистаминных препаратов (терфенадина), ингибиторов моноаминооксидазы (МАО) и трициклических антидепрессантов может удлинять QTc-интервал и увеличивать риск возникновения желудочковых аритмий. Кроме того, леводопа, левотироксин, окситоцин и этанол могут снижать толерантность сердечной мышцы к 2-адреномиметикам. Совместное применение ингибиторов МАО, а также препаратов, обладающих подобными свойствами, таких как фуразолидон и прокарбазин, может вызвать повышение артериального давления. Существует повышенный риск развития аритмий у пациентов при проведении общей анестезии препаратами галогенированных углеводородов. В результате применения 2-адреномиметиков может возникать гипокалиемия, которая может усиливаться при сопутствующем лечении производными ксантина, минералокортикостероидам, глюкокортикостероидами и диуретиками (см. раздел "Особые указания"), Гипокалиемия может усиливать предрасположенность к развитию аритмий у пациентов, принимающих сердечные гликозиды. Из-за содержания в препарате Фостер небольшого количества этанола имеется теоретическая возможность взаимодействия у пациентов, принимающих дисульфирам или метронидазол, у которых имеется повышенная чувствительностью к этанолу. Условия хранения и отпуска из аптек По рецепту При температуре + 2-8°С, в защищенном от солнца месте, вдали от нагревательных приборов. Не замораживать. Хранить в недоступном для детей месте. Регистрационные данные Международное непатентованное название. Беклометазон + Формотерол Форма выпуска. Аэрозоль для ингаляций дозированный. Состав 1 доза препарата содержит: Активные вещества: беклометазона дипропионат 0,100 мг формотерола фумарат 0,006 мг Вспомогательные вещества: кислота хлористоводородная 1М 0,014 мг, этанол безводный 6,960 мг, норфлуран (1,1,1,2- тетрафторэтан) 50,92 мг. АТХ: Регистрация Лекарственное средство ЛСР-000876/09 Дата регистрации 09.02.2009. Владелец рег.удостоверения:Кьези Фармацевтичи С.п.А. Производитель:CHIESI FARMACEUTICI, S.p.A. Представительство:Кьези Фармацевтичи С.п.А. Фармгруппа: Бронходилатирующее средство - (глюкокортикостероид местный + 2-адреномиметик селективный) Информация предоставлена: Компанией ГЭОТАР -http://www.lsgeotar.ru

Модель:
RUR 577
Показания Сезонные аллергические риниты у взрослых с 18 лет. Противопоказания Противопоказания Гиперчувствительность к любому из компонентов препарата. Недавнее оперативное вмешательство или травма носа с повреждением слизистой оболочки носовой полости - до заживления раны (в связи с ингибирующим действием ГКС на процесс заживления). Детский возраст до 18 лет - в связи с отсутствием соответствующих данных. С осторожностью: Туберкулезная инфекция (активная и латентная) респираторного тракта, нелеченная грибковая, бактериальная, системная вирусная инфекция или инфекция, вызванная Herpes simplex с поражением глаз (в виде исключения возможно назначение препарата при перечисленных инфекциях по указанию врача), наличие нелеченной инфекции с вовлечением в процесс слизистой оболочки носовой полости. Беременность Соответствующим образом спланированных и хорошо контролируемых исследований препарата у беременных женщин не проводилось. Азеластина гидрохлорид способен вызывать токсичность в период внутриутробного развития у мышей, крыс и кроликов. Применение препарата при беременности и в период грудного вскармливания противопоказано. Применение и дозы Интраназально. Ингаляция суспензии, содержащейся во флаконе, осуществляется при помощи специальной дозирующей насадки на флаконе. По 1 дозе спрея (азеластина гидрохлорид - 140 мкг/мометазона фуроат - 50 мкг) в каждую ноздрю 2 раза в день утром и вечером. Продолжительность курса лечения - 2 недели. Руководство по использованию флакона с дозирующим устройством - Снять защитный колпачок: - Перед первым применением назального спрея необходимо провести его "калибровку" путем нажатия на дозирующее устройство около 10 раз. Если назальный спрей не использовался на протяжении 7 дней или дольше, необходима повторная "калибровка" путем нажатия дозирующего устройства около 2 раз, либо нажимая на крышку до тех пор, пока при нажатии не появятся брызги. Необходимо поместить указательный и средний пальцы по бокам назального адаптера, а большой палец на дно флакона и, делая вдох через нос, произвести нажатие. Нс следует протыкать назальный адаптер. При распылении не направлять в глаза. - Перед применением по возможности очистить ноздри. Зажать одну ноздрю, а концевую часть назального адаптера ввести в другую ноздрю, при этом флакон следует держать вертикально. Быстро и резко нажать на адаптер. Не следует производить распыление на носовую перегородку. - Произвести выдох через рот. - Повторить действия, описанные в пункте 3 для другой ноздри. - Протереть назальный адаптер чистой салфеткой и надеть защитный колпачок. Инструкции по очистке назального адаптера - Снять защитный колпачок: Осторожно снять назальный адаптер, потянув вверх: - Промыть назальный адаптер холодной проточной водой с двух сторон и высушить. Не следует использовать какие-либо вспомогательные предметы (например, иглы или острые предметы) для очистки адаптера во избежание его повреждения: - Промыть защитный колпачок холодной проточной водой и высушить: - Установить назальный адаптер на прежнее место. Убедиться, что стержень флакона помещен в центр назального адаптера: - Выполнить калибровку путем 2 нажатий дозирующего устройства, либо нажимая на крышку до тех пор, пока при нажатии не начнет устойчиво выходить тонкая дисперсия. Не распылять в глаза. - Надеть защитный колпачок. Побочные эффекты и передозировка Побочные эффекты: Частота развития побочных эффектов определена следующим образом: Очень часто: >: 1/10: Часто: <: 1/10 >:1/100: Нечасто: <:1/100 >:1/1000: Редко: <: 1/1000 >: 1/10000: Очень редко: <: 1/10000. Нарушения со стороны нервной системы: Часто: головная боль, дисгевзия (неприятный вкус) как следствие неправильного применения, а именно, при чрезмерном отклонении головы назад во время введения. Очень редко: головокружение (может быть вызвано самим заболеванием). Нарушения со стороны желудочно-кишечного тракта: Редко: ощущение раздражения слизистой оболочки глотки, тошнота. Нарушения со стороны дыхательной системы, органов грудной клетки и средостения: Часто: носовые кровотечения, дискомфорт в полости носа (чувство жжения, зуд), изъязвление слизистой оболочки носа, чихание, фарингит, синусит, инфекции верхних дыхательных путей. Нарушения со стороны иммунной системы: Очень редко: гиперчувствительность, анафилактоидные реакции. Нарушения со стороны кожи и подкожных тканей: Очень редко: сыпь, кожный зуд, крапивница. Общие расстройство и нарушения в месте введения: Очень редко: утомляемость, сонливость, слабость (может быть вызвано самим заболеванием). При длительном использовании глюкокортикостероидов (ГКС) в высоких дозах возможно развитие системных побочных эффектов, в том числе глаукомы и катаракты. Передозировка: В настоящий момент о случаях передозировки препарата при интраназальном применении неизвестно. В случае передозировки азеластином в результате случайного приема внутрь, возможно появление нарушений со стороны нервной системы (сонливость, спутанность сознания, тахикардия, гипотензия). Терапия этих нарушений носит симптоматический характер. При длительном применении глюкокортикостероидов в высоких дозах, а также при одновременном использовании нескольких ГКС возможно угнетение гипоталамо-гипофизарно-надпочечниковой системы. Вследствие малой системной биодоступности препарата маловероятно, что при случайной или намеренной передозировке потребуется принятие каких-либо мер помимо наблюдения с возможным последующим возобновлением приема препарата в рекомендованной дозе. Взаимодействие с другими ЛС: Азеластин. При интраназальном применении азеластина не выявлено клинически значимого взаимодействия с другими лекарственными средствами. Мометазона фуроат. Комбинированная терапия с лоратадином хорошо переносилась пациентами. При этом не было отмечено какого-либо влияния препарата на концентрацию лоратадина или его основного метаболита в плазме крови. В этих исследованиях мометазона фуроат в плазме крови обнаружен не был (при чувствительности метода определения 50 пг/мл). Фармакологическое действие и фармакокинетика Азеластин, производное фталазинона, является противоаллергическим средством длительного действия. Азеластин является селективным Н1-гистаминоблокатором, оказывает антигистаминное, противоаллергическое и мембраностабилизирующее действие, снижает проницаемость капилляров и экссудацию, стабилизирует мембраны тучных клеток и препятствует высвобождению из них биологически активных веществ (гистамин, серотонин, лейкотриены, фактор, активирующий тромбоциты и др.), вызывающих бронхоспазм и способствующих развитию ранней и поздней стадии аллергических реакций и воспаления. Мометазон является синтетическим глюкокортикостероидом (ГКС) для местного применения. Оказывает противовоспалительное и противоаллергическое действие при применении в дозах, при которых не возникает системных эффектов. Тормозит высвобождение медиаторов воспаления. Повышает продукцию липомодулина, являющегося ингибитором фосфолипазы А, что обусловливает снижение высвобождения арахидоновой кислоты и, соответственно, угнетение синтеза продуктов метаболизма арахидоновой кислоты - циклических эндоперекисей, простагландинов. Предупреждает краевое скопление нейтрофилов, что уменьшает воспалительный экссудат и продукцию лимфокинов, тормозит миграцию макрофагов, приводит к уменьшению процессов инфильтрации и грануляции. Уменьшает воспаление за счет снижения образования субстанции хемотаксиса (влияние на "поздние" реакции аллергии), тормозит развитие аллергической реакции немедленного типа (обусловлено торможением продукции метаболитов арахидоновой кислоты и снижением высвобождения из тучных клеток медиаторов воспаления). Фармакокинетика: Азеластина гидрохлорид. Биодоступность после интраназального применения составляет около 40 %. Максимальная концентрация (Сmах) в плазме крови после интраназального применения достигается через 2-3 часа. При применении интраназально в суточной дозе 0,56 мг азеластина гидрохлорида средняя равновесная концентрация азеластина гидрохлорида в плазме через 2 часа после приема составляет 0,65 нг/мл. Удвоение общей суточной дозы до 1,12 мг приводит к устойчивой средней концентрации азеластина в плазме, равной 1,09 нг/мл. Однако, несмотря на относительно высокое всасывание у пациентов, системное воздействие после интраназального применения приблизительно в 8 раз ниже, чем после перорального приема суточной дозы 4,4 мг азеластина гидрохлорида, являющейся терапевтической пероральной дозой для лечения аллергического ринита. Интраназальное применение у пациентов с аллергическим ринитом вызывает повышение уровня азеластина в плазме крови по сравнению со здоровыми субъектами. Другие фармакокинетические данные изучены при применении внутрь. Связь с белками крови 80 - 90%. Метаболизируется в печени путем окисления с участием системы цитохрома Р450 с образованием активного метаболита дезметилазеластина. Выводится в основном почками в виде неактивных метаболитов. Период полувыведения (Т1/2) азеластина - около 20 ч, его активного метаболита дезметилазеластина - около 45 ч. Мометазона фуроат. При интраназальном применении системная биодоступность мометазона фуроата составляет <: 1% (при чувствительности метода определения 0,25 пг/мл). Суспензия мометазона очень плохо всасывается в желудочно-кишечном тракте, и то небольшое количество суспензии мометазона, которое может попасть в желудочно-кишечный тракт после носовой ингаляции, еще до экскреции с мочой или желчью подвергается активному первичному метаболизму. Особые указания Как и при всяком долгосрочном лечении, пациенты, пользующиеся назальным спреем Момат Рино Адванс в течение нескольких месяцев и дольше, должны периодически проходить осмотр у врача на предмет возможных изменений слизистой оболочки носа, перфорации носовой перегородки (очень редко) и возможного развития системных побочных эффектов. В случае развития местной грибковой инфекции носа или глотки может потребоваться прекращение терапии назальным спреем Момат Рино Адванс и проведение специального лечения. В случае развития стойкого раздражения носоглотки необходимо решить вопрос о прекращении терапии. Пациенты, которые переходят к лечению назальным спреем Момат Рино Адванс после длительной терапии глюкокортикостероидами системного действия, требуют к себе особого внимания. Отмена глюкокортикостероидов системного действия у таких пациентов может привести к недостаточной функции надпочечников, последующее восстановление которой может занять до нескольких месяцев. В случае появления признаков надпочечниковой недостаточности следует возобновить прием системных глюкокортикостероидов и принять другие необходимые меры. Во время перехода от лечения глюкокортикостероидами системного действия к лечению назальным спреем Момат Рино Адванс у некоторых пациентов могут возникнуть начальные симптомы отмены системных глюкокортикостероидов (например, боли в суставах и/или мышцах, чувство усталости и депрессия), несмотря на уменьшение выраженности симптомов, связанных с поражением слизистой оболочки носа: таких больных необходимо специально убеждать в целесообразности продолжения лечения назальным спреем Момат Рино Адванс. Переход от системных к местным глюкокортикостероидам может, также, выявить уже существовавшие, но маскировавшиеся терапией глюкокортикостероидами системного действия, аллергические заболевания, такие как аллергический конъюнктивит и экзема. При использовании интраназальных стероидов в дозах, превышающих рекомендованные, или у чувствительных пациентов в рекомендованных дозах, могут развиться системные эффекты глюкокортикостероидов и подавление надпочечников. При появлении таких изменений применение назального спрея Момат Рино Адванс должно быть постепенно прекращено, в соответствии с принятыми для прекращения приёма пероральных глюкокортикостероидов процедурами. Пациенты, которым проводится лечение глюкокортикостероидами, обладают потенциально сниженной иммунной реактивностью и должны быть предупреждены о повышенном для них риске заражения в случае контакта с больными некоторыми инфекционными заболеваниями (например, ветряной оспой, корью), а также о необходимости врачебной консультации, если такой контакт произошел. При появлении признаков выраженной бактериальной инфекции (например, лихорадки, упорной и резкой боли с одной стороны лица или зубной боли, припухлости в орбитальной или периорбитальной области) требуется немедленная врачебная консультация. Глюкокортикостероиды для назального и ингаляционного применения способны вызвать развитие глаукомы и/или катаракты. Поэтому, следует проводить тщательное наблюдение за пациентами с изменениями зрения, а также за пациентами, у которых ранее отмечалось повышенное внутриглазное давление, глаукома и/или катаракта. Влияние на способность управлять транспортными средствами: В редких случаях утомление, усталость, головокружение и слабость, которые могут быть следствием самого заболевания, могут развиваться при использовании назального спрея Момат Рино Адванс. В таких случаях следует избегать управления транспортным средством и работы со сложными механизмами. Условия хранения и отпуска из аптек Условия хранения:В защищенном от света месте при температуре от 15 до 25 °С. Не замораживать. Хранить в недоступном для детей месте. Отпуск из аптек: По рецепту Регистрационные данные Торговое название Момат Рино Адванс Международное непатентованное название. Форма выпуска:спрей назальный дозированный. Состав:1 доза спрея содержит: Действующие вещества: азеластина гидрохлорид - 140 мкг, мометазона фуроат - 50 мкг. Вспомогательные вещества: целлюлоза микрокристаллическая (Авицел RC-591) - 0,910 мг, кармеллоза натрия - 0,021 мг, декстроза - 3,500 мг, полисорбат-80 - 0,0175 мг, бензалкония хлорид - 0,014 мг, динатрия эдетат- 0,035 мг, неотам - 0,0007 мг, лимонной кислоты моногидрат - 0,0105 мг, натрия цитрат - 0,021 мг, вода очищенная - до 70 мг. АТХ:R.01.A Регистрация: Лекарственное средство ЛП-003328 Фармгруппа: Противоаллергическое средство - Н1-гистаминовых рецепторов блокатор + глюкокортикостероид для местного применения. Дата регистрации: 23.11.2015. Окончание регстрации: . Описание:Белая или почти белая суспензия. Упаковка:Спрей назальный дозированный, 140 мкг + 50 мкг/доза. По 150 доз во флакон из ПЭВП, снабженный дозирующим устройством и назальным адаптером с защитным колпачком. Флакон с инструкцией по применению помещают в картонную пачку. Срок годности:2 года. Не использовать препарат по истечении срока годности. Владелец рег.удостоверения:Гленмарк Фармасьютикалз Лтд Производитель:GLENMARK PHARMACEUTICALS, Ltd. Представительство:ГЛЕНМАРК ИМПЭКС ООО
Модель:
RUR 798
Показания Эссенциальная гипертензия I - II степени тяжести. Противопоказания Противопоказания - Повышенная чувствительность к лерканидипину, другим производным дигидропиридинового ряда или любому компоненту препарата: - нелеченная сердечная недостаточность: - нестабильная стенокардия: - обструкция сосудов, исходящих из левого желудочка сердца: - период в течение 1 месяца после перенесенного инфаркта миокарда: - тяжелая печеночная недостаточность: - тяжелая почечная недостаточность (КК менее 30 мл/мин): - непереносимость лактозы, дефицит лактазы, синдром глюкозо-галактозной мальабсорбции: - беременность и период грудного вскармливания: - применение у женщин детородного возраста, не пользующихся надежными методами контрацепции: - возраст до 18 лет (эффективность и безопасность не изучены): - одновременное применение с препаратами-ингибиторы CYP3A4 (кетоконазол, итраконазол, эритромицин, ритонавир, тролеандомицин): циклоспорин: - одновременный прием препарата Леркамен 20 с соком грейпфрута. С осторожностью: Почечная недостаточность (КК более 30 мл/мин) и/или печеночная недостаточность легкой и средней степени тяжести, пожилой возраст, синдром слабости синусового узла (без кардиостимулятора), ишемическая болезнь сердца, дисфункция левого желудочка сердца. Беременность Применение препарата Леркамен 20 во время беременности и в период грудного вскармливания, а также у женщин детородного возраста при отсутствии надежной контрацепции противопоказано. В ходе доклинических исследований не выявлено тератогенного эффекта лерканидипина у крыс и кроликов, репродуктивная функция крыс была без изменений. В виду отсутствия клинического опыта применения лерканидипина во время беременности и в период грудного вскармливания и поскольку известно, что другие производные дигидропиридина оказывали тератогенное действие у животных, лерканидипин не рекомендуется применять при беременности и у женщин детородного возраста, непользующихся надежными методами контрацепции. Вследствие высокой липофильности лерканидипина, можно предполагать его проникновение в грудное молоко, поэтому препарат не рекомендуется применять в период кормления грудью. Применение и дозы По 10 мг (1/2 таблетки препарата Леркамен 20) внутрь 1 раз в сутки не менее чем за 15 минут до еды, предпочтительно утром, не разжевывая, запивая достаточным количеством воды. В зависимости от индивидуальной переносимости препарата пациентом, доза может быть увеличена до 20 мг (1 таблетка препарата Леркамен 20). Терапевтическая доза подбирается постепенно, так как максимальное антигипертензивное действие развивается приблизительно через 2 недели после начала приема препарата. Маловероятно, что эффективность препарата будет возрастать с повышением дозы более 20 мг/сут, в тоже время повышается риск возникновения побочных эффектов. Применение у пожилых пациентов Фармакокинетический профиль и данные клинических исследований показывают, что у пожилых пациентов коррекции дозы препарата Леркамен 20 не требуется. Однако следует соблюдать осторожность на начальном этапе лечения препаратом Леркамен 20 у данной группы пациентов. Применение у пациентов с нарушениями функции почек или печени При применении препарата Леркамен 20 у пациентов с почечной и печеночной недостаточностью легкой и средней степени тяжести следует соблюдать осторожность. При наличии почечной недостаточности (КК более 30 мл/мин) или печеночной недостаточности легкой или средней степени тяжести, начальная доза составляет 10 мг, затем с осторожностью увеличивают дозу до 20 мг в сутки. Антигипертензивный эффект может усиливаться у пациентов с печеночной недостаточностью легкой или средней степени тяжести и может потребоваться коррекция (снижение) дозы. При почечной недостаточности (КК менее 30 мл/мин) и печеночной недостаточности тяжелой степени тяжести применение препарата Леркамен 20 противопоказано (см. раздел "Противопоказания"). Побочные эффекты и передозировка Побочные эффекты: Возможные побочные эффекты приведены ниже по нисходящей частоте возникновения: часто (<: 1/10, 1/100), нечасто (<:1/100, 1/1000), редко (<:1/1000, 1/10000), очень редко (<:1/10000), включая отдельные сообщения. Нарушения со стороны нервной системы Нечасто: головная боль, головокружение: Редко: сонливость. Нарушения со стороны сердечнососудистой системы Нечасто: ощущение сердцебиения, тахикардия, "приливы" крови к коже лица: Редко: стенокардия, боль за грудиной: Очень редко: обморок, у пациентов со стенокардией возможно увеличение частоты, продолжительности и тяжести приступов. Нарушения со стороны желудочно-кишечного тракта Редко: тошнота, диспепсия, диарея, эпигастральная боль, рвота. Нарушения со стороны кожи и подкожных тканей Редко: кожная сыпь. Нарушения со стороны скелетно-мышечной и соединительной ткани Редко: миалгия. Нарушения со стороны почек и мочевыводящих путей Редко: полиурия. Нарушения общего характера Нечасто: периферические отеки: Редко: астения, повышенная утомляемость. Нарушения со стороны иммунной системы Очень редко: реакции повышенной чувствительности. Имеются сообщения о следующих побочных очень редких (<:1/10000) явлениях: инфаркт миокарда, гиперплазия десен, обратимое повышение активности "печеночных" трансаминаз, выраженное снижение АД поллакиурия (увеличение частоты мочеиспускания), боль в грудной клетке. Передозировка: Предположительно, в случае передозировки лерканидипина будут наблюдаться симптомы, сходные с таковыми при передозировке других производных дигидропиридина (периферическая вазодилатация с выраженным снижением АД и рефлекторной тахикардией). Лечение симптоматическое: в случае выраженного снижения АД, потери сознания показана сердечно-сосудистая терапия, при брадикардии внутривенное введение атропина. Имеются данные о 3-х случаях передозировки при приеме лерканидипина в дозах 150 мг, 280 мг и 800 мг с целью суицида. В случае приема 150 мг лерканидипина + алкоголь (неустановленное количество) наблюдалась сонливость. Лечение: промывание желудка, прием активированного угля. В случае приема 280 мг лерканидипина + 5,6 мг моксонидина наблюдались следующие симптомы: кардиогенный шок, выраженная ишемия миокарда, почечная недостаточность легкой степени. Лечение: сердечные гликозиды, диуретики (фуросемид), высокие дозы катехоламинов, плазмозаменители. В случае приема 800 мг лерканидипина наблюдались тошнота и выраженное снижение АД. Лечение: прием активированного угля и слабительного средства, внутривенно - допамин. Во всех случаях передозировки все пациенты остались живы. Информация по эффективности диализа для лерканидипина отсутствует. Наиболее вероятно, что из-за высокой связи лерканидипина с белками плазмы крови, диализ может быть неэффективным. Взаимодействие с другими ЛС: Лерканидипин можно одновременно применять с β-адреноблокаторами, диуретиками, ингибиторами ангиотензинпревращающего фермента (ИАПФ). При одновременном применении с метопрололом, биодоступность лерканидипина уменьшается на 50 %. Этот эффект может встречаться и при одновременном применении с другими β-адреноблокаторами, поэтому может потребоваться коррекция дозы лерканидипина для достижения терапевтического эффекта при данной комбинации. Лерканидипин метаболизируется при участии изофермента CYP3A4, поэтому ингибиторы и индукторы этого изофермента, при одновременном применении, могут влиять на метаболизм и выведение лерканидипина. Не рекомендуется одновременное применение лерканидипина с ингибиторами CYP3A4 (кетоконазол, итраконазол, ритонавир, эритромицин, тролеандомицин) (см. раздел "Противопоказания"). Не рекомендуется одновременное применение циклоспорина и лерканидипина, так как наблюдается увеличение концентрации обоих веществ в плазме крови (см. раздел "Противопоказания"). Следует проявлять осторожность при одновременном применении лерканидипина с другими субстратами CYP3A4 (терфенадин, астемизол, антиаритмические препараты III класса, например, амиодарон, квинидин). При одновременном применении лерканидипина в дозе 20 мг с мидазоламом биодоступность лерканидипина у пожилых пациентов может увеличиваться приблизительно на 40 %. Лерканидипин следует назначать с осторожностью одновременно с индукторами CYP3A4, например, противосудорожные средства (фенитоин, карбамазепин) и рифампицин, поскольку возможно снижение антигипертензивного действия препарата. Необходим регулярный контроль АД. При одновременном применении лерканидипина в дозе 20 мг у пациентов, постоянно принимающих бета-метилдигоксин, не было отмечено фармакокинетического взаимодействия, в то время как у здоровых добровольцев, которых лечили дигоксином, отмечалось увеличение значения Сmax (максимальная концентрация в плазме крови) для дигоксина в среднем на 33 % после приема 20 мг лерканидипина натощак, при этом AUC (площадь под кривой - "концентрация - время") и почечный клиренс изменялись незначительно. Необходимо контролировать наличие признаков интоксикации дигоксином у пациентов, принимающих одновременно дигоксин и лерканидипин. Одновременное применение лерканидипина с циметидином (до 800 мг) не вызывает значительных изменений концентрации лерканидипина в плазме крови. При высоких дозах циметидина могут увеличиваться биодоступность и антигипертензивное действие лерканидипина. При одновременном применении лерканидипина (20 мг) и симвастатина (40 мг), значение AUC для симвастатина увеличивалось на 56 %, а это же значение для его активного метаболита - β-гидроксикислоты - на 28 %. При приеме препаратов в разное время суток (лерканидипин - утром, симвастатин - вечером) можно избежать нежелательного взаимодействия. При одновременном применении 20 мг лерканидипина и варфарина у здоровых добровольцев изменений фармакокинетики варфарина не наблюдалось. Одновременное применение с флуоксетином (ингибитором CYP2D6 и CYP3A4) у пациентов пожилого возраста не оказало клинически значимых изменений фармакокинетики лерканидипина. Возможно усиление антигипертензивного действия при одновременном при одновременном приеме сока грейпфрута и лерканидипина (см. раздел "Противопоказания"). Этанол может потенцировать антигипертензивное действие лерканидипина. Фармакологическое действие и фармакокинетика Лерканидипин является селективным блокатором "медленных" кальциевых каналов, производное дигидропиридина, ингибирует трансмембранный ток ионов кальция в клетки гладкой мускулатуры сосудов. Механизм антигипертензивного действия лерканидипина обусловлен прямым релаксирующим действием на гладко-мышечные клетки сосудов, в результате чего снижается общее периферическое сопротивление. Несмотря на относительно короткий период полувыведения из плазмы крови, лерканидипин оказывает пролонгированное антигипертензивное действие вследствие высокого коэффициента мембранного распределения. Благодаря высокой сосудистой селективности не оказывает отрицательного инотропного действия. Острая артериальная гипотензия с рефлекторной тахикардией возникает редко благодаря постепенному развитию вазодилатации при приеме лерканидипина. Лерканидипин представляет собой рацемическую смесь (+)-R- и (-)S- энантиомеров. Антигипертензивный эффект лерканидипина, прежде всего обусловлен S-энантиомером. Фармакокинетика: Лерканидипин полностью всасывается после приема внутрь. Максимальная концентрация в плазме крови (Сmах) достигается через 1,5-3 часа и составляет 3,3 ± 2,09 нг/мл и 7,66 ± 5,90 нг/мл после приема 10 и 20 мг лерканидипина, соответственно. (+)-R- и (-)S- энантиомеры лерканидипина демонстрируют сходный фармакокинетический профиль: имеют одинаковое время достижения максимальной концентрации (ТСmах), одинаковый период полувыведения (T1/2): значения Сmах и площади под кривой - "концентрация-время" (AUC) в 1,2 раза выше для (-)-S энантиомера. Взаимопревращения энантиомеров в опытах in vivo не наблюдали. При "первичном прохождении" через печень, абсолютная биодоступность лерканидипина при приеме внутрь после еды составляет приблизительно 10 %, при приеме натощак значение биодоступности уменьшается на 1/3. При приеме лерканидипина не позднее 2 часов после приема жирной пищи его биодоступность увеличивается в 4 раза, поэтому препарат Леркамен 20 не следует принимать после еды. При пероральном применении лерканидипина его концентрация в плазме крови не является прямо пропорциональной к принятой дозе (нелинейная кинетика). Насыщение пресистемного метаболизма, происходит постепенно. Таким образом, биодоступность увеличивается с повышением дозы. Распределение из плазмы крови в ткани и органы происходит быстро и обширно. Связь с белками плазмы крови превышает 98 %. У пациентов с тяжелой почечной и/или печеночной недостаточностью, из-за снижения концентрации белка в плазме крови, свободная фракция лерканидипина может увеличиваться. Лерканидипин метаболизируется с участием изофермента CYP3A4 с образованием неактивных метаболитов. Около 50 % принятой дозы выводится почками (около 50 % выводится кишечником). Элиминация происходит в основном путем биотрансформации. Среднее значение T1/2 составляет 8-10 часов. Длительность терапевтического действия - 24 часа. Кумуляции лерканидипина при повторном приеме внутрь не наблюдается. Было показано, что фармакокинетика лерканидипина, у пожилых пациентов, пациентов с почечной недостаточностью (клиренс креатинина (КК) более 30 мл/мин) и у пациентов с печеночной недостаточностью легкой и средней степени тяжести схожа с фармакокинетикой, которая наблюдается в общей популяции пациентов. У пациентов с почечной недостаточностью (КК менее 30 мл/мин) и у пациентов, находящихся на гемодиализе, концентрации лерканидипина в плазме крови были более высокими (приблизительно 70 %). У пациентов с печеночной недостаточностью средней и тяжелой степени тяжести, системная биодоступность лерканидипина, вероятно, увеличивается, поскольку лерканидипин метаболизируется главным образом в печени. Особые указания Влияние на способность управлять транспортными средствами: Поскольку на фоне терапии препаратом Леркамен 20 возможно появление головокружения, астении, повышенной утомляемости и, в редких случаях сонливости, в период применения препарата пациентам следует с особой осторожностью управлять автотранспортом и заниматься другими потенциально опасными видами деятельности, требующими высокой скорости психомоторных реакций. Условия хранения и отпуска из аптек Условия хранения:При температуре не выше 30 °С. Хранить в недоступном для детей месте. Отпуск из аптек: По рецепту Регистрационные данные Торговое название Леркамен 20 Международное непатентованное название:Лерканидипин. Форма выпуска:таблетки покрытые пленочной оболочкой. Состав:Состав на одну таблетку: Ядро: Действующее вещество: лерканидипина гидрохлорид - 20,0 мг. Вспомогательные вещества: лактозы моногидрат - 60,0 мг, целлюлоза микрокристаллическая - 78,0 мг, карбоксиметилкрахмал натрия (тип А) - 31,0 мг, повидон (значение К=30) - 9,0 мг, магния стеарат - 2,0 мг. Оболочка Opadry 02F25077 - 6,0 мг, состоящая из: гипромеллозы - 3,825 мг, талька - 0,300 мг, титана диоксида -1,200 мг, макрогола 6000 - 0,600 мг, железа оксида (III) - 0,075 мг. АТХ: Регистрация: Лекарственное средство ЛСР-006976/08 Фармгруппа: Селективные блокаторы кальциевых каналов с преимущественным влиянием на сосуды. Дата регистрации: 01.09.2008 / 06.12.2017. Окончание регстрации: . Описание:Круглые двояковыпуклые таблетки, покрытые пленочной оболочкой, красновато-розового цвета с риской на одной стороне. Вид на изломе: светло-желтого цвета. Упаковка:Таблетки, покрытые пленочной оболочкой 20 мг. По 7, 10 или 14 таблеток в блистер [непрозрачная ПВХ-пленка / фольга алюминиевая]. По 1 (по 7 или 14 таблеток), 2 (по 14 таблеток), 3 (по 14 таблеток), 4 (по 14 таблеток), 5 (по 7 или 10 таблеток), 6 (по 10 таблеток), 7 (по 14 таблеток), 9 (по 10 таблеток) или 10 (по 10 таблеток) блистеров вместе с инструкцией по применению помещают в картонную пачку. Срок годности:3 года. Не применять по истечении срока годности. Владелец рег.удостоверения:Берлин-Хеми/А. Менарини, ООО Производитель:BERLIN-CHEMIE, AG. Представительство:БЕРЛИН-ХЕМИ/МЕНАРИНИ ФАРМА ГмбХ. Информация предоставлена: Компанией ГЭОТАР - http://www.lsgeotar.ru/

Модель:
RUR 418
Показания Сезонные аллергические риниты у взрослых с 18 лет. Противопоказания Противопоказания Гиперчувствительность к любому из компонентов препарата. Недавнее оперативное вмешательство или травма носа с повреждением слизистой оболочки носовой полости - до заживления раны (в связи с ингибирующим действием ГКС на процесс заживления). Детский возраст до 18 лет - в связи с отсутствием соответствующих данных. С осторожностью: Туберкулезная инфекция (активная и латентная) респираторного тракта, нелеченная грибковая, бактериальная, системная вирусная инфекция или инфекция, вызванная Herpes simplex с поражением глаз (в виде исключения возможно назначение препарата при перечисленных инфекциях по указанию врача), наличие нелеченной инфекции с вовлечением в процесс слизистой оболочки носовой полости. Беременность Соответствующим образом спланированных и хорошо контролируемых исследований препарата у беременных женщин не проводилось. Азеластина гидрохлорид способен вызывать токсичность в период внутриутробного развития у мышей, крыс и кроликов. Применение препарата при беременности и в период грудного вскармливания противопоказано. Применение и дозы Интраназально. Ингаляция суспензии, содержащейся во флаконе, осуществляется при помощи специальной дозирующей насадки на флаконе. По 1 дозе спрея (азеластина гидрохлорид - 140 мкг/мометазона фуроат - 50 мкг) в каждую ноздрю 2 раза в день утром и вечером. Продолжительность курса лечения - 2 недели. Руководство по использованию флакона с дозирующим устройством - Снять защитный колпачок: - Перед первым применением назального спрея необходимо провести его "калибровку" путем нажатия на дозирующее устройство около 10 раз. Если назальный спрей не использовался на протяжении 7 дней или дольше, необходима повторная "калибровка" путем нажатия дозирующего устройства около 2 раз, либо нажимая на крышку до тех пор, пока при нажатии не появятся брызги. Необходимо поместить указательный и средний пальцы по бокам назального адаптера, а большой палец на дно флакона и, делая вдох через нос, произвести нажатие. Нс следует протыкать назальный адаптер. При распылении не направлять в глаза. - Перед применением по возможности очистить ноздри. Зажать одну ноздрю, а концевую часть назального адаптера ввести в другую ноздрю, при этом флакон следует держать вертикально. Быстро и резко нажать на адаптер. Не следует производить распыление на носовую перегородку. - Произвести выдох через рот. - Повторить действия, описанные в пункте 3 для другой ноздри. - Протереть назальный адаптер чистой салфеткой и надеть защитный колпачок. Инструкции по очистке назального адаптера - Снять защитный колпачок: Осторожно снять назальный адаптер, потянув вверх: - Промыть назальный адаптер холодной проточной водой с двух сторон и высушить. Не следует использовать какие-либо вспомогательные предметы (например, иглы или острые предметы) для очистки адаптера во избежание его повреждения: - Промыть защитный колпачок холодной проточной водой и высушить: - Установить назальный адаптер на прежнее место. Убедиться, что стержень флакона помещен в центр назального адаптера: - Выполнить калибровку путем 2 нажатий дозирующего устройства, либо нажимая на крышку до тех пор, пока при нажатии не начнет устойчиво выходить тонкая дисперсия. Не распылять в глаза. - Надеть защитный колпачок. Побочные эффекты и передозировка Побочные эффекты: Частота развития побочных эффектов определена следующим образом: Очень часто: >: 1/10: Часто: <: 1/10 >:1/100: Нечасто: <:1/100 >:1/1000: Редко: <: 1/1000 >: 1/10000: Очень редко: <: 1/10000. Нарушения со стороны нервной системы: Часто: головная боль, дисгевзия (неприятный вкус) как следствие неправильного применения, а именно, при чрезмерном отклонении головы назад во время введения. Очень редко: головокружение (может быть вызвано самим заболеванием). Нарушения со стороны желудочно-кишечного тракта: Редко: ощущение раздражения слизистой оболочки глотки, тошнота. Нарушения со стороны дыхательной системы, органов грудной клетки и средостения: Часто: носовые кровотечения, дискомфорт в полости носа (чувство жжения, зуд), изъязвление слизистой оболочки носа, чихание, фарингит, синусит, инфекции верхних дыхательных путей. Нарушения со стороны иммунной системы: Очень редко: гиперчувствительность, анафилактоидные реакции. Нарушения со стороны кожи и подкожных тканей: Очень редко: сыпь, кожный зуд, крапивница. Общие расстройство и нарушения в месте введения: Очень редко: утомляемость, сонливость, слабость (может быть вызвано самим заболеванием). При длительном использовании глюкокортикостероидов (ГКС) в высоких дозах возможно развитие системных побочных эффектов, в том числе глаукомы и катаракты. Передозировка: В настоящий момент о случаях передозировки препарата при интраназальном применении неизвестно. В случае передозировки азеластином в результате случайного приема внутрь, возможно появление нарушений со стороны нервной системы (сонливость, спутанность сознания, тахикардия, гипотензия). Терапия этих нарушений носит симптоматический характер. При длительном применении глюкокортикостероидов в высоких дозах, а также при одновременном использовании нескольких ГКС возможно угнетение гипоталамо-гипофизарно-надпочечниковой системы. Вследствие малой системной биодоступности препарата маловероятно, что при случайной или намеренной передозировке потребуется принятие каких-либо мер помимо наблюдения с возможным последующим возобновлением приема препарата в рекомендованной дозе. Взаимодействие с другими ЛС: Азеластин. При интраназальном применении азеластина не выявлено клинически значимого взаимодействия с другими лекарственными средствами. Мометазона фуроат. Комбинированная терапия с лоратадином хорошо переносилась пациентами. При этом не было отмечено какого-либо влияния препарата на концентрацию лоратадина или его основного метаболита в плазме крови. В этих исследованиях мометазона фуроат в плазме крови обнаружен не был (при чувствительности метода определения 50 пг/мл). Фармакологическое действие и фармакокинетика Азеластин, производное фталазинона, является противоаллергическим средством длительного действия. Азеластин является селективным Н1-гистаминоблокатором, оказывает антигистаминное, противоаллергическое и мембраностабилизирующее действие, снижает проницаемость капилляров и экссудацию, стабилизирует мембраны тучных клеток и препятствует высвобождению из них биологически активных веществ (гистамин, серотонин, лейкотриены, фактор, активирующий тромбоциты и др.), вызывающих бронхоспазм и способствующих развитию ранней и поздней стадии аллергических реакций и воспаления. Мометазон является синтетическим глюкокортикостероидом (ГКС) для местного применения. Оказывает противовоспалительное и противоаллергическое действие при применении в дозах, при которых не возникает системных эффектов. Тормозит высвобождение медиаторов воспаления. Повышает продукцию липомодулина, являющегося ингибитором фосфолипазы А, что обусловливает снижение высвобождения арахидоновой кислоты и, соответственно, угнетение синтеза продуктов метаболизма арахидоновой кислоты - циклических эндоперекисей, простагландинов. Предупреждает краевое скопление нейтрофилов, что уменьшает воспалительный экссудат и продукцию лимфокинов, тормозит миграцию макрофагов, приводит к уменьшению процессов инфильтрации и грануляции. Уменьшает воспаление за счет снижения образования субстанции хемотаксиса (влияние на "поздние" реакции аллергии), тормозит развитие аллергической реакции немедленного типа (обусловлено торможением продукции метаболитов арахидоновой кислоты и снижением высвобождения из тучных клеток медиаторов воспаления). Фармакокинетика: Азеластина гидрохлорид. Биодоступность после интраназального применения составляет около 40 %. Максимальная концентрация (Сmах) в плазме крови после интраназального применения достигается через 2-3 часа. При применении интраназально в суточной дозе 0,56 мг азеластина гидрохлорида средняя равновесная концентрация азеластина гидрохлорида в плазме через 2 часа после приема составляет 0,65 нг/мл. Удвоение общей суточной дозы до 1,12 мг приводит к устойчивой средней концентрации азеластина в плазме, равной 1,09 нг/мл. Однако, несмотря на относительно высокое всасывание у пациентов, системное воздействие после интраназального применения приблизительно в 8 раз ниже, чем после перорального приема суточной дозы 4,4 мг азеластина гидрохлорида, являющейся терапевтической пероральной дозой для лечения аллергического ринита. Интраназальное применение у пациентов с аллергическим ринитом вызывает повышение уровня азеластина в плазме крови по сравнению со здоровыми субъектами. Другие фармакокинетические данные изучены при применении внутрь. Связь с белками крови 80 - 90%. Метаболизируется в печени путем окисления с участием системы цитохрома Р450 с образованием активного метаболита дезметилазеластина. Выводится в основном почками в виде неактивных метаболитов. Период полувыведения (Т1/2) азеластина - около 20 ч, его активного метаболита дезметилазеластина - около 45 ч. Мометазона фуроат. При интраназальном применении системная биодоступность мометазона фуроата составляет <: 1% (при чувствительности метода определения 0,25 пг/мл). Суспензия мометазона очень плохо всасывается в желудочно-кишечном тракте, и то небольшое количество суспензии мометазона, которое может попасть в желудочно-кишечный тракт после носовой ингаляции, еще до экскреции с мочой или желчью подвергается активному первичному метаболизму. Особые указания Как и при всяком долгосрочном лечении, пациенты, пользующиеся назальным спреем Момат Рино Адванс в течение нескольких месяцев и дольше, должны периодически проходить осмотр у врача на предмет возможных изменений слизистой оболочки носа, перфорации носовой перегородки (очень редко) и возможного развития системных побочных эффектов. В случае развития местной грибковой инфекции носа или глотки может потребоваться прекращение терапии назальным спреем Момат Рино Адванс и проведение специального лечения. В случае развития стойкого раздражения носоглотки необходимо решить вопрос о прекращении терапии. Пациенты, которые переходят к лечению назальным спреем Момат Рино Адванс после длительной терапии глюкокортикостероидами системного действия, требуют к себе особого внимания. Отмена глюкокортикостероидов системного действия у таких пациентов может привести к недостаточной функции надпочечников, последующее восстановление которой может занять до нескольких месяцев. В случае появления признаков надпочечниковой недостаточности следует возобновить прием системных глюкокортикостероидов и принять другие необходимые меры. Во время перехода от лечения глюкокортикостероидами системного действия к лечению назальным спреем Момат Рино Адванс у некоторых пациентов могут возникнуть начальные симптомы отмены системных глюкокортикостероидов (например, боли в суставах и/или мышцах, чувство усталости и депрессия), несмотря на уменьшение выраженности симптомов, связанных с поражением слизистой оболочки носа: таких больных необходимо специально убеждать в целесообразности продолжения лечения назальным спреем Момат Рино Адванс. Переход от системных к местным глюкокортикостероидам может, также, выявить уже существовавшие, но маскировавшиеся терапией глюкокортикостероидами системного действия, аллергические заболевания, такие как аллергический конъюнктивит и экзема. При использовании интраназальных стероидов в дозах, превышающих рекомендованные, или у чувствительных пациентов в рекомендованных дозах, могут развиться системные эффекты глюкокортикостероидов и подавление надпочечников. При появлении таких изменений применение назального спрея Момат Рино Адванс должно быть постепенно прекращено, в соответствии с принятыми для прекращения приёма пероральных глюкокортикостероидов процедурами. Пациенты, которым проводится лечение глюкокортикостероидами, обладают потенциально сниженной иммунной реактивностью и должны быть предупреждены о повышенном для них риске заражения в случае контакта с больными некоторыми инфекционными заболеваниями (например, ветряной оспой, корью), а также о необходимости врачебной консультации, если такой контакт произошел. При появлении признаков выраженной бактериальной инфекции (например, лихорадки, упорной и резкой боли с одной стороны лица или зубной боли, припухлости в орбитальной или периорбитальной области) требуется немедленная врачебная консультация. Глюкокортикостероиды для назального и ингаляционного применения способны вызвать развитие глаукомы и/или катаракты. Поэтому, следует проводить тщательное наблюдение за пациентами с изменениями зрения, а также за пациентами, у которых ранее отмечалось повышенное внутриглазное давление, глаукома и/или катаракта. Влияние на способность управлять транспортными средствами: В редких случаях утомление, усталость, головокружение и слабость, которые могут быть следствием самого заболевания, могут развиваться при использовании назального спрея Момат Рино Адванс. В таких случаях следует избегать управления транспортным средством и работы со сложными механизмами. Условия хранения и отпуска из аптек Условия хранения:В защищенном от света месте при температуре от 15 до 25 °С. Не замораживать. Хранить в недоступном для детей месте. Отпуск из аптек: По рецепту Регистрационные данные Торговое название Момат Рино Адванс Международное непатентованное название. Форма выпуска:спрей назальный дозированный. Состав:1 доза спрея содержит: Действующие вещества: азеластина гидрохлорид - 140 мкг, мометазона фуроат - 50 мкг. Вспомогательные вещества: целлюлоза микрокристаллическая (Авицел RC-591) - 0,910 мг, кармеллоза натрия - 0,021 мг, декстроза - 3,500 мг, полисорбат-80 - 0,0175 мг, бензалкония хлорид - 0,014 мг, динатрия эдетат- 0,035 мг, неотам - 0,0007 мг, лимонной кислоты моногидрат - 0,0105 мг, натрия цитрат - 0,021 мг, вода очищенная - до 70 мг. АТХ:R.01.A Регистрация: Лекарственное средство ЛП-003328 Фармгруппа: Противоаллергическое средство - Н1-гистаминовых рецепторов блокатор + глюкокортикостероид для местного применения. Дата регистрации: 23.11.2015. Окончание регстрации: . Описание:Белая или почти белая суспензия. Упаковка:Спрей назальный дозированный, 140 мкг + 50 мкг/доза. По 150 доз во флакон из ПЭВП, снабженный дозирующим устройством и назальным адаптером с защитным колпачком. Флакон с инструкцией по применению помещают в картонную пачку. Срок годности:2 года. Не использовать препарат по истечении срока годности. Владелец рег.удостоверения:Гленмарк Фармасьютикалз Лтд Производитель:GLENMARK PHARMACEUTICALS, Ltd. Представительство:ГЛЕНМАРК ИМПЭКС ООО

Модель:
RUR 337
Показания Инфекционно-воспалительные заболевания, вызванные чувствительными к азитромицину микроорганизмами, в том числе: - инфекции верхних дыхательных путей и ЛОР-органов (ангина, синусит, тонзиллит, фарингит, средний отит): - инфекции нижних дыхательных путей (пневмония, в том числе вызванная атипичными возбудителями: бронхит, в том числе острый, обострение хронического): - инфекции урогенитального тракта (уретрит, цервицит): - инфекции кожи и мягких тканей (болезнь Лайма (начальная стадия - erythema migrans), рожа, импетиго, вторичные пиодерматозы, угри обыкновенные (акне) средней степени тяжести). Противопоказания Противопоказания Повышенная чувствительность к азитромицину (в том числе к другим макролидам), компонентам препарата: тяжелая печеночная недостаточность: более 9 баллов по шкале Чайлд-Пью (нет данных по эффективности и безопасности): тяжелая почечная недостаточность: клиренс креатинина (КК) менее 40 мл/мин (нет данных по эффективности и безопасности): дети в возрасте до 12 лет с массой тела менее 45 кг (для данной лекарственной формы): одновременный прием эрготамина и дигидроэрготамина. С осторожностью: При умеренном нарушении функции печени (7-9 баллов по шкале Чайлд-Пью): хронической почечной недостаточности (КК более 40 мл/мин): аритмиях или предрасположенности к аритмии и удлинению интервала Q-T: при одновременном приеме терфенадина, варфарина, дигоксина: при миастении: при беременности. Беременность Применение препарата в период беременности возможно только в том случае, когда предполагаемая польза для матери превышает потенциальный риск для плода. Описания отдельных случаев и обсервационных исследований показали, что применение азитромицина во время беременности не приводит к повышению частоты неблагоприятных исходов беременности и не связано с возникновением каких-либо специфических пороков развития у ребенка. При необходимости назначения препарата в период лактации следует прекратить грудное вскармливание. Применение и дозы Внутрь, за 1 ч до или через 2 ч после еды 1 раз в сутки. Взрослым при инфекциях верхних и нижних дыхательных путей, ЛОР-органов, кожи и мягких тканей (за исключением начальной стадии болезни Лайма (erythema migrans) и акне средней степени тяжести) -500 мг (2 капсулы) в сутки за 1 прием в течение 3 дней (курсовая доза - 1,5 г). При начальной стадии болезни Лайма (erythema migrans) - 1000 мг (4 капсулы) в сутки в первый день за один прием, далее по 500 мг (2 капсулы) в сутки ежедневно со 2 по 5 день (курсовая доза - 3 г). При показании угри обыкновенные (акне) средней степени тяжести в 1, 2 и 3 день лечения принимают по 500 мг (2 капсулы) 1 раз в день, затем делают перерыв с четвертого по седьмой день, с восьмого дня лечения принимают по 500 мг (2 капсулы) 1 раз в неделю в течение 9 недель (курсовая доза 6 г). При инфекциях урогенитального тракта (уретрит, цервицит) для лечения неосложненного уретрита или цервицита, вызванного Chlamydia trachomatis, принимают однократно 1000 мг (4 капсулы). Детям с массой тела более 45 кг при инфекциях верхних и нижних дыхательных путей, ЛОР-органов, кожи и мягких тканей - 500 мг (2 капсулы) в сутки за 1 прием в течение 3 дней: при лечении начальной стадии болезни Лайма (erythema migrans) -1000 мг (4 капсулы) в первый день и 500 мг (2 капсулы) ежедневно со 2 по 5 день (курсовая доза - 3 г). Для пациентов с нарушением функции почек (клиренс креатинина более 40 мл/мин) коррекция режима дозирования не требуется. Побочные эффекты и передозировка Побочные эффекты: Большинство отмечаемых побочных реакций обратимы после окончания курса лечения или отмены препарата. Классификация частоты развития побочных эффектов (ВОЗ): очень часто (с частотой более 1/10), часто (с частотой не менее 1/100, но менее 1/10), нечасто (с частотой не менее 1/1000, но менее 1/100), редко (с частотой не менее 1/10000, но менее 1/1000), очень редко (с частотой менее 1/10000), (включая отдельные сообщения). Со стороны кровеносной и лимфатической систем: часто - лимфоцитопения, эозинофилия: нечасто - лейкопения, нейтропения: очень редко - тромбоцитопения, гемолитическая анемия. Со стороны ЦНС: часто - головокружение, головная боль, парестезия, нарушение восприятия вкусовых ощущений: нечасто - тревожность, нервозность, гипостезия, бессонница, сонливость: редко - ажитация: очень редко - обмороки, судороги, психомоторная гиперактивность, аносмия, потеря вкусовых ощущений, паросмия, обострение миастении гравис. Со стороны органов чувств: нечасто - снижение остроты слуха, шум в ушах: редко - вертиго, снижение остроты зрения, глухота. Со стороны сердечно-сосудистой системы: нечасто - ощущение сердцебиения: редко - снижение артериального давления: очень редко - аритмия, в том числе: желудочковая тахикардия, увеличение интервала Q-T, аритмия типа "пируэт". Со стороны пищеварительной системы: очень часто - тошнота, диарея, боль в животе, метеоризм: часто - рвота: нечасто - гастрит, запор, мелена, анорексия: очень редко - изменение цвета языка, псевдомембранозный колит, панкреатит. Со стороны печени и желчевыводящих путей: нечасто - гепатит, гипербилирубинемия, повышение активности "печеночных" трансаминаз: очень редко - холестатическая желтуха, печеночная недостаточность (в редких случаях с летальным исходом, в основном на фоне нарушения функции печени), фульминантный гепатит, некроз печени. Аллергические реакции: часто - зуд, сыпь: нечасто - синдром Стивенса-Джонсона, фотосенсибилизация, крапивница: очень редко - анафилактические реакции (включая ангионевротический отек) в редких случаях со смертельным исходом, токсический эпидермальный некролиз, мультиформная эритема. Со стороны опорно-двигательного аппарата: часто - артралгия. Со стороны мочеполовой системы: нечасто - повышение остаточного азота мочевины и концентрации креатинина в плазме крови: очень редко - интерстициальный нефрит, острая почечная недостаточность. Прочие: часто - слабость: нечасто - боль в груди, периферические отеки, астения, гипергликемия, конъюнктивит. Инфекции и инвазии: нечасто - вагинит, кандидоз различных локализаций. О возникновении любого побочного эффекта следует сообщить лечащему врачу. Передозировка: При приеме высоких доз препарата может наблюдаться усиление побочного действия: временная потеря слуха, сильная тошнота, рвота, понос. В этом случае показано промывание желудка, назначение активированного угля, проведение симптоматической терапии. Взаимодействие с другими ЛС: Антацидные средства (алюминий и магнийсодержащие) не влияют на биодоступность азитромицина, но уменьшают его максимальную концентрацию в крови на 30 %, поэтому интервал между их приемом должен составлять как минимум 1 час до или 2 часа после приема указанных препаратов. При одновременном приеме с производными эрготамина и дигидроэрготамина возможно усиление их токсического действия (вазоспазм, дизестезия). При совместном применении с антикоагулянтами непрямого действия кумаринового ряда (варфарин) и азитромицина (в обычных дозах) пациентам необходим тщательный контроль протромбинового времени. Необходимо соблюдать осторожность при совместном назначении терфенадина и азитромицина, поскольку было установлено, что одновременный прием терфенадина и макролидов может вызывать аритмию и удлинение Q-T интервала. Исходя из этого, нельзя исключить вышеуказанных осложнений при совместном приеме терфенадина и азитромицина. При одновременном применении с циклоспорином, необходимо контролировать концентрацию циклоспорина в крови. При совместном приеме дигоксина и азитромицина необходимо контролировать концентрацию дигоксина в крови, так как многие макролиды повышают всасывание дигоксина в кишечнике. При одновременном применении с нелфинавиром возможно увеличение частоты побочных реакций азитромицина (снижение слуха, повышение активности "печеночных" трансаминаз). При совместном приеме азитромицина и зидовудина, азитромицин не влияет на фармакокинетические параметры зидовудина в плазме крови или на выведение почками его и его метаболита глюкуронида, но увеличивается концентрация активного метаболита - фосфорилированного зидовудина в моноядерных клетках периферической крови. Клиническое значение данного факта не определено. При одновременном приеме азитромицина и рифабутина в редких случаях возможно развитие нейтропении, механизм развития которой, а также наличие причинно- следственной связи с приемом препарата не установлены. Азитромицин не влияет на концентрацию карбамазепина, циметидина, диданозина, эфавиренза, флуконазола, индинавира, мидазолама, теофиллина, триазолама, триметоприма/сульфаметоксазола, цетиризина, силденафила, аторвастатина, рифабутина и метилпреднизолона в крови при одновременном применении. Следует учитывать возможность ингибирования изофермента CYP3A4 препаратами группы макролидов при одновременном применении с циклоспорином, терфенадином, алкалоидами спорыньи, цизапридом, пимозидом, хинидином, астемизолом и другими лекарственными средствами, метаболизм которых происходит с участием этого фермента, однако, при применении азитромицина такого вида взаимодействия не отмечалось. Специальных исследований по изучению взаимодействия с этими препаратами не проводилось. Фармакологическое действие и фармакокинетика Антибиотик широкого спектра действия. Является представителем подгруппы макролидных антибиотиков - азалидов. Связываясь с 50S субъединицей рибосом, угнетает пептидтранслоказу на стадии трансляции, подавляет синтез белка, замедляет рост и размножение бактерий, действует бактериостатически, в высоких концентрациях оказывает бактерицидный эффект. Действует на вне- и внутриклеточных возбудителей. Активен в отношении грамположительных аэробных микроорганизмов: Streptococcus spp. (групп А, В, С, G), Streptococcus pneumoniae (пенициллинчувствительный), Streptococcus pyogenes, Staphylococcus aureus (метициллинчувствительный): грамотрицательных аэробных микроорганизмов: Haemophilus influenzae, Haemophilus parainfluenzae, Moraxella catarrhalis, Legionella pneumophila, Neisseria gonorrhoeae, Pasteurella multocida: некоторых анаэробных микроорганизмов: Prevotella spp, Clostridium perfringens, Fusobacterium spp, Porphyriomonas spp: a также Chlamydia trachomatis, Chlamydia pneumoniae, Chlamydia psittaci, Mycoplasma pneumoniae, Mycoplasma hominis, Borrelia burgdorferi. Микроорганизмы, способные развивать устойчивость к азитромицину: грамположительные аэробы (Streptococcus pneumoniae (пенициллинустойчивый)). Изначально устойчивые микроорганизмы: грамположительные аэробы (. Enterococcus faecalis, Staphylococcus spp. (метициллинустойчивые стафилококки проявляют очень высокую степень устойчивости к макролидам), грамположительные бактерии, устойчивые к эритромицину): анаэробы (Bacteroides fragilis). Фармакокинетика: Азитромицин быстро всасывается из желудочно-кишечного тракта, что обусловлено его устойчивостью в кислой среде и липофильностью. После приема внутрь 500 мг максимальная концентрация азитромицина в плазме крови достигается через 2,5 - 3,0 ч и составляет 0,4 мг/л. Биодоступность составляет 37 %. Азитромицин хорошо проникает в дыхательные пути, органы и ткани урогенитального тракта (в частности в предстательную железу), в кожу и мягкие ткани. Высокая концентрация в тканях (в 10-50 раз выше, чем в плазме крови) и длительный период полувыведения обусловлены низким связыванием азитромицина с белками плазмы крови, а также его способностью проникать в эукариотические клетки и концентрироваться в среде с низким pH, окружающей лизосомы. Это, в свою очередь, определяет большой кажущийся объем распределения (31,1 л/кг) и высокий плазменный клиренс. Способность азитромицина накапливаться преимущественно в лизосомах особенно важна для элиминации внутриклеточных возбудителей. Доказано, что фагоциты доставляют азитромицин в места локализации инфекции, где он высвобождается в процессе фагоцитоза. Концентрация азитромицина в очагах инфекции достоверно выше, чем в здоровых тканях (в среднем на 24-34 %) и коррелирует со степенью воспалительного отека. Несмотря на высокую концентрацию в фагоцитах, азитромицин не оказывает существенного влияния на их функцию. Азитромицин сохраняется в бактерицидных концентрациях в очаге воспаления в течение 5- 7 дней после приема последней дозы, что позволило разработать короткие (3-дневные и 5-дневные) курсы лечения. В печени деметилируется, образующиеся метаболиты не активны. Выведение азитромицина из плазмы крови проходит в 2 этапа: период полувыведения составляет 14-20 ч в интервале от 8 до 24 ч после приема препарата и 41 ч - в интервале от 24 до 72 ч, что позволяет применять препарат 1 раз/сут. Азитромицин выводится, в основном, в неизмененном виде - 50 % кишечником, 12 % почками. Особые указания В случае пропуска приема одной дозы препарата пропущенную дозу следует принять как можно раньше, а последующие - с интервалами в 24 ч. Азитромицин следует принимать как минимум за 1 час до или через 2 часа после приема антацидных лекарственных средств. Азитромицин следует применять с осторожностью пациентам с умеренным нарушением функции печени из-за возможности развития фульминантного гепатита и тяжелой печеночной недостаточности у таких пациентов. При наличии симптомов нарушения функции печени (быстро нарастающая астения, желтуха, потемнение цвета мочи, склонность к кровотечениям, печеночная энцефалопатия) терапию азитромицином следует прекратить и провести исследование функционального состояния печени. При умеренной почечной недостаточности (КК более 40 мл/мин) применение азитромицина следует проводить под контролем функции почек. Противопоказан одновременный прием азитромицина с производными эрготамина и дигидроэрготамина из-за возможного развития эрготизма. При применении препарата, как на фоне приема, так и через 2-3 недели после прекращения лечения возможно развитие диареи, вызванной Clostridium difficile (псевдомемранозный колит). В легких случаях достаточно отмены лечения и применения ионообменных смол (колестирамин, колестипол), в тяжелых случаях показано возмещение потери жидкости, электролитов и белка, назначение ванкомицина, бацитрацина или метронидазола. Нельзя применять лекарственные средства, тормозящие перистальтику кишечника. Поскольку возможно удлинение интервала Q-T у пациентов, получающих макролиды, включая азитромицин, при применении азитромицина следует соблюдать осторожность у пациентов с известными факторами риска удлинения интервала Q-T: пожилой возраст: нарушение электролитного баланса (гипокалиемия, гипомагниемия): синдром врожденного удлинения интервала Q-T: заболевания сердца (сердечная недостаточность, инфаркт миокарда, брадикардия): одновременный прием лекарственных средств, способных удлинять интервал Q-T (в том числе антиаритмические средства IA и III классов, трициклические и тетрациклические антидепрессанты, нейролептики, фторхинолоны). Азитромицин может спровоцировать развитие миастенического синдрома или вызвать обострение миастении гравис. Европейское отделение ВОЗ рекомендует азитромицин в качестве препарата выбора при лечении хламидийной инфекции у беременных женщин. Азитромицин по риску применения у беременных женщин, согласно классификации FDA, относится к категории В (исследования репродукции на животных не выявили повреждения плода вследствие приема азитромицина, но контролируемые исследования у беременных женщин не проводились). Влияние на способность управлять транспортными средствами: При возникновении побочных реакций со стороны ЦНС пациентам рекомендуется воздержаться от управления автотранспортом и занятий другими потенциально опасными видами деятельности, требующих повышенной концентрации внимания, быстроты психомоторных и двигательных реакций. Условия хранения и отпуска из аптек Условия хранения:Хранить при температуре не выше 25 °С. Хранить в недоступном для детей месте. Отпуск из аптек: По рецепту Регистрационные данные Торговое название Азитрокс® Международное непатентованное название:Азитромицин. Форма выпуска:капсулы. Состав:Состав на одну капсулу Активное вещество: азитромицина дигидрат в пересчете на азитромицин 250 мг. Вспомогательные вещества: маннитол (маннит) - 54,58 мг, крахмал кукурузный- 13,10 мг, магния стеарат - 2,0 мг, натрия лаурилсульфат -0,32 мг: Капсулы твердые желатиновые: состав капсулы: корпус и крышечка - титана диоксид (Е 171), желатин (желатин медицинский). АТХ: Регистрация: Лекарственное средство Р N001157/01 Фармгруппа: Антибиотик - азалид. Дата регистрации: 02.06.2010. Окончание регстрации: . Описание:Капсулы белого цвета №0. Содержимое капсул - порошок белого цвета или белого с желтоватым оттенком цвета. Упаковка:Капсулы 250 мг. 6 или 10 капсул в контурную ячейковую упаковку. 1, 2, 6 или 12 контурных ячейковых упаковок с инструкцией по применению в пачку из картона. Срок годности:3 года. Не использовать по истечении срока годности, указанного на упаковке. Владелец рег.удостоверения:ФАРМСТАНДАРТ-ЛЕКСРЕДСТВА, ОАО Производитель:ФАРМСТАНДАРТ-ЛЕКСРЕДСТВА, ОАО. Представительство

Модель:
RUR 443
Состав Действующее вещество: этилметилгидроксипиридина сукцинат. 1 таблетка содержит: этилметилгидроксипиридина сукцинат – 125,0 мг. Вспомогательные вещества: лактозы моногидрат, повидон К-30, магния стеарат. Пленочная оболочка: гипромеллоза, титана диоксид, лактозы моногидрат, макрогол, триацетин. Лекарственная форма Таблетки, покрытые пленочной оболочкой. Круглые, двояковыпуклые таблетки, покрытые пленочной оболочкой, от белого до белого с желтоватым оттенком цвета, допускается наличие характерного запаха. Показания к применению последствия острых нарушений мозгового кровообращения, в том числе после транзиторных ишемических атак, в фазе субкомпенсации в качестве профилактических курсов; легкая черепно-мозговая травма, последствия черепно-мозговых травм; энцефалопатии различного генеза (дисциркуляторные, дисметаболические, посттравматические, смешанные); синдром вегетативной дистонии; легкие когнитивные расстройства атеросклеротического генеза; тревожные расстройства при невротических и неврозоподобных состояниях; ишемическая болезнь сердца в составе комплексной терапии; купирование абстинентного синдрома при алкоголизме с преобладанием неврозоподобных и вегетативно-сосудистых расстройств, постабстинентные расстройства; состояние после острой интоксикации антипсихотическими средствами; астенические состояния, а также для профилактики развития соматических заболеваний под воздействием экстремальных факторов и нагрузок; воздействие экстремальных (стрессорных) факторов; синдром дефицита внимания с гиперактивностью (СДВГ) у детей, в том числе гиперактивность, нарушение внимания, импульсивность. Режим дозирования и способ применения Режим дозирования Внутрь по 125-250 мг 3 раза в сутки; максимальная суточная доза – 750 мг. Длительность лечения – 2-8 недель; для купирования алкогольной абстиненции – 5-7 дней. Лечение прекращают постепенно, уменьшая дозу в течение 2-3 дней. Начальная доза – 125-250 мг (1-2 таблетки) 1-2 раза в сутки с постепенным повышением до получения терапевтического эффекта. Для лечения последствий острых нарушений мозгового кровообращения, в том числе после транзиторных ишемических атак, таблетки назначают после курса препарата в виде раствора для внутривенного и внутримышечного введения. Продолжительность курса терапии у больных ишемической болезнью сердца не менее 1,5-2 месяцев. Повторные курсы (по рекомендации врача) желательно проводить в весенне-осенние периоды. Дети При синдроме дефицита внимания с гиперактивностью (СДВГ) у детей, в том числе гиперактивности, нарушении внимания, импульсивности: по 125 мг 2 раза в сутки в течение 6 недель. Способ применения Внутрь, запивая водой. Противопоказания повышенная индивидуальная чувствительность к препарату и его компонентам; острые нарушения функции печени и/или почек; детский возраст до 6 лет (в связи с недостаточной изученностью действия препарата); беременность, грудное вскармливание (в связи с недостаточной изученностью действия препарата); непереносимость лактозы, дефицит лактазы, глюкозо-галактозная мальабсорбация. Особые указания и меры предосторожности при применении Пациентам с редко встречающейся наследственной непереносимостью галактозы, дефицитом лактазы, глюкозо-галактозной мальабсорбцией не следует принимать этот препарат. Взаимодействие с другими лекарственными препаратами и другие виды взаимодействия Мексидол сочетается со всеми препаратами, используемыми для лечения соматических заболеваний. Усиливает действие бензодиазепиновых препаратов, антидепрессантов, анксиолитиков, противосудорожных средств и противопаркинсонических средств. Уменьшает токсические эффекты этилового спирта. Фертильность, беременность и лактация Препарат Мексидол противопоказан при беременности и в период грудного вскармливания. Влияние на способность управлять транспортными средствами и работать с механизмами В период приема препарата следует соблюдать осторожность при работе, требующей быстроты психофизических реакций (управление транспортными средствами, механизмами и т.п.). Нежелательные реакции Частота побочных эффектов определялась в соответствии с классификацией Всемирной организации здравоохранения (ВОЗ): очень часто ( 10 %); часто ( 1 %, но ˂ 10 %); нечасто ( 0,1 %, но ˂ 1 %); редко ( 0,01 %, но ˂ 0,1 %); очень редко (˂ 0,01 %); частота неизвестна (частота не может быть определена на основе имеющихся данных). Нарушения со стороны иммунной системы: очень редко – ангионевротический отек, крапивница. Психические нарушения: очень редко – сонливость. Нарушения со стороны нервной системы: очень редко – головная боль. Желудочно-кишечные нарушения: очень редко – сухость во рту, тошнота, боль, жжение и дискомфорт в эпигастральной области, изжога, метеоризм, диарея. Нарушения со стороны кожи и подкожных тканей: очень редко – сыпь, зуд, гиперемия. Передозировка Симптомы Сонливость, бессонница. Лечение В связи с низкой токсичностью передозировка маловероятна. Лечение, как правило, не требуется, – симптомы исчезают самостоятельно в течение суток. При выраженных проявлениях проводится поддерживающее и симптоматическое лечение. Фармакодинамические свойства Фармакотерапевтическая группа: антиоксидантное средство. Код АТХ: N07XX. Механизм действия Механизм действия Мексидола обусловлен его антиоксидантным, антигипоксантным и мембранопротекторным действием. Он ингибирует перекисное окисление липидов, повышает активность супероксиддисмутазы, повышает соотношение липид-белок, уменьшает вязкость мембраны, увеличивает ее текучесть. Мексидол модулирует активность мембраносвязанных ферментов (кальций-независимой фосфодиэстеразы, аденилатциклазы, ацетилхолинэстеразы), рецепторных комплексов (бензодиазепинового, ГАМК, ацетилхолинового), что усиливает их способность связывания с лигандами, способствует сохранению структурно-функциональной организации биомембран, транспорта нейромедиаторов и улучшению синаптической передачи. Вызывает усиление компенсаторной активации аэробного гликолиза и снижение степени угнетения окислительных процессов в цикле Кребса в условиях гипоксии с увеличением содержания АТФ и креатинфосфата, активацию энергосинтезирующих функций митохондрий, стабилизацию клеточных мембран. Мексидол повышает содержание в головном мозге дофамина. Фармакодинамические эффекты Мексидол является ингибитором свободнорадикальных процессов, мембранопротектором, обладающим антигипоксическим, стресс-протективным, ноотропным, противосудорожным и анксиолитическим действием. Препарат повышает резистентность организма к воздействию различных повреждающих факторов (шок, гипоксия и ишемия, нарушения мозгового кровообращения, интоксикация алкоголем и антипсихотическими средствами (нейролептиками)). Антистрессорное действие проявляется в нормализации постстрессового поведения, соматовегетативных нарушений, восстановлении циклов сон-бодрствование, нарушенных процессов обучения и памяти, снижении дистрофических и морфологических изменений в различных структурах головного мозга. Обладает гиполипидемическим действием, уменьшает содержание общего холестерина и липопротеидов низкой плотности. Мексидол улучшает функциональное состояние ишемизированного миокарда. В условиях коронарной недостаточности увеличивает коллатеральное кровоснабжение ишемизированного миокарда, способствует сохранению целостности кардиомиоцитов и поддержанию их функциональной активности. Эффективно восстанавливает сократимость миокарда при обратимой сердечной дисфункции. Стабилизирует мембранные структуры клеток крови (эритроцитов и тромбоцитов) при гемолизе. Препарат улучшает метаболизм и кровоснабжение головного мозга, улучшает микроциркуляцию и реологические свойства крови, уменьшает агрегацию тромбоцитов. Мексидол достоверно уменьшает выраженность проявлений синдрома дефицита внимания с гиперактивностью у детей 6-12 лет: уменьшает выраженность симптомов невнимательности, гиперактивности/импульсивности, способствует клиническому улучшению. Применение препарата при СДВГ способствует повышению концентрации внимания и способности к сосредоточению, повышению усидчивости, уменьшению признаков гиперактивности и снижению импульсивности, что способствует улучшению обучения и социальной адаптации детей. Мексидол обладает выраженным антитоксическим действием при абстинентном синдроме. Он устраняет неврологические и нейротоксические проявления острой алкогольной интоксикации, восстанавливает нарушения поведения, вегетативные функции, а также способен снимать когнитивные нарушения, вызванные длительным приемом этанола и его отменой. Под влиянием Мексидола усиливается действие транквилизирующих, нейролептических, антидепрессивных, снотворных и противосудорожных средств, что позволяет снизить их дозы и уменьшить побочные эффекты. Клиническая эффективность и безопасность Рандомизированное двойное слепое плацебо-контролируемое в параллельных группах исследование эффективности и безопасности препарата Мексидол фазы III (ЭПИКА) при длительной последовательной терапии у пациентов с полушарным ишемическим инсультом в остром и раннем восстановительном периодах проводилось с участием 150 пациентов в возрасте от 40 до 79 лет. Пациенты были рандомизированы в 2 группы: первая группа получала терапию препаратом Мексидол по 500 мг в сутки внутривенно капельно в течение 10 дней с последующим приемом по 1 таблетке (125 мг) 3 раза в сутки в течение 8 недель. В группе терапии препаратом Мексидол показано достоверное уменьшение симптомов и функциональных нарушений. При применении препарата Мексидол отмечалось достоверно более выраженное по сравнению с плацебо улучшение жизнедеятельности: на момент окончания терапии средний балл по модифицированной шкале Рэнкина (мШР) был ниже в группе применения препарата Мексидол (p = 0,04); также в этой группе была более выраженной динамика уменьшения среднего балла по мШР (p = 0,023). Доля пациентов, достигших восстановления, соответствующего 0-2 баллам по мШР (5 визит), была достоверно выше в группе применения препарата Мексидол по сравнению с плацебо – 59 (96,7 %) и 53 (84,1 %), соответственно (p = 0,039). На момент окончания терапии неврологический дефицит был достоверно ниже в группе терапии препаратом Мексидол: при тестировании по шкале инсульта Национального института здоровья на 5 визите среднее значение было ниже в первой группе (p = 0,035). Применение препарата Мексидол способствовало лучшему функциональному восстановлению: доля пациентов с отсутствием проблем с передвижением в пространстве была достоверно выше в первой группе (p = 0,022). По результатам субанализа, эффективность препарата Мексидол по всем используемым шкалам была равной во всех возрастных группах. Достоверных различий по частоте нежелательных реакций у пациентов обеих групп выявлено не было. Многоцентровое двойное слепое, рандомизированное, плацебо-контролируемое в трёх параллельных группах клиническое исследование по оценке эффективности и безопасности препарата Мексидол таблетки, покрытые пленочной оболочкой, 125 мг в лечении синдрома дефицита внимания с гиперактивностью (СДВГ) у детей 6-12 лет при различных режимах дозирования (МЕГА) проводилось с участием 333 пациентов. По результатам оценки конечных точек эффективности по окончании 6 недель терапии были получены статистически значимые изменения суммы общего балла по субшкалам «невнимательность», «гиперактивность/импульсивность» шкалы SNAP-IV, среднего изменения в баллах по субшкале «невнимательность» шкалы SNAP-IV, среднего изменения в баллах по субшкале «гиперактивность/импульсивность» шкалы SNAP-IV, среднего изменения в баллах по индексу Коннерса шкалы SNAP-IV, среднего изменения значения по шкале ADHD Rating Scale IV, оценки по шкале общего клинического впечатления степени тяжести СДВГ (Clinical Global Impressions-ADHD-Severity, CGI-ADHD-S), оценки по шкале общего клинического впечатления – улучшение (The Clinical Global Impressions Scale – Improvement, CGI-I). Доказана превосходящая эффективность препарата Мексидол над плацебо. По результатам исследования статистически значимые изменения суммы общего балла по субшкалам «невнимательность», «гиперактивность/импульсивность» шкалы SNAP-IV через 6 недель терапии были выявлены во всех трёх группах исследования (p < 0,05). При этом между группами Мексидол+Плацебо и Плацебо, а также между группами Мексидол и Плацебо наблюдались выраженные статистически значимые различия (для популяции PP: p = 0,000308 и p = 0,000024, соответственно; для популяции FAS: p = 0,000198 и p = 0,000024, соответственно). Верхняя граница 95 %-ного доверительного интервала для разности средних основного показателя эффективности в группах Мексидол+Плацебо и Плацебо составила -1,22 в популяции PP и -1,33 в популяции FAS; в группах Мексидол и Плацебо -3,25 в популяции PP и -3,36 в популяции FAS. Для популяции FAS всех пациентов, включенных в исследование, верхняя граница 95 %-ного доверительного интервала является отрицательной величиной, что позволяет констатировать превосходящую эффективность препарата Мексидол над Плацебо. Анализ для популяции PP подтверждает указанный вывод. Согласно оценке степени тяжести СДВГ по шкале общего клинического впечатления (Clinical Global Impressions-ADHD-Severity, CGI-ADHD-S), 3 и менее баллов к окончанию терапии имели 66 пациентов в группе Мексидол (59,46 %), 34 пациента в группе Мексидол+Плацебо (30,63 %) и 25 пациентов в группе Плацебо (22,52 %). При оценке по шкале общего клинического впечатления – улучшение (The Clinical Global Impressions Scale – Improvement, CGI-I) улучшение наступило у 95 (85,59 %) человек в группе Мексидол, 84 (75,68 %) человек в группе Мексидол+Плацебо, и у 50 (45,05 %) человек в группе Плацебо, при этом значительное улучшение отмечалось у 45 (40,54 %) человек в группе Мексидол, 20 (18,02 %) человек в группе Мексидол+Плацебо, и у 10 (9,01 %) человек – в группе Плацебо. Между группами были выявлены статистически значимые различия (критерий χ 2 Пирсона, p < 0,000001). Результаты статистического анализа частоты возникновения НЯ, показателей лабораторных анализов, физикального обследования демонстрируют отсутствие значимых различий между сравниваемыми группами по основным показателям безопасности. Изложенное указывает на сопоставимый характер профилей безопасности исследуемых режимов дозирования препарата Мексидол и Плацебо. Фармакокинетические свойства Абсорбция Быстро всасывается при приеме внутрь. Максимальная концентрация при дозах 400-500 мг составляет 3,5-4,0 мкг/мл. Быстро распределяется в органах и тканях. Распределение Среднее время удержания препарата в организме при приеме внутрь – 4,9-5,2 ч. Биотрансформация Метаболизируется в печени путем глюкуронконъюгирования. Идентифицировано 5 метаболитов: 3-оксипиридина фосфат – образуется в печени и при участии щелочной фосфатазы распадается на фосфорную кислоту и 3-оксипиридин; 2-й метаболит – фармакологически активный, образуется в больших количествах и обнаруживается в моче на 1-2 сутки после введения; 3-й – выводится в больших количествах с мочой; 4-й и 5-й – глюкуронконъюгаты. Элиминация Период полувыведения (T1/2) при приеме внутрь – 2,0-2,6 ч. Быстро выводится с мочой в основном в виде метаболитов и в незначительном количестве – в неизменном виде. Наиболее интенсивно выводится в течение первых 4 ч после приема препарата. Показатели выведения с мочой неизмененного препарата и метаболитов имеют индивидуальную вариабельность. Срок годности 3 года. Не использовать после истечения срока годности, указанного на упаковке. Условия отпуска Отпускают по рецепту. Особые меры предосторожности при хранении Хранить в защищенном от света месте при температуре не выше 25 °C. Хранить в недоступном для детей месте. Характер и содержание первичной упаковки По 10 таблеток, покрытых пленочной оболочкой, в контурную ячейковую упаковку из пленки поливинилхлоридной и фольги алюминиевой. По 1, 2, 3, 4, 5 контурных ячейковых упаковок вместе с инструкцией по применению в пачку картонную
Модель:
RUR 998
Показания Артериальная гипертензия (пациентам, которым показана комбинированная терапия амлодипином и рамиприлом в дозах, как в комбинации). Противопоказания Противопоказания Амлодипин Повышенная чувствительность к амлодипину и другим производным дигидропиридина: Тяжелая артериальная гипотензия (САД менее 90 мм рт. ст.), шок (включая кардиогенный): Обструктивный процесс, затрудняющий выброс крови из левого желудочка (например, клинически значимый стеноз аорты) Гемодинамически нестабильная сердечная недостаточность после инфаркта миокарда: Беременность: Период грудного вскармливания: Возраст до 18 лет (безопасность и эффективность не определены). Рамиприл Повышенная чувствительность к рамиприлу, другим ингибиторам ангиотензинпревращающего фермента (АПФ): Ангионевротический отек в анамнезе (наследственный или идиопатический, а также связанный с предшествующей терапией ингибиторами АПФ): Гемодинамически значимый стеноз почечных артерий (двусторонний или односторонний, в случае единственной почки): Артериальная гипотензия (систолическое артериальное давление (САД) <:90 мм.рт.ст.) или состояния с нестабильными показателями гемодинамики: Гемодинамически значимый стеноз аортального или митрального клапана, или гипертрофическая обструктивная кардиомиопатия: Первичный гиперальдостеронизм: Тяжёлая почечная недостаточность (КК<:20 мл/мин/1.73 м 2 площади поверхности тела) Гемодиализ (опыт клинического применения недостаточен): Беременность: Период грудного вскармливания: Нефропатия, лечение которой проводится глюкокортикостероидами (ГКС), нестероидными противовоспалительными препаратами (НПВП), иммуномодуляторами и/или другими цитотоксическими средствами (опыт клинического применения недостаточен): Декомпенсированная хроническая сердечная недостаточность (опыт клинического применения недостаточен): Возраст до 18 лет (опыт клинического применения недостаточен): Гемодиализ или гемофильтрация с применением некоторых мембран с отрицательно заряженной поверхностью, таких как высокопроточные мембраны из полиакрилнитрила (опасность развития реакций повышенной чувствительности): Апоферез липопротеинов низкой плотности (ЛПНП) с применением декстрана сульфата (опасность развития реакций повышенной чувствительности): Десенсибилизирующая терапия при реакциях повышенной чувствительности к ядам насекомых - пчел, ос: Острая стадия инфаркта миокарда у пациентов с такими заболеваниями как: - тяжелая сердечная недостаточность (IV функциональный класс по NYHA): - опасные для жизни желудочковые нарушения ритма сердца: - "легочное" сердце. Одновременное применение препаратов, содержащих алискирен, у пациентов с нарушением функции почек (КК менее 60 мл/мин) и пациентов с сахарным диабетом. Амлодипин+рамиприл Повышенная чувствительность к вспомогательным веществам, входящим в состав препарата: Беременность: Период грудного вскармливания: Почечная недостаточность: КК<:20 мл/мин на 1,73 м площади поверхности тела: Возраст до 18 лет (опыт клинического применения недостаточен). С осторожностью: С осторожностью применять комбинацию амлодипин+рамиприл при следующих заболеваниях и состояниях: - атеросклеротические поражения коронарных и церебральных артерий (опасность чрезмерного снижения АД): - повышение активности ренин-ангиотензин-альдостероновой системы (РААС), при котором при ингибировании АПФ имеется риск резкого снижения АД с ухудшением функции почек: - выраженная, особенно злокачественная АГ, - ХСН, особенно тяжелая или по поводу которой принимаются другие лекарственные средства (ЛС) с антигипертензивным действием, - гемодинамически значимый односторонний стеноз почечной артерии (при наличии обеих почек), - предшествующий прием диуретиков, - нарушения водно-электролитного баланса, снижение объема циркулирующей крови (ОЦК) (в том числе на фоне приема диуретиков, бессолевой диеты, диареи, рвоты, обильного потоотделения): - одновременное применение с препаратами, содержащими алискирен (при двойной блокаде РААС повышается риск резкого снижения АД, гиперкалиемии и ухудшения функции почек): - нарушения функции печени - недостаточность опыта применения: возможно как усиление, так и ослабление эффектов рамиприла: при наличии у пациентов цирроза печени с асцитом и отеками возможна значительная активация РААС: - нарушение функции почек (КК более 20 мл/мин.): - состояние после трансплантации почек: - системные заболевания соединительной ткани, в том числе системная красная волчанка, склеродермия, сопутствующая терапия препаратами, способными вызвать изменения в картине периферической крови (в том числе аллопуринолом, прокаинамидом) - возможно угнетение костномозгового кроветворения, развитие нейтропении или агранулоцитоза: - сахарный диабет - риск развития гиперкалиемии: - пожилой возраст - риск усиления антигипертензивного действия: - гиперкалиемия: - гипонатриемия: - ХСН неишемической этиологии III-IV функционального класса по классификации NYHA: - аортальный стеноз: - синдром слабости синусового узла: - митральный стеноз: - артериальная гипотензия: - единственная функционирующая почка: - реноваскулярная гипертензия: - одновременное применение дантролена, эстрамустина, калийсберегающих диуретиков и препаратов калия, калийсодержащих заменителей пищевой соли, препаратов лития: - хирургическое вмешательство/общая анестезия: - проведение гемодиализа с применением высокопроточных мембран (например, AN69®). Беременность Беременность Препарат противопоказан для применения, так как рамиприл может оказать неблагоприятное воздействие на плод: нарушение развития почек плода, снижение АД плода и новорожденных, нарушение функции почек, гиперкалиемия, гипоплазия костей черепа, олигогидрамнион, контрактура конечностей, деформация костей черепа, гипоплазия легких. Перед началом приема препарата у женщин детородного возраста следует исключить беременность. Если женщина планирует беременность, то лечение препаратом должно быть прекращено. В случае наступления беременности во время лечения препаратом следует как можно скорее прекратить его прием и перевести пациентку на прием других препаратов, при применении которых риск для ребенка будет наименьшим. Период грудного вскармливания Если лечение препаратом необходимо в период грудного вскармливания, оно должно быть прекращено (данные по выведению амлодипина и рамиприла с грудным молоком женщин отсутствуют). Фертильность Амлодипин У некоторых пациентов, получавших блокаторы кальциевых каналов, наблюдались обратимые биохимические изменения в головках сперматозоидов. Клинические данные недостаточны для оценки потенциального эффекта амлодипина на фертильность. Применение и дозы Применять Эгипрес внутрь, по 1 капсуле 1 раз в сутки, в одно и то же время, вне зависимости от приёма пищи. Доза препарата Эгипрес подбирается после ранее проведенного титрования доз отдельных компонентов препарата: рамиприла и амлодипина у пациентов с АЕ. Препарат Эгипрес с фиксированными дозами активных компонентов не может применяться для начальной терапии. Если больным необходима коррекция доз, то её следует проводить только с помощью титрации доз активных компонентов в монотерапии. Только после этого возможно применение препарата Эгипрес с фиксированными дозами активных компонентов в нижеприведенных комбинациях. При терапевтической необходимости доза препарата Эгипрес может быть изменена на основании индивидуального титрования доз отдельных компонентов: 2,5 мг амлодипина + 2,5 мг рамиприла или 5 мг амлодипина + 5 мг рамиприла или 5 мг амлодипина + 10 мг рамиприла или 10 мг амлодипина + 5 мг рамиприла или 10 мг амлодипина + 10 мг рамиприла. Эгипрес в дозе 10 мг амлодипина + 10 мг рамиприла является максимальной суточной дозой препарата, которую не рекомендуется превышать. Дозировки 10 мг амлодипина + 5 мг рамиприла (по амлодипину) и 5 мг амлодипина + 10 мг рамиприла (по рамиприлу) являются максимальными суточными дозами. Взрослые У пациентов, принимающих диуретики, препарат следует назначать с осторожностью, вследствие риска нарушения водно-электролитного баланса. У этих пациентов следует контролировать функцию почек и содержание калия в крови. Пациенты пожилого возраста и пациенты с почечной недостаточностью Выведение амлодипина и рамиприла и его метаболитов у пациентов пожилого возраста и пациентов с почечной недостаточностью замедлено. Поэтому у таких пациентов необходимо регулярно контролировать содержание креатинина и калия в плазме крови. Эгипрес может назначаться пациентам с КК равным или превышающем 60 мл/мин. При КК<:60 мл/мин, а также у пациентов с АГ, находящихся на гемодиализе, Эгипрес рекомендуется только пациентам, получавшим 2.5 мг или 5 мг рамиприла как оптимальную поддерживающую дозу по ходу титрования индивидуальной дозы. Нет необходимости титрования индивидуальной дозы амлодипина у пациентов с нарушением функции почек. Эгипрес противопоказан пациентам с КК<:20 мл/мин/1.73 м площади поверхности тела. Изменение концентрации амлодипина в плазме крови не коррелирует со степенью выраженности почечной недостаточности. Пациенты с печеночной недостаточностью Следует соблюдать осторожность при назначении препарата Эгипрес пациентам с печеночной недостаточностью из-за отсутствия рекомендаций по дозированию препарата у таких пациентов. Эгипрес рекомендуется только пациентам, получавшим 2.5 мг рамиприла как оптимальную поддерживающую дозу по ходу титрования индивидуальной дозы. Дети и подростки Эгипрес не следует назначать детям и подросткам до 18 лет из-за отсутствия данных об эффективности и безопасности применения рамиприла и амлодипина у данных групп пациентов как в виде монотерапии, так и в виде комбинированной терапии. Побочные эффекты и передозировка Побочные эффекты: Указанные ниже нежелательные эффекты даются в соответствии со следующими градациями частоты их возникновения по классификации ВОЗ: очень частые: более 1/10 (более 10%): частые: более 1/100 но менее 1/10 (более 1%, но менее 10%): нечастые: более 1/1000 но менее 1/100 (более 0,1%, но менее 1%): редкие: более 1/10000 но менее 1/1000 (более 0,01%, но менее 0,1%): очень редкие: менее 1/10000 (менее 0,01%). Амлодипин Со стороны ССС: часто - периферические отеки (лодыжек и стоп), ощущение сердцебиения: нечасто - чрезмерное снижение АД, ортостатическая гипотензия, васкулит: редко - развитие или усугубление СН: очень редко - нарушения ритма сердца (включая брадикардию, желудочковую тахикардию и мерцание предсердий), ИМ, боли в грудной клетке, мигрень. Со стороны опорно-двигательного аппарата и соединительной ткани: нечасто - артралгия, судороги мышц, миалгия, боль в спине, артроз: редко - миастения. Со стороны ЦНС и периферической нервной системы: часто - ощущение жара и приливов крови к коже лица, повышенная утомляемость, головокружение, головная боль, сонливость: нечасто - недомогание, обморок, повышенное потоотделение, астения, гипестезии, парестезии, периферическая нейропатия, тремор, бессонница, лабильность настроения, необычные сновидения, нервозность, депрессия, тревога: редко - судороги, апатия: очень редко - атаксия, амнезия, зарегистрированы отдельные случаи экстрапирамидного синдрома. Со стороны пищеварительной системы: часто - боль в брюшной полости, тошнота: нечасто - рвота, изменения режима дефекации (включая запор, метеоризм), диспепсия, диарея, анорексия, сухость слизистой оболочки полости рта, жажда: редко - гиперплазия десен, повышение аппетита: очень редко - гастрит, панкреатит, гипербилирубинемия, желтуха (обычно холестатическая), повышение активности "печеночных" трансаминаз, гепатит. Со стороны крови: очень редко - тромбоцитопеническая пурпура, тромбоцитопения, лейкопения. Метаболические нарушения: очень редко - гипергликемия. Со стороны дыхательной системы: нечасто - одышка, ринит: очень редко - кашель. Со стороны почек и мочевыводящих путей: нечасто - учащенное мочеиспускание, болезненное мочеиспускание, никтурия, импотенция: очень редко - дизурия, полиурия. Аллергические реакции: нечасто - кожный зуд, сыпь: очень редко - ангионевротический отек, мультиформная эритема, крапивница. Прочие: нечасто - алопеция, "звон" в ушах, гинекомастия, увеличение/снижение массы тела, нарушение зрения, диплопия, нарушение аккомодации, ксерофтальмия, конъюнктивит, боль в глазах, извращение вкуса, озноб, носовое кровотечение: редко - дерматит: очень редко - паросмия, ксеродермия, "холодный" пот, нарушение пигментации кожи. Рамиприл Со стороны сердца: нечасто - ишемия миокарда, включая развитие приступа стенокардии или ИМ, тахикардия, аритмии (появление или усиление), ощущение сердцебиения, периферические отеки. Со стороны сосудов: часто - чрезмерное снижение АД, нарушение ортостатической регуляции сосудистого тонуса (ортостатическая гипотензия), синкопальные состояния: нечасто - "приливы" крови к коже лица: редко - возникновение или усиление нарушений кровообращения на фоне стенозирующих сосудистых поражений, васкулит: частота неизвестна - синдром Рейно. Со стороны центральной нервной системы (ЦНС): часто - головная боль, ощущение "легкости" в голове: нечасто - головокружение, агевзия (утрата вкусовой чувствительности), дисгевзия (нарушение вкусовой чувствительности), парестезии (ощущение жжения): редко - тремор, нарушение равновесия: частота неизвестна - ишемия головного мозга, включая ишемический инсульт и преходящее нарушение мозгового кровообращения, нарушение психомоторных реакций, паросмия (нарушение восприятия запахов). Со стороны органа зрения: нечасто - нарушения зрения, включая нечеткость зрительного восприятия: редко - конъюнктивит. Нарушения со стороны органа слуха: редко - нарушения слуха, звон в ушах. Со стороны психики: нечасто - подавленное настроение, тревога, нервозность, двигательное беспокойство, нарушения сна, включая сонливость: редко - спутанность сознания: частота неизвестна - нарушение концентрации внимания. Со стороны дыхательной системы: часто - "сухой" кашель (усиливающийся по ночам и в положении лежа), бронхит, синусит, одышка: нечасто - бронхоспазм, включая утяжеление течения бронхиальной астмы, заложенность носа. Со стороны пищеварительной системы: часто - воспалительные реакции в желудке и кишечнике, расстройства пищеварения, ощущение дискомфорта в области живота, диспепсия, диарея, тошнота, рвота: нечасто - панкреатит, в т.ч. и с летальным исходом (случаи панкреатита с летальным исходом при приеме ингибиторов АПФ наблюдались крайне редко), повышение активности ферментов поджелудочной железы в плазме крови, интестинальный ангионевротический отек, боли в животе, гастрит, запор, сухость слизистой оболочки полости рта: редко - глоссит: частота неизвестна - афтозный стоматит (воспалительная реакция слизистой оболочки полости рта). Со стороны гепатобилиарной системы: нечасто - повышение активности "печеночных" ферментов и содержания конъюгированного билирубина в плазме крови: редко - холестатическая желтуха, гепатоцеллюлярные поражения: частота неизвестна - острая печеночная недостаточность, холестатический или цитолитический гепатит (летальный исход наблюдался крайне редко). Со стороны почек и мочевыводящих путей: нечасто - нарушение функции почек, включая развитие острой почечной недостаточности, увеличение выделения количества мочи, усиление ранее существовавшей протеинурии, повышение концентрации мочевины и креатинина в крови. Со стороны репродуктивной системы и молочных желез: нечасто - преходящая импотенция за счет эректильной дисфункции, снижение либидо: частота неизвестна - гинекомастия. Со стороны крови и лимфатической системы: нечасто - эозинофилия: редко - лейкопения, включая нейтропению и агранулоцитоз, уменьшение количества эритроцитов в периферической крови, снижение гемоглобина, тромбоцитопения: частота неизвестна - угнетение костно-мозгового кроветворения, панцитопения, гемолитическая анемия. Со стороны кожных покровов и слизистых оболочек: часто - кожная сыпь, в частности, макулопапулезная: нечасто - ангионевротический отек, в т.ч. и с летальным исходом (отек гортани может вызвать обструкцию дыхательных путей, приводящую к летальному исходу), кожный зуд, гипергидроз (повышенное потоотделение): редко - эксфолиативный дерматит, крапивница, онихолизис: очень редко - реакции фотосенсибилизации: частота неизвестна - токсический эпидермальный некролиз, синдром Стивенса-Джонсона, мультиформная эритема, пемфигус, утяжеление течения псориаза, псориазоподобный дерматит, пемфигоидная или лихеноидная (лишаевидная) экзантема или энантема, алопеция. Со стороны опорно-двигательного аппарата и соединительной ткани: часто - мышечные судороги, миалгия: нечасто - артралгия. Со стороны обмена веществ, питания и лабораторных показателей: часто - повышение содержания калия в крови: нечасто - анорексия, снижение аппетита: частота неизвестна - снижение концентрации натрия в крови, синдром неадекватной секреции анти- диуретического гормона. Со стороны иммунной системы, частота неизвестна - анафилактические или анафилактоидные реакции (при ингибировании АПФ увеличивается количество анафилактических или анафилактоидных реакций на яды насекомых), повышение титра антинуклеарных антител. Общие нарушения: часто - боли в груди, чувство усталости: нечасто - повышение температуры тела: редко - астения (слабость). Передозировка: Информация о передозировке препарата Эгипрес отсутствует. Амлодипин Симптомы: выраженное снижение АД с возможным развитием рефлекторной тахикардии и чрезмерной периферической вазодилатации (существует вероятность появления выраженной и стойкой артериальной гипотензии, в том числе с развитием шока и летального исхода). Лечение: Назначение активированного угля (особенно в первые 2 часа после передозировки), промывание желудка, придание возвышенного положения конечностям, активное поддержание функций ССС, мониторинг показателей работы сердца и легких, контроль за ОЦК и диурезом. Для восстановления тонуса сосудов и АД, если нет противопоказаний, может оказаться полезным применение сосудосуживающих препаратов. Используют внутривенное введение глюконата кальция. Амлодипин в значительной степени связывается с белками сыворотки крови, поэтому гемодиализ малоэффективен. Рамиприл Симптомы: чрезмерная периферическая вазодилатация с развитием выраженного снижения АД, шока: брадикардия или рефлекторная тахикардия, водно-электролитные нарушения, острая почечная недостаточность, ступор. Лечение: промывание желудка, назначение адсорбентов, натрия сульфата (по возможности в течение первых 30 мин). В случае выраженного снижения АД пациента следует уложить, ноги приподнять, активно поддерживать функции ССС: к терапии по восполнению ОЦК и восстановлению электролитного баланса дополнительно может быть добавлено введение альфа 1-адренергических агонистов (норэпинефрин, допамин) и ангиотензинамида. В случае рефрактерной к медикаментозному лечению брадикардии может потребоваться установка временного искусственного водителя ритма. При передозировке необходимо мониторировать содержание креатинина и электролитов в сыворотке крови. Рамиприлат плохо выводится из крови с помощью гемодиализа. Взаимодействие с другими ЛС: Амлодипин Можно ожидать, что ингибиторы ферментов микросомального окисления печени (эритромицин у молодых, дилтиазем у пожилых, кетоконазол, итраконазол, ритонавир) будут повышать концентрацию амлодипина в плазме крови, усиливая риск побочных эффектов, а индукторы ферментов микросомального окисления печени - уменьшать. При одновременном применении амлодипина с циметидином фармакокинетика амлодипина не меняется. Одновременный однократный прием 240 мл грейпфрутового сока и 10 мг амлодипина внутрь не сопровождается существенным изменением фармакокинетики амлодипина. В отличие от других блокаторов "медленных" кальциевых каналов (БМКК), не было обнаружено клинически значимого взаимодействия амлодипина (III поколение БМКК) при совместном применении с НПВП, особенно индометацином. Возможно усиление антиангинального и антигипертензивного действия БМКК при совместном применении с тиазидными и "петлевыми" диуретиками, верапамилом, ингибиторами АПФ, бета-адреноблокаторами и нитратами, а также повышение их антигипертензивного действия при совместном применении с альфа 1-адреноблокаторами, нейролептиками. Хотя при изучении амлодипина отрицательного инотропного эффекта обычно не наблюдали, тем не менее, некоторые БМКК могут усиливать выраженность отрицательного инотропного действия антиаритмических препаратов, вызывающих удлинение интервала QT (например, амиодарон и хинидин). При совместном применении БМКК с препаратами лития (для амлодипина данные отсутствуют), возможно усиление проявления их нейротоксичности (тошнота, рвота, диарея, атаксия, тремор, шум в ушах). Амлодипин не влияет in vitro на степень связывания с белками плазмы крови дигоксина, фенитоина, варфарина и индометацина. Однократный прием алюминий/магний-содержащих антацидов не оказывает существенного влияния на фармакокинетику амлодипина. Однократный прием 100 мг силденафила у больных эссенциальной гипертензией не оказывает влияния на параметры фармакокинетики амлодипина. Повторное применение амлодипина в дозе 10 мг и аторвастатина в дозе 80 мг не сопровождается значительными изменениями показателей фармакокинетики аторвастатина. При одновременном применении амлодипина с дигоксином у здоровых добровольцев содержание дигоксина в сыворотке и его почечный клиренс не изменяются. При однократном и повторном применении в дозе 10 мг амлодипин не оказывает существенного влияния на фармакокинетику этанола. Амлодипин не влияет на изменение протромбинового времени, вызванное варфарином. Амлодипин не вызывает значительных изменений фармакокинетики циклоспорина. Не рекомендуемые комбинации Одновременное применение дантролена (в/в введение), индукторов изоферментов системы цитохрома СУРЗА4 (например, рифампицин, препараты Зверобоя продырявленного) и ингибиторов изоферментов системы цитохрома СУРЗА4 (ингибиторы протеазы, противогрибковые препараты группы азолов, макролиды, например, эритромицин или кларитромицин, верапамил или дилтиазем). Рамиприл Противопоказанные комбинации Применение некоторых высокопроточных мембран с отрицательно заряженной поверхностью (например, полиакрилнитрильных мембран) при проведении гемодиализа или гемофильтрации: применение декстрана сульфата при аферезе ЛПНП - риск развития тяжелых анафилактических реакций. Нерекомендуемые комбинации С солями калия, калийсберегающими диуретиками (например, амилоридом, триамтереном, спиронолактоном) и другими препаратами (в том числе с антагонистами рецепторов ангиотензина II (АРА II), с триметопримом, такролимусом, циклоспорином) - возможно развитие гиперкалемии (при одновременном применении требуется регулярный контроль содержания калия в сыворотке крови). Комбинации, которые следует применять с осторожностью С антигипертензивными средствами (особенно диуретиками) и другими препаратами, снижающими АД (нитратами, трициклическими антидепрессантами, средствами для общей и местной анестезии, этанолом, баклофеном, алфузозином, доксазозином, празозином, тамсулозином, теразозином) - потенцирование антигипертензивного эффекта. При комбинации с диуретиками следует контролировать содержание натрия в сыворотке крови. Со снотворными, наркотическими и обезболивающими средствами - возможно более выраженное снижение АД. С вазопрессорными симпатомиметиками (эпинефрином, изопротеренолом, добутамином, допамином) - уменьшение антигипертензивного действия рамиприла, требуется регулярный контроль АД. С аллопуринолом, прокаинамидом, цитостатиками, иммунодепрессантами, системными ГКС и другими средствами, которые могут влиять на гематологические показатели - совместное применение увеличивает риск развития лейкопении. С солями лития - повышение содержания лития в сыворотке и усиление кардио- и нейротоксического действия лития. С гипогликемическими средствами для приема внутрь (производными сульфонилмочевины, бигуанидами), инсулином - в связи с уменьшением инсулинорезистентности под влиянием рамиприла возможно усиление гипогликемического эффекта этих препаратов, вплоть до развития гипогликемии. Одновременное применение препаратов, содержащих алискирен, у пациентов с сахарным диабетом и почечной недостаточностью (КК менее 60 мл/мин), а также с вилдаглиптином - в связи с увеличением частоты развития ангионевротического отека при одновременном применении с ингибиторами АПФ. Комбинации, которые следует принимать во внимание С НПВП (индометацин, ацетилсалициловая кислота) - возможно ослабление действия рамиприла, повышение риска нарушения функции почек и повышения содержания калия в сыворотке крови. С гепарином - возможно повышение содержания калия в сыворотке крови. С натрия хлоридом - ослабление антигипертензивного действия рамиприла и менее эффективное лечение симптомов ХСН. С этанолом - усиление симптомов вазодилатации. Рамиприл может усиливать неблагоприятное воздействие этанола на организм. С эстрогенами - ослабление антигипертензивного действия рамиприла (задержка жидкости). Десенсибилизирующая терапия при повышенной чувствительности к ядам насекомых - ингибиторы АПФ, включая рамиприл, увеличивают вероятность развития тяжелых анафилактических или анафилактоидных реакций на яды насекомых. Фармакологическое действие и фармакокинетика Амлодипин Амлодипин - производное дигидропиридина. Связываясь с дигидропиридиновыми рецепторами, блокирует "медленные" кальциевые каналы, ингибирует трансмембранный переход кальция внутрь клеток гладких мышц сосудов и сердца (в большей степени - в гладкомышечные клетки сосудов, чем в кардиомиоциты). Оказывает антигипертензивный и антиангинальный эффекты. Механизм антигипертензивного действия амлодипина обусловлен прямым расслабляющим влиянием на гладкие мышцы сосудов. Амлодипин уменьшает ишемию миокарда следующими двумя путями: - Расширяет периферические артериолы и, таким образом, снижает ОПСС (постнагрузку), при этом ЧСС практически не изменяется, что приводит к снижению потребления энергии и потребности миокарда в кислороде. - Расширяет коронарные и периферические артерии и артериолы как в нормальных, так и в ишемизированных зонах миокарда, что увеличивает поступление кислорода в миокард у пациентов с вазоспастической стенокардией (стенокардия Принцметала) и предотвращает развитие коронароспазма, вызванного курением. У пациентов с АГ суточная доза амлодипина обеспечивает снижение АД на протяжении 24 ч (как в положении на спине, так и стоя). Благодаря медленному началу действия, амлодипин не вызывает резкого снижения АД. У пациентов со стенокардией разовая суточная доза препарата увеличивает продолжительность выполнения физической нагрузки, задерживает развитие очередного приступа стенокардии и депрессии сегмента ST (на 1 мм) на фоне физической нагрузки, снижает частоту приступов стенокардии и потребность в нитроглицерине. Применение амлодипина у пациентов с ИБС У пациентов с заболеваниями ССС (включая коронарный атеросклероз с поражением от одного сосуда и до стеноза 3 и более артерий и атеросклероза сонных артерий), перенесших ИМ, чрезкожную транслюминальную ангиопластику коронарных артерий (ТЛП) или страдающих стенокардией) применение амлодипина предупреждает развитие утолщения интимы-медии сонных артерий, значительно снижает летальность от сердечнососудистых причин, ИМ, инсульта, ТЛП, аорто-коронарного шунтирования, приводит к снижению числа госпитализаций по поводу нестабильной стенокардии и прогрессирования ХСН, снижает частоту вмешательств, направленных на восстановление коронарного кровотока. Применение амлодипина у пациентов с СП. Амлодипин не повышает риск смерти или развития осложнений и смертельных исходов у пациентов с ХСН III-IV ФК по NYHA на фоне терапии дигоксином, диуретиками и ингибиторами АИФ. У пациентов с ХСН III-IV ФК по NYHA неишемической этиологии при применении амлодипина существует вероятность возникновения отека легких. Амлодипин не вызывает неблагоприятных метаболических эффектов, в том числе он не влияет на содержание показателей липидного профиля. Рамиприл Рамиприлат, образующийся при участии "печеночных" ферментов активный метаболит рамиприла, является длительно действующим ингибитором фермента дипептидилкарбоксипептидазы I (синонимы: ангиотензинпревращающий фермент (АИФ), кининаза II). В плазме крови и в тканях этот фермент кининаза II катализирует превращение ангиотензина I в активное сосудосуживающее вещество - ангиотензин II, а также способствует распаду брадикинина. Снижение образования ангиотензина II и ингибирование распада брадикинина приводит к расширению сосудов и снижению артериального давления (АД). Повышение активности калликреин-кининовой системы в крови и тканях обуславливает кардиопротективное и эндотелиопретективное действие рамиприла за счет активации простагландиновой системы и, соответственно, увеличения синтеза простагландинов (ПГ), стимулирующих образование оксида азота (N0) в эндотелиоцитах. Ангиотензин II стимулирует выработку альдостерона, поэтому прием рамиприла приводит к снижению секреции альдостерона и повышению содержания ионов калия в сыворотке. При снижении содержания ангиотензина II в крови устраняется его ингибирующее влияние на секрецию ренина по типу отрицательной обратной связи, что приводит к повышению активности ренина плазмы крови. Предполагается, что развитие некоторых нежелательных реакций (в частности, "сухого" кашля) связано с повышением активности брадикинина. У пациентов с артериальной гипертензией (АГ) прием рамиприла приводит к снижению АД в положении на спине и стоя, без компенсаторного увеличения частоты сердечных сокращений (ЧСС). Рамиприл значительно снижает общее периферическое сопротивление сосудов (ОПСС), практически не вызывая изменений в почечном кровотоке и скорости клубочковой фильтрации. Антигипертензивное действие начинает проявляться через 1-2 ч после приема внутрь разовой дозы препарата, достигая наибольшего значения через 3-6 ч, и сохраняется в течение 24 ч. При курсовом приеме антигипертензивный эффект может постепенно увеличиваться, стабилизируясь обычно к 3-4 неделе регулярного приема препарата и затем сохраняясь в течение длительного времени. Внезапное прекращение приема препарата не приводит к быстрому и значительному повышению АД (отсутствие синдрома "отмены"). У пациентов с АГ рамиприл замедляет развитие и прогрессирование гипертрофии миокарда и сосудистой стенки. У пациентов с хронической сердечной недостаточностью (ХСН) рамиприл снижает ОПСС (уменьшение постнагрузки на сердце), увеличивает емкость венозного русла и снижает давление наполнения левого желудочка (ЛЖ), что, соответственно, приводит к уменьшению преднагрузки на сердце. У этих пациентов при приеме рамиприла наблюдается увеличение сердечного выброса, фракции выброса и улучшение переносимости физической нагрузки. При диабетической и недиабетической нефропатии прием рамиприла замедляет скорость прогрессирования почечной недостаточности и время наступления терминальной стадии почечной недостаточности и, благодаря этому, уменьшает потребность в процедурах гемодиализа или трансплантации почки. При начальных стадиях диабетической или недиабетической нефропатии рамиприл уменьшает степень выраженности альбуминурии. У пациентов с высоким риском развития заболеваний сердечно-сосудистой системы (ССС) вследствие наличия сосудистых поражений (диагностированная ишемическая болезнь сердца (ИБС), облитерирующие заболевания периферических артерий в анамнезе, инсульт в анамнезе) или сахарного диабета с не менее чем одним дополнительным фактором риска (микроальбуминурия, АГ, увеличение содержания общего холестерина, снижение содержания холестерина липопротеинов высокой плотности (ЛПВП), курение) добавление рамиприла к стандартной терапии значительно снижает частоту развития инфаркта миокарда (ИМ), инсульта и смертности от сердечно-сосудистых причин. Кроме этого, рамиприл снижает показатели общей смертности, а также потребность в процедурах реваскуляризации, замедляет возникновение или прогрессирование ХСН. У пациентов с сердечной недостаточностью (СН), развившейся в первые дни острого инфаркта миокарда (ОИМ) (2-9 сутки), при приеме рамиприла, начиная с 3 по 10 сутки ОИМ, снижается риск показателя смертности (на 27%), риск внезапной смерти (на 30%), риск прогрессирования ХСН до тяжелой - III-IV функциональный класс (ФК) по классификации Нью-Йоркской ассоциации кардиологов (NYHA) - резистентной к терапии (на 27%), вероятность последующей госпитализации из-за развития СН (на 26%). В общей популяции пациентов, а также у пациентов с сахарным диабетом, как с АГ, так и с нормальными показателями АД, рамиприл значительно снижает риск развития нефропатии и возникновения микроальбуминурии. Фармакокинетика: Амлодипин После приема внутрь в терапевтических дозах амлодипин хорошо абсорбируется, время достижения максимальной концентрации в плазме крови (ТСmах) при пероральном приеме составляет 6-12 ч. Абсолютная биодоступность оставляет 64-80%. Vd составляет примерно 21 л/кг. Связь с белками плазмы крови составляет примерно 97,5%. Прием пищи не влияет на всасывание амлодипина. Препарат проникает через гематоэнцефалический барьер. Т1/2 из плазмы крови составляет около 35-50 ч, что соответствует назначению препарата один раз в сутки. У пациентов с печеночной недостаточностью и тяжелой ХСН Т1/2 увеличивается до 56-60 ч. Общий клиренс - 0,43 л/ч/кг. Стабильная Css (5-15 нг/мл) достигается через 7-8 дней постоянного приема амлодипина, он метаболизируется в печени с образованием неактивных метаболитов. 10% исходного препарата и 60% метаболитов выводится почками, а 20% - через кишечник. Выведение с грудным молоком неизвестно. В ходе гемодиализа амлодипин не удаляется. Применение у больных почечной недостаточностью Т1/2 из плазмы крови у больных с почечной недостаточностью увеличивается до 60 ч. Изменение концентрации амлодипина в плазме крови не коррелирует со степенью нарушения функции почек. Применение у пожилых пациентов У пожилых пациентов ТСmах и Сmах амлодипина практически не отличаются от таковых у более молодых пациентов. У пациентов пожилого возраста, страдающих ХСН, отмечена тенденция к снижению клиренса амлодипина, что приводит к увеличению AUC и Т1/2 до 65 ч. Рамиприл После приема внутрь рамиприл быстро всасывается из желудочно-кишечного тракта (ЖКТ) (50-60%). Прием пищи замедляет его абсорбцию, но не влияет на степень всасывания. Рамиприл подвергается интенсивному пресистемному метаболизму/активации (главным образом, в печени путем гидролиза), в результате которого образуется его единственный активный метаболит - рамиприлат, активность которого в отношении ингибирования АПФ примерно в 6 раз превышает активность рамиприла. Кроме этого, в результате метаболизма рамиприла образуется не обладающий фармакологической активностью дикетопиперазин, который затем подвергается конъюгации с глюкуроновой кислотой. Рамиприлат также глюкуронируется и метаболизируется до дикетопиперазиновой кислоты. Биодоступность рамиприла после приема внутрь колеблется от 15% (для дозы 2,5 мг) до 28% (для дозы 5 мг). Биодоступность рамиприлата после приема внутрь 2,5 мг и 5 мг рамиприла составляет приблизительно 45% (по сравнению с его биодоступностью после внутривенного введения в тех же дозах). После приема рамиприла внутрь максимальные концентрации в плазме крови (Стmах) рамиприла и рамиприлата достигаются через 1 и 2-4 ч, соответственно. Снижение концентрации рамиприлата в плазме крови происходит в несколько этапов: фаза распределения и выведения с периодом полувыведения (Т1/2) рамиприлата, составляющим приблизительно 3 ч, затем промежуточная фаза с Т1/2 рамиприлата, составляющим приблизительно 15 ч, и конечная фаза с очень низкой концентрацией рамиприлата в плазме крови и Т1/2 рамиприлата, составляющим приблизительно 4-5 дней. Эта конечная фаза обусловлена медленным высвобождением рамиприлата из прочной связи с рецепторами АПФ. Несмотря на продолжительную конечную фазу при однократном в течение суток приеме рамиприла внутрь в дозе 2,5 мг и более, равновесная плазменная концентрация (Css) рамиприлата достигается приблизительно через 4 дня лечения. При курсовом назначении препарата "эффективный" Т1/2 в зависимости от дозы составляет 13-17 ч. Связывание с белками плазмы крови приблизительно составляет для рамиприла 73%, а для рамиприлата - 56%. После внутривенного (в/в) введения объемы распределения (Vd) рамиприла и рамиприлата составляют приблизительно 90 и 500 л, соответственно. После приема внутрь меченного радиоактивным изотопом рамиприла (10 мг) 39% радиоактивности выводится через кишечник и около 60% - почками. После в/в введения рамиприла, 50-60% дозы обнаруживается в моче в виде рамиприла и его метаболитов. После в/в введения рамиприлата около 70% дозы обнаруживается в моче в виде рамиприлата и его метаболитов, иначе говоря, при в/в введении рамиприла и рамиприлата значительная часть дозы выводится через кишечник с желчью, минуя почки (50 и 30%, соответственно). После приема внутрь 5 мг рамиприла у пациентов с дренированием желчных протоков практически одинаковые количества рамиприла и его метаболитов выделяются почками и через кишечник в течение первых 24 ч после приема. Приблизительно 80-90% метаболитов в моче и желчи были идентифицированы как рамиприлат и метаболиты рамиприлата. Рамиприла глюкуронид и рамиприла дикетопиперазин составляют приблизительно 10-20% от общего количества, а содержание в моче неметаболизированного рамиприла составляет приблизительно 2%. При нарушениях функции почек с клиренсом креатинина (КК) менее 60 мл/мин выведение рамиприлата и его метаболитов почками замедляется. Это приводит к повышению концентрации рамиприлата в плазме крови, которая снижается медленнее, чем у пациентов с нормальной функцией почек. При приеме рамиприла в высоких дозах (10 мг) нарушение функции печени приводит к замедлению пресистемного метаболизма рамиприла до активного рамиприлата и более медленному выведению рамиприлата. У здоровых добровольцев и у пациентов с АГ после 2 недель лечения рамиприлом в суточной дозе 5 мг не наблюдается клинически значимого накопления рамиприла и рамиприлата. У пациентов с ХСН после 2 недель лечения рамиприлом в суточной дозе 5 мг отмечается 1,5-1,8-кратное увеличение концентраций рамиприлата в плазме крови и площади под фармакокинетической кривой концентрации вещества в плазме в зависимости от времени (AUC). У здоровых добровольцев пожилого возраста (65-76 лет) фармакокинетика рамиприла и рамиприлата существенно не отличается от таковой у молодых здоровых добровольцев. Особые указания Особые указания, относящиеся к рамиприлу и амлодипину, применимы к препарату Эгипрес. Особые указания, относящиеся к приему амлодипина При лечении АГ амлодипин может сочетаться с приемом тиазидных диуретиков, альфа- и бета-адреноблокаторов, ингибиторов АПФ, нитратов пролонгированного действия, сублингвальным нитроглицерином, НПВП, антибиотиками и гипогликемическими средствами для приема внутрь. При лечении стенокардии амлодипин можно назначать в комбинации с другими антиангинальными средствами, в том числе у пациентов, рефрактерных к лечению нитратами и/или бета-адреноблокаторами в адекватных дозах. Амлодипин не оказывает какого-либо неблагоприятного влияния на обмен веществ и липиды плазмы крови и может применяться при лечении пациентов с бронхиальной астмой, сахарным диабетом и подагрой. Амлодипин может быть применен и в тех случаях, когда пациент предрасположен к вазоспазму/вазоконстрикции. Пациентам с малой массой тела, невысокого роста и пациентам с выраженным нарушением функций печени может потребоваться меньшая дозировка. Во время лечения необходим контроль массы тела и наблюдение у стоматолога (для предотвращения болезненности, кровоточивости и гиперплазии десен). Особые указания, относящиеся к приему рамиприла Перед началом лечения рамиприлом необходимо устранить гипонатриемию и гиповолемию. Пациентам, ранее принимавшим диуретики, необходимо их отменить или, по крайней мере, снизить их дозу за 2-3 дня до начала приема рамиприла (в этом случае следует регулярно контролировать состояние пациентов с ХСН, в связи с возможностью развития у них декомпенсации при увеличении ОЦК). После приема первой дозы препарата, а также при увеличении его дозы и/или дозы диуретиков (особенно "петлевых"), необходимо обеспечить регулярное медицинское наблюдение за пациентом в течение не менее 8 ч для своевременного принятия соответствующих мер в случае чрезмерного снижения АД. Если рамиприл используется впервые или в высокой дозе у пациентов с повышенной активностью РААС, то у них следует регулярно контролировать АД, особенно в начале лечения, т.к. у этих пациентов имеется повышенный риск чрезмерного снижения АД. При злокачественной АГ и СН, в особенности в острой стадии ИМ, лечение с применением рамиприла следует начинать только в условиях стационара. У пациентов с ХСН прием препарата может привести к развитию выраженного снижения АД, которое в ряде случаев сопровождается олигурией или азотемией и редко - развитием острой почечной недостаточности. Следует соблюдать осторожность при лечении пожилых пациентов, т.к. они могут быть особенно чувствительны к ингибиторам АПФ: в начальной фазе лечения рекомендуется контролировать показатели функции почек. У пациентов, для которых снижение АД может представлять определенный риск (например, у пациентов с атеросклеротическим сужением коронарных или мозговых артерий), лечение должно начинаться под строгим медицинским наблюдением. Следует соблюдать осторожность при физической нагрузке и/или жаркой погоде из-за риска повышенного потоотделения и дегидратации с развитием артериальной гипотензии вследствие уменьшения ОЦК и снижения содержания натрия в крови. Во время лечения не рекомендуется употреблять алкоголь. Преходящая артериальная гипотензия не является противопоказанием для продолжения лечения после стабилизации АД. В случае повторного возникновения выраженной артериальной гипотензии следует уменьшить дозу или отменить препарат. У пациентов, получавших лечение ингибиторами АПФ, наблюдались случаи ангионевротического отека лица, конечностей, губ, языка, глотки или гортани. При возникновении отечности в области лица (губы, веки) или языка, либо нарушении глотания или дыхания, пациент должен немедленно прекратить прием препарата. Ангионевротический отек, локализующийся в области языка, глотки, или гортани (возможные симптомы: нарушение глотания или дыхания), может угрожать жизни и требует проведения неотложных мер по его купированию: подкожное введение 0,3-0,5 мг или внутривенное капельное введение 0,1 мг эпинефрина (под контролем АД, ЧСС и ЭКГ) с последующим применением ГКС (в/в, в/м, или внутрь): также рекомендуется внутривенное введение антигистаминных средств (антагонистов H1- и Н2-гистаминовых рецепторов), а в случае недостаточности инактиваторов фермента C1-эстеразы можно рассмотреть вопрос о необходимости введения в дополнение к эпинефрину ингибиторов фермента C1-эстеразы. Пациент должен быть госпитализирован, и наблюдение за ним должно проводиться до полного купирования симптомов, но не менее 24 ч. У пациентов, получавших ингибиторы АПФ, наблюдались случаи интестинального ангионевротического отека, который проявлялся болями в животе с тошнотой и рвотой или без них: в некоторых случаях одновременно наблюдался и ангионевротический отек лица. При появлении у пациента на фоне лечения ингибиторами АПФ вышеописанных симптомов следует при проведении дифференциального диагноза рассматривать и возможность развития у них интестинального ангионевротического отека. Лечение, направленное на десенсибилизацию к яду насекомых (пчелы, осы), и одновременный прием ингибиторов АПФ могут инициировать анафилактические и анафилактоидные реакции (например, снижение АД, одышку, рвоту, аллергические кожные реакции), которые могут иногда быть опасными для жизни. На фоне лечения ингибиторами АПФ реакции повышенной чувствительности на яд насекомых (например, пчел, ос) развиваются быстрее и протекают тяжелее. Если необходимо проведение десенсибилизации к яду насекомых, то ингибитор АПФ должен быть временно заменен соответствующим ЛС другого класса. При использовании ингибиторов АПФ были описаны опасные для жизни, быстро развивающиеся анафилактоидные реакции, иногда вплоть до развития шока во время проведения гемодиализа или плазмофильтрации с применением определенных высокопроточных мембран (например, полиакрилнитрильных мембран) (см. также инструкции производителей мембран). Необходимо избегать совместного использования рамиприла и такого рода мембран (например, для срочного гемодиализа или гемофильтрации). В данном случае предпочтительно применение других мембран или исключение приема ингибитора АПФ. Сходные реакции наблюдались при аферезе ЛПНП с применением декстрана сульфата. Поэтому данный метод не следует применять у пациентов, получающих ингибитор АПФ. У пациентов с нарушениями функции печени реакция на лечение препаратами рамиприла может быть или усиленной или ослабленной. Кроме этого, у пациентов с тяжелым циррозом печени с отеками и/или асцитом возможна значительная активация РААС, поэтому при лечении этих пациентов следует соблюдать особую осторожность. Перед хирургическим вмешательством (включая стоматологическое) необходимо предупредить хирурга/анестезиолога о применении ингибитора АПФ. Применение ингибитора АПФ у пациентов, подвергающихся обширному хирургическому вмешательству и/или общей анестезии, может привести к выраженному снижению АД, если используются средства для общей анестезии с гипотензивным действием. Это связано с блокированием образования ангиотензина II на фоне компенсаторного повышения активности ренина. В таком случае следует увеличить объем циркулирующей жидкости. Рекомендуется прекратить прием ингибитора АПФ за 24 часа до хирургического вмешательства. На основании результатов эпидемиологических исследований предполагается, что одновременный прием ингибиторов АПФ и инсулина, а также гипогликемических средств для приема внутрь может приводить к развитию гипогликемии. Наибольший риск развития наблюдается в течение первых недель комбинированной терапии, а также у пациентов с нарушением функции почек. У пациентов с сахарным диабетом требуется регулярный контроль гликемии, особенно во время первого месяца терапии ингибиторами АПФ. Рекомендуется вести тщательное наблюдение за новорожденными, которые подвергались внутриутробному воздействию ингибиторами АПФ, для выявления артериальной гипотензии, олигурии и гиперкалиемии. При олигурии необходимо поддержание АД и почечной перфузии путем введения соответствующих жидкостей и сосудосуживающих средств. У таких новорожденных имеется риск развития олигурии и неврологических расстройств, возможно, из-за снижения почечного и мозгового кровотока вследствие снижения АД, вызываемого ингибиторами АПФ. На фоне терапии ингибиторами АПФ может возникать "сухой" кашель. Кашель длительно сохраняется на фоне приема препаратов этой группы и исчезает после их отмены. При появлении у пациента "сухого" кашля следует помнить о возможном ятрогенном характере этого симптома. У пациентов негроидной расы чаще, чем у представителей других рас, на фоне приема ингибиторов АПФ развивается ангионевротический отек. Рамиприл, как и другие ингибиторы АПФ, возможно оказывает менее выраженное антигипертензивное действие у пациентов негроидной расы по сравнению с представителями других рас. Возможно, это различие обусловлено тем, что у пациентов с АГ негроидной расы чаще отмечается низкая активность ренина. Контроль лабораторных показателей до и во время лечения рамиприлом (до 1 раза в месяц в первые 3-6 мес лечения) включает: Контроль функции почек (определение содержания креатинина в сыворотке) При лечении ингибиторами АПФ в первые недели лечения и в последующем рекомендуется проводить контроль функции почек. Особенно тщательный контроль требуется пациентам с СН, нарушением функции почек, после трансплантации почек, пациентам с реноваскулярными заболеваниями, включая пациентов с гемодинамически значимым односторонним стенозом почечной артерии при наличии двух почек (у таких пациентов даже незначительное повышение уровня сывороточного креатинина может быть показателем снижения функции почек). Контроль содержания электролитов Рекомендуется регулярный контроль содержания калия в сыворотке крови. Особенно тщательный мониторинг содержания калия в сыворотке крови требуется пациентам с нарушениями функции почек, значимыми нарушениями водно-электролитного баланса, ХСН. Контроль гематологических показателей (содержание гемоглобина, количества лейкоцитов, эритроцитов, тромбоцитов, лейкоцитарная формула) Рекомендуется контролировать показатели общего анализа крови для выявления возможной лейкопении. Более регулярный мониторинг рекомендуется в начале лечения и у пациентов с нарушением функции почек, а также у пациентов с заболеваниями соединительной ткани или у пациентов, получающих одновременно другие ЛС, способные изменять картину периферической крови. Контроль количества лейкоцитов необходим для раннего выявления лейкопении, что особенно важно у пациентов с повышенным риском ее развития, а также при первых признаках развития инфекции. При выявлении нейтропении (число нейтрофилов меньше 2000/мкл) требуется прекращение лечения рамиприлом. При появлении симптоматики, обусловленной лейкопенией (например, лихорадки, увеличения лимфатических узлов, тонзиллита), необходим срочный контроль картины периферической крови. В случае появления признаков кровоточивости (мельчайших петехий, красно-коричневых высыпаний на коже и слизистых оболочках) необходим также контроль числа тромбоцитов в периферической крови. Определение активности "печеночных" ферментов, концентрации билирубина в крови При появлении желтухи или значимого повышения активности "печеночных" ферментов лечение рамиприлом следует прекратить и обеспечить врачебное наблюдение за пациентом. Влияние на способность управлять транспортными средствами: В период лечения препаратом рекомендуется воздерживаться от управления транспортными средствами и от занятий другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций (возможно головокружение, особенно в начале лечения, и у пациентов, принимающих диуретические ЛС, снижение концентрации внимания). После первой дозы, а также после значительного повышения дозы препарата не рекомендуется управлять транспортными средствами и работать с техническим оборудованием в течение нескольких часов. Условия хранения и отпуска из аптек Условия хранения:При температуре не выше 25 °С. Хранить в недоступном для детей месте. Отпуск из аптек: По рецепту Регистрационные данные Торговое название Эгипрес® Международное непатентованное название:Амлодипин + Рамиприл. Форма выпуска:капсулы. Состав:Состав на 1 капсулу: Действующие вещества: амлодипина безилат 3,475/6,95/6,95/13,9/13,9 мг (что соответствует амлодипина 2,5/5/5/10/10 мг) и рамиприл 2,5/5/10/5/10 мг. Вспомогательные вещества: кросповидон 10/20/40/40/40 мг, гипромеллоза 0,59/1,18/2,36/2,36/2,36 мг, целлюлоза микрокристаллическая 57,41/114,82/229,64/229,64/229,64 мг, глицерил дибегенат 1,025/2,05/4,1/4,1/4,1 мг. Состав твердой желатиновой капсулы (CONI-SNAP 3), код цвета крышки и основания 37350 (капсулы 2,5 мг+2,5 мг): краситель железа оксид красный (Е172), титана диоксид, желатин. Состав твердой желатиновой капсулы (CONI-SNAP 3), код цвета крышки и основания 51072 (капсулы 5 мг+5 мг): краситель бриллиантовый голубой (Е133), краситель красный очаровательный (Е129), титана диоксид, желатин. Состав твердой желатиновой капсулы (CONI-SNAP 0), код цвета крышки и основания: 51072/37350 (капсулы 5 мг+10 мг): крышка: титана диоксид, краситель бриллиантовый голубой (Е133), краситель красный очаровательный (Е129), желатин: основание: титана диоксид, краситель железа оксид красный (Е172), желатин. Состав твердой желатиновой капсулы (CONI-SNAP 0), код цвета крышки и основания: 33007/37350 (капсулы 10 мг+5 мг): крышка: титана диоксид, краситель азорубин (Е122), индигокармин (Е132), желатин: основание: титана диоксид, краситель железа оксид красный (Е172), желатин. Состав твердой желатиновой капсулы (CONI-SNAP 0), код цвета крышки и основания: 33007 (капсулы 10 мг+10 мг): краситель азорубин (Е122), индигокармин (Е132), титана диоксид, желатин. АТХ: Регистрация: Лекарственное средство ЛП-002402 Фармгруппа: гипотензивное средство комбинированное (ангиотензинпревращающего фермента ингибитор + блокатор "медленных" кальциевых каналов)Дата регистрации: 18.03.2014. Окончание регстрации: . Описание:Капсулы 2,5 мг+2,5 мг: Твердые желатиновые капсулы CONI-SNAP 3, самозакрывающиеся, с основанием и крышкой светло-розового цвета, содержащие смесь гранул и порошков белого или почти белого цвета, без или почти без запаха. Капсулы 5 мг+5 мг: Твердые желатиновые капсулы CONI-SNAP 3, самозакрывающиеся, с основанием и крышкой светло-бордового цвета, содержащие смесь гранул и порошков белого или почти белого цвета, без или почти без запаха. Капсулы 5 мг+10 мг: Твердые желатиновые капсулы CONI-SNAP 0, самозакрывающиеся, с основанием светло-розового цвета и крышкой светло-бордового цвета, содержащие смесь гранул и порошков белого или почти белого цвета, без или почти без запаха. Капсулы 10 мг+5 мг: Твердые желатиновые капсулы CONI-SNAP 0, самозакрывающиеся, с основанием светло-розового цвета и крышкой темно-бордового цвета, содержащие смесь гранул и порошков белого или почти белого цвета, без или почти без запаха. Капсулы 10 мг+10 мг: Твердые желатиновые капсулы CONI-SNAP 0, самозакрывающиеся, с основанием и крышкой темно-бордового цвета, содержащие смесь гранул и порошков белого или почти белого цвета, без или почти без запаха. Упаковка:Капсулы 2,5 мг+2,5 мг, 5 мг+5 мг, 5 мг+10 мг, 10 мг+5 мг, 10 мг+ 10 мг. По 7 или 10 капсул в блистере из комбинированной пленки "cold" (поли- амид/алюминиевая фольга УПВХ)//алюминиевая фольга. 4 или 8 блистеров (по 7 капсул) или 3 или 9 блистеров (по 10 капсул) в картонной пачке вместе с инструкцией по применению. Срок годности:3 года. Не использовать по истечении срока годности, указанного на упаковке. Владелец рег.удостоверения:Эгис Фармацевтический завод ОАО Производитель:EGIS PHARMACEUTICALS, Plc. Представительство:ЭГИС ЗАО фармацевтический завод