мальчики письмо печатные длинные брюки дети весна осень повседневная свободная высокая талия спортивные брюки

Модель:
RUR 145
Показания Сахарный диабет 2 типа, особенно у пациентов с ожирением, при неэффективности диетотерапии и физических нагрузок- у взрослых в качестве монотерапии или в сочетании с другими пероральными гипогликемическими средствами, или с инсулином- у детей с 10 лет в качестве монотерапии или в сочетании с инсулином. Противопоказания Противопоказания - Повышенная чувствительность к метформину или к любому вспомогательному веществу- диабетический кетоацидоз, диабетическая прекома, кома: " почечная недостаточность или нарушение функции почек (клиренс креатинина (КК) менее 60 мл/мин)- острые состояния, протекающие с риском развития нарушения функции почек: дегидратация (при диарее, рвоте), тяжёлые инфекционные заболевания, шок- клинически выраженные проявления острых или хронических заболеваний, которые могут приводить к развитию тканевой гипоксии (в том числе, сердечная или дыхательная недостаточность, острый инфаркт миокарда)- обширные хирургические операции и травмы, когда показано проведение инсулинотерапии (см. раздел "Особые указания")- печёночная недостаточность, нарушение функции печени- хронический алкоголизм, острое отравление алкоголем- беременность- лактоацидоз (в т.ч. и в анамнезе)- применение в течение менее 48 ч до и в течение 48 ч после проведения радиоизотопных или рентгенологических исследований с введением йодсодержащего контрастного вещества (см. раздел "Взаимодействие с другими лекарственными средствами")- соблюдение низкокалорийной диеты (менее 1000 ккал/сут)- детский возраст до 10 лет. С осторожностью: Применять препарат у лиц старше 60 лет, выполняющих тяжелую физическую работу, что связано с повышенным риском развития у них лактоацидоза: в период грудного вскармливания. Беременность Ограниченное количество данных свидетельствует о том, что прием метформина у беременных женщин не увеличивает риск развития врожденных пороков у детей. При планировании беременности, а также в случае наступления беременности на фоне приема метформина, препарат должен быть отменен, и назначена инсулинотерапия. Необходимо поддерживать содержание глюкозы в плазме крови на уровне, наиболее близком к норме для снижения риска возникновения пороков развития плода. Метформин выводится с грудным молоком. Побочные эффекты у новорожденных при грудном вскармливании на фоне приема метформина не наблюдались. Однако в связи с ограниченным количеством данных, применение препарата в период кормления грудью не рекомендовано. Решение о прекращении кормления грудью должно быть принято с учетом пользы от грудного вскармливания и потенциального риска возникновения побочных эффектов у ребенка. Применение и дозы Таблетки следует принимать внутрь, проглатывать целиком, не разжевывая, во время или непосредственно после еды, запивая достаточным количеством воды. Взрослые: монотерапия и комбинированная терапия в сочетании с другими пероральными гипогликемическими средствами- Обычная начальная доза составляет 500 мг или 850 мг 2-3 раза в сутки после или во время приема пищи. Возможно дальнейшее постепенное увеличение дозы в зависимости от концентрации глюкозы в крови- Поддерживающая доза препарата обычно составляет 1500-2000 мг/сут. Для уменьшения побочных явлений со стороны желудочно-кишечного тракта суточную дозу следует разделить на 2-3 приема. Максимальная доза составляет 3000 мг/сут, разделенная на три приема- Медленное увеличение дозы может способствовать улучшению желудочно-кишечной переносимости- Пациенты, принимающие метформин в дозах 2000-3000 мг/сут, могут быть переведены на прием препарата 1000 мг. Максимальная рекомендованная доза составляет 3000 мг/сут, разделенная на 3 приема.В случае планирования перехода с приёма другого гипогликемического средства: необходимо прекратить приём другого средства и начать приём препарата Метформин в дозе, указанной выше. Комбинация с инсулином:Для достижения лучшего контроля глюкозы в крови метформин и инсулин можно применять в виде комбинированной терапии. Обычная начальная доза препарата Метформин 500 мг или 850 мг составляет одну таблетку 2-3 раза в сутки, препарата Метформин 1000 мг - одну таблетку 1 раз в сутки, в то время как дозу инсулина подбирают на основании концентрации глюкозы в крови. Дети и подростки: у детей с 10-летнего возраста препарат Метформин может применяться как в монотерапии, так и в сочетании с инсулином. Обычная начальная доза составляет 500 мг или 850 мг 1 раз в сутки после или во время приема пищи. Через 10-15 дней дозу необходимо скорректировать на основании концентрации глюкозы крови. Максимальная суточная доза составляет 2000 мг, разделенная на 2-3 приема. Пациенты пожилого возраста: из-за возможного снижения функции почек дозу метформина необходимо подбирать под регулярным контролем показателей функции почек (определять концентрацию креатинина в сыворотке крови не менее 2-4 раз в год). Длительность лечения определяет врач. Не рекомендуется прерывание приема препарата без указания лечащего врача. Побочные эффекты и передозировка Побочные эффекты: Частота побочных эффектов препарата расценивается следующим образом:Очень частые: 1/10 Частые: 1/100, <: 1/10 Нечастые: 1/1000, <: 1/100 Редкие: 1/10 000, <: 1/1000 Очень редкие: <: 1/10 000. Неизвестные: не могут оцениваться при имеющихся данных. Побочное действие представлено в порядке снижения значимости. Нарушения со стороны обмена веществ и питания: Очень редко: лактоацидоз (см. "Особые указания"). При длительном приёме метформина может наблюдаться снижение всасывания витамина В12. При обнаружении мегалобластной анемии необходимо учитывать возможность такой этиологии. Нарушения со стороны нервной системы:Часто: нарушение вкуса. Нарушения со стороны желудочно-кишечного тракта:Очень часто: тошнота, рвота, диарея, боли в животе и отсутствие аппетита. Наиболее часто они возникают в начальный период лечения и в большинстве случаев спонтанно проходят. Для предотвращения симптомов рекомендуется принимать метформин 2 или 3 раза в день во время или после приема пищи. Медленное увеличение дозы может улучшить желудочно-кишечную переносимость. Нарушения со стороны кожа и подкожных тканей:Очень редко: кожные реакции такие, как эритема, зуд, сыпь. Нарушения со стороны печени и желчевыводяишх путей:Очень редко: нарушение показателей функции печени и гепатит: после отмены метформина эти нежелательные явления полностью исчезают. Опубликованные данные, постмаркетинговые данные, а так же контролируемые клинические исследования в ограниченной детской популяции в возрастной группе 10 -16 лет показывают, что побочные эффекты у детей по характеру и тяжести схожи с таковыми у взрослых пациентов. Передозировка: Симптомы: при применении метформина в дозе 85 г (в 42,5 раз превышающей максимальную суточную дозу) гипогликемии не наблюдалось, однако отмечалось развитие лактоацидоза. Значительная передозировка метформина или сопряженные факторы риска могут привести к развитию лактоацидоза (см. "Особые указания"). Лечение: в случае появления признаков лактоацидоза лечение препаратом необходимо немедленно прекратить, пациента срочно госпитализировать и, определив концентрацию лактата, уточнить диагноз. Наиболее эффективным мероприятием по выведению из организма лактата и метформина является гемодиализ. Проводят также симптоматическое лечение. Взаимодействие с другими ЛС: Противопоказанные комбинации. Йодсодержащие рентгеноконтрастные средства: на фоне функциональной почечной недостаточности у больных сахарным диабетом радиологическое исследование с применением йодсодержащих рентгеноконтрастных средств может вызывать развитие лактоацидоза. Лечение метформином необходимо отменить в зависимости от функции почек за 48 ч до или на время рентгенологического исследования с применением йодсодержащих рентгеноконтрастных средств и не возобновлять ранее 48 ч после, при условии, что в ходе обследования почечная функция была признана нормальной. Нерекомендуемые комбинации. Алкоголь: при острой алкогольной интоксикации увеличивается риск развития лактоацидоза, особенно в случае- недостаточного питания, соблюдения низкокалорийной диеты- печёночной недостаточности. Во время приема препарата следует избегать приема алкоголя и лекарственных средств, содержащих этанол. Комбинации, требующие осторожности. Даназол: не рекомендуется одновременный прием даназола во избежание гипергликемического действия последнего. При необходимости лечения даназолом и после прекращения приема последнего требуется коррекция дозы метформина под контролем концентрации глюкозы в крови. Хлорпромазин: при приеме в больших дозах (100 мг в день) повышает концентрацию глюкозы в крови, снижая высвобождение инсулина. При лечении нейролептиками и после прекращения приема последних требуется коррекция дозы препарата под контролем концентрации глюкозы в крови. Глюкокортикостероиды (ГКС) системного и местного действия снижают толерантность к глюкозе, повышают концентрацию глюкозы в крови, иногда вызывая кетоз. При лечении ГКС и после прекращения приема последних требуется коррекция дозы метформина под контролем концентрации глюкозы в крови. Диуретики: одновременный прием "петлевых" диуретиков может привести к развитию лактоацидоза из-за возможной функциональной почечной недостаточности. Не следует назначать метформин, если КК ниже 60 мл/мин. Назначаемые в виде инъекций бета 2-адреномиметики: повышают концентрацию глюкозы в крови вследствие стимуляции бета 2-адренорецепторов. В этом случае необходим контроль концентрации глюкозы в крови. При необходимости рекомендуется назначение инсулина. При одновременном применении вышеперечисленных лекарственных средств может потребоваться более частый контроль содержания глюкозы в крови, особенно в начале лечения. При необходимости доза метформина может быть скорректирована в процессе лечения и после его прекращения. Ингибиторы ангиотензинпревращающего фермента и другие гипотензивные лекарственные средства могут снижать концентрацию глюкозы в крови. При необходимости следует скорректировать дозу метформина. При одновременном применении метформина с производными сулъфонилмочевины, инсулином, акарбозой, салицилатами возможно развитие гипогликемии. Нифедипин повышает абсорбцию и Сmax метформина. Катионные лекарственные средства (амилорид, дигоксин, морфин, прокаинамид, хинидин, хинин, ранитидин, триамтерен, триметоприм и ванкомицин), секретирующиеся в почечных канальцах, конкурируют с метфомином за канальцевые транспортные системы и могут приводить к увеличению его Сmax Фармакологическое действие и фармакокинетика Метформин снижает гипергликемию, не приводя к развитию гипогликемии. В отличие от производных сульфонилмочевины, не стимулирует секрецию инсулина и не оказывает гипогликемического эффекта у здоровых лиц. Повышает чувствительность периферических рецепторов к инсулину и утилизацию глюкозы клетками. Тормозит глюконеогенез в печени. Задерживает всасывание углеводов в кишечнике. Метформин стимулирует синтез гликогена, воздействуя на гликогенсинтазу. Увеличивает транспортную емкость всех типов мембранных переносчиков глюкозы. Кроме того, оказывает благоприятный эффект на метаболизм липидов: снижает содержание общего холестерина, липопротеинов низкой плотности и триглицеридов. На фоне приема метформина масса тела пациента либо остается стабильной, либо умеренно снижается. Фармакокинетика: После приема внутрь метформин абсорбируется из желудочно-кишечного тракта достаточно полно. Абсолютная биодоступность составляет 50-60%. Максимальная концентрация (Сmax) (примерно 2 мкг/мл или 15 мкмоль) в плазме достигается через 2,5 ч. При одновременном приеме пищи абсорбция метформина снижается и задерживается. Метформин быстро распределяется в ткани, практически не связывается с белками плазмы. Подвергается метаболизму в очень слабой степени и выводится почками. Клиренс метформина у здоровых субъектов составляет 400 мл/мин (в 4 раза больше, чем клиренс креатинина), что свидетельствует о наличии активной канальциевой секреции. Период полувыведения составляет приблизительно 6,5 часов. При почечной недостаточности он возрастает, появляется риск кумуляции препарата. Особые указания Лактоацидоз. Лактоацидоз является редким, но серьёзным (высокая смертность при отсутствии неотложного лечения) осложнением, которое может возникнуть из-за кумуляции метформина. Случаи лактоацидоза при приеме метформина возникали, в основном, у пациентов с сахарным диабетом с выраженной почечной недостаточностью. Следует учитывать и другие сопряженные факторы риска, такие как декомпенсированный сахарный диабет, кетоз, продолжительное голодание, алкоголизм, печёночная недостаточность и любое состояние, связанное с выраженной гипоксией, что может помочь снизить частоту случаев возникновения лактоацидоза. Следует учитывать риск развития лактоацидоза при появлении неспецифических признаков, таких как мышечные судороги, сопровождающиеся диспепсическими расстройствами, болью в животе и выраженной астенией. Лактоацидоз характеризуется ацидотической одышкой, болью в животе и гипотермией с последующей комой. Диагностическими лабораторными показателями являются снижение pH крови (менее 7,25), содержание лактата в плазме крови свыше 5 ммоль/л, повышенные анионный промежуток и отношение лактат/пируват. При подозрении на лактоацидоз необходимо прекратить прием препарата и немедленно обратиться к врачу. Хирургические операции. Применение метформина должно быть прекращено за 48 ч до проведения плановых хирургических операций и может быть продолжено не ранее чем через 48 ч после, при условии, что в ходе обследования почечная функция была признана нормальной. Функция почек. Поскольку метформин выводится почками, перед началом лечения и регулярно в последующем, необходимо определять КК: не реже одного раза в год у пациентов с нормальной функцией почек, и 2-4 раза в год у пожилых пациентов, а также у пациентов с КК на нижней границе нормы. Следует проявлять особую осторожность при возможном нарушении функций почек у пожилых пациентов, при одновременном применении гипотензивных препаратов, диуретиков или нестероидных противовоспалительных препаратов. Дети и подростки. Диагноз сахарного диабета 2 типа должен быть подтвержден до начала лечения метформином.В ходе клинических исследований продолжительностью 1 год было показано, что метформин не влияет на рост и половое созревание. Однако, в виду отсутствия долгосрочных данных, рекомендован тщательный контроль последующего влияния метформина на эти параметры у детей, особенно в период полового созревания. Наиболее тщательный контроль необходим у детей в возрасте 10-12 лет. Другие меры предосторожности:Пациентам рекомендуется продолжать соблюдать диету с равномерным потреблением углеводов в течение дня. Пациентам с избыточной массой тела рекомендуется продолжать соблюдать низкокалорийную диету (но не менее 1000 ккал/сут). Рекомендуется регулярно проводить стандартные лабораторные анализы для контроля сахарного диабета. Метформин при монотерапии не вызывает гипогликемию, однако рекомендуется проявлять осторожность при его применении в комбинации с инсулином или другими гипогликемическими средствами (например, производными сульфонилмочевины или репаглинидом). Влияние на способность управлять транспортными средствами: Монотерапия препаратом Метформин не вызывает гипогликемии, поэтому не влияет на способность управлять транспортными средствами и механизмами. Тем не менее, следует предостеречь пациентов о риске гипогликемии при применении метформина в сочетании с другими гипогликемическими препаратами (производными сульфонилмочевины, репаглинидом, инсулином), при которой ухудшается способность к управлению транспортными средствами и занятиям другими потенциально опасными видами деятельности, требующими повышенного внимания и быстрых психомоторных реакций. Условия хранения и отпуска из аптек Условия хранения:В защищенном от света месте при температуре не выше 25 °С. Хранить в недоступном для детей месте. Отпуск из аптек: По рецепту Регистрационные данные Торговое название Метформин Международное непатентованное название:Метформин. Форма выпуска:Таблетки. Состав:Каждая таблетка 500 мг содержит активное вещество: метформина гидрохлорид - 500 мг. Вспомогательные вещества: целлюлоза микрокристаллическая - 15,0 мг, кроскармеллоза натрия - 30,0 мг, вода очищенная - 10,0 мг, повидон К-17 (поливинилпирролидон) - 40,0 мг, магния стеарат - 5,0 мг. Каждая таблетка 850 мг содержит активное вещество: метформина гидрохлорид - 850 мг. Вспомогательные вещества: целлюлоза микрокристаллическая - 25,5 мг, кроскармеллоза натрия - 51,0 мг, вода очищенная - 17,0 мг, повидон К-17 (поливинилпирролидон) - 68,0 мг, магния стеарат - 8,5 мг. Каждая таблетка 1000 мг содержит активное вещество: метформина гидрохлорид - 1000 мг. Вспомогательные вещества: целлюлоза микрокристаллическая - 30,0 мг, кроскармеллоза натрия - 60,0 мг, вода очищенная - 20,0 мг, повидон К-17 (поливинилпирролидон) - 80,0 мг, магния стеарат - 10,0 мг. АТХ: Регистрация: Лекарственное средство ЛП-002189 Фармгруппа: Гипогликемическое средство группы бигуанидов для перорального применения. Дата регистрации: 20.08.2013 / 30.01.2015. Окончание регстрации: . Описание:Дозировка 500 мг: круглые плоскоцилиндрические таблетки белого или почти белого цвета с риской с одной стороны и фаской с двух сторон. Допускается наличие мраморности. Дозировка 850 мг: овальные двояковыпуклые таблетки белого или почти белого цвета с риской с одной стороны. Допускается наличие мраморности. Дозировка 1000 мг: овальные двояковыпуклые таблетки белого или почти белого цвета с риской с одной стороны. Допускается наличие мраморности. Упаковка:Таблетки 500 мг, 850 мг, 1000 мг. По 10, 20, 25, 30 или 60 таблеток в контурную ячейковую упаковку из пленки поливинилхлоридной и фольги алюминиевой печатной лакированной. По 10, 20, 25, 30, 40, 50, 60, 100 или 120 таблеток в банки полимерные для лекарственных средств. Одну банку или 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или 12 контурных ячейковых упаковок вместе с инструкцией по применению помещают в картонную упаковку (пачку). Срок годности:3 года. Не использовать по истечении срока годности. Владелец рег.удостоверения:АТОЛЛ, ООО Производитель:АТОЛЛ, ООО. Представительство
Модель:
RUR 583
Показания Язвенная болезнь желудка в стадии обострения и язва анастомоза: Язвенная болезнь двенадцатиперстной кишки в стадии обострения: Эрозивная и язвенная гастроэзофагеальная рефлюксная болезнь или рефлюкс- эзофагит: Поддерживающая терапия гастроэзофагеальной рефлюксной болезни: Неэрозивная гастроэзофагеальная рефлюксная болезнь: Синдром Золлингера-Эллисона и другие состояния, характеризующиеся патологической гиперсекрецией: В комбинации с соответствующей антибактериальной терапией для Helicobacter pilory у пациентов с язвенной болезнью. Противопоказания Противопоказания Гиперчувствительность к рабепразолу, замещенным бензимидазолам или другим вспомогательным компонентам препарата: беременность: период лактации: детский возраст (до 12 лет). С осторожностью: Тяжелая печеночная недостаточность, тяжелая почечная недостаточность. Беременность Рабепразол не следует назначать беременным женщинам (данных по безопасности применения рабепразола во время беременности нет). На время лечения следует прекратить грудное вскармливание. Неизвестно, выделяется ли рабепразол с грудным молоком. Соответствующие исследования у кормящих женщин не проводились. Применение и дозы Таблетки препарата Хайрабезол нельзя разжевывать или измельчать. Таблетки следует глотать целиком. Установлено, что ни время суток, ни прием пищи не влияют на активность рабепразола. При язвенной болезни желудка в стадии обострения и язве анастомоза рекомендуется принимать внутрь по 10 мг или по 20 мг один раз в день. Обычно излечение наступает после 6 недель терапии, однако в некоторых случаях длительность лечения может быть увеличена еще на 6 недель. При язвенной болезни двенадцатиперстной кишки в стадии обострения рекомендуется принимать внутрь по 20 мг один раз в день. В некоторых случаях лечебный эффект наступает при приеме 10 мг один раз в день. Длительность лечения составляет от 2 до 4 недель. В случае необходимости длительность лечения может быть увеличена еще на 4 недели. При лечении эрозивной гастроэзофагеальной рефлюксной болезни (ГЭРБ) или рефлюкс эзофагите рекомендуется принимать внутрь по 10 мг или по 20 мг один раз в день. Длительность лечения составляет от 4 до 8 недель. В случае необходимости длительность лечения может быть увеличена еще на 8 недель. При поддерживающей терапии гастроэзофагеальной рефлюксной болезни (ГЭРБ) рекомендуется принимать внутрь по 10 мг или по 20 мг один раз в день. Длительность лечения зависит от состояния пациента. При неэрозивной гастроэзофагеальной рефлюксной болезни (НЭРБ) без эзофагита рекомендуется принимать внутрь по 10 мг или по 20 мг один раз в день. Если после четырех недель лечения симптомы не исчезают, следует провести дополнительное исследование пациента. После купирования симптомов для предупреждения их последующего возникновения следует принимать препарат внутрь в дозе 10 мг один раз в день по требованию. Для лечения синдрома Золлингеуа-Элисона и других состояний, характеризующихся патологической гиперсекрецией, дозу подбирают индивидуально. Начальная доза - 60 мг в день, затем дозу повышают и назначают препарат в дозе до 100 мг в день при однократном приеме или по 60 мг два раза в день. Для некоторых пациентов дробное дозирование препарата является предпочтительным. Лечение должно продолжаться по мере клинической необходимости. У некоторых больных с синдромом Золлингера-Элисона длительность лечения рабепразолом составляет до одного года. Для лечения язвенной болезни двенадиатиперстной кишки или хронического гастрита, связанного с инфицированием Н. pylori, рекомендуется курс лечения длительностью 7 дней одной из следующих комбинаций препаратов: Хайрабезол по 20 мг 2 раза в день + кларитромицин по 500 мг 2 раза в день и амоксициллин по 1г. 2 раза в день. Хайрабезол по 20 мг 2 раза в день + кларитромицин по 500 мг 2 раза в день и метронидазол по 400 мг 2 раза в день. Пациенты с почечной и печеночной недостаточностью Коррекции дозы пациентам с почечной недостаточностью не требуется. У пациентов с легкой и умеренной степенью печеночной недостаточности концентрация рабепразола в крови обычно выше, чем у здоровых пациентов. При назначении препарата Хайрабезол пациентам с тяжелой степенью печеночной недостаточности следует соблюдать осторожность. Пожилые пациенты Коррекции дозы не требуется. Дети. Безопасность и эффективность рабепразола 20 мг для краткосрочного (до 8 недель) лечения ГЭРБ у детей в возрасте 12 лет и более подтверждена экстраполяцией результатов адекватных и хорошо контролируемых исследований, подкрепляющих эффективность рабепразола для взрослых и исследованиями безопасности и фармакокинетики для пациентов детского возраста. Рекомендуемая доза для детей в возрасте 12 лет и более составляет 20 мг 1 раз в день продолжительностью до 8 недель. Безопасность и эффективность рабепразола для лечения ГЭРБ у детей в возрасте младше 12 лет не установлена. Безопасность и эффективность рабепразола для применения по другим показаниям не установлена для пациентов детского возраста. Побочные эффекты и передозировка Побочные эффекты: Исходя из опыта клинических испытаний, можно сделать вывод, что рабепразол обычно хорошо переносится пациентами. Побочные эффекты в целом слабо выраженные или умеренные и носят преходящий характер. При приеме рабепразола в ходе клинических исследований отмечались следующие побочные действия: головная боль, боль в животе, диарея, метеоризм, запор, сухость во рту, головокружение, сыпь, периферический отек. В ходе пострегистрационного применения рабепразола сообщалось о следующих побочных эффектах: повышение уровня печеночных ферментов, редко - гепатит и желтуха. У пациентов с циррозом печени редко сообщалось о развитии печеночной энцефалопатии. Также в редких случаях отмечались тромбоцитопения, нейтропения, лейкопения, буллезные высыпания, крапивница,острые системные аллергические реакции, миалгия, артралгия, гипомагниемия. Очень редко сообщалось о развитии интерстициального нефрита, гинекомастии, мультиформной эритемы, токсического эпидермального некролиза, синдрома Стивенса-Джонсона. Согласно данным постмаркетингового наблюдения при приеме ингибиторов протонной помпы возможно увеличение риска возникновения переломов (см. раздел "Особые указания") Передозировка: Симптомы: Данные о намеренной или случайной передозировке минимальны. Случаев сильной передозировки рабепразолом не было отмечено. Лечение: Специфический антидот для рабепразола неизвестен. Рабепразол хорошо связывается с белками плазмы, и поэтому слабо выводится при диализе. При передозировке необходимо проводить симптоматическое и поддерживающее лечение. Взаимодействие с другими ЛС: Рабепразол замедляет выведение некоторых лекарственных средств, метаболизирующихся в печени путем микросомального окисления (диазепам, фенитоин, непрямые антикоагулянты). Снижает концентрацию кетоконазола на 33%, дигоксина - на 22%. Не взаимодействует с жидкими антацидами. Совместим с препаратами, метаболизирующимися системой CYP450 (варфарин, фенитоин, теофиллин, диазепам). Фармакологическое действие и фармакокинетика Противоязвенное средство из группы ингибиторов протонного насоса (Н+/К-АТФ-азы), метаболизируется в париетальных клетках желудка до активных сульфонамидных производных, которые инактивируют сульфгидрильные группы Н+/К-АТФ-азы. Блокирует заключительную стадию секреции хлористоводородной кислоты, снижая содержание базальной и стимулированной секреции, независимо от природы раздражителя. Обладает высокой липофильностью, легко проникает в париетальные клетки желудка и концентрируется в них, оказывая цитопротекторное действие. Антисекреторный эффект после перорального приема 20 мг наступает в течение 1 ч и достигает максимума через 2-4 ч: угнетение базальной и стимулированной пищей секреции кислоты через 23 ч после приема первой дозы составляет 62% и 82%, соответственно: продолжительность действия - 48 ч. После окончания приема секреторная активность нормализуется в течение 2-3 дней. В первые 2-8 недель терапии концентрация гастрина в сыворотке крови увеличивается и возвращается к исходным уровням в течение 1-2 недель после отмены препарата. Не влияет на центральную нервную систему, сердечно-сосудистую и дыхательную системы. Фармакокинетика: Абсорбция происходит в тонком кишечнике (из-за наличия кислотоустойчивой кишечнорастворимой оболочки) высокая, время достижения максимальной концентрации - 3,5 ч. Значения максимальной концентрации (Сmах) и площади под кривой "концентрация действующего вещества - время" (AUC) носят линейный характер в диапазоне доз от 10 до 40 мг. Метаболизируется в печени с участием изоферментов цитохрома Р-450 CYP2C19 и CYP3A4. Биодоступность - 52%, не увеличивается при многократном приеме. Период полувыведения (T1/2) - 0,7-1,5 ч, клиренс - 283 ± 98 мл/мин. У пациентов с хронической печеночной недостаточностью слабой или средней степени после однократного приема AUC увеличивается в 2 раза, Т1/2 - в 2-3 раза. После приема 20 мг рабепразола в течение 7 дней AUC увеличивается в 1,5 раза, Т1/2 - в 1,2 раза. У пациентов со стабильной терминальной стадией почечной недостаточности, нуждающихся в гемодиализе (клиренс креатинина менее 5 мл/мин/1,73 м 2), распределение рабепразола натрия близко к таковому у здоровых лиц. У пожилых пациентов после приема рабепразола в течение 7 дней AUC в 2 раза больше, Сmах - на 60% больше, чем у молодых. Связь с белками плазмы - 97%. Выводится почками - 90% в виде двух метаболитов: конъюгата меркаптуровой кислоты (М5) и карбоновой кислоты (Мб): кишечником - 10%. У пациентов с замедленным метаболизмом CYP2C19 после 7 дней приема рабепразола в дозе 20 мг в сутки AUC увеличивается в 1,9 раза, а период полувыведения в 1,6 раза по сравнению с теми же параметрами у "быстрых метаболизаторов", в то время как Сmах увеличивается на 40 %. Особые указания Ответ пациента на терапию рабепразолом не исключает наличие злокачественных новообразований в желудке. Таблетки препарата Хайрабезол нельзя разжевывать или измельчать. Таблетки следует глотать целиком. Установлено, что ни время суток, ни прием пищи не влияют на активность рабепразола. В специальном исследовании у пациентов с легкими или умеренными нарушениями функции печени не было обнаружено значимого отличия частоты побочных эффектов рабепразола от таковой у подобранных по полу и возрасту здоровых лиц, но, несмотря на это, рекомендуется соблюдать осторожность при первом назначении пациентам с тяжелыми нарушениями функции печени. Пациентам с нарушениями функции почек или печени корректировка дозы препарата Хайрабезол не требуется. AUC рабепразола у пациентов с тяжелым нарушением функции печени примерно в два раза выше, чем у здоровых пациентов. Гипомагниемия. При лечении ингибиторами протонной помпы на протяжении, по крайней мере, 3 месяцев в редких случаях были отмечены случаи симптоматической или асимптоматической гипомагниемии. В большинстве случаев эти сообщения поступали через год после проведения терапии. Серьезными побочными явлениями были тетания, аритмия и судороги. Большинству пациентов требовалось лечение гипомагниемии, включающее замещение магния и отмену терапии ингибиторами протонной помпы. У пациентов, которые будут получать длительное лечение или которые принимают ингибиторы протонной помпы с препаратами, такими как дигоксин или препаратами, которые могут вызвать гипомагниемию (например, диуретики), медицинские работники должны контролировать уровень магния до начала лечения ингибиторами протонной помпы и в период лечения. Переломы. Согласно данным наблюдательных исследований можно предположить, что терапия ингибиторами протонной помпы может привести к возрастанию риска, связанного с остеопорозом переломов бедра, запястья, позвоночника. Риск переломов был увеличен у пациентов, принимавших высокие дозы ингибиторов протонной помпы в течение года и более. Влияние на способность управлять транспортными средствами: В случае появления в процессе лечения сонливости следует отказаться от управления автомобилем и других видов деятельности, требующих повышенной концентрации внимания и быстроты психомоторных реакций. Условия хранения и отпуска из аптек Условия хранения: В сухом, защищенном от света месте, при температуре от 8 °С до 25 °С. Хранить в недоступном для детей месте Отпуск из аптек: По рецепту Регистрационные данные Торговое название Хайрабезол® Международное непатентованное название:Рабепразол. Форма выпуска:таблетки покрытые кишечнорастворимой пленочной оболочкой. Состав:Дозировка 10 мг: Активный ингредиент: рабепразол натрия - 10 мг. Вспомогательные ингредиенты: магния оксид 50 мг, маннитол 17,5 мг, крахмал кукурузный 2,5 мг, повидон-КЗО 1,5 мг, гипролоза низкозамещенная 16 мг, натрия стеарилфумарат 2мг. Оболочка: целлацефат 11,25 мг, титана диоксид 1 мг, краситель железа оксид красный 0,1 мг. Дозировка 20 мг: Активный ингредиент: рабепразол натрия - 20 мг. Вспомогательные ингредиенты: магния оксид 69 мг, маннитол 40 мг, крахмал кукурузный 2,5 мг, повидон-КЗО 1,5 мг, гипролоза низкозамещенная 24 мг, натрия стеарилфумарат 2 мг. Оболочка: целлацефат 18 мг, титана диоксид 1,6 мг, краситель железа оксид желтый 0,16 мг АТХ: Регистрация: ЛП-001479 Фармгруппа: средство, понижающее секрецию желез желудка - протонного насоса ингибитор. Дата регистрации: 06.02.2012. Окончание регстрации: . Описание:Дозировка 10 мг: круглые двояковыпуклые таблетки, покрытые оболочкой от светло-розового до красновато-розового цвета. На поперечном разрезе ядро белого или белого с желтоватым оттенком цвета. Дозировка 20 мг:круглые двояковыпуклые таблетки, покрытые оболочкой от светло-желтого до желтого цвета. На поперечном разрезе ядро белого или белого с желтоватым оттенком цвета. Упаковка:таблетки покрытые кишечнорастворимой пленочной оболочкой 10мг и 20мг. Для аптек: 10, 14, 15 таблеток в Ал/Ал блистер или в Ал/Ал стрип. 1 или 10 стрипов/блистеров по 10 таблеток, 1 или 2 стрипа/блистера по 14 таблеток, 1, 2 или 10 стрипов/блистеров по 15 таблеток вместе с инструкцией по применению в пачку картонную. 1 стрип/блистер по 14 или 15 таблеток вместе с инструкцией по применению в пачку картонную с клапаном и перфорацией, защищенной пленкой ПВХ с внутренней стороны пачки (7 перфораций в виде круга). Для стационаров: 100, 500, 1000 таблеток в пакет из полиэтилена. пакет вместе с инструкцией по применению в банку из полиэтилена высокой плотности. На банку наклеивают этикетку. Срок годности:2 года. Не использовать по истечению срока годности указанного на упаковке. Владелец рег.удостоверения:Хайгланс Лабораториз Пвт. Лтд. Производитель:HIGLANCE LABORATORIES Pvt. Ltd. Представительство:ХАЙГЛАНС ЛАБОРАТОРИЗ
Модель:
RUR 815
Показания Язвенная болезнь желудка в стадии обострения и язва анастомоза: Язвенная болезнь двенадцатиперстной кишки в стадии обострения: Эрозивная и язвенная гастроэзофагеальная рефлюксная болезнь или рефлюкс- эзофагит: Поддерживающая терапия гастроэзофагеальной рефлюксной болезни: Неэрозивная гастроэзофагеальная рефлюксная болезнь: Синдром Золлингера-Эллисона и другие состояния, характеризующиеся патологической гиперсекрецией: В комбинации с соответствующей антибактериальной терапией для Helicobacter pilory у пациентов с язвенной болезнью. Противопоказания Противопоказания Гиперчувствительность к рабепразолу, замещенным бензимидазолам или другим вспомогательным компонентам препарата: беременность: период лактации: детский возраст (до 12 лет). С осторожностью: Тяжелая печеночная недостаточность, тяжелая почечная недостаточность. Беременность Рабепразол не следует назначать беременным женщинам (данных по безопасности применения рабепразола во время беременности нет). На время лечения следует прекратить грудное вскармливание. Неизвестно, выделяется ли рабепразол с грудным молоком. Соответствующие исследования у кормящих женщин не проводились. Применение и дозы Таблетки препарата Хайрабезол нельзя разжевывать или измельчать. Таблетки следует глотать целиком. Установлено, что ни время суток, ни прием пищи не влияют на активность рабепразола. При язвенной болезни желудка в стадии обострения и язве анастомоза рекомендуется принимать внутрь по 10 мг или по 20 мг один раз в день. Обычно излечение наступает после 6 недель терапии, однако в некоторых случаях длительность лечения может быть увеличена еще на 6 недель. При язвенной болезни двенадцатиперстной кишки в стадии обострения рекомендуется принимать внутрь по 20 мг один раз в день. В некоторых случаях лечебный эффект наступает при приеме 10 мг один раз в день. Длительность лечения составляет от 2 до 4 недель. В случае необходимости длительность лечения может быть увеличена еще на 4 недели. При лечении эрозивной гастроэзофагеальной рефлюксной болезни (ГЭРБ) или рефлюкс эзофагите рекомендуется принимать внутрь по 10 мг или по 20 мг один раз в день. Длительность лечения составляет от 4 до 8 недель. В случае необходимости длительность лечения может быть увеличена еще на 8 недель. При поддерживающей терапии гастроэзофагеальной рефлюксной болезни (ГЭРБ) рекомендуется принимать внутрь по 10 мг или по 20 мг один раз в день. Длительность лечения зависит от состояния пациента. При неэрозивной гастроэзофагеальной рефлюксной болезни (НЭРБ) без эзофагита рекомендуется принимать внутрь по 10 мг или по 20 мг один раз в день. Если после четырех недель лечения симптомы не исчезают, следует провести дополнительное исследование пациента. После купирования симптомов для предупреждения их последующего возникновения следует принимать препарат внутрь в дозе 10 мг один раз в день по требованию. Для лечения синдрома Золлингеуа-Элисона и других состояний, характеризующихся патологической гиперсекрецией, дозу подбирают индивидуально. Начальная доза - 60 мг в день, затем дозу повышают и назначают препарат в дозе до 100 мг в день при однократном приеме или по 60 мг два раза в день. Для некоторых пациентов дробное дозирование препарата является предпочтительным. Лечение должно продолжаться по мере клинической необходимости. У некоторых больных с синдромом Золлингера-Элисона длительность лечения рабепразолом составляет до одного года. Для лечения язвенной болезни двенадиатиперстной кишки или хронического гастрита, связанного с инфицированием Н. pylori, рекомендуется курс лечения длительностью 7 дней одной из следующих комбинаций препаратов: Хайрабезол по 20 мг 2 раза в день + кларитромицин по 500 мг 2 раза в день и амоксициллин по 1г. 2 раза в день. Хайрабезол по 20 мг 2 раза в день + кларитромицин по 500 мг 2 раза в день и метронидазол по 400 мг 2 раза в день. Пациенты с почечной и печеночной недостаточностью Коррекции дозы пациентам с почечной недостаточностью не требуется. У пациентов с легкой и умеренной степенью печеночной недостаточности концентрация рабепразола в крови обычно выше, чем у здоровых пациентов. При назначении препарата Хайрабезол пациентам с тяжелой степенью печеночной недостаточности следует соблюдать осторожность. Пожилые пациенты Коррекции дозы не требуется. Дети. Безопасность и эффективность рабепразола 20 мг для краткосрочного (до 8 недель) лечения ГЭРБ у детей в возрасте 12 лет и более подтверждена экстраполяцией результатов адекватных и хорошо контролируемых исследований, подкрепляющих эффективность рабепразола для взрослых и исследованиями безопасности и фармакокинетики для пациентов детского возраста. Рекомендуемая доза для детей в возрасте 12 лет и более составляет 20 мг 1 раз в день продолжительностью до 8 недель. Безопасность и эффективность рабепразола для лечения ГЭРБ у детей в возрасте младше 12 лет не установлена. Безопасность и эффективность рабепразола для применения по другим показаниям не установлена для пациентов детского возраста. Побочные эффекты и передозировка Побочные эффекты: Исходя из опыта клинических испытаний, можно сделать вывод, что рабепразол обычно хорошо переносится пациентами. Побочные эффекты в целом слабо выраженные или умеренные и носят преходящий характер. При приеме рабепразола в ходе клинических исследований отмечались следующие побочные действия: головная боль, боль в животе, диарея, метеоризм, запор, сухость во рту, головокружение, сыпь, периферический отек. В ходе пострегистрационного применения рабепразола сообщалось о следующих побочных эффектах: повышение уровня печеночных ферментов, редко - гепатит и желтуха. У пациентов с циррозом печени редко сообщалось о развитии печеночной энцефалопатии. Также в редких случаях отмечались тромбоцитопения, нейтропения, лейкопения, буллезные высыпания, крапивница,острые системные аллергические реакции, миалгия, артралгия, гипомагниемия. Очень редко сообщалось о развитии интерстициального нефрита, гинекомастии, мультиформной эритемы, токсического эпидермального некролиза, синдрома Стивенса-Джонсона. Согласно данным постмаркетингового наблюдения при приеме ингибиторов протонной помпы возможно увеличение риска возникновения переломов (см. раздел "Особые указания") Передозировка: Симптомы: Данные о намеренной или случайной передозировке минимальны. Случаев сильной передозировки рабепразолом не было отмечено. Лечение: Специфический антидот для рабепразола неизвестен. Рабепразол хорошо связывается с белками плазмы, и поэтому слабо выводится при диализе. При передозировке необходимо проводить симптоматическое и поддерживающее лечение. Взаимодействие с другими ЛС: Рабепразол замедляет выведение некоторых лекарственных средств, метаболизирующихся в печени путем микросомального окисления (диазепам, фенитоин, непрямые антикоагулянты). Снижает концентрацию кетоконазола на 33%, дигоксина - на 22%. Не взаимодействует с жидкими антацидами. Совместим с препаратами, метаболизирующимися системой CYP450 (варфарин, фенитоин, теофиллин, диазепам). Фармакологическое действие и фармакокинетика Противоязвенное средство из группы ингибиторов протонного насоса (Н+/К-АТФ-азы), метаболизируется в париетальных клетках желудка до активных сульфонамидных производных, которые инактивируют сульфгидрильные группы Н+/К-АТФ-азы. Блокирует заключительную стадию секреции хлористоводородной кислоты, снижая содержание базальной и стимулированной секреции, независимо от природы раздражителя. Обладает высокой липофильностью, легко проникает в париетальные клетки желудка и концентрируется в них, оказывая цитопротекторное действие. Антисекреторный эффект после перорального приема 20 мг наступает в течение 1 ч и достигает максимума через 2-4 ч: угнетение базальной и стимулированной пищей секреции кислоты через 23 ч после приема первой дозы составляет 62% и 82%, соответственно: продолжительность действия - 48 ч. После окончания приема секреторная активность нормализуется в течение 2-3 дней. В первые 2-8 недель терапии концентрация гастрина в сыворотке крови увеличивается и возвращается к исходным уровням в течение 1-2 недель после отмены препарата. Не влияет на центральную нервную систему, сердечно-сосудистую и дыхательную системы. Фармакокинетика: Абсорбция происходит в тонком кишечнике (из-за наличия кислотоустойчивой кишечнорастворимой оболочки) высокая, время достижения максимальной концентрации - 3,5 ч. Значения максимальной концентрации (Сmах) и площади под кривой "концентрация действующего вещества - время" (AUC) носят линейный характер в диапазоне доз от 10 до 40 мг. Метаболизируется в печени с участием изоферментов цитохрома Р-450 CYP2C19 и CYP3A4. Биодоступность - 52%, не увеличивается при многократном приеме. Период полувыведения (T1/2) - 0,7-1,5 ч, клиренс - 283 ± 98 мл/мин. У пациентов с хронической печеночной недостаточностью слабой или средней степени после однократного приема AUC увеличивается в 2 раза, Т1/2 - в 2-3 раза. После приема 20 мг рабепразола в течение 7 дней AUC увеличивается в 1,5 раза, Т1/2 - в 1,2 раза. У пациентов со стабильной терминальной стадией почечной недостаточности, нуждающихся в гемодиализе (клиренс креатинина менее 5 мл/мин/1,73 м 2), распределение рабепразола натрия близко к таковому у здоровых лиц. У пожилых пациентов после приема рабепразола в течение 7 дней AUC в 2 раза больше, Сmах - на 60% больше, чем у молодых. Связь с белками плазмы - 97%. Выводится почками - 90% в виде двух метаболитов: конъюгата меркаптуровой кислоты (М5) и карбоновой кислоты (Мб): кишечником - 10%. У пациентов с замедленным метаболизмом CYP2C19 после 7 дней приема рабепразола в дозе 20 мг в сутки AUC увеличивается в 1,9 раза, а период полувыведения в 1,6 раза по сравнению с теми же параметрами у "быстрых метаболизаторов", в то время как Сmах увеличивается на 40 %. Особые указания Ответ пациента на терапию рабепразолом не исключает наличие злокачественных новообразований в желудке. Таблетки препарата Хайрабезол нельзя разжевывать или измельчать. Таблетки следует глотать целиком. Установлено, что ни время суток, ни прием пищи не влияют на активность рабепразола. В специальном исследовании у пациентов с легкими или умеренными нарушениями функции печени не было обнаружено значимого отличия частоты побочных эффектов рабепразола от таковой у подобранных по полу и возрасту здоровых лиц, но, несмотря на это, рекомендуется соблюдать осторожность при первом назначении пациентам с тяжелыми нарушениями функции печени. Пациентам с нарушениями функции почек или печени корректировка дозы препарата Хайрабезол не требуется. AUC рабепразола у пациентов с тяжелым нарушением функции печени примерно в два раза выше, чем у здоровых пациентов. Гипомагниемия. При лечении ингибиторами протонной помпы на протяжении, по крайней мере, 3 месяцев в редких случаях были отмечены случаи симптоматической или асимптоматической гипомагниемии. В большинстве случаев эти сообщения поступали через год после проведения терапии. Серьезными побочными явлениями были тетания, аритмия и судороги. Большинству пациентов требовалось лечение гипомагниемии, включающее замещение магния и отмену терапии ингибиторами протонной помпы. У пациентов, которые будут получать длительное лечение или которые принимают ингибиторы протонной помпы с препаратами, такими как дигоксин или препаратами, которые могут вызвать гипомагниемию (например, диуретики), медицинские работники должны контролировать уровень магния до начала лечения ингибиторами протонной помпы и в период лечения. Переломы. Согласно данным наблюдательных исследований можно предположить, что терапия ингибиторами протонной помпы может привести к возрастанию риска, связанного с остеопорозом переломов бедра, запястья, позвоночника. Риск переломов был увеличен у пациентов, принимавших высокие дозы ингибиторов протонной помпы в течение года и более. Влияние на способность управлять транспортными средствами: В случае появления в процессе лечения сонливости следует отказаться от управления автомобилем и других видов деятельности, требующих повышенной концентрации внимания и быстроты психомоторных реакций. Условия хранения и отпуска из аптек Условия хранения: В сухом, защищенном от света месте, при температуре от 8 °С до 25 °С. Хранить в недоступном для детей месте Отпуск из аптек: По рецепту Регистрационные данные Торговое название Хайрабезол® Международное непатентованное название:Рабепразол. Форма выпуска:таблетки покрытые кишечнорастворимой пленочной оболочкой. Состав:Дозировка 10 мг: Активный ингредиент: рабепразол натрия - 10 мг. Вспомогательные ингредиенты: магния оксид 50 мг, маннитол 17,5 мг, крахмал кукурузный 2,5 мг, повидон-КЗО 1,5 мг, гипролоза низкозамещенная 16 мг, натрия стеарилфумарат 2мг. Оболочка: целлацефат 11,25 мг, титана диоксид 1 мг, краситель железа оксид красный 0,1 мг. Дозировка 20 мг: Активный ингредиент: рабепразол натрия - 20 мг. Вспомогательные ингредиенты: магния оксид 69 мг, маннитол 40 мг, крахмал кукурузный 2,5 мг, повидон-КЗО 1,5 мг, гипролоза низкозамещенная 24 мг, натрия стеарилфумарат 2 мг. Оболочка: целлацефат 18 мг, титана диоксид 1,6 мг, краситель железа оксид желтый 0,16 мг АТХ: Регистрация: ЛП-001479 Фармгруппа: средство, понижающее секрецию желез желудка - протонного насоса ингибитор. Дата регистрации: 06.02.2012. Окончание регстрации: . Описание:Дозировка 10 мг: круглые двояковыпуклые таблетки, покрытые оболочкой от светло-розового до красновато-розового цвета. На поперечном разрезе ядро белого или белого с желтоватым оттенком цвета. Дозировка 20 мг:круглые двояковыпуклые таблетки, покрытые оболочкой от светло-желтого до желтого цвета. На поперечном разрезе ядро белого или белого с желтоватым оттенком цвета. Упаковка:таблетки покрытые кишечнорастворимой пленочной оболочкой 10мг и 20мг. Для аптек: 10, 14, 15 таблеток в Ал/Ал блистер или в Ал/Ал стрип. 1 или 10 стрипов/блистеров по 10 таблеток, 1 или 2 стрипа/блистера по 14 таблеток, 1, 2 или 10 стрипов/блистеров по 15 таблеток вместе с инструкцией по применению в пачку картонную. 1 стрип/блистер по 14 или 15 таблеток вместе с инструкцией по применению в пачку картонную с клапаном и перфорацией, защищенной пленкой ПВХ с внутренней стороны пачки (7 перфораций в виде круга). Для стационаров: 100, 500, 1000 таблеток в пакет из полиэтилена. пакет вместе с инструкцией по применению в банку из полиэтилена высокой плотности. На банку наклеивают этикетку. Срок годности:2 года. Не использовать по истечению срока годности указанного на упаковке. Владелец рег.удостоверения:Хайгланс Лабораториз Пвт. Лтд. Производитель:HIGLANCE LABORATORIES Pvt. Ltd. Представительство:ХАЙГЛАНС ЛАБОРАТОРИЗ

Модель:
RUR 671
Показания Сахарный диабет 2 типа у взрослых: - при неэффективности диетотерапии, физических упражнений и предшествующей монотерапии метформином или производными сульфонилмочевины: - для замещения предшествующей терапии двумя препаратами (метформином и производным сульфонилмочевины) у больных со стабильным и хорошо контролируемым уровнем гликемии. Противопоказания Противопоказания повышенная чувствительность к метформину, глибенкламиду или другим производным сульфонилмочевины, а также к вспомогательным веществам: сахарный диабет 1 типа: диабетический кетоацидоз, диабетическая прекома, диабетическая кома:почечная недостаточность или нарушение функции почек (клиренс креатинина менее 60 мл/мин): острые состояния, которые могут приводить к изменению функции почек: дегидратация, тяжелая инфекция, шок, внутрисосудистое введение йодсодержащих контрастных средств (см. "Особые указания"): острые или хронические заболевания, которые сопровождаются гипоксией тканей: сердечная или дыхательная недостаточность, недавно перенесенный инфаркт миокарда, шок: печеночная недостаточность: порфирия: беременность, период грудного вскармливания: одновременный прием миконазола: обширные хирургические операции:хронический алкоголизм, острая алкогольная интоксикация: лактоацидоз (в т.ч. в анамнезе): соблюдение гипокалорийной диеты (менее 1000 ккал/сут):Не рекомендуется применять препарат у лиц старше 60 лет, выполняющих тяжелую физическую работу, что связано с повышенным риском развития у них лактоацидоза. Глюкованс® содержит лактозу, поэтому его применение не рекомендовано пациентам с редкими наследственными заболеваниями, связанными с непереносимостью галактозы, дефицитом лактазы или синдромом глюкозо-галактозной мальабсорбции. С осторожностью: Лихорадочный синдром, надпочечниковая недостаточность, гипофункция передней доли гипофиза, заболевания щитовидной железы с некомпенсированным нарушением ее функции. Беременность Применение препарата противопоказано в период беременности. Пациент должен быть предупрежден о том, что в период лечения препаратом Глюкованс® необходимо информировать врача о планируемой беременности и о наступлении беременности. При планировании беременности, а также в случае наступления беременности в период приема препарата Глюкованс®, препарат должен быть отменен, и назначено лечение инсулином. Глюкованс® противопоказан при грудном вскармливании, поскольку отсутствуют данные о его способности проникать в грудное молоко. Применение и дозы Дозу препарата определяет врач индивидуально для каждого пациента в зависимости от уровня гликемии. Начальная доза составляет 1 таблетку препарата Глюкованс® 2,5 мг+500 мг или Глюкованс® 5 мг+500 мг 1 раз в день. Во избежание гипогликемии начальная доза не должна превышать дневную дозу глибенкламида (или эквивалентную дозу другого ранее принимаемого препарата сульфонилмочевины) или метформина, если они применялись в качестве терапии первой линии. Рекомендуется увеличивать дозу не более чем на 5 мг глибенкламида + 500 мг метформина в день каждые 2 или более недель для достижения адекватного контроля содержания глюкозы в крови. Замещение предшествующей комбинированной терапии мет. Формином и глибенкламидом: начальная доза не должна превышать дневную дозу глибенкламида (или эквивалентную дозу другого препарата сульфонилмочевины) и метформина, принимаемых ранее. Каждые 2 или более недель после начала лечения дозу препарата корректируют в зависимости от уровня гликемии. Максимальная суточная доза составляет 4 таблетки препарата Глюкованс® 5 мг+500 мг или 6 таблеток препарата Глюкованс® 2,5 мг+500 мг. Режим дозирования: Режим дозирования зависит от индивидуального назначения: Для дозировок 2.5 мг+500 мг и 5 мг+500 мг Один раз в день, утром во время завтрака, при назначении 1 таблетки в день. Два раза в день, утром и вечером, при назначении 2 или 4 таблеток в день. Для дозировки 2.5 мг+500 мг Три раза в день, утром, днем и вечером, при назначении 3,5 или 6 таблеток в день. Для дозировки 5 мг+500 мг Три раза в день, утром, днем и вечером, при назначении 3 таблеток в день. Таблетки следует принимать во время еды. Каждый прием препарата должен сопровождаться приемом пищи с достаточно высоким содержанием углеводов для предотвращения возникновения гипогликемии. Пожилые пациенты Доза препарата подбирается исходя из состояния функции почек. Начальная доза не должна превышать 1 таблетку препарата Глюкованс® 2.5 мг+500 мг. Необходимо проводить регулярную оценку функции почек. Дети Препарат Глюкованс® не рекомендован для применения у детей. Побочные эффекты и передозировка Побочные эффекты: В ходе лечения препаратом Глюкованс® могут наблюдаться следующие побочные эффекты. Частота побочных эффектов препарата расценивается следующим образом: Очень частые: 1/10 Частые: 1/100, <: 1/10 Нечастые: 1/1000, <: 1/100 Редкие: 1/10 000, <: 1/1000 Очень редкие: <: 1/10 000 Единичные: не могут оцениваться при имеющихся данных. Нарушения обмена веществ: Гипогликемия (См. "Передозировка", "Особые указания"). Редко: Приступы печеночной порфирии и кожной порфирии. Очень редко: лактоацидоз (См. "Особые указания"). Снижение всасывания витамина В12, сопровождавшееся снижением его концентрации в сыворотке крови при длительном применении метформина. При обнаружении мегалобластной анемии необходимо учитывать возможность такой этиологии. Дисульфирамподобная реакция при употреблении алкоголя. Лабораторные показатели: Нечасто: Увеличение концентраций мочевины и креатинина в сыворотке крови от средней до умеренной степени. Очень редко: Гипонатриемия. Кровеносная и лимфатическая системы: Данные нежелательные явления исчезают после отмены препарата. Редко: Лейкопения и тромбоцитопения. Очень редко: Агранулоцитоз, гемолитическая анемия, аплазия костного мозга и панцитопения. Нервная система: Часто: Нарушение вкуса (металлический привкус во рту). Зрение: В начале лечения может возникнуть временное нарушение зрения из-за снижения содержания глюкозы в крови. Желудочно-кишечные нарушения: Очень часто: тошнота, рвота, диарея, боли в животе и отсутствие аппетита. Данные симптомы чаще встречаются в начале лечения и в большинстве случаев проходят самостоятельно. Для профилактики развития указанных симптомов рекомендуется принимать препарат в 2 или 3 приема: медленное повышение дозы препарата также улучшает его переносимость. Кожа и подкожная клетчатка: Редко: кожные реакции такие, как зуд, крапивница, макулопапулезная сыпь. Очень редко: кожный или висцеральный аллергический васкулит, полиморфная эритема, эксфолиативный дерматит, фотосенсибилизация. Иммунологические реакции: Очень редко: Анафилактический шок. Могут встречаться реакции перекрестной гиперчувствительности к сульфонамидам и их производным. Гепато-билиарные расстройства: Очень редко: Нарушение показателей функции печени или гепатит, требующие прекращения лечения. Передозировка: При передозировке возможно развитие гипогликемии из-за наличия производного сульфонилмочевины в составе препарата (см. "Особые указания"). Легкие и умеренные симптомы гипогликемии без потери сознания и неврологических проявлений могут быть скорректированы немедленным потреблением сахара. Необходимо выполнить корректировку дозы и/или изменить режим питания. Возникновение тяжелых гипогликемических реакций у больных сахарным диабетом, сопровождающихся комой, пароксизмом или другими неврологическими расстройствами, требует оказания неотложной медицинской помощи. Необходимо внутривенное введение раствора декстрозы сразу после установления диагноза или возникновения подозрения на гипогликемию, до госпитализации пациента. После восстановления сознания необходимо дать больному пищу, богатую легкоусвояемыми углеводами (во избежание повторного развития гипогликемии). Длительная передозировка или наличие сопряженных факторов риска могут спровоцировать развитие лактоацидоза, так как в состав препарата входит метформин (см. "Особые указания"). Лактоацидоз является состоянием, требующим неотложной медицинской помощи: лечение лактоацидоза должно проводиться в клинике. Наиболее эффективным методом лечения, позволяющим выводить лактат и метформин, является гемодиализ. Клиренс глибенкламида в плазме крови может увеличиваться у пациентов с заболеваниями печени. Поскольку глибенкламид активно связывается с белками крови, то препарат не элиминируется при диализе. Взаимодействие с другими ЛС: Противопоказанные комбинации Связанные с применением глибенкламида Миконазол может провоцировать развитие гипогликемии (вплоть до развития комы). Связанные с применением метформина Йодсодержащие контрастные средства: В зависимости от функции почек прием препарата следует прекратить за 48 часов до или после внутривенного введения йодсодержащих контрастных средств. Нерекомендуемые комбинации Связанные с применением производных сульфонилмочевины Алкоголь: Очень редко наблюдается дисульфирамоподобные реакции (непереносимость алкоголя) при одновременном приеме алкоголя и глибенкламида. Прием алкоголя может увеличивать гипогликемическое действие (посредством ингибирования компенсаторных реакций или задержки его метаболической инактивации), что может способствовать развитию гипогликемической комы. В период лечения препаратом Глюкованск следует избегать приема алкоголя и лекарственных средств, содержащих этанол. Фенилбутазон повышает гипогликемический эффект производных сульфонилмочевины (замещая производные сульфонилмочевины в местах связывания с белком и/или уменьшая их элиминацию). Предпочтительно применять другие противовоспалительные средства, обнаруживающие меньшие взаимодействия, или же предупреждать пациента о необходимости самостоятельного контроля уровня гликемии: при необходимости, следует скорректировать дозу при совместном применении противовоспалительного средства и после его прекращения. Связанные с применением глибенкламида Бозентан в комбинации с глибеикламидом повышает риск гепатотоксического действия. Рекомендуется избегать одновременного приема этих препаратов. Также может снижаться гипогликемический эффект глибенкламида. Связанные с применением метформина Алкоголь: Риск развития лактоацидоза усиливается при острой алкогольной интоксикации, особенно в случае голодания, или плохого питания, или печеночной недостаточности. В период лечения препаратом Глюкованс® следует избегать приема алкоголя и лекарственных средств, содержащих этанол. Комбинации, требующие осторожности Связанные с применением всех гипогликемических средств Хлорпромазин: в высоких дозах (100 мг/сут) вызывает повышение уровня гликемии (снижая выброс инсулина). Меры предосторожности: следует предупредить пациента о необходимости самостоятельного контроля содержания глюкозы в крови: при необходимости, следует скорректировать дозу гипогликемического средства в ходе одновременного применения нейролептика и после прекращения его применения. Глюкокортикостероиды (ГКС) и тетракозактид: увеличение в крови содержания глюкозы, иногда сопровождающееся кетозом (ГКС вызывают снижение толерантности к глюкозе). Меры предосторожности: следует предупредить пациента о необходимости самостоятельного контроля содержания глюкозы в крови: при необходимости, следует скорректировать дозу гипогликемического средства в ходе одновременного применения ГКС и после прекращения их применения. Даназол оказывает гипергликемичсское действие. При необходимости лечения даназолом и при прекращении приема последнего требуется коррекция дозы препарата Глюкованс под контролем уровня гликемии. β 2-адрепомиметики: за счет стимуляции β 2-адренорецепторов повышают концентрацию глюкозы в крови. Меры предосторожности: необходимо предупредить пациента и установить контроль содержания глюкозы в крови, возможен перевод на инсулииотерапию. Диуретики: увеличение содержания глюкозы в крови. Меры предосторожности: следует предупредить пациента о необходимости самостоятельного контроля содержания глюкозы в крови: может потребоваться коррекция дозы гипогликемического средства в ходе одновременного применения с диуретиками и после прекращения их применения. Ингибиторы ангиотензинпревращающего фермента (АПФ) (каптоприл, эналаприл): применение ингибиторов АПФ способствует снижению содержания глюкозы в крови. При необходимости следует скорректировать дозу препарата Глюкованск в ходе одновременного применения с ингибиторами АПФ и после прекращения их применения. Связанные с применением метформина Диуретики: Лактоацидоз, возникающий при приеме метформина на фоне функциональной почечной недостаточности, вызванной приемом диуретиков, в особенности петлевых. Связанные с применением глибенкламида β-адреноблокаторы, клонидип, резерпин, гуапетидин и симпатомиметики маскируют некоторые симптомы гипогликемии: ощущение сердцебиения и тахикардию: большинство неселективных бета-адреноблокаторов повышают частоту развития и тяжесть гипогликемии. Следует предупредить пациента о необходимости самостоятельного контроля содержания глюкозы в крови, особенно в начале лечения. Флуконазол: Увеличение периода полувыведения глибенкламида с возможным возникновением проявлений гипогликемии. Следует предупредить пациента о необходимости самостоятельного контроля содержания глюкозы в крови: может потребоваться корректировка дозы гипогликемических препаратов в ходе одновременного лечения флуконазолом и после прекращения его применения. Секвестранты желчных кислот: Одновеременное применение с препаратом Глюкованс® уменьшает концентрацию глибенкламида в плазме крови, что может привести к снижению гипогликемического эффекта. Следует принимать Глюкованс® по меньшей мере за 4 часа до приема секвестрангов желчных кислот. Другие взаимодействия:комбинации, которые следует принять во внимание:Связанные с применением глибенкламида. Десмопрессин: Глюкованс® может снижать антидиуретический эффект десмспрессина. Антибактериальные ЛС из группы сульфаниламидов, фторхинолоны, антикоагулянты (производные кумарина), ингибиторы МАО, хлорамфеникол, пентоксифиллин, гиполипидемические ЛС из группы фибратов, дизопирамид - риск развития гипогликемии на фоне применения глибенкламида. Фармакологическое действие и фармакокинетика Глюкованс® представляет собой фиксированную комбинацию двух пероральных гипогликемических средств различных фармакологических групп: метформина и глибенкламида. Метформин относится к группе бигуанидов и снижает содержание как базальной, так и постпрандиальной глюкозы в плазме крови. Метформин не стимулирует секрецию инсулина и в связи с этим не вызывает гипогликемии. Имеет 3 механизма действия: снижает выработку глюкозы печенью за счет ингибирования глюконеогенеза и гликогенолиза: повышает чувствительность периферических рецепторов к инсулину, потребление и утилизацию глюкозы клетками в мышцах: задерживает всасывание глюкозы в желудочно-кишечном тракте. Препарат также оказывает благоприятное действие на липидный состав крови, снижая уровень общего холестерина, липопротеинов низкой плотности (ЛПНП) и триглицеридов. Глибенкламид относится к группе производных сульфонилмочевины II поколения. Содержание глюкозы при приеме глибенкламида снижается в результате стимуляции секреции инсулина бета-клетками поджелудочной железы. Метформин и глибенкламид имеют различные механизмы действия, но взаимно дополняют гипогликемическую активность друг друга. Комбинация двух гипогликемических средств имеет синергический эффект в снижении содержания глюкозы. Фармакокинетика: Глибенкламид. При приеме внутрь абсорбция из желудочно-кишечного тракта составляет более 95%. Глибенкламид, входящий в состав препарата Глюкованс® является микронизированным. Пик концентрации в плазме достигается примерно за 4 часа, объем распределения - около 10 л. Связь с белками плазмы составляет 99%. Почти полностью метаболизируется в печени с образованием двух, неактивных метаболитов, которые выводятся почками (40 %) и с желчью (60 %). Период полувыведения - от 4 до 11 часов. Метформин после приема внутрь абсорбируется из желудочно-кишечного тракта достаточно полно, пик концентрации в плазме достигается в течение 2,5 часов. Примерно 20- 30% метформина выводится через желудочно-кишечный тракт в неизменном виде. Абсолютная биодоступность составляет от 50 до 60%. Метформин быстро распределяется в тканях, практически не связывается с белками плазмы. Подвергается метаболизму в очень слабой степени и выводится почками. Период полувыведения составляет в среднем 6,5 часов. При нарушении функции почек, почечный клиренс снижается, так же как и клиренс креатинина, при этом период полувыведения увеличивается, что приводит к увеличению концентрации метформина в плазме крови. Сочетание метформина и глибенкламида в одной лекарственной форме имеет ту же биодоступность, что и при приеме таблеток, содержащих метформин или глибенкламид изолированно. На биодоступность метформина в сочетании с глибенкламидом не влияет прием пищи, так же, как и на биодоступность глибенкламида. Однако скорость абсорбции глибенкламида возрастает при приеме пищи. Особые указания На фоне лечения препаратом Глюкованс® необходимо регулярно контролировать уровень гликемии натощак и после еды. Лактоацидоз Лактоацидоз является крайне редким, но серьёзным (высокая смертность при отсутствии неотложного лечения) осложнением, которое может возникнуть из-за кумуляции метформина. Случаи лактоацидоза у пациентов, получавших метформин, возникали в основном у больных сахарным диабетом с выраженной почечной недостаточностью. Следует учитывать и другие сопряженные факторы риска, такие как плохо контролируемый диабет, кетоз, продолжительное голодание, чрезмерное потребление алкоголя, печеночная недостаточность и любое состояние, связанное с выраженной гипоксией. Следует учитывать риск развития лактоацидоза при появлении неспецифических признаков таких, как мышечные судороги, сопровождающиеся диспепсическими расстройствами, болью в животе и сильным недомоганием. В тяжелых случаях может отмечаться ацидотическая одышка, гипоксия, гипотермия и кома. Диагностическими лабораторными - показателями являются: низкий показатель pH-крови, концентрация лактата в плазме выше 5 ммоль/л, повышенный анионный интервал и соотношение лактат/пируват. Гипогликемия Так как Глюкованс® содержит глибенкламид, то прием препарата сопровождается риском возникновения, гипогликемии у пациента. Постепенное титрование дозы, после начала лечения может предотвратить возникновение гипогликемии. Данное лечение может быть назначено только пациенту, придерживающемуся режима регулярного приема пищи (включая завтрак). Важно, чтобы потребление углеводов было регулярным, так как риск развития гипогликемии увеличивается при позднем приеме пищи, недостаточном или несбалансированном потребление углеводов. Развитие гипогликемии наиболее вероятно при гипокалорийной диете, после интенсивной или продолжительной физической нагрузки, при употреблении алкоголя или при приеме комбинации гипогликемических средств. Из-за компенсаторных реакций, вызванных гипогликемией, может возникать потливость, страх, тахикардия, гипертензия, сердцебиение, стенокардия и аритмия. Последние симптомы могут отсутствовать, если гипогликемия развивается медленно, в случае вегетативной нейропатии или при одновременном приеме бета-адреноблокаторов, клонидина, резерпина, гуанетидина или симпатомиметиков. Другими симптомами гипогликемии у больных сахарным диабетом могут являться головная боль, голод, тошнота, рвота, выраженная усталость, расстройства сна, возбужденное состояние, агрессия, нарушение концентрации внимания и психомоторных реакций, депрессия, спутанность сознания, нарушение речи, нарушение зрения, дрожь, паралич и парестезия, головокружение, делирий, судороги, сомноленция, бессознательное состояние, поверхностное дыхание и брадикардия. Осторожное назначение препарата, подбор дозы и надлежащие инструкции для пациента являются важными для снижения риска развития гипогликемии. Если у пациента повторяются приступы гипогликемии, которые являются либо тяжелыми, либо связанными с незнанием симптомов, следует рассмотреть возможность лечения другими гипогликемическими средствами. Факторы, способствующие развитию гипогликемии: Одновременное употребление алкоголя, особенно при голодании,Отказ или (особенно касается пожилых пациентов) неспособность пациента взаимодействовать с врачом и следовать рекомендациям, изложенным в инструкции по применению, Плохое питание, нерегулярный прием пищи, голодание или изменения в диете, Дисбаланс между физической нагрузкой и приемом углеводов, Почечная недостаточность, Тяжелая печеночная недостаточность, Передозировка препарата Глюкованс®, Отдельные эндокринные нарушения: недостаточность функции щитовидной железы, гипофиза и надпочечников, Одновременный прием отдельных лекарственных препаратов. Почечная и печеночная недостаточность Фармакокинетика и/или фармакодинамика может меняться у пациентов с печеночной недостаточностью или тяжелой почечной недостаточностью. Возникающая у таких пациентов гипогликемия может быть продолжительной, в этом случае должно быть начато соответствующее лечение. Нестабильность содержания глюкозы в крови В случае хирургического вмешательства или другой причины декомпенсации диабета, рекомендуется предусмотреть временный переход на инсулинотерапию. Симптомами гипергликемии являются учащенное мочеиспускание, выраженная жажда, сухость кожи. За 48 часов до планового хирургического вмешательства или внутривенного введения йодсодержащего рентгеноконтрастного средства прием препарата Глюкованс® следует прекратить. Лечение рекомендуется возобновить через 48 часов, и только после того, как функция почек была оценена и признана нормальной. Функция почек Поскольку метформин выводится почками, перед началом лечения, и регулярно в последующем, необходимо определять клиренс креатинина и/или содержание креатинина в сыворотке крови: не реже одного раза в год у пациентов с нормальной функцией почек, и 2-4 раза в год у пожилых пациентов, а также у пациентов с клиренсом креатинина на верхней границе нормы. Рекомендуется соблюдать особую осторожность в случаях, когда функция почек может быть нарушена, например, у пожилых пациентов, или в случае начала антигипертензивной терапии, приема диуретиков или нестероидных противовоспалительных препаратов (НПВП). Другие меры предосторожности Пациент должен сообщить врачу о появлении бронхолегочной инфекции или инфекционного заболевания мочеполовых органов. Влияние на способность управлять транспортными средствами: Пациенты должны быть информированы о риске возникновения гипогликемии и должны соблюдать меры предосторожности при управлении автомобилем и работе с механизмами, требующими повышенной концентрации внимания и быстроты психомоторных реакций. Условия хранения и отпуска из аптек Условия хранения: При температуре не выше 30 °С. Хранить в недоступном для детей месте. Отпуск из аптек: По рецепту Регистрационные данные Торговое название Глюкованс® Международное непатентованное название:Глибенкламид + Метформин. Форма выпуска:таблетки покрытые пленочной оболочкой. Состав:1 таблетка покрытая пленочной оболочкой содержит:Дозировка 2,5 мг+500 мг: Активные компоненты: глибенкламид - 2.5 мг, метформина гидрохлорид - 500 мг. Вспомогательные компоненты:Ядро: кроскармеллоза натрия - 14,0 мг, повидон К 30 - 20,0 мг, целлюлоза микрокристаллическая - 56,5 мг, магния стеарат - 7,0 мг. Оболочка: опадрай OY-L-24808 розовый - 12,0 мг: лактозы моногидрат - 36,0 %, гипромеллоза 15сР - 28,0 %, титана диоксид - 24,39 %, макрогол - 10,00 %, железа оксид желтый - 1,30 %, железа оксид красный - 0,3 %, железа оксид черный - 0,010 %: вода очищенная - q.s. Дозировка 5 мг+500 мг:Активные компоненты: глибенкламид - 5 мг, метформина гидрохлорид - 500 мг. Вспомогательные компоненты:Ядро: кроскармеллоза натрия - 14,0 мг, повидон К 30 - 20,0 мг, целлюлоза микрокристаллическая - 54,0 мг, магния стеарат - 7,0 мг. Оболочка: опадрай 31-F-22700 желтый - 12,0 мг: лактозы моногидрат - 36,0 %, гипромеллоза 15 сР - 28,0 %, титана диоксид - 20,42 %, макрогол - 10,00 %, краситель хинолин желтый - 3,00 %, железа оксид желтый - 2,50 %, железа оксид красный - 0,08 %: вода очищенная - q.s. АТХ: Регистрация: Лекарственное средство ЛС-000304 Фармгруппа: Гипогликемическое средство для перорального применения (производное сульфонилмочевины II поколения + бигуанид)Дата регистрации: 05.04.2010 / 02.02.2012. Окончание регстрации: . Описание: Дозировка 2,5 мг+500 мг: капсуловидные двояковыпуклые таблетки, покрытые пленочной оболочкой светло-оранжевого цвета, с гравировкой "2,5" на одной стороне. Дозировка 5 мг+500 мг: капсуловидные двояковыпуклые таблетки, покрытые пленочной оболочкой желтого цвета, с гравировкой "5" на одной стороне. Упаковка: Таблетки покрытые пленочной оболочкой, 2,5 мг+500 мг и 5 мг+ 500 мг. По 15 таблеток в ПВХ/Ал блистер. По 2 блистера вместе с инструкцией по применению помещают в картонную пачку. На блистер и картонную пачку нанесен символ "М" для защиты от фальсификации. Срок годности: 3 года. Не применять по истечении срока годности, указанного на упаковке. Владелец рег.удостоверения:Мерк Сантэ c.а.c. Производитель:MERCK SANTE, s.a.s. Представительство:МЕРК, ООО

Модель:
RUR 1085
Показания Симптоматическое лечение недержания мочи, учащенного мочеиспускания и ургентных позывов к мочеиспусканию у пациентов с синдромом гиперактивного мочевого пузыря. Противопоказания Противопоказания - Задержка мочеиспускания- тяжелые желудочно-кишечные заболевания (включая токсический мегаколон)- миастения gravis- закрытоугольная глаукома- гиперчувствительность к активному веществу или любому из вспомогательных веществ- проведение гемодиализа- тяжелая печеночная недостаточность- тяжелая почечная недостаточность или печеночная недостаточность средней степени тяжести при одновременном лечении сильными ингибиторами изофермента CYP3A4, такими как кетоконазол (см. раздел "Взаимодействие с другими лекарственными средствами")- дефицит лактазы, непереносимость лактозы, глюкозо-галактозная мальабсорбция- детский возраст до 18 лет. С осторожностью: Прежде чем начать лечение Везикаром®, следует установить, нет ли других причин нарушения мочеиспускания (сердечная недостаточность или заболевания почек). Если выявлена инфекция мочевыводящих путей, следует начать соответствующее антибактериальное лечение. Везикар® следует с осторожностью назначать пациентам- с клинически значимой обструкцией выходного отверстия мочевого пузыря, ведущей к риску развития задержки мочи- с желудочно-кишечными заболеваниями с обструкцией- с риском пониженной моторики желудочно-кишечного тракта- с тяжелой почечной (клиренс креатинина <:30 мл в минуту) и умеренной печеночной недостаточностью (стадия В по классификации Чайлд-Пью): дозы для этих пациентов не должны превышать 5 мг- одновременно принимающим сильный ингибитор изофермента CYP3A4, например, кетоконазол- с грыжей пищеводного отверстия диафрагмы, гастроэзофагеальным рефлюксом и пациентам, одновременно принимающим лекарственные препараты (например, бисфосфонаты), которые могут вызвать или усилить эзофагит: - с вегетативной нейропатией. Беременность Нет клинических данных о женщинах, которые забеременели во время приема солифенацина. Исследования на животных не выявили прямого неблагоприятного воздействия на фертильность, развитие эмбриона/плода или роды. Следует соблюдать осторожность при назначении данного препарата беременным женщинам, только если потенциальная польза для матери превышает потенциальный риск для плода. Нет данных об экскреции солифенацина в грудное молоко. У мышей солифенацин и/или его метаболиты экскретировались в грудное молоко и вызывали дозозависимое нарушение развития у новорожденных мышей. Применение Везикара® не рекомендуется в период грудного вскармливания. Применение и дозы Взрослые, включая пожилых. По 5 мг один раз в день внутрь, целиком, запивая жидкостью, независимо от времени приема пищи. При необходимости доза может быть увеличена до 10 мг один раз в день. Дети. Безопасность и эффективность Везикара® у детей не изучена. Поэтому не следует использовать Везикар® у детей. Пациенты с почечной недостаточностью. Не требуется корректировки дозы у пациентов со слабой или умеренной почечной недостаточностью (клиренс креатинина >: 30 мл/мин). Пациентам с тяжелой почечной недостаточностью (клиренс креатинина 30 мл/мин) солифенацин должен назначаться с осторожностью и не следует назначать более 5 мг в сутки. Пациенты с печеночной недостаточностью. Не требуется корректировки дозы у пациентов со слабой печеночной недостаточностью. Пациентам с умеренной печеночной недостаточностью (стадия В по классификации Чайлд-Пью) солифенацин должен назначаться с осторожностью и не следует назначать более 5 мг в сутки. Пациенты, получающие сильные ингибиторы изофермента CYP3A4 Максимальная доза Везикара® должна быть ограничена 5 мг, когда принимается совместно с кетоконазолом или терапевтической дозой другого ингибитора изофермента CYP3A4 (ритонавир, нелфинавир, итраконазол). Побочные эффекты и передозировка Побочные эффекты: Везикар® может вызывать побочные эффекты, связанные с антихолинергическим действием солифенацина, чаще слабой или умеренной выраженности. Частота этих нежелательных эффектов зависит от дозы. Наиболее часто отмечаемый побочный эффект Везикара® - сухость во рту. Она наблюдалась у 11% пациентов, получавших дозу 5 мг в день, у 22% пациентов, получавших дозу 10 мг в день, и у 4%, получавших плацебо. Выраженность сухости во рту обычно была слабой и лишь в редких случаях приводила к прерыванию лечения. В целом приверженность лечению (комплаенс) была очень высока. Около 90% пациентов, получавших Везикар®, полностью завершили курс 12-недельного лечения.В таблице ниже приводятся остальные побочные эффекты, зарегистрированные в клинических исследованиях Везикара®:ТАБЛИЦЪ*наблюдалось в постмаркетинговом периоде Сообщение о нежелательных явлениях Сообщения о предполагаемых нежелательных явлениях после авторизации препарата на рынке очень важны, поскольку компания проводит непрерывный мониторинг соотношения риск/польза. Передозировка: Передозировка солифенацином потенциально может привести к тяжелым антихолинергическим эффектам. Самая высокая доза солифенацина, которая случайна была дана одному пациенту - 280 мг в течение 5 часов. Эта доза привела к изменению психического состояния пациента, но не потребовала госпитализации. В случаях передозировки следует назначить активированный уголь, промывание желудка эффективно в течение часа, но не следует вызывать рвоту. Как и в случаях передозировки других антихолинергических средств, симптомы следует лечить следующим образом- при тяжелых антихолинергических эффектах центрального действия (галлюцинации, выраженная возбудимость) - физостигмин или карбахол- при судорогах или выраженной возбудимости - бензодиазепины- при дыхательной недостаточности - искусственное дыхание- при тахикардии - бета-блокаторы- при острой задержке мочи - катетеризация- при мидриазе - закапывать в глаза пилокарпин и/или поместить больного в темное помещение. Как и в случае передозировки других антихолинэргических препаратов, особое внимание следует уделять пациентам с установленным риском удлинения интервала QT (т.е. при гипокалиемии, брадикардии и при одновременном приеме препаратов, вызывающих удлинения интервала QT) и пациентам с ранее выявленными сердечными заболеваниями (ишемия миокарда, аритмии, застойная сердечная недостаточность). Взаимодействие с другими ЛС: Фармакологическое взаимодействие. Сопутствующее лечение лекарственными средствами с антихолинергическими свойствами может привести к более выраженным терапевтическим и нежелательным эффектам. После прекращения приема солифенацина следует сделать примерно недельный перерыв, прежде чем начинать лечение другим антихолинергическим препаратом. Терапевтический эффект может быть снижен при одновременном приеме агонистов холинергических рецепторов. Солифенацин может снизить эффект лекарственных препаратов, стимулирующих моторику желудочно-кишечного тракта, например - метоклопрамида и цизаприда. Фармакокинетическое взаимодействие. Исследования in vitro показали, что в терапевтических концентрациях солифенацин не ингибирует изоферменты CYP1A 1/2, 2С9, 2С19, 2D6 или 3А4, выделенные из микросом печени человека. Поэтому маловероятно, что солифенацин изменит клиренс лекарств, метаболизируемых этими CYP-ферментами. Воздействие других лекарственных средств на фармакокинетику солифенацина. Солифенацин метаболизируется изофермент CYP3A4. Одновременное введение кетоконазола (200 мг в день), сильного ингибитора изофермента CYP3A4, вызывало двукратное увеличение AUC зависимости концентрации от времени солифенацина, а в дозе 400 мг/день - трехкратное увеличение. Поэтому максимальная доза Везикара® не должна превышать 5 мг, если больной одновременно принимает кетоконазол или терапевтические дозы других сильных ингибиторов изофермента CYP3A4 (таких, как ритонавир, нелфинавир, итраконазол). Одновременное лечение солифенацином и сильным ингибитором изофермента CYP3A4 противопоказано пациентам с тяжелой почечной недостаточностью или с умеренной печеночной недостаточностью. Не изучались явления индукции ферментов на фармакокинетику солифенацина и его метаболитов, а так же влияние высокоафинных субстратов изофермента CYP3A4 на действие солифенацина. Поскольку солифенацин метаболизируется изоферментом CYP3A4, возможны фармакокинетические взаимодействия с другими субстратами изофермента CYP3A4 с более высоким сродством (верапамил, дилтиазем) и с индукторами изофермента CYP3A4 (рифампицин, фенитоин, карбамазепин). Влияние солифенацина на фармакокинетику других лекарственных средств. Пероральные контрацептивы:Не выявлено фармакокинетического взаимодействия солифенацина и комбинированных пероральных контрацептивов (этинилэстрадиол / левоноргестрел). Варфарин: Прием Везикара® не вызывал изменений фармакокинетики R-варфарина или S-варфарина или их влияния на протромбиновое время. Дигоксин: Прием Везикара® не оказывал влияния на фармакокинетику дигоксина. Фармакологическое действие и фармакокинетика Механизм действия. Солифенацин - это специфический конкурентный антагонист мускариновых рецепторов. Мочевой пузырь иннервируется парасимпатическими холинэргическими нервами. Ацетилхолин воздействует на мускариновые рецепторы (преимущественно М3) и вызывает сокращение детрузора. Фармакологические исследования, проводившиеся in vitro и in vivo, показали, что солифенацин является специфическим конкурентным ингибитором мускариновых рецепторов подтипа М3. Также было установлено, что солифенацин имеет низкое или отсутствие сродства к различным другим рецепторам и ионным каналам. Фармакодинамика. Эффективность препарата Везикар® в дозах 5 мг и 10 мг, изученная в нескольких двойных слепых, рандомизированных, контролируемых клинических испытаниях на мужчинах и женщинах с синдромом гиперактивного мочевого пузыря, наблюдалась уже в течение первой недели лечения и стабилизировалась на протяжении последующих 12 недель лечения. Долгосрочное открытое клиническое исследование показала, что эффективность сохраняется, как минимум, на протяжении 12 месяцев. Через 12 недель применения приблизительно 50% пациентов, страдавших от недержания мочи до лечения, перестали испытывать недержание мочи, и 35% пациентов достигли урежения частоты мочеиспусканий меньше 8 в день. Лечение симптомов гиперактивного мочевого пузыря (ГМП) приводило к значимым улучшениям показателей качества жизни. Максимальный эффект Везикара® может быть выявлен через 4 недели. Фармакокинетика: Общие характеристики. Абсорбция: Максимальная концентрация в плазме (Сmах) достигается через 3-8 часов. Время достижения максимальной концентрации (tmax) не зависит от дозы. Сmах и площадь под кривой (AUC) зависимости концентрации от времени увеличиваются пропорционально повышению дозы от 5 до 40 мг. Абсолютная биодоступность - 90%. Прием пищи не влияет на Сmах и AUC солифенацина. Распределение: Объем распределения солифенацина после внутривенного введения составляет примерно 600 л. Солифенацин в значительной степени (около 98%) связан с протеинами плазмы, преимущественно с α 1-кислым гликопротеином. Метаболизм: Солифенацин активно метаболизируется печенью, преимущественно изоферментом CYP3A4. Однако существуют альтернативные метаболические пути, посредством которых может осуществляться метаболизм солифенацина. Системный клиренс солифенацина составляет около 9,5 л/час, а конечный период полувыведения равен 45-68 часам. После приема препарата внутрь в плазме помимо солифенацина были идентифицированы следующие метаболиты: один фармакологически активный (4R-гидроксисолифенацин) и три неактивных (N-глюкуронид, N-оксид и 4R-гидрокси-N-оксид солифенацина). Выведение: После однократного введения 10 мг 14С-меченого солифенацина спустя 26 дней около 70% радиоактивности было обнаружено в моче и 23% в фекалиях. В моче примерно 11% радиоактивности обнаружено в виде неизмененного активного вещества, около 18% в виде N-оксидного метаболита, 9% в виде 4R-гидрокси-N-оксидного метаболита и 8% в виде 4R-гидрокси метаболита (активный метаболит). Фармакокинетика солифенацина линейна в терапевтическом диапазоне доз. Особенности фармакокинетики у отдельных категорий пациентов. Возраст: Нет необходимости корректировать дозу в зависимости от возраста больных. Исследования показали, что экспозиция солифенацина (5 и 10 мг), выраженная в виде AUC, была сходной у здоровых пожилых индивидов (от 65 до 80 лет) и у здоровых молодых индивидов (<: 55 лет). Средняя скорость абсорбции, выраженная в виде tmax, была несколько ниже, а конечный период полувыведения примерно на 20% длиннее у пожилых людей. Эти незначительные различия не являются клинически значимыми. Фармакокинетика солифенацина не определялась у детей и подростков. Пол: Фармакокинетика солифенацина не зависит от пола пациента. Раса: Расовая принадлежность не влияет на фармакокинетику солифенацина. Почечная недостаточность: AUC и Сmах солифенацина у пациентов с легкой и умеренной почечной недостаточностью незначительно отличаются от соответствующих показателей у здоровых добровольцев. У пациентов с тяжелой почечной недостаточностью (клиренс креатинина 30 мл/мин) экспозиция солифенацина значительно выше - увеличение Сmах составляет около 30%, AUC - более 100% и t 1/2 - более 60%. Отмечена статистически значимая взаимосвязь между клиренсом креатинина и клиренсом солифенацина. Фармакокинетика у пациентов, подвергающихся гемодиализу, не изучалась. Печеночная недостаточность: У пациентов с умеренной печеночной недостаточностью (стадия В по классификации Чайлд-Пью) величина Сmах не меняется, AUC увеличивается на 60%, t 1/2 увеличивается вдвое. Фармакокинетика у пациентов с тяжелой печеночной недостаточностью не определялась. Особые указания У пациентов с такими факторами риска, как существующее удлинение интервала QT и гипокалиемия, наблюдалась удлинение интервала QT и желудочковая тахикардия по типу "пируэт". Эффективность и безопасность не изучалась у пациентов с нейрогенной дисфункцией мочевого пузыря. Было доложено о нескольких случаях ангионевротического отека с обструкцией дыхательных путей у пациентов, принимающих солифенацин. Поэтому при возникновении ангионевротического отека, должен быть прекращен прием солифенацина и приняты соответствующие меры. Было доложено о нескольких случаях анафилактических реакций у пациентов, принимающих солифенацин. Поэтому при возникновении анафилактической реакции должен быть прекращен прием солифенацина и приняты соответствующие меры. Влияние на способность управлять транспортными средствами: Солифенацин, подобно другим антихолинергическим препаратам, может вызывать нечеткость зрительного восприятия, а также (редко) сонливость и чувство усталости, что может отрицательно сказаться на способности управлять автомобилем и работать с механизмами. Условия хранения и отпуска из аптек Условия хранения:Хранить при температуре не выше 25 °С, в недоступном для детей месте. Отпуск из аптек: По рецепту Регистрационные данные Торговое название Везикар® Международное непатентованное название:Солифенацин. Форма выпуска:таблетки, покрытые пленочной оболочкой. Состав:Каждая таблетка 5 мг содержит:состав ядра таблетки: солифенацин сукцинат - 5,0 мг, лактоза моногидрат - 107,5 мг, крахмал кукурузный - 30,0 мг, гипромеллоза 3 м. Па с - 6,0 мг, магния стеарат - 1,5 мг, вода очищенная - 54,0 мг:состав плёночного покрытия таблетки: опадрай жёлтый 03F12967 - 4,0 мг (гипромеллоза 6 м. Па с - 61,83%, тальк - 18,54%, макрогол 8000 - 11,6%, титана диоксид - 7,88%, железа оксид желтый - 0,15%), вода очищенная - 36,0 мг. Каждая таблетка 10 мг содержит:состав ядра таблетки: солифенацин сукцинат - 10,0 мг, лактоза моногидрат - 102,5 мг, крахмал кукурузный - 30,0 мг, гипромеллоза 3 м. Пa c - 6,0 мг, магния стеарат - 1,5 мг, вода очищенная - 54,0 мг:состав плёночного покрытия таблетки: опадрай розовый 03F14895 - 4,0 мг (гипромеллоза 6 м. Па с - 62,0%, тальк - 18,59%, макрогол 8000 - 11,63%, титана диоксид - 7,75%, железа оксид красный - 0,03%), вода очищенная - 36,0 мг. - вода удаляется в процессе производства. АТХ: Регистрация: Лекарственное средство ЛС-000687 Фармгруппа: Спазмолитическое средство. Дата регистрации: 05.07.2010 / 14.04.2014. Окончание регстрации: . Описание:Везикар® 5 мг. Круглые, двояковыпуклые таблетки, покрытые пленочной оболочкой светло-желтого цвета, имеющие маркировку " 150" и логотип компании на одной стороне. Везикар® 10 мг Круглые, двояковыпуклые таблетки, покрытые пленочной оболочкой, светло-розового цвета, имеющие маркировку "151" и логотип компании на одной стороне. Упаковка: Таблетки, покрытые пленочной оболочкой, 5 и 10 мг. По 10 таблеток в блистере из поливинилхлоридной пленки и алюминиевой фольги. По 1 или 3 блистера вместе с инструкцией по применению помещают в картонную пачку. Срок годности:3 года. Препарат не следует применять после срока годности, указанного на упаковке. Владелец рег.удостоверения:Астеллас Фарма Юроп Б.В. Производитель:ASTELLAS PHARMA EUROPE, B.V. : ОРТАТ, ЗАО. Представительство*:АСТЕЛЛАС ФАРМА ЮРОП Б.В
Модель:
RUR 346
Лекарственная форма Таблетки диспергируемые. Состав Действующие вещества: Амоксициллина тригидрат (соответствует амоксициллину) – 574,00 мг (500 мг), клавуланат калия (соответствует клавулановой кислоте) – 148,87 мг (125 мг). Вспомогательные вещества: Ароматизатор тропическая смесь - 26,00 мг, ароматизатор сладкий апельсин - 26,00 мг, аспартам - 6,50 мг, кремния диоксид коллоидный безводный - 13,00 мг, краситель железа оксид желтый, Е 172 - 3,50 мг, тальк - 13,00 мг, касторовое масло гидрогенизированное - 26,00 мг, целлюлоза микрокристаллическая кремнийсодержащая* - до 1300,00 мг. *Содержит 98 % целлюлозы микрокристаллической и 2 % кремния диоксида коллоидного безводного. Описание Продолговатые восьмиугольные таблетки светло-желтого цвета с вкраплениями коричневого цвета, с фруктовым запахом. Фармакотерапевтическая группа Антибиотик ˗ пенициллин полусинтетический + бета-лактамаз ингибитор. Код АТХ: J01CR02. Фармакологические свойства Фармакодинамика Механизм действия Амоксициллин - полусинтетический антибиотик широкого спектра действия, обладающий активностью против многих грамположительных и грамотрицательных микроорганизмов. В то же время, амоксициллин подвержен разрушению бета-лактамазами, и поэтому спектр активности амоксициллина не распространяется на микроорганизмы, которые продуцируют этот фермент. Клавулановая кислота - ингибитор бета-лактамаз, структурно родственный пенициллинам, обладает способностью инактивировать широкий спектр бета-лактамаз, обнаруженных у микроорганизмов, устойчивых к пенициллинам и цефалоспоринам. Клавулановая кислота обладает достаточной эффективностью в отношении плазмидных бета-лактамаз, которые чаще всего обуславливают резистентность бактерий, и не эффективна в отношении хромосомных бета-лактамаз 1 типа, которые не ингибируются клавулановой кислотой. Присутствие клавулановой кислоты в препарате защищает амоксициллин от разрушения ферментами - бета-лактамазами, что позволяет расширить антибактериальный спектр амоксициллина. Фармакокинетика Всасывание Амоксициллин и клавулановая полностью диссоциируют в водном растворе при физиологических значениях pH. Оба активных компонента препарата, амоксициллин и клавулановая кислота, быстро и хорошо всасываются из желудочно-кишечного тракта (ЖКТ) после перорального приема. Абсорбция действующих веществ оптимальна в начале приема пищи. Биодоступность амоксициллина и клавулановой кислоты при приеме внутрь высокая. После однократного приема препарата в дозе 500 мг амоксициллина / 125 мг клавулановой кислоты максимальная концентрация амоксициллина в плазме крови создается через 1,5 ч (1,0-2,5 ч), и составляет 7,19±2,26 мкг/мл (Сmax), клавулановой кислоты – через 1,5 ч (1,0 – 2,0 ч), составляя 2,4±0,83 мкг/мл. ПФК (показатель «площадь под фармакокинетической кривой») амоксициллина и клавулановой кислоты составляет 53,5±8,87 мкг*ч/л и 15,72±3,86 мкг*ч/л, соответственно. Плазменные концентрации амоксициллина и клавулановой кислоты, достигаемые при применении амоксициллин/клавуланата, схожи с таковыми при пероральном приеме эквивалентных доз амоксициллина и клавулановой кислоты по отдельности. Распределение Приблизительно около 18 % амоксициллина и 25 % клавулановой кислоты связываются с белками плазмы крови. Кажущийся объем распределения составляет 0,3-0,4 л/кг для амоксициллина и около 0,2 л/кг для клавулановой кислоты. Амоксициллин плохо распределяется в спинномозговую жидкость. В исследованиях на животных кумуляции компонентов препарата в тканях организма не выявлено. Как и большинство пенициллинов, амоксициллин проникает в грудное молоко. Клавулановая кислота также обнаруживается в грудном молоке в следовых концентрациях. Амоксициллин и клавулановая кислота проникают через плацентарный барьер. Метаболизм 10-25 % от начальной дозы амоксициллина выводится почками в виде неактивного метаболита (пенициллоевой кислоты). Клавулановая кислота подвергается интенсивному метаболизму и выводится почками, кишечником, а также с выдыхаемым воздухом, в виде диоксида углерода. Выведение После однократного приема препарата в дозе 500 мг/125 мг период полувыведения амоксициллина составляет 1,15±0,20 ч, клавулановой кислоты – 0,98±0,12 ч, общий клиренс – около 25 л/ч. Приблизительно 60-70 % амоксициллина и около 40-65 % клавулановой кислоты выводится почками в неизмененном виде в течение первых 6 часов после приема 1 таблетки препарата 250/125 мг или 500/125 мг. Наибольшее количество клавулановой кислоты экскретируется в течение первых 2 часов после приема. В различных исследованиях было показано, что в течение 24 часов через почки выводится до 50-85% амоксициллина и до 27-60% клавулановой кислоты. Одновременный прием пробенецида задерживает выведение амоксициллина, но не влияет на экскрецию почками клавулановой кислоты (см. раздел «Взаимодействие с другими лекарственными препаратами»). Факмакокинетика в особых случаях Возрастные особенности Период полувыведения амоксициллина у детей 3 месяцев – 2 лет не отличается от такового у детей старшего возраста и взрослых. Детям первой недели жизни (в том числе недоношенным) не следует назначать препарат более 2 раз в день из-за незрелости почечного пути элиминации. Из-за возможного снижения функции почек подбор дозы препарата для пожилых пациентов следует производить с осторожностью. Может потребоваться контроль функции почек. Половые особенности При пероральном приеме амоксициллин/клавулановой кислоты здоровыми мужчинами и женщинами не установлено значимого влияния пола пациента на фармакокинетику активных компонентов препарата. Нарушение функции почек Суммарный клиренс амоксициллин/клавулановой кислоты уменьшается пропорционально снижению почечной функции. Особенно заметно нарушается клиренс амоксициллина, поскольку почками экскретируется большая его часть. Таким образом, при нарушении функции почек следует корректировать дозу препарата во избежание избыточной концентрации амоксициллина и для поддержания необходимого уровня клавулановой кислоты. Нарушение функции печени У пациентов с нарушением функции печени препарат следует назначать с осторожностью. Необходимо регулярно контролировать функцию печени. Показания к применению Препарат Амоксиклав® показан для лечения бактериальных инфекций, вызванных чувствительными к амоксициллину/клавулановой кислоте микроорганизмами: инфекции верхних дыхательных путей (включая инфекции ЛОР-органов), например, рецидивирующий тонзиллит, синусит, средний отит, обычно вызываемые Streptococcus pneumoniae, Haemophilus influenzae#, Moraxella catarrhalis# и Streptococcus pyogenes; инфекции нижних дыхательных путей, например, обострение хронического бронхита, долевая пневмония и бронхопневмония, обычно вызываемые Streptococcus pneumoniae, Haemophilus influenzae# и Moraxella catarrhalis#); инфекции мочеполового тракта, например, цистит, уретрит, пиелонефрит, инфекции женских половых органов, обычно вызываемые видами семейства Enterobacteriaceae# (преимущественно Escherichia coli#), Staphylococcus saprophyticus и видами рода Enterococcus, а также гонорея, вызываемая Neisseria gonorrhoeae#; инфекции кожи и мягких тканей, обычно вызываемые Staphylococcus aureus#, Staphylococcus pyogenes и видами рода Bacteroides#; инфекции костей и суставов, например, остеомиелит, обычно вызываемый Staphylococcus aureus#; в этом случае может потребоваться более длительная терапия. одонтогенные инфекции, например, периодонтит, одонтогенный верхнечелюстной синусит, тяжелые дентальные абсцессы с распространяющимся целлюлитом; другие смешанные инфекции (например, септический аборт, послеродовой сепсис, интраабдоминальный сепсис) в рамках ступенчатой терапии. #отдельные представители указанного рода микроорганизмов продуцируют бета-лактамазу, что делает их нечувствительными к монотерапии амоксициллином. Чувствительность бактерий к комбинации амоксициллина/клавулановой кислоты варьирует в зависимости от региона с течением времени. Там, где это возможно, должны быть приняты во внимание локальные данные по чувствительности. В случае необходимости следует осуществлять сбор микробиологических образцов и проводить анализ на бактериологическую чувствительность. Противопоказания Повышенная чувствительность к амоксициллину, клавулановой кислоте, другим пенициллинам или другим вспомогательным веществам препарата; тяжелые реакции гиперчувствительности немедленного типа (например, анафилактические реакции) в анамнезе к другим бета-лактамным антибиотикам (цефалоспорины, карбапенемы или монобактамы); предшествующие эпизоды желтухи и/или нарушения функции печени, вызванные приемом амоксициллина/клавулановой кислоты, в анамнезе. нарушение функции почек (клиренс креатинина менее 30 мл/мин) (для дозировки 875 мг + 125 мг); детский возраст до 12 лет или масса тела менее 40 кг; нарушение функции почек (КК менее 30 мл/мин) (для дозировки 875 мг+125 мг); фенилкетонурия. С осторожностью Тяжелая печеночная недостаточность; заболевания желудочно-кишечного тракта (в т.ч. колит, связанный с применением пенициллинов в анамнезе); хроническая почечная недостаточность; беременность; период грудного вскармливания; одновременное применение с антикоагулянтами. Применение при беременности и в период грудного вскармливания Исследования на животных не выявили данных о вреде приема препарата Амоксиклав® Квиктаб в период беременности и его воздействии на эмбриональное развитие плода. В одном исследовании у женщин с преждевременным разрывом околоплодных оболочек было установлено, что профилактическая терапия амоксициллином/клавулановой кислотой может быть связана с повышением риска развития некротизирующего энтероколита у новорожденных. Также есть сведения о развитии у новорожденных диареи и кандидоза слизистых оболочек полости рта. При беременности и в период лактации препарат Амоксиклав® Квиктаб применяют только в том случае, если предполагаемая польза для матери превышает потенциальный риск для плода и ребенка. Амоксициллин и клавулановая кислота в небольших количествах проникают в грудное молоко, поэтому прием препарата в период грудного вскармливания должен быть продолжен только при наличии четких показаний. У младенцев, получающих грудное вскармливание, возможно развитие сенсибилизации, диареи, кандидоза слизистых оболочек полости рта. В подобных случаях грудное вскармливание следует прекратить. Способ применения и дозы Внутрь. Режим дозирования устанавливается индивидуально в зависимости от возраста, массы тела, функции почек пациента и степени тяжести инфекции. Таблетки необходимо растворить в половине стакана воды (минимум 30 мл) и тщательно перемешать, затем выпить, или подержать таблетки во рту до полного растворения, после чего проглотить. С целью снижения риска развития побочных эффектов со стороны ЖКТ следует принимать препарат в начале еды. Диспергируемые таблетки препарата Амоксиклав® Квиктаб 500 мг/125 мг: Взрослые и дети старше 12 лет с массой тела более 40 кг: Для лечения инфекций легкой и средней степени тяжести - одна таблетка (500 мг/125 мг) каждые 12 ч (2 раза в день). Для лечения тяжелых инфекций и инфекций органов дыхания - одна таблетка (500 мг/125 мг) каждые 8 ч (3 раза в день). Максимальная суточная доза препарата Амоксиклав® Квиктаб составляет 1500 мг амоксициллина/375 мг клавулановой. Пациенты с нарушением функции почек У пациентов с клиренсом креатинина (КК) выше 30 мл/мин отсутствует необходимость в коррекции дозы. Диспергируемые таблетки препарата Амоксиклав® Квиктаб 875 мг/125 мг: Взрослые и дети старше 12 лет с массой тела более 40 кг: При тяжелых инфекциях и инфекциях органов дыхания - одна таблетка (875 мг/125 мг) каждые 12 часов (2 раза в день). Суточная доза препарата Амоксиклав® Квиктаб при применении 2 раза в день составляет 1750 мг амоксициллина/250 мг клавулановой кислоты. Пациенты с нарушением функции почек У пациентов с клиренсом креатинина (КК) более 30 мл/мин отсутствует необходимость в коррекции дозы. Пациентам с КК менее 30 мл/мин использование диспергируемых таблеток препарата Амоксиклав® Квиктаб, 875 мг/125 мг противопоказано. Таким пациентам следует принимать препарат в дозировке 500 мг/125 мг после соответствующей уровню КК коррекции дозы. Пациенты с нарушением функции печени При приеме препарата Амоксиклав® Квиктаб следует соблюдать осторожность. Необходимо проводить регулярный контроль функции печени. В случае начала лечения с парентерального введения препарата, терапию возможно продолжить приемом таблеток препарата Амоксиклав® Квиктаб. Продолжительность курса лечения определяется лечащим врачом! Минимальный курс антибактериальной терапии составляет 5 дней. Лечение не должно продолжаться более 14 дней без пересмотра клинической ситуации. Побочное действие Нежелательные реакции, представленные ниже, перечислены в соответствии с поражением органов и систем органов и частотой встречаемости. Частота встречаемости определяется следующим образом: очень часто (более 1/10), часто (более 1/100, менее 1/10), нечасто (более 1/1000, менее 1/100), редко (более 1/10000, менее 1/1000), очень редко (менее 1/10000), частота неизвестна (не может быть установлена на основании имеющихся данных). Категории частоты были сформированы на основании клинических исследований препарата и пострегистрационного наблюдения. Частота встречаемости нежелательных реакций Инфекционные и паразитарные заболевания Часто: кандидоз кожи и слизистых оболочек. Частота неизвестна: избыточный рост чувствительных микроорганизмов. Нарушения со стороны крови и лимфатической системы Редко: обратимая лейкопения (включая нейтропению), обратимая тромбоцитопения. Частота неизвестна: обратимый агранулоцитоз и обратимая гемолитическая анемия, удлинение времени кровотечения и протромбинового времени. Нарушения со стороны иммунной системы Частота неизвестна: ангионевротический отек, анафилактические реакции, синдром, сходный с сывороточной болезнью, аллергический васкулит, острый коронарный синдром, ассоциированный с гиперчувствительностью (синдром Коуниса). Нарушения со стороны нервной системы Нечасто: головокружение, головная боль. Частота неизвестна: обратимая гиперактивность, асептический менингит, судороги. Судороги могут наблюдаться у пациентов с нарушениями функции почек, а также у тех, кто получает высокие дозы препарата (см. разделы «Способ применения и дозы» - Пациенты с нарушением функции почек, «Передозировка»). Нарушения со стороны желудочно-кишечного тракта Взрослые: Очень часто: диарея. Часто: тошнота, рвота. Дети: Часто: диарея, тошнота, рвота. Вся популяция: Тошнота наиболее часто была связана с использованием высоких доз препарата. Если после начала приема препарата наблюдаются нежелательные реакции со стороны ЖКТ, они могут быть устранены, если принимать препарат в начале приема пищи. Нечасто: нарушение пищеварения. Частота неизвестна: антибиотико-ассоциированный колит (включая псевдомембранозный колит и геморрагический колит) (см. раздел «Особые указания»), черный «волосатый» язык. Нарушения со стороны печени и желчевыводящих путей Нечасто: умеренное повышение активности аспартатаминотрансферазы и/или аланинаминотрансферазы (АСТ и/или АЛТ). Данная реакция наблюдается у пациентов, получающих терапию бета-лактамными антибиотиками, однако клиническая значимость ее неизвестна. Частота неизвестна: гепатит и холестатическая желтуха. Данные реакции наблюдаются у пациентов, получающих терапию антибиотиками пенициллинового ряда и цефалоспоринами. Нежелательные реакции со стороны печени наблюдались, главным образом, у мужчин и пациентов пожилого возраста и могут быть связаны с длительной терапией. Данные нежелательные реакции очень редко наблюдаются у детей. Перечисленные признаки и симптомы обычно встречаются в процессе или сразу по окончании терапии, однако в отдельных случаях могут не проявляться в течение нескольких недель после завершения терапии. Нежелательные реакции, как правило, обратимы. Нежелательные реакции со стороны печени могут быть тяжелыми, в исключительно редких случаях были сообщения о летальных исходах. Почти во всех случаях это были лица с серьезной сопутствующей патологией или пациенты, получающие одновременно потенциально гепатотоксичные препараты. Нарушения со стороны кожи и подкожных тканей Нечасто: сыпь, зуд, крапивница. Редко: многоформная экссудативная эритема. Частота неизвестна: синдром Стивенса-Джонсона, токсический эпидермальный некролиз, буллезный эксфолиативный дерматит, острый генерализованный экзантематозный пустулез (AGEP) и лекарственная сыпь с эозинофилией и системными симптомами (DRESS). В случае возникновения кожных аллергических реакций лечение препаратом Амоксиклав® Квиктаб необходимо прекратить. Нарушения со стороны почек и мочевыводящих путей Частота неизвестна: интерстициальный нефрит, кристаллурия (см. раздел «Передозировка»). Передозировка Сообщений о летальном исходе или возникновении угрожающих жизни побочных эффектов вследствие передозировки препарата Амоксиклав® Квиктаб нет. Симптомы передозировки включают расстройства со стороны ЖКТ (боль в области живота, диарея, рвота) и нарушения водно-электролитного баланса. Зарегистрированы сообщения о кристаллурии, вызванной приемом амоксициллина, которая, в некоторых случаях, приводила к развитию почечной недостаточности. Возможно развитие судорог у пациентов с почечной недостаточностью или у пациентов, получающих высокие дозы препарата. При передозировке пациент должен находиться под наблюдением врача, лечение симптоматическое. При передозировке препарата рекомендовано промывание желудка и прием адсорбентов (активированный уголь). Гемодиализ эффективен. Взаимодействие с другими лекарственными препаратами Антациды, глюкозамин, слабительные лекарственные средства, аминогликозиды замедляют абсорбцию, аскорбиновая кислота - повышает абсорбцию. Диуретики, аллопуринол, фенилбутазон, нестероидные противовоспалительные препараты (НПВП) и другие лекарственные средства, блокирующие канальцевую секрецию, повышают концентрацию амоксициллина (клавулановая кислота выводится в основном путем клубочковой фильтрации). Одновременное применение с аллопуринолом может привести к развитию кожных аллергических реакций. Одновременное применение препарата Амоксиклав® Квиктаб и метотрексата повышает токсичность метотрексата. Следует избегать одновременного применения с дисульфирамом. Повышает эффективность непрямых антикоагулянтов (подавляя кишечную микрофлору, снижает синтез витамина К и протромбиновый индекс). В некоторых случаях прием препарата может удлинять протромбиновое время, в связи с этим следует соблюдать осторожность при одновременном применении антикоагулянтов и препарата Амоксиклав® Квиктаб. В литературе описываются редкие случаи увеличения международного нормализованного отношения (МНО) у пациентов при одновременном применении аценокумарола или варфарина и амоксициллина. При необходимости одновременного применения с антикоагулянтами протромбиновое время или МНО должны тщательно контролироваться при назначении или отмене препарата, может потребоваться коррекция дозы антикоагулянтов для приема внутрь. При комбинации с рифампицином наблюдается взаимное ослабление антибактериального эффекта. Амоксиклав® Квиктаб не следует применять одновременно с бактериостатическими антибиотиками (макролиды, тетрациклины), сульфаниламидами из-за возможного снижения эффективности препарата Амоксиклав® Квиктаб. Пробенецид снижает выведение амоксициллина, увеличивая его сывороточную концентрацию. Антибиотики снижают эффективность пероральных контрацептивов. Уменьшает эффективность лекарственных средств, в процессе метаболизма которых образуется парааминобензойная кислота, этинилэстрадиол - риск развития кровотечений «прорыва». У пациентов, получавших микофенолата мофетил, после начала применения комбинации амоксициллина с клавулановой кислотой наблюдалось снижение концентрации активного метаболита - микофеноловой кислоты, до приема очередной дозы препарата приблизительно на 50 %. Изменения данной концентрации не могут точно отражать общие изменения экспозиции микофеноловой кислоты. Особые указания Перед началом лечения препаратом Амоксиклав® Квиктаб необходимо собрать подробный анамнез, касающийся предшествующих реакций гиперчувствительности на пенициллины, цефалоспорины или другие вещества, вызывающие аллергическую реакцию у пациента. Описаны серьезные, а иногда и летальные, реакции гиперчувствительности (включая анафилактические и тяжелые кожные нежелательные реакции) на пенициллины. Риск возникновения таких реакций наиболее высок у пациентов, имеющих в анамнезе реакции гиперчувствительности на пенициллины. В случае возникновения аллергической реакции необходимо прекратить лечение препаратом Амоксиклав® Квиктаб и начать соответствующую альтернативную терапию. В случае если доказано, что инфекция вызвана чувствительными к амоксициллину микроорганизмами, следует рассмотреть возможность замены комбинации амоксициллин/клавулановая кислота на амоксициллин в соответствии с официальными клиническими рекомендациями. Комбинация амоксициллин/клавулановая кислота не подходит для применения в случаях, когда высок риск того, что предполагаемые патогенные микроорганизмы обладают пониженной чувствительностью или резистентностью к бета-лактамным препаратам, которая, не обусловлена бета-лактамазами, восприимчивыми к ингибированию клавулановой кислотой. Амоксициллин/ клавулановую кислоту не следует применять для терапии инфекций, вызванных резистентными к пенициллину штаммами S. pneumoniae. Острый коронарный синдром, ассоциированный с гиперчувствительностью (синдром Коуниса) В редких случаях сообщалось о реакциях гиперчувствительности во время лечения амоксициллином (острый коронарный синдром, ассоциированный с гиперчувствительностью), в этих случаях необходимо назначать соответствующее лечение. У пациентов с нарушением функции почек, а также при приеме высоких доз препарата могут наблюдаться судороги (см. раздел «Побочные действия»). В случае подозрения на инфекционный мононуклеоз не следует применять препарат Амоксиклав® Квиктаб, поскольку у пациентов с этим заболеванием амоксициллин может вызывать экзантему (кореподобную сыпь). Одновременное применение аллопуринола во время лечения амоксициллином может повышать вероятность возникновения кожных аллергических реакций. Длительное лечение препаратом Амоксиклав® Квиктаб может приводить к чрезмерному росту нечувствительных микроорганизмов. Возникновение в начале лечения генерализованной эритемы с лихорадкой, сопровождаемой образованием пустул, может быть симптомом острого генерализованного экзантематозного пустулеза (ОГЭП). Такая реакция требует отмены препарата, содержащего амоксициллин/клавулановую кислоту, и является противопоказанием к последующему применению препаратов амоксициллина. Препараты, содержащие амоксициллин/клавулановую кислоту, следует применять с осторожностью у пациентов с нарушениями функции печени. Нежелательные явления со стороны печени наблюдались, главным образом, у мужчин, и пациентов пожилого возраста и могут быть связаны с длительной терапией. Данные нежелательные явления очень редко наблюдаются у детей. Во всех популяциях перечисленные признаки и симптомы обычно встречаются в процессе или вскоре после окончания терапии, однако в некоторых случаях могут проявляться и через несколько недель после завершения терапии. Они, как правило, обратимы. Нежелательные явления со стороны печени могут быть тяжелыми, в исключительно редких случаях сообщалось о смертельных исходах. Почти во всех случаях это были пациенты с серьезными сопутствующими заболеваниями или пациенты, одновременно получающими препараты, потенциально влияющие на печень. Описаны случаи возникновения псевдомембранозного колита при приеме антибиотиков, степень тяжести которого может варьироваться от легкой до угрожающей жизни. Поэтому важно учитывать возможность развития псевдомембранозного колита у пациентов с диареей во время или после применения антибиотиков. При возникновении антибиотик-ассоциированного колита следует немедленно прекратить лечение комбиницией амоксициллин/клавулановая кислота, обратиться к врачу и начать соответствующее лечение. Препараты, тормозящие перистальтику кишечника, противопоказаны в данной ситуации. Во время длительной терапии препаратом Амоксиклав® Квиктаб рекомендуется периодически оценивать функцию почек, печени и кроветворения. У пациентов, получавших комбинацию амоксициллина с клавулановой кислотой, в редких случаях сообщалось об удлинении протромбинового времени (повышении МНО). При одновременном применении непрямых (пероральных) антикоагулянтов с комбинацией амоксициллина с клавулановой кислотой необходим контроль соответствующих показателей. Для поддержания необходимого эффекта пероральных антикоагулянтов может потребоваться коррекция их дозы. У пациентов с нарушением функции почек дозу препарата Амоксиклав® Квиктаб следует снижать соответственно степени нарушения (см. раздел «Способ применения и дозы» - «Пациенты с нарушением функции почек»). У пациентов со сниженным диурезом очень редко возникает кристаллурия, преимущественно при парентеральной терапии. Во время введения высоких доз амоксициллина рекомендуется принимать достаточное количество жидкости и поддерживать адекватный диурез для уменьшения вероятности образования кристаллов амоксициллина (см. раздел «Передозировка»). У пациентов с катетерами мочевого пузыря следует регулярно проверять их проходимость. Прием препарата Амоксиклав® Квиктаб внутрь приводит к высокому содержанию амоксициллина в моче, что может приводить к ложноположительным результатам при определении глюкозы в моче (например, проба Бенедикта, проба Фелинга). В этом случае рекомендуется применять глюкозоксидантный (ферментативный) метод определения концентрации глюкозы в моче. Клавулановая кислота может вызывать неспецифическое связывание иммуноглобулинов класса G и альбумина с мембранами эритроцитов, что приводит к ложноположительным результатам пробы Кумбса. Сообщалось о положительных результатах теста Плателли Aspergillus с использованием тест-системы для иммуноферментного анализа (ИФА) компании Bio-Rad Laboratories у пациентов, получавших комбинацию амоксициллин/клавулановая кислота, у которых впоследствии не была обнаружена Aspergillus инфекция. При проведении теста Плателли Aspergillus ИФА сообщалось о перекрестных реакциях с полисахаридами и полифуранозами, не характерными для Aspergillus. В связи с этим положительные результаты теста Плателли Aspergillus ИФА у пациентов, получавших комбинацию амоксициллин/клавулановая кислота, следует интерпретировать с осторожностью и подтверждать другими методами диагностики. В одной диспергируемой таблетке Амоксиклав® Квиктаб 500 мг/125 мг содержится 0,63 ммоль (24,53 мг) калия, в 875 мг/125 мг содержится 0,63 ммоль (24,53 мг) калия. Прием калия более 1 ммоль в сутки требует особого внимания у пациентов со сниженной функцией почек и находящихся на контролируемой калиевой диете. Влияние на способность управлять транспортными средствами, механизмами Данных об отрицательном влиянии препарата Амоксиклав® Квиктаб в рекомендуемых дозах на способность к управлению автомобилем или работу с механизмами нет. Однако из-за возможности развития побочных эффектов со стороны центральной нервной системы, таких, как головокружение, головная боль, судороги, во время лечения следует соблюдать осторожность при управлении автомобилем и занятиях другими видами деятельности, требующими концентрации внимания и быстроты психомоторных реакций. При появлении описанных нежелательных явлений следует воздержаться от выполнения указанных видов деятельности. Форма выпуска Таблетки диспергируемые, 500 мг+125 мг, 875 мг+125 мг Первичная упаковка По 2 таблетки в блистер из алюминия/алюминия. Вторичная упаковка По 5 или 7 блистеров вместе с инструкцией по медицинскому применению в пачку картонную. Срок годности 3 года. Не использовать после истечения срока годности. Условия хранения Хранить в оригинальной упаковке (блистер в пачке) при температуре не выше 25°C. Хранить в недоступном для детей месте. Условия отпуска Отпускают по рецепту

Модель:
RUR 275
Показания Первичная гиперхолестеринемия (гетерозиготная семейная и несемейная гиперхолестеринемия (тип IIa по классификации Фредриксона):комбинированная (смешанная) гиперлипидемия (типа IIa и IIb по классификации Фредриксона):дисбеталипопротеинемия (тип III по классификации Фредриксона) (в качестве дополнения к гипохолестериновой диете):семейная эндогенная гипертриглицеридемия (тип IV по классификации Фредриксона), резистентная к гипохолестериновой диете:гомозиготная семейная гиперхолестеринемия при недостаточной эффективности диетотерапии и других нефармакологических методов лечения: первичная профилактика сердечно-сосудистых осложнений у пациентов без клинических признаков ишемической болезни сердца, но имеющих несколько факторов риска ее развития: возраст старше 55 лет, никотиновая зависимость, артериальная гипертензия, сахарный диабет, низкие концентрации ХС-ЛПВП в плазме крови, генетическая предрасположенность, в том числе на фоне дислипидемии:вторичная профилактика сердечно-сосудистых осложнений у пациентов с ишемической болезнью сердца с целью снижения суммарного показателя смертности, инфаркта миокарда, инсульта, повторной госпитализации по поводу стенокардии и необходимости в проведении процедур реваскуляризации. Противопоказания Противопоказания Повышенная чувствительность к любому компоненту препарата. Активное заболевание печени или повышение активности "печеночных" трансаминаз в плазме крови неясного генеза более чем в 3 раза по сравнению с верхней границей нормы (ВГН). Возраст до 18 лет (недостаточно клинических данных по эффективности и безопасности препарата в данной возрастной группе). Применение у женщин репродуктивного возраста, не пользующихся адекватными методами контрацепции. Беременность, период грудного вскармливания. Непереносимость лактозы, дефицит лактазы, синдром глюкозо-галактозной мальабсорбции. С осторожностью: Злоупотребление алкоголем, заболевания печени в анамнезе, тяжелые нарушения водно-электролитного баланса, эндокринные и метаболические нарушения, артериальная гипотензия, тяжелые острые инфекции (сепсис), неконтролируемая эпилепсия, обширные хирургические вмешательства, травмы, заболевания скелетных мышц, сахарный диабет. Беременность Аторвастатин противопоказан к применению при беременности и в период грудного вскармливания. Женщины репродуктивного возраста во время лечения должны использовать адекватные средства контрацепции. Аторвастатин можно назначать женщинам репродуктивного возраста только в том случае, если вероятность беременности у них очень низкая, и пациентка информирована о возможном риске лечения для плода. Поскольку холестерин и вещества, синтезируемые из холестерина важны для развития плода, потенциальный риск ингибирования ГМГ-КоА-редуктазы превышает пользу от применения аторвастатина во время беременности. В случае диагностирования беременности, прием препарата должен быть прекращен как можно быстрее, а пациентка предупреждена о потенциальном риске для плода. Неизвестно, выводится ли аторвастатин с грудным молоком. Учитывая возможность нежелательных явлений у грудных детей, при необходимости применения препарата в период лактации следует решить вопрос о прекращении грудного вскармливания. Применение и дозы Внутрь. Принимать в любое время суток независимо от приема пищи. Перед началом лечения препаратом следует попытаться добиться контроля гиперхолестеринемии с помощью диеты, физических упражнений и снижения массы тела у пациентов с ожирением, а также терапией основного заболевания. При назначении препарата пациенту необходимо рекомендовать стандартную гипохолестеринемическую диету, которой он должен придерживаться в течение всего периода терапии. Доза препарата варьируется от 10 мг до 80 мг 1 раз в сутки и титруется с учетом исходной концентрации ХС-ЛПНП, цели терапии и индивидуального эффекта на проводимую терапию. Максимальная суточная доза препарата для однократного приема составляет 80 мг.В начале лечения и/или во время повышения дозы препарата необходимо каждые 2-4 недели контролировать концентрацию липидов в плазме крови и соответствующим образом корректировать дозу препарата. Первичная гиперхолестеринемия и комбинированная (смешанная) гиперлипидемия. Для большинства пациентов - 10 мг 1 раз в сутки: терапевтическое действие проявляется в течение 2 недель терапии и обычно достигает максимума в течение 4-х недель. При длительном лечении эффект сохраняется. Гомозиготная семейная гиперхолестеринемияВ большинстве случаев назначают по 80 мг 1 раз в сутки (снижение концентрации ХС- ЛПНП на 18-45 %). Недостаточность функции печени При недостаточности функции печени дозу препарата необходимо снижать, при регулярном контроле активности "печеночных" трансаминаз: аспартатаминотрансферазы (АСТ) и аланинаминотрансферазы (АЛТ). Недостаточность функции почек Нарушение функции почек не влияет на концентрацию аторвастатина в плазме крови или степень снижения концентрации ХС-ЛПНП при терапии препаратом, поэтому коррекции дозы препарата не требуется. Пожилые пациенты Различий в эффективности, безопасности или терапевтическом эффекте препарата у пожилых пациентов по сравнению с общей популяцией не обнаружено и коррекции дозы не требуется (см. раздел "Фармакокинетика"). Применение в комбинации с другими лекарственными препаратами. При необходимости одновременного применения с циклоспорином доза препарата не должна превышать 10 мг в сутки (см. раздел "Особые указания"). Следует соблюдать осторожность и применять самую низкую эффективную дозу аторвастатина при одновременном применении с ингибиторами ВИЧ протеазы, ингибиторами гепатита С, кларитромицином и итраконазолом. Побочные эффекты и передозировка Побочные эффекты: Частота развития побочных эффектов классифицирована согласно рекомендациям Всемирной организации здравоохранения: очень часто - не менее 10%: часто - не менее 1%, но менее 10%: нечасто - не менее 0,1%, но менее 1%: редко - не менее 0,01%, но менее 0,1%: очень редко (включая отдельные сообщения) - менее 0,01%, частота неизвестна - не может быть подсчитана по имеющимся данным. Со стороны крови и лимфатической системы: редко - тромбоцитопения. Со стороны иммунной системы: часто - аллергические реакции: очень редко - ангионевротический отек: анафилактический шок. Со стороны нервной системы: часто - головная боль: нечасто - головокружение, парестезия, гипестезия, амнезия, нарушение вкусовых ощущений, бессонница, "кошмарные" сновидения: редко - периферическая нейропатия: частота неизвестна - депрессия. Со стороны органа зрения: нечасто - снижение четкости зрения: редко - нарушение зрительного восприятия. Со стороны органа слуха и лабиринтные нарушения: нечасто - "шум" в ушах, очень редко - потеря слуха. Со стороны дыхательной системы, органов грудной клетки и средостения: часто - назофарингит, носовое кровотечение, боль в глоточно-гортанной области: частота неизвестна - интерстициальное заболевание легких. Со стороны пищеварительного тракта: часто - тошнота, метеоризм, запор, диспепсия, диарея: нечасто - отрыжка, рвота, боль в животе, панкреатит. Со стороны печени и желчевыводящих путей: нечасто - гепатит: редко - холестаз: очень редко - печеночная недостаточность, холестатическая желтуха. Со стороны кожи и подкожных тканей: нечасто - алопеция, кожная сыпь, кожный зуд, крапивница: редко - буллезный дерматит, мультиформная эритема: очень редко - синдром Стивенса-Джонсона, токсический эпидермальный некролиз (синдром Лайелла). Со стороны скелетно-мышечной системы и соединительной ткани: часто - миалгия, артралгия, боль в конечностях, мышечный спазм, боль в спине, "припухлость" суставов: нечасто - боль в шее, мышечная слабость: редко - миопатия, миозит, рабдомиолиз, тендинопатия, осложненная разрывом сухожилия: частота неизвестна - иммуноопосредованная некротизирующая миопатия. Со стороны репродуктивной системы: очень редко - гинекомастия: частота неизвестна - импотенция. Общие нарушения: нечасто - астения, слабость, боль в груди, периферические отеки, повышение температуры тела, повышенная утомляемость, увеличение массы тела, анорексия. Лабораторные показатели: часто - гипергликемия, повышение активности креатинфосфокиназы в сыворотке крови: нечасто - лейкоцитурия, гипогликемия, повышение активности "печеночных" трансаминаз. При применении ингибиторов ГМГ-КоА-редуктазы (статинов), в том числе и аторвастатина, отмечались случаи повышения гликозилированного гемоглобина Передозировка: Специфического антидота для лечения передозировки препаратом нет.В случае передозировки следует проводить симптоматическое лечение по мере необходимости. Необходим контроль функции печени и активности креатинфосфокиназы (КФК) в сыворотке крови. Поскольку препарат активно связывается с белками плазмы крови, гемодиализ неэффективен. Взаимодействие с другими ЛС: Риск миопатии во время лечения ингибиторами ГМГ-КоА-редуктазы повышается при одновременном применении циклоспорина, фибратов, эритромицина, кларитромицина, противогрибковых средств - производных азола, - и никотиновой кислоты в липидснижающих дозах (см. раздел "Особые указания"). Ингибиторы изофермента CYP3А4 Поскольку аторвастатин метаболизируется изоферментом СYP3А4, одновременное применение аторвастатина с ингибиторами изофермента CYP3А4 может приводить к увеличению концентрации аторвастатина в плазме крови. Степень взаимодействия и эффект потенцирования определяются вариабельностью воздействия на изофермент СYP3А4. Одновременное применение аторвастатина с лекарственными средствами, снижающими концентрацию эндогенных стероидных гормонов (в том числе циметидином, кетоконазолом, спиронолактоном), увеличивает риск снижения эндогенных стероидных гормонов. Ингибиторы транспортного белка ОАТР1В1 Аторвастатин и его метаболиты являются субстратами транспортного белка ОАТР1В1. Ингибиторы ОАТР1В1 (например, циклоспорин) могут увеличивать биодоступность аторвастатина. Так, одновременное применение аторвастатина в дозе 10 мг и циклоспорина в дозе 5,2 мг/кг/сут. приводит к увеличению концентрации аторвастатина в плазме крови в 7,7 раза (см. раздел "Способ применения и дозы"). Влияние угнетения функции транспортеров печеночного захвата на концентрацию аторвастатина в гепатоцитах неизвестно. В случае, если невозможно избежать одновременного применения таких препаратов, рекомендуется уменьшение дозы и контроль эффективности терапии. Гемфиброзил/фибраты На фоне применения фибратов в монотерапии периодически отмечали нежелательные реакции, в том числе, рабдомиолиз, касающиеся скелетно-мышечной системы. Риск таких реакций возрастает при одновременном применении фибратов и аторвастатина. В случае, если одновременного применения этих препаратов невозможно избежать, то следует применять минимально эффективную дозу аторвастатина, а также следует проводить регулярный контроль состояния пациентов. Эритромицин/кларитромицин При одновременном применении аторвастатина и эритромицина (по 500 мг 4 раза в сутки) или кларитромицина (по 500 мг 2 раза в сутки), которые ингибируют изофермент CYP3A4, наблюдалось повышение концентрации аторвастатина в плазме крови (см. раздел "Особые указания"). Дилтиазем Одновременное применение аторвастатина в дозе 40 мг с дилтиаземом в дозе 240 мг, приводит к увеличению концентрации аторвастатина в плазме крови. Циметидин Клинически значимого взаимодействия аторвастатина с циметидином не обнаружено. Итраконазол Одновременное применение аторвастатина в дозах от 20 мг до 40 мг и итраконазола в дозе 200 мг приводило к увеличению значения AUC аторвастатина. Грейпфрутовый сок Поскольку грейпфрутовый сок содержит один или более компонентов, которые ингибируют изофермент CYP3A4, его чрезмерное потребление (более 1,2 л в день) может вызвать увеличение концентрации аторвастатина в плазме крови. Индукторы изофермента цитохрома CYP3A4 Совместное применение аторвастатина с индукторами изофермента CYP3A4 (например, эфавирензом, рифампицином, фенитоином, препаратами Зверобоя продырявленного) может приводить к снижению концентрации аторвастатина в плазме крови. Вследствие двойственного механизма взаимодействия с рифампицином (индуктором изофермента CYP3A4 и ингибитором транспортного белка гепатоцитов ОАТР1В1), рекомендуется одновременное применение аторвастатина и рифампицина, поскольку отсроченный прием аторвастатина после приема рифампицина приводит к существенному снижению концентрации аторвастатина в плазме крови. Однако, влияние рифампицина на концентрацию аторвастатина в гепатоцитах неизвестно и в случае, если одновременного применения невозможно избежать, следует тщательно контролировать эффективность такой комбинации во время терапии. Антациды Одновременный прием внутрь суспензии, содержащей магния гидроксид и алюминия гидроксид, снижал концентрацию аторвастатина в плазме крови примерно на 35%, однако степень снижения концентрации ХС-ЛПНП при этом не изменялась. Феназон Аторвастатин не влияет на фармакокинетику феназона, поэтому взаимодействие с другими препаратами, метаболизирующимися теми же изоферментами цитохрома, не ожидается. Колестипол При одновременном применении колестипола концентрация аторвастатина в плазме крови снижалась примерно на 25%: однако гиполипидемический эффект комбинации аторвастатина и колестипола превосходил таковой каждого препарата в отдельности. Дигоксин При повторном приеме дигоксина и аторвастатина в дозе 10 мг равновесные концентрации дигоксина в плазме крови не менялись. Однако при применении дигоксина в комбинации с аторвастатином в дозе 80 мг/сут. концентрация дигоксина увеличивалась примерно на 20%. Пациенты, получающие дигоксин в сочетании с аторвастатином, требуют соответствующего наблюдения. Азитромицин При одновременном применении аторвастатина в дозе 10 мг 1 раз в сутки и азитромицина в дозе 500 мг в сутки концентрация аторвастатина в плазме крови не изменялась. Пероральные контрацептивы При одновременном применении аторвастатина и перорального контрацептива, содержащего норэтистерон и этинилэстрадиол, наблюдалось значительное повышение AUC норэтистерона и этинилэстрадиола примерно на 30% и 20%, соответственно. Этот эффект следует учитывать при выборе перорального контрацептива для женщины, принимающей аторвастатин. Терфенадин При одновременном применении аторвастатина и терфенадина клинически значимых изменений фармакокинетики терфенадина не выявлено. Варфарин Признаков клинически значимого взаимодействия аторвастатина с варфарином не обнаружено. Амлодипин. При одновременном применении аторвастатина в дозе 80 мг и амлодипина в дозе 10 мг фармакокинетика аторвастатина в равновесном состоянии не изменялась. Фузидовая кислота Во время постмаркетинговых исследований отмечали случаи развития рабдомиолиза у пациентов, принимающих статины, включая аторвастатин и физудовую кислоту. У пациентов, для которых применение фузидовой кислоты считают необходимым, лечение статинами должно быть прекращено в течение всего периода применения фузидовой кислоты. Терапия статинами может быть возобновлена через 7 дней после последнего приема фузидовой кислоты. В исключительных случаях, где необходима продолжительная системная терапия фузидовой кислотой, например, для лечения тяжелых инфекций, необходимость одновременного применения аторвастатина и фузидовой кислоты должна быть рассмотрена в каждом конкретном случае и под строгим наблюдением врача. Пациент должен немедленно обратиться к врачу при появлении симптомов мышечной слабости, чувствительности или боли. Колхицин Следует соблюдать осторожность при одновременном применении аторвастатина с колхицином, так как были описаны случаи развития миопатии. Эзетимиб Применение эзетимиба связано с развитием нежелательных реакций, в том числе рабдомиолиза, со стороны скелетно-мышечной системы. Риск таких реакций повышается при одновременном применении аторвастатина и эзетимиба. Для таких пациентов рекомендуется тщательное наблюдение. Другая сопутствующая терапия В клинических исследованиях аторвастатин применяли одновременно с гипотензивными препаратами и эстрогенами в рамках заместительной гормональной терапии. Признаков клинически значимого нежелательного взаимодействия не отмечено: исследования взаимодействия со специфическими препаратами не проводилось. Кроме того, отмечалось повышение концентрации аторвастатина при одновременном применении с ингибиторами протеазы ВИЧ (комбинации лопинавира и ритонавира, саквинавира и ритонавира, дарунавира и ритонавира, фосампревир, фосампревир с ритонавиром и нелфинавиром), ингибиторами протеазы гепатита С (боцепревир), кларитромицином и итраконазолом. Следует соблюдать осторожность при одновременном применении этих препаратов, а также применять самую низкую эффективную дозу аторвастатина. Влияние других препаратов на фармакокинетику аторвастатинаТАБЛИЦЪ *коэффициент изменения [(I-В)/В], где I - фармакокинетические значения во время взаимодействия и В = фармакокинетические значения в норме: Фармакологическое действие и фармакокинетика Синтетическое гиполипидемическое средство. Аторвастатин - селективный конкурентный ингибитор 3-гидрокси-3-метилглутарил-коэнзим А-редуктазы (ГМГ-КоА-редуктазы), ключевого фермента, превращающего 3-гидрокси-3-метилглутарил-КоА в мевалонат - предшественник стеролов, включая холестерин.У пациентов с гомозиготной и гетерозиготной семейной гиперхолестеринемией, несемейными формами гиперхолестеринемии и смешанной дислипидемией аторвастатин снижает концентрацию в плазме крови общего холестерина (ХС), холестерина липопротеинов низкой плотности (ХС-ЛПНП) и аполипопротеина В (Апо-В), а также холестерина липопротеинов очень низкой плотности (ХС-ЛПОНП) и триглицеридов (ТГ), вызывает неустойчивое повышение концентрации холестерина липопротеинов высокой плотности (ХС-ЛПВП). Аторвастатин снижает концентрацию холестерина и липопротеинов в плазме крови, ингибируя ГМГ-КоА-редуктазу и синтез холестерина в печени и, увеличивая число "печеночных" рецепторов ЛПНП на поверхности клеток, что приводит к усилению захвата и катаболизма ХС-ЛПНП. Аторвастатин уменьшает образование ХС-ЛПНП и число частиц ЛПНП, вызывает выраженное и стойкое повышение активности ЛПНП-рецепторов в сочетании с благоприятными качественными изменениями ЛПНП-частиц, а также снижает концентрацию ХС-ЛПНП у пациентов с гомозиготной наследственной семейной гиперхолестеринемией, устойчивой к терапии другими гиполипидемическими средствами. Аторвастатин в дозах от 10 мг до 80 мг снижает концентрацию общего холестерина на 30-46 %, ХС-ЛПНП - на 41-61 %, Апо-В - на 34-50 % и ТГ - на 14-33 %. Результаты терапии сходны у пациентов с гетерозиготной семейной гиперхолестеринемией, несемейными формами гиперхолестеринемии и смешанной гиперлипидемией, в том числе, у пациентов с сахарным диабетом 2 типа.У пациентов с изолированной гипертриглицеридемией аторвастатин снижает концентрацию общего холестерина, ХС-ЛПНП, ХС-ЛПОНП, Апо-В и ТГ и повышает концентрацию ХС-ЛПВП. У пациентов с дисбеталипопротеинемией аторвастатин снижает концентрацию холестерина липопротеинов промежуточной плотности. У пациентов с гиперлипопротеинемией типа IIa и IIb по Фредриксону среднее значение повышения концентрации ХС-ЛПВП при лечении аторвастатином (10-80 мг) по сравнению с исходным показателем составляет 5,1-8,7% и не зависит от дозы. Имеется значительное дозозависимое снижение величины соотношений: общий холестерин/ХС-ЛПВП и ХС-ЛПНП/ХС-ЛПВП на 29-44 % и 37-55 %, соответственно. Аторвастатин в дозе 80 мг достоверно снижает риск развития ишемических осложнений и показателя смертности на 16% после 16-недельного курса, а риск повторной госпитализации по поводу стенокардии, сопровождающейся признаками ишемии миокарда, на 26 %. У пациентов с различными исходными концентрациями ХС-ЛПНП аторвастатин вызывает снижение риска ишемических осложнений и смертности (у пациентов с инфарктом миокарда без зубца и нестабильной стенокардией, также как у мужчин и женщин, и у пациентов в возрасте моложе и старше 65 лет). Снижение концентрации в плазме крови ХС-ЛПНП лучше коррелирует с дозой препарата, чем с его концентрацией в плазме крови. Дозу подбирают с учетом терапевтического эффекта (см. раздел "Способ применения и дозы"). Терапевтический эффект достигается через 2 недели после начала терапии, достигает максимума через 4 недели и сохраняется в течение всего периода терапии. Аторвастатин в дозе 10 мг снижает смертельный и несмертельный исход ишемической болезни сердца (ИБС) в сравнении с плацебо у пациентов с артериальной гипертензией с тремя и более факторами риска. Фармакокинетика: Всасывание Аторвастатин быстро всасывается после приема внутрь: время достижения его максимальной концентрации (ТСmax) в плазме крови - 1-2 ч. У женщин максимальная концентрация аторвастатина (Сmaх) на 20 % выше, а площадь под кривой "концентрация- время" (AUC) - на 10 % ниже, чем у мужчин. Степень всасывания и концентрация в плазме крови повышаются пропорционально дозе. Абсолютная биодоступность - около 14 %, а системная биодоступность ингибирующей активности в отношении ГМГ-КоА- редуктазы - около 30%. Низкая системная биодоступность обусловлена пресистемным метаболизмом в слизистой оболочке желудочно-кишечного тракта и/или при "первичном прохождении" через печень. Прием пищи несколько снижает скорость и степень абсорбции препарата (на 25 % и 9 %, соответственно, о чем свидетельствуют результаты определения Сmах и AUC), однако снижение ХС-ЛПНП сходно с таковыми при приеме аторвастатина натощак. Несмотря на то, что после приема аторвастатина в вечернее время его концентрация в плазме крови ниже (Сmах и AUC, примерно, на 30 %), чем после приема в утреннее время, снижение концентрации ХС-ЛПНП не зависит от времени суток, в которое принимают препарат. Распределение Средний объем распределения аторвастатина составляет около 381 л. Связь с белками плазмы крови не менее 98 %. Отношение содержания в эритроцитах/плазме крови составляет около 0,25, т.е. аторвастатин плохо проникает в эритроциты. Метаболизм Аторвастатин в значительной степени метаболизируется с образованием орто- и пара- гидроксилированных производных и различных продуктов β-окисления. In vitro орто- и парагидроксилированные метаболиты оказывают ингибирующее действие на ГМГ-КоА-редуктазу, сопоставимое с таковым аторвастатина. Примерно 70 % снижения активности ГМГ-КоА-редуктазы происходит за счет действия активных циркулирующих метаболитов. Результаты исследований in vitro дают основания предположить, что изофермент CYP3A4 печени играет важную роль в метаболизме аторвастатина. В пользу этого факта свидетельствует повышение концентрации аторвастатина в плазме крови при одновременном приеме эритромицина, который является ингибитором этого изофермента. Исследования in vitro также показали, что аторвастатин является слабым ингибитором изофермента CYP3A4. Аторвастатин не оказывает клинически значимого влияния на концентрацию в плазме крови терфенадина, который метаболизируется, главным образом, изоферментом CYP3A4, поэтому его существенное влияние на фармакокинетику других субстратов изофермента CYP3A4 маловероятно (см. раздел "Взаимодействие с другими лекарственными препаратами"). Выведение Аторвастатин и его метаболиты выводятся, главным образом, через кишечник с желчью после печеночного и/или внепеченочного метаболизма (аторвастатин не подвергается выраженной кишечно-печеночной рециркуляции). Период полувыведения (Т1/2) составляет около 14 ч, при этом ингибирующий эффект препарата в отношении ГМГ-КоА-редуктазы примерно на 70% определяется активностью циркулирующих метаболитов и сохраняется около 20-30 ч благодаря их наличию. После приема внутрь, в моче обнаруживается менее 2 % от принятой дозы препарата. Особые группы пациентов Пожилые пациенты Концентрации аторвастатина в плазме крови пациентов старше 65 лет выше (Сmaх примерно на 40 %, AUC примерно на 30 %), чем у взрослых пациентов молодого возраста. Различий в эффективности и безопасности препарата, или достижений целей гиполипидемической терапии у пожилых пациентов по сравнению с общей популяцией не выявлено. Дети Исследования фармакокинетики препарата у детей не проводились. Недостаточность функции почек Нарушение функции почек не влияет на концентрацию аторвастатина в плазме крови или воздействие на показатели липидного обмена, в связи с этим изменение дозы у пациентов с нарушением функции почек не требуется (см. раздел "Способ применения и дозы"). Аторвастатин не выводится в ходе гемодиализа вследствие интенсивного связывания с белками плазмы крови. Недостаточность функции печени Концентрация аторвастатина значительно повышается (Сmах примерно в 16 раз, AUC примерно в 11 раз) у пациентов с алкогольным циррозом печени (класс В по классификации Чайлд-Пью) (см. раздел "Противопоказания"). Особые указания Перед началом терапии препаратом Аторвастатин пациенту необходимо назначить стандартную гипохолестериновую диету, которую он должен соблюдать во время всего периода лечения. Применение ингибиторов ГМГ-КоА-редуктазы для снижения концентрации липидов в крови может приводить к изменению биохимических показателей, отражающих функцию печени. Функцию печени следует контролировать перед началом терапии, через 6 недель, 12 недель после начала приема Аторвастатина и после каждого повышения дозы, а также периодически, например, каждые 6 месяцев. Повышение активности "печеночных" ферментов в сыворотке крови может наблюдаться в течение терапии Аторвастатином. Пациенты, у которых отмечается повышение активности ферментов, должны находиться под контролем до возвращения активности ферментов в норму. В случае стойкого повышения активности АЛТ или ACT до уровня, превышающего более чем в 3 раза ВГН, рекомендуется снизить дозу Аторвастатина или прекратить лечение. Аторвастатин следует применять с осторожностью у пациентов, злоупотребляющих алкоголем и/или имеющих заболевание печени. Активное заболевание печени или стойкое повышение активности аминотрансфераз неясного генеза служат противопоказанием к назначению Аторвастатина. Лечение Аторвастатином, как и другими ингибиторами ГМГ-КоА-редуктазы, может вызвать миопатию. Диагноз миопатии (боль и слабость в мышцах в сочетании с повышением активности КФК более чем в 10 раз по сравнению с ВГН) следует обсуждать у пациентов с распространенными миалгиями, болезненностью или слабостью мышц и/или выраженным повышением активности КФК. Пациентов необходимо предупредить о том, что им следует немедленно сообщить врачу о появлении необъяснимых болей или слабости в мышцах, если они сопровождаются недомоганием или лихорадкой. Терапию Аторвастатином следует прекратить в случае выраженного повышения активности КФК или при наличии подтвержденной или предполагаемой миопатии. Риск миопатии при лечении другими препаратами этого класса повышался при одновременном применении циклоспорина, фибратов, эритромицина, никотиновой кислоты в липидснижающих дозах (более 1 г/сутки) или азольных противогрибковых средств. Многие из этих препаратов ингибируют метаболизм, опосредованный цитохромом Р4503А4, и/или транспорт лекарственных средств. Аторвастатин биотрансформируется под действием изофермента СYP3А4. Назначая Аторвастатин в комбинации с фибратами, эритромицином, иммуносупрессивными средствами, азольными противогрибковыми средствами или никотиновой кислотой в липидснижающих дозах (более 1 г/сутки), следует тщательно взвесить ожидаемую пользу и риск лечения и регулярно наблюдать пациентов с целью выявления болей или слабости в мышцах, особенно в течение первых месяцев лечения и в период повышения дозы любого препарата. В подобных ситуациях можно рекомендовать периодическое определение активности КФК, хотя такой контроль не позволяет предотвратить развитие тяжелой миопатии. При применении Аторвастатина, как и других средств этого класса, описаны случаи рабдомиолиза с острой почечной недостаточностью, обусловленной миоглобинурией. Терапию Аторвастатином следует временно прекратить или полностью отменить при появлении признаков возможной миопатии или наличии фактора риска развития почечной недостаточности на фоне рабдомиолиза (например, тяжелая острая инфекция, артериальная гипотензия, серьезная операция, травма, тяжелые обменные, эндокринные и водно-электролитные нарушения и неконтролируемые судороги). Перед началом терапии препаратом Аторвастатин необходимо попытаться добиться контроля гиперхолестеринемии путем адекватной диетотерапии, повышения физической активности, снижения массы тела у пациентов с ожирением и лечения других состояний. Пациентов необходимо предупредить о том, что им следует немедленно обратиться к врачу при появлении необъяснимых болей или слабости в мышцах, особенно если они сопровождаются недомоганием или лихорадкой. При применении ингибиторов ГМГ-КоА-редуктазы (статинов), в том числе и аторвастатина, отмечались случаи повышения гликозилированного гемоглобина и концентрации глюкозы в плазме крови натощак. Тем не менее, риск гипергликемии ниже, чем степень снижения риска сосудистых осложнений на фоне приема статинов. Пациенты, относящиеся к группе риска (концентрация глюкозы в крови натощак от 5,6 до 6,9 ммоль/л, индекс массы тела более 30 кг/м 2, повышенная концентрация тиреотропного гормона, артериальная гипертензия), должны находиться под медицинским контролем, включая контроль биохимических параметров крови. На фоне терапии некоторыми ингибиторами ГМГ-КоА-редуктазы (статинами), особенно на фоне длительной терапии отмечались единичные случаи интерстициального заболевания легких. Могут наблюдаться одышка, непродуктивный кашель и ухудшение общего состояния пациента (повышенная утомляемость, снижение массы тела и лихорадка). В случае если у пациента подозревается интерстициальное заболевание легких, следует отменить терапию аторвастатином. Профилактика инсульта посредством активного снижения концентрации холестеринаВ ретроспективном анализе подтипов инсульта у пациентов без ишемической болезни сердца, недавно перенесших инсульт или транзиторную ишемическую атаку, на начальном этапе, получавших аторвастатин в дозе 80 мг, была отмечена более высокая частота случаев развития геморрагического инсульта, по сравнению с пациентами, получавшими плацебо. Повышенный риск особенно был заметен у пациентов с геморрагическим инсультом или лакунарным инфарктом миокарда в анамнезе в начале исследования. У данной группы пациентов соотношение польза/риск при приеме аторвастатина в дозе 80 мг достаточно неопределенно, в связи с этим перед началом терапии следует тщательно оценить возможный риск развития геморрагического инсульта у таких пациентов. Влияние на способность управлять транспортными средствами: О неблагоприятном влиянии Аторвастатина на способность управлять автотранспортными средствами и заниматься потенциальными опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций, не сообщалось. Однако, учитывая возможность развития головокружения, следует соблюдать осторожность при выполнении перечисленных видов деятельности. Условия хранения и отпуска из аптек Условия хранения:В защищенном от света месте при температуре не выше 25 °С. Хранить в недоступном для детей месте. Отпуск из аптек: По рецепту Регистрационные данные Торговое название Аторвастатин Международное непатентованное название:Аторвастатин. Форма выпуска:таблетки, покрытые пленочной оболочкой. Состав:Таблетка 10,0 мг:Активное вещество: аторвастатин кальция тригидрат - 10,84 мг, в пересчете на аторвастатин - 10,00 мг. Вспомогательные вещества (ядро): лактозы моногидрат (сахар молочный) - 43,71 мг, целлюлоза микрокристаллическая - 15,00 мг, натрия лаурилсульфат - 0,50 мг, повидон-К25 - 2,50 мг, кальция карбонат - 17,50 мг, карбоксиметилкрахмал натрия - 4,00 мг, магния стеарат - 0,95 мг. Вспомогательные вещества (оболочка): гипромеллоза - 1,71 мг, макрогол-4000 - 0,45 мг, титана диоксид - 0,84 мг. Таблетка 20,0 мг:Активное вещество: аторвастатин кальция тригидрат - 21,69 мг, в пересчете на аторвастатин - 20,00 мг. Вспомогательные вещества (ядро): лактозы моногидрат (сахар молочный) - 87,41 мг, целлюлоза микрокристаллическая - 30,00 мг, натрия лаурилсульфат - 1,00 мг, повидон-К25 - 5,00 мг, кальция карбонат - 35,00 мг, карбоксиметилкрахмал натрия - 8,00 мг, магния стеарат - 1,90 мг. Вспомогательные вещества (оболочка): гипромеллоза - 3,42 мг, макрогол-4000 - 0,90 мг, титана диоксид - 1,68 мг. Таблетка 40,0 мг:Активное вещество: аторвастатин кальция тригидрат - 43,37 мг, в пересчете на аторвастатин - 40,00 мг. Вспомогательные вещества (ядро): лактозы моногидрат (сахар молочный) - 174,83 мг, целлюлоза микрокристаллическая - 60,00 мг, натрия лаурилсульфат - 2,00 мг, повидон-К25 - 10,00 мг, кальция карбонат - 70,00 мг, карбоксиметилкрахмал натрия - 16,00 мг, магния стеарат - 3,80 мг. Вспомогательные вещества (оболочка): гипромеллоза - 6,84 мг, макрогол-4000 - 1,80 мг титана диоксид - 3,36 мг. Таблетка 80,0 мг: Активное вещество: аторвастатин кальция тригидрат - 86,74 мг, в пересчете на аторвас

Модель:
RUR 1718
Показания Эпилепсия Для взрослых и детей старше 12 лет: В качестве монотерапии или в комбинации с другими противоэпилептическими средствами для лечения парциальных и генерализованных приступов, в т.ч. тонико-клонических судорог, судорожных припадков при синдроме Леннокса-Гасто. Биполярные расстройства Больным старше 18 лет: Для предупреждения нарушений настроения (главным образом, эпизодов депрессии). Противопоказания Противопоказания Повышенная чувствительность к какому-либо из компонентов препарата: тяжёлые нарушения функции печени: детский возраст до 12 лет: биполярные расстройства у пациентов в возрасте до 18 лет, непереносимость лактозы: дефицит лактазы: глюкозо-галактозная мальабсорбция. С осторожностью: Почечная недостаточность (в связи с возможным накоплением метаболита ламотриджина - глюкуронида). Беременность Фертильность Исследования по влиянию ламотриджина на фертильность у человека не проводились. Беременность Клинических данных о безопасности применения ламотриджина при беременности недостаточно. Имеются сообщения об увеличении риска развития врожденных аномалий ротовой полости. Ламотриджин должен назначаться при беременности только в том случае, если ожидаемая терапевтическая польза для матери превышает потенциальный риск для плода. Физиологические изменения при беременности могут оказать влияние на концентрацию ламотриджина и/или его терапевтический эффект. Имеются сообщения о снижении концентрации ламотриджина во время беременности. Назначение ламотриджина беременным должно быть обеспечено соответствующей состоянию тактикой ведения больных. Лактация Ламотриджин в различной степени проникает в грудное молоко, концентрация ламотриджина у младенцев может достигать примерно 50% от концентрации, зарегистрированной у матери. Таким образом, у некоторых детей, находящихся на грудном вскармливании, сывороточные концентрации препарата могут достигать значений, при которых проявляются фармакологические эффекты. Следует тщательно соотносить потенциальную пользу грудного вскармливания и возможный риск развития побочных эффектов у младенцев. Применение и дозы Монотерапия эпилепсии Взрослым и детям старше 12 лет: начальная доза при монотерапии составляет 25 мг один раз в день, в течение 2 недель: в последующие 2 недели - по 50 мг один раз в день. В дальнейшем, каждые одну-две недели можно повышать суточную дозу на 50-100 мг до тех пор, пока не будет достигнут оптимальный эффект. Обычно, поддерживающая суточная доза, распределённая на один или два приёма, составляет 100-200 мг. В единичных случаях желаемый эффект обеспечивали дозами 500 мг в день. Таблица №1. Схема повышения доз при монотерапии для взрослых и детей старше 12 лет ТАБЛИЦЪ Отмена ламотриджина при лечении биполярных расстройств. Прекращение лечения ламотриджином не требует постепенного снижения дозы. Общие рекомендации: принимать внутрь, не разжёвывая и запивая небольшим количеством воды. В случае, когда рассчитанная доза включает в себя неполную таблетку (только страдающим эпилепсией детям или больным с печеночной недостаточностью), следует назначать дозу, равную целому числу таблеток. Пожилой возраст (>: 65 лет): коррекция дозы с учётом возраста не требуется, т.к. фармакокинетика препарата существенно не отличается от таковой, наблюдаемой у молодых больных. Печеночная недостаточность: при средней степени тяжести печёночной недостаточности (класс В по Чайлд-Пью) начальная и поддерживающая дозы, а так же увеличение дозы должны быть на 50% ниже обычного: при тяжёлой степени печеночной недостаточности (класс С по Чайлд-Пью) - на 75% ниже обычного. Увеличение дозы и поддерживающие дозы зависят от клинического эффекта. Заболевания почек: назначается с осторожностью при почечной недостаточности. В терминальной стадии почечной недостаточности начальная доза ламотриджина вычисляется в соответствии со стандартной схемой назначения противоэпилептического препарата: при выраженном снижении функции почек может потребоваться уменьшение поддерживающей дозы. Побочные эффекты и передозировка Побочные эффекты: Побочные реакции представлены для каждого заболевания отдельно: для оценки побочных эффектов препарата следует принять во внимание обе группы. Побочные эффекты классифицированы на категории в зависимости от частоты их возникновения: очень частые (>: 1/10), частые (>: 1/100 - <:1/10), нечастые (>: 1/1 000 - <: 1/100), редкие (>: 1/10 000 - <: 1/1 000), очень редкие (<: 1/10 000). Эпилепсия. Со стороны кожных покровов: монотерапия (в ходе клинических исследований): очень часто - в первые 8 недель лечения кожная сыпь (часто макулопапулезная) исчезает после отмены ламотриджина: комбинированная терапия: очень часто - кожная сыпь, редко - синдром Стивенса-Джонсона: очень редко - токсический эпидермальный некролиз (синдром Лайелла, в некоторых случаях выздоровление с образованием рубцов). Со стороны системы кроветворения: очень редко - нейтропения, лейкопения, анемия, тромбоцитопения, панцитопения, апластическая анемия, агранулоцитоз, лимфаденопатия. Эти симптомы могут быть, а могут и не быть связаны с синдромом повышенной чувствительности (см. "нарушения со стороны иммунной системы"). Со стороны иммунной системы: кожная сыпь являлась составной синдрома повышенной чувствительности, протекающего с различной степенью тяжести. Очень редко: синдром повышенной чувствительности (включая такие синдромы, как лихорадка, лимфаденопатия, отечность лица, нарушения со стороны крови и печени, синдром диссеминированного внутрисосудистого свертывания (ДВС), полиорганная недостаточность). Важно отметить, что ранние проявления повышенной чувствительности (лихорадка, лимфаденопатия) могут иметь место даже при отсутствии явных признаков сыпи. При развитии подобных симптомов больной должен быть немедленно осмотрен врачом и, если не будет установлена другая причина развития симптомов, ламотриджин должен быть отменен. Психические расстройства: часто - раздражительность, агрессивность, очень редко - тики, галлюцинации, спутанность сознания. Со стороны центральной нервной системы: монотерапия в клинических исследованиях: очень часто - головная боль, часто - сонливость, бессонница, головокружение, тремор, не часто - атаксия: редко - нистагм. Комбинированная терапия: очень часто - головная боль, головокружение, сонливость, атаксия, часто - нистагм, тремор, бессонница, очень редко - асептический менингит, ажитация, потеря равновесия, двигательные расстройства, ухудшение течения болезни Паркинсона, экстрапирамидные симптомы, хореоатетоз, учащение судорожных припадков. Имеются сообщения о том, что ламотриджин может ухудшать экстрапирамидные симптомы паркинсонизма у больных с сопутствующей болезнью Паркинсона, а в единичных случаях вызывать экстрапирамидные симптомы и хореоатетоз у больных без предшествующих нарушений. Со стороны органов чувств: при монотерапии: нечасто - диплопия, нечеткость зрения: комбинированная терапия: очень часто - диплопия, снижение остроты зрения, редко - конъюнктивит. Со стороны сердечно-сосудистой системы: нечасто - "приливы", гипертензия, сердцебиение, постуральная (ортостатическая) гипотензия, синкопальное состояние (обморок), тахикардия, вазодилатация. Со стороны пищеварительной системы: монотерапия в клинических исследованиях: часто - тошнота, рвота, диарея: комбинированная терапия: очень часто - тошнота, рвота: часто - диарея. Со стороны гепатобилиарной системы: очень редко - повышение активности "печеночных" ферментов, нарушения функции печени, печёночная недостаточность. Расстройства функции печени, обычно, являются частью синдрома повышенной чувствительности, однако не всегда сопровождаются другими симптомами повышенной чувствительности. Со стороны эндокринной системы: редко - струма (зоб), гипотиреоидизм. Со стороны опорно-двигательного аппарата: очень редко - волчаночно-подобные реакции. Прочие, дозозависимые: часто - повышенная усталость. Биполярные расстройства. Нижеперечисленные побочные эффекты следует оценивать вместе с вышеперечисленными побочными реакциями, обнаруженными при эпилепсии. Со стороны кожных покровов: очень часто - кожная сыпь, редко - синдром Стивенса-Джонсона. Со стороны центральной нервной системы: очень часто - головная боль, часто - возбуждение, сонливость, головокружение. Со стороны опорно-двигательного аппарата: часто - артралгия. Со стороны пищеварительной системы: часто - сухость слизистой оболочки полости рта. Прочие, дозозависимые: миалгия, боли в спине. Передозировка: Сообщалось об однократном приёме доз, в 10-20 раз превышавших максимальные терапевтические. Симптомы передозировки: нистагм, атаксия, головокружение, головная боль, сонливость, рвота, нарушение сознания, кома. Лечение: госпитализация, симптоматическая и поддерживающая терапия в соответствии с клинической картиной или рекомендациями национального токсикологического центра. Взаимодействие с другими ЛС: УДФ-глюкуронилтрансфераза является основным ферментом, метаболизирующим ламотриджин. Нет данных о способности ламотриджина вызывать клинически значимую индукцию или ингибирование микросомальных ферментов печени. В этой связи взаимодействия между ламотриджином и препаратами, метаболизирующимися изоферментами цитохрома Р450, маловероятно. Ламотриджин может индуцировать собственный метаболизм, но этот эффект выражен умеренно и не имеет клинически значимых последствий. Влияние других препаратов на глюкуронирование ламотриджина ТАБЛИЦЪ Вальпроевая кислота, которая подавляет глюкуронирование ламотриджина, снижает скорость его метаболизма и удлиняет его средний период полувыведения почти в 2 раза. Некоторые противоэпилептические препараты (такие как, фенитоин, карбамазепин, фенобарбитал и примидон), которые индуцируют микросомальные ферменты печени, ускоряют глюкуронирование ламотриджина и его метаболизм. Карбамазепин. Сообщалось о развитии нежелательных эффектов со стороны центральной нервной системы, включавших головокружение, атаксию, диплопию, нечеткость зрения и тошноту у больных, начавших принимать карбамазепин на фоне терапии ламотриджином. Снижение дозы карбамазепина обычно приводило к исчезновению этих симптомов. Фенобарбитал уменьшает концентрацию ламотриджина на 40%. Рифампицин повышает клиренс ламотриджина и снижает его период полувыведения благодаря индукции микросомальных ферментов печени, ответственных за глюкуронирование. Больным, принимающим рифампицин в качестве сопутствующей терапии, режим назначения ламотриджина должен соответствовать схеме, рекомендуемой при совместном назначении ламотриджина и средств, индуцирующих ферменты микросомального окисления в печени. Лопинавир/ритонавир. При применении лопинавира/ритонавира наблюдалось снижение примерно наполовину концентрации ламотриджина в плазме, возможно, вследствие индукции глюкуронирования. У пациентов, принимающих сопутствующее лечение лопинавиром/ритонавиром режим назначения ламотриджина должен соответствовать схеме, рекомендуемой при совместном назначении ламотриджина и средств, индуцирующих ферменты микросомального окисления в печени. Атазанавир/ритонавир. В исследовании у здоровых добровольцев прием атазанавира/ритонавира (300 мг/100 мг) приводил к снижению значений площади под кривой "концентрация - время" (AUC) и Сmах ламотриджина (в разовой дозе 100 мг) примерно на 32% и 6% соответственно. Прием комбинированных пероральных контрацептивов, содержащих 30 мкг этинилэстрадиола и 150 мкг левоноргестрела, вызывает приблизительно 2-х кратное повышение клиренса ламотриджина (после его приема внутрь), что приводит к снижению площади под кривой "концентрация - время" (AUC) и Сmах ламотриджина в среднем на 52% и 39% соответственно. У женщин, уже не принимающих индукторы ферментов микросомального окисления в печени и принимающих гормональные пероральные контрацептивы, схема лечения которых включает неделю приема неактивного препарата (или недельный перерыв в приеме контрацептива), в этот период времени наблюдается повышение плазменной концентрации ламотриджина, при этом концентрация ламотриджина, измеренная в конце этой недели перед введением следующей дозы, в среднем в 2 раза выше, чем в период активной терапии (с контрацептивом). В период равновесных концентраций ламотриджин в дозе 300 мг не влияет на фармакокинетику этинилэстрадиола - компонента комбинированного перорального контрацептива. Отмечается небольшое повышение клиренса второго компонента перорального контрацептива - левоноргестрела, что приводило к снижению AUC и Сmах левоноргестрела на 19% и 12% соответственно. Измерение сывороточных концентраций фолликулостимулирующего гормона (ФСГ), лютеинизирующего гормона (ЛГ) и эстрадиола выявило небольшое уменьшение подавления гормональной активности яичников у некоторых женщин, хотя измерение плазменной концентрации прогестерона ни у одной из 16 женщин не выявило гормональных подтверждений овуляции. Влияние умеренного повышения клиренса левоноргестрела и изменения плазменных концентраций ФСГ и ЛГ на овуляционную активность яичников не установлено. Влияние других доз ламотриджина (кроме 300 мг в сутки) не изучалось и исследования с включением других гормональных препаратов не проводились. Препараты лития. Ламотриджин в дозе 100 мг в сутки не вызывает изменений фармакокинетики глюконата лития (по 2 г 2 раза в день в течение 6 дней) при их совместном применении. Бупропион. Многократный приём бупропиона внутрь не оказывает значимого влияния на фармакокинетику однократной дозы ламотриджина и вызывает незначительное увеличение AUC метаболита ламотриджина N-глюкуронида. Оланзапин в дозе 15 мг снижает AUC и Сmах ламотриджина в среднем на 24% и 20% соответственно, что клинически незначимо. Ламотриджин в дозе 200 мг не изменяет фармакокинетики оланзапина. Окскарбазепин. При одновременном приеме ламотриджина в дозе 200 мг и окскарбазепина в дозе 1200 мг, ни окскарбазепин, ни ламотриджин не нарушают метаболизм друг друга. Фелбамат. Сочетанное применение фелбамата в дозе 1200 мг 2 раза в сутки и ламотриджина 100 мг 2 раза в сутки не приводило к клинически значимым изменениям фармакокинетики ламотриджина. Габапентин. При совместном применении ламотриджина и габапентина клиренс ламотриджина не менялся. Леветирацетам. Не выявлено влияния на фармакокинетику леветирацетама и ламотриджина при совместном применении этих лекарственных средств. Прегабалин. Не наблюдалось влияния прегабалина в дозе 200 мг 3 раза в сутки на равновесные концентрации ламотриджина, т.е. прегабалин и ламотриджин не взаимодействуют фармакокинетически друг с другом. Топирамат. Применение топирамата не приводило к изменению концентрации ламотриджина в плазме. Однако прием ламотриджина приводил к увеличению концентрации топирамата на 15%. Зонизамид. Прием зонизамида (в дозе от 200-400 мг в сутки) совместно с ламотриджином (в дозе 150-500 мг в сутки) не приводил к изменению фармакокинетических параметров ламотриджина. Исследования показали, что ламотриджин не влияет на плазменную концентрацию других, одновременно принимаемых противоэпилептических лекарственных препаратов. В исследованиях in vitro ламотриджин не вытесняет другие противоэпилептические средства из их связей с белками плазмы. Рисперидон. Многократный прием ламотриджина в дозе 400 мг в сутки не оказывал клинически значимого эффекта на фармакокинетику рисперидона после приема разовой дозы 2 мг здоровыми добровольцами. При этом у 12 из 14 пациентов при сочетанном приеме ламотриджина и рисперидона отмечалась сонливость: тогда как только у 1 из 20 пациентов при приеме только рисперидона, и ни у одного - при приеме только одного ламотриджина. Ингибирование ламотриджина амитриптилином, бупропионом, клоназепамом, флуоксетином, галоперидолом и лоразепамом оказывает минимальное влияние на образование первичного метаболита ламотриджина 2-N-глюкуронида. Буфуралол. Изучение метаболизма буфуралола микросомальными ферментами печени, выделенными у человека, свидетельствует о том, что ламотриджин не снижает клиренс лекарственных средств, метаболизирующихся преимущественно изоферментами CYP2D6. По данным исследований in vitro можно предположить, что клозапин, фенелзин, рисперидон, сертралин и тразодон не влияют на клиренс ламотриджина. Фармакологическое действие и фармакокинетика Стабилизирует клеточную мембрану, воздействуя на потенциалзависимые натриевые каналы, и блокирует выброс нейротрансмиттеров, главным образом глутамата. Являясь активирующей аминокислотой, глутамат играет ключевую роль в возникновении эпилептических приступов. Эффективность ламотриджина в профилактике нарушений настроения у больных, страдающих биполярными расстройствами, была доказана в двух клинических исследованиях. При анализе результатов этих исследований было установлено, что ламотриджин увеличивает продолжительность ремиссии при биполярных расстройствах, оказывая более выраженное действие в отношении депрессии. Фармакокинетика: Всасывание: Быстро и полностью всасывается в кишечнике, не подвергается существенному "первичному" метаболизму в печени. Максимальная концентрация (Сmах) в плазме достигается через 2,5 часа после приёма внутрь. Приём пищи несколько замедляет всасывание ламотриджина, но не влияет на его степень. Фармакокинетика разовой дозы, не превышающей 450 мг, имеет линейный характер. Максимальная концентрация в стадии насыщения носит индивидуальный характер. Распределение: Связь с белками плазмы крови составляет 55%, весьма маловероятно, что вытеснение ламотриджина из связи с белками плазмы крови может вызвать токсический эффект. Объём распределения 0,92-1,22 л/кг массы тела. Метаболизм: осуществляется благодаря ферменту - уридиндифосфат-глюкуронилтрансферазе (УДФ-глюкуронилтрансферазе). В умеренной степени и в зависимости от дозы ламотриджин индуцирует собственный метаболизм. Данных о влиянии ламотриджина на фармакокинетику других противоэпилептических средств нет и вряд ли возможны лекарственные взаимодействия между ламотриджином и лекарственными средствами, метаболизм которых связан с CYP450. Выведение: Клиренс ламотриджина в состоянии равновесных концентраций у здоровых взрослых людей составляет в среднем 39±14 мл/мин. Ламотриджин метаболизируется в печени до глюкуронидов (65% метаболитов ламотриджина - N-глюкурониды), которые выводятся почками. Менее 10% препарата выводится почками в неизмененном виде, около 2% - через кишечник. Клиренс и период полувыведения не зависят от дозы. Период полувыведения у здоровых взрослых людей составляет в среднем от 24 ч до 35 ч. У больных с синдромом Жильбера средний клиренс ламотриджина оказался на 32% ниже, чем в контрольной группе, однако, эти показатели не отличались от наблюдаемых в общей популяции. Лекарственные препараты, принимаемые одновременно, значительно изменяют период полувыведения ламотриджина. Период полувыведения уменьшается до 14 ч, если одновременно больной принимает индуктор ферментов микросомального окисления в печени, например, карбамазепин или фенитоин - и увеличивается до 70 часов, если больной принимает вальпроевую кислоту (см. "Способ применения и дозы"). Детский возраст Клиренс, пересчитанный на кг массы тела, у детей выше, чем у взрослых. Период полувыведения, обычно, короче, чем у взрослых, при одновременном приёме индуктора ферментов микросомального окисления в печени равен 7 ч, и 45-50 ч - при приёме с вальпроевой кислотой (см. "Способ применения и дозы") Пожилой возраст По данным фармакокинетического анализа клиренс ламотриджина у молодых и пожилых больных эпилепсией не отличаются друг от друга в клинически значимой степени. Почечная недостаточность В этой группе больных начальную дозу ламотриджина следует рассчитывать по стандартной схеме дозирования противоэпилептических средств. Уменьшение дозы может потребоваться только при значительном снижении функции почек. Печёночная недостаточность Начальную, возрастающую и поддерживающую дозы следует снизить на 50% для больных со средней степенью тяжести печёночной недостаточности и на 75% - для больных с тяжёлой степенью печёночной недостаточности. Увеличение дозы и поддерживающую дозу подбирают исходя из клинического эффекта. Особые указания В первые 8 недель лечения возможны кожные реакции как побочные эффекты ламотриджина. Кожные высыпания, как правило, выражены в лёгкой форме, спонтанно исчезают, однако, возможны и тяжёлые формы, требующие госпитализации и прекращения терапии ламотриджином, например, потенциально представляющие угрозу для жизни синдром Стивенса-Джонсона и токсический эпидермальный некролиз (синдром Лайелла) (см. "Побочное действие"). Среди взрослых, страдающих эпилепсией и получавших в клинических испытаниях рекомендуемые дозы препарата, частота тяжёлых форм кожных реакций составляла 1:500. Среди них синдром Стивенса-Джонсона наблюдали в половине случаев (1:1000). Дети более предрасположены к развитию тяжёлых форм кожных реакций. По данным многочисленных клинических наблюдений частота случаев кожных реакций, требующих госпитализации детей, составляла 1:300-1:100. Раннюю сыпь у детей легко спутать с сыпью при инфекционных заболеваниях, поэтому, если высокая температура и сыпь возникают в первые 8 недель лечения, следует предположить лекарственную реакцию. Вероятно, общий риск развития кожных реакций у взрослых находится в тесной взаимосвязи с высокими начальными дозами и ускорением предписанных темпов увеличения дозы ламотриджина (см. "Способ применения и дозы"), а так же с одновременным приёмом вальпроевой кислоты (см. "Способ применения и дозы"). Осторожность необходима при назначении ламотриджина пациентам, имеющим в анамнезе аллергические реакции или сыпь в ответ на прием других противоэпилептических препаратов, поскольку частота развития сыпи (не классифицировавшейся как серьезная) у пациентов с таким анамнезом наблюдалась в три раза чаще при назначении ламотриджина, чем у пациентов с неотягощенным анамнезом. При появлении сыпи каждого больного, независимо от возраста, следует немедленно подвергнуть тщательному обследованию и прекратить лечение ламотриджином, за исключением случаев, когда сыпь однозначно не связана с приёмом препарата. Появление сыпи может сопровождаться различными системными проявлениями повышенной чувствительности (высокая температура, лимфаденопатия, отёк лица, реакции со стороны печени и системы кроветворения) (см. "Побочное действие"). Степень тяжести реакций повышенной чувствительности может быть различной, в редких случаях возможно диссеминированное внутрисосудистое свертывание (ДВС) с полиорганной недостаточностью. Следует иметь в виду, что ранние признаки повышенной чувствительности (например, высокая температура, лимфаденопатия) не всегда сопровождаются кожной сыпью. Если их появление нельзя объяснить другой причиной, лечение ламотриджином следует немедленно прекратить. Комбинированный препарат этинилэстрадиол/левоноргестрел (30 мкг/150 мкг) приблизительно в 2 раза повышает клиренс ламотриджина в плазме (см. "Взаимодействие с другими лекарственными средствами"). Если на фоне применения препарата Ламолеп пациентки начинают или прекращают принимать гормональные контрацептивы, может потребоваться коррекция дозы ламотриджина (см. "Взаимодействие с другими лекарственными средствами"). Длительное лечение ламотриджином может изменить метаболизм фолиевой кислоты, т.к. ламотриджин является слабым ингибитором дигидрофолатредуктазы. Вместе с тем длительное, 12-месячное, лечение ламотриджином существенно не влияло на показатель гемоглобина, средний объём эритроцитов, концентрацию фолиевой кислоты в плазме и эритроцитах, после 5 лет лечения - на концентрацию фолиевой кислоты в эритроцитах. Нарушения функции печени обычно являются частью синдрома повышенной чувствительности, однако не всегда сопровождаются другими симптомами повышенной чувствительности. В клинических исследованиях концентрация ламотриджина в крови больных, находящихся в терминальной стадии почечной недостаточности, существенно не изменилась после однократного приёма препарата. При лечении больных с почечной недостаточностью, находящихся на гемодиализе, следует иметь в виду, что в среднем во время 4-часового гемодиализа из организма выводится 20% ламотриджина. Нельзя назначать ламотриджин больным, уже получающим какие-либо другие препараты, содержащие ламотриджин, без консультации врача. Эпилепсия. Объективным критерием эффективности является способность уменьшать частоту спайков на ЭЭГ на 78-98%. Подобно другим противоэпилептическим препаратам, резкое прекращение лечения ламотриджином провоцирует эпилептические приступы (явление "рикошета"). За исключением особых случаев, например, появление кожной сыпи, требующих немедленного прекращения лечения, отмена препарата должна проводиться постепенно, с плавным, в течение 2 недель, снижением дозы. На основании литературных данных, тяжёлые судорожные приступы, включая эпилептический статус, могут привести к развитию рабдомиолиза, нарушению функции многочисленных органов, а также ДВС-синдрома, иногда со смертельным исходом. Подобные случаи имели место и в связи с применением ламотриджина. Симптомы депрессии и/или биполярного расстройства могут отмечаться у пациентов с эпилепсией. Пациенты с эпилепсией и сопутствующими биполярными расстройствами находятся в группе высокого риска суицидов, поэтому лечение пациентов с повышенной склонностью к самоубийству должно сопровождаться тщательным наблюдением за больными. Влияние на способность управлять транспортными средствами: В начальном периоде лечения управлять автомобилем и рабочими механизмами запрещается, в последующем продолжительность и степень ограничения определяется врачом в индивидуальном порядке. Условия хранения и отпуска из аптек Условия хранения:При температуре не выше 30°С. Хранить в недоступном для детей месте. Отпуск из аптек: По рецепту Регистрационные данные Торговое название Ламолеп Международное непатентованное название:Ламотриджин. Форма выпуска:таблетки. Состав:На 1 таблетку: Действующее вещество: 25 мг, 50 мг или 100 мг ламотриджина: Вспомогательные вещества: кремния диоксид коллоидный 0,10 мг, 0,20 мг или 0,40 мг: магния стеарат 0,40 мг, 0,80 мг или 1,6 мг: карбоксиметилкрахмал натрия, тип А 3,00 мг, 6,00 мг или 12,00 мг: повидон 2,50 мг, 5,00 мг или 10,00 мг: лактозы моногидрат 16,25 мг, 32,50 мг или 65,00 мг: целлюлоза микрокристаллическая 32,75 мг, 65,50 мг или 131,00 мг. АТХ: Регистрация: Лекарственное средство ЛС-000299 Фармгруппа: Противоэпилептическое средство. Дата регистрации: 13.04.2010. Окончание регстрации: . Описание:Таблетки 25 мг Белые или почти белые круглые двояковыпуклые таблетки с гравировкой "L25" на одной стороне. Таблетки 50 мг Белые или почти белые круглые двояковыпуклые таблетки с гравировкой "L50" на одной стороне. Таблетки 100 мг Белые или почти белые круглые двояковыпуклые таблетки с гравировкой "L100" на одной стороне. Упаковка:Таблетки, 25 мг, 50 мг и 100 мг. По 10 таблеток в блистере из ПВХ/ПВДХ - плёнки и фольги алюминиевой. По 3 блистера с инструкцией по применению в картонной пачке. Для упаковки и расфасовки на ЗАО "ГЕДЕОН РИХТЕР - РУС": По 10 таблеток в блистере из ПВХ/ПВДХ - плёнки и фольги алюминиевой. По 3 блистера с инструкцией по применению в картонной пачке. Срок годности:5 лет. Не использовать после истечения срока годности, указанного на упаковке. Владелец рег.удостоверения:ГЕДЕОН РИХТЕР, ОАО Производитель:GEDEON RICHTER, Ltd. Представительство:ГЕДЕОН РИХТЕР ОАО
Модель:
RUR 1385
Показания Базисная противовоспалительная терапия бронхиальной астмы взрослых и детей 1 года и старше (включая пациентов с тяжелым течением заболевания, у которых имеется зависимость от системных ГКС):лечение хронической обструктивной болезни легких у взрослых в качестве дополнительного средства к терапии бронходилататорами длительного действия (например, к бета- агонистам длительного действия (ДДБА)). Противопоказания Противопоказания Гиперчувствительность к любому компоненту препарата:острый бронхоспазм: астматический статус (в качестве первоочередного средства):детский возраст (до 1 года). С осторожностью: Препарат следует применять с осторожностью при циррозе печени, глаукоме, гипотиреозе, системных инфекциях (бактериальных, грибковых, паразитарных, вирусных), остеопорозе, туберкулезе легких, беременности и в период лактации. Беременность Беременность Контролируемые клинические исследования по применению флутиказона пропионата у беременных женщин не проводились. Влияние флутиказона пропионата на течение беременности не изучалось. Доклинические исследования влияния флутиказона пропионата на репродуктивную функцию показали, что при значениях системной экспозиции, превышающих наблюдаемые при применении рекомендуемых терапевтических ингаляционных доз, наблюдались только характерные для ГКС эффекты. Исследования генотоксичности не показали мутагенного потенциала. Однако, как и при применении других лекарственных препаратов, применение флутиказона пропионата при беременности возможно только в том случае, когда предполагаемая польза для матери превышает любой потенциальный риск для плода. Период грудного вскармливания На настоящий момент не установлено, проникает ли флутиказона пропионат в грудное молоко. Поддающиеся измерению концентрации флутиказона пропионата в плазме крови лабораторных крыс, находящихся в периоде лактации, после подкожного введения препарата указывают на наличие флутиказона пропионата в грудном молоке. Однако ожидается, что после ингаляционного применения флутиказона пропионата в рекомендуемых дозах его концентрации в плазме крови будут низкими. Применение препарата Фликсотид в период грудного вскармливания не рекомендуется, за исключением случаев, когда, по мнению лечащего врача, потенциальная польза для ребенка от продолжения грудного вскармливания превышает потенциальный риск развития нежелательных явлений, связанных с присутствием флутиказона пропионата в грудном молоке. Применение и дозы Дозированный аэрозоль Фликсотид предназначен только для ингаляций через рот. Лечение аэрозолем Фликсотид относится к методам профилактической терапии, препарат необходимо принимать регулярно, даже при отсутствии симптомов заболевания. Пациентам, у которых использование дозированного аэрозоля для ингаляций затруднительно, рекомендуется применять спейсер. Особые группы пациентов: лицам пожилого возраста и пациентам с заболеваниями печени или почек специального подбора дозы не требуется. Бронхиальная астма. Терапевтический эффект после применения препарата Фликсотид наступает через 4- 7 дней после начала лечения. У пациентов, которые ранее не принимали ингаляционные глюкокортикостероиды, улучшение может отмечаться уже через 24 часа после начала применения препарата. Если пациент считает, что лечение бронходилататорами быстрого действия становится менее эффективным или ему требуется большее число ингаляций, чем обычно, врачу следует обратить на это особое внимание. Взрослые и подростки старше 16 лет. Рекомендуемая доза составляет 100-1000 мкг 2 раза в сутки. Начальная доза препарата зависит от степени тяжести заболевания- бронхиальная астма легкой степени тяжести: 100-250 мкг 2 раза в сутки- бронхиальная астма средней степени тяжести: 250-500 мкг 2 раза в сутки- бронхиальная астма тяжелой степени: 500-1000 мкг 2 раза в сутки.В зависимости от индивидуального ответа пациента дозу препарата можно увеличить до достижения контроля над заболеванием или снизить до минимальной эффективной дозы. Дети в возрасте 4 лет и старше Детям рекомендуется применять препарат Фликсотид, содержащий 50 мкг флутиказона пропионата в одной дозе. Рекомендуемая доза составляет 50-200 мкг 2 раза в сутки. У большинства детей контроля астмы можно достичь, применяя дозы 50-100 мкг 2 раза в сутки. У детей с недостаточно контролируемой бронхиальной астмой возможно увеличение дозы до 200 мкг 2 раза в сутки. Начальная доза препарата зависит от степени тяжести заболевания. Затем, в зависимости от индивидуального ответа пациента, дозу препарата можно увеличивать до достижения контроля над заболеванием или снизить до минимальной эффективной дозы. Дети в возрасте от 1 года до 4 лет Рекомендуемая доза составляет 100 мкг 2 раза в сутки. Препарат вводится с помощью ингалятора через спейсер с лицевой маской, например, "Бэбихалер". Дозированный аэрозоль Фликсотид особенно показан детям младшего возраста с частыми и продолжительными приступами бронхиальной астмы. Диагностика и лечение бронхиальной астмы должны выполняться при регулярном осмотре пациента врачом. Хроническая обструктивная болезнь легких. Взрослые Рекомендуемая доза составляет 500 мкг 2 раза в сутки вкачестве дополнительного средства к терапии бронходилататорами длительного действия (например, ДЦБА). Рекомендовано применять дозированный аэрозоль Фликсотид, содержащий 250 мкг в дозе. Для достижения оптимального эффекта препарат рекомендовано применять ежедневно в течение 3-6 месяцев. При отсутствии клинического улучшения по прошествии 3-6 месяцев необходимо проведение медицинского осмотра. Побочные эффекты и передозировка Побочные эффекты: Нежелательные реакции, представленные ниже, перечислены в соответствии с поражением органов и систем органов и частотой встречаемости. Частота встречаемости определяется следующим образом: очень часто (>: 1/10), часто (>: 1/100 и <: 1/10), нечасто (>: 1/1 000 и <: 1/100), редко (>: 1/10 000 и <: 1/1 000), очень редко (<: 1/10 000, включая отдельные случаи). Категории частоты были сформированы на основании клинических исследований препарата и пострегистрационного наблюдения. Частота встречаемости нежелательных реакций. Инфекционные и паразитарные заболевания. Очень часто: кандидоз рта и глотки.У некоторых пациентов может развиваться кандидоз рта и глотки (кандидозный стоматит). В подобных случаях рекомендуется после ингаляции полоскать рот и горло водой. Можно применять противогрибковые препараты местного действия, одновременно продолжая терапию препаратом Фликсотид. Часто: пневмония (у пациентов с ХОБЛ). Редко: кандидоз пищевода. Нарушения со стороны иммунной системы Были описаны реакции повышенной чувствительности со следующими проявлениями:Нечасто: кожные реакции повышенной чувствительности. Очень редко: ангионевротический отек (преимущественно отек лица и ротоглотки), дыхательные нарушения (одышка и/или бронхоспазм) ианафилактические реакции. Нарушения со стороны эндокринной системы. Возможные системные эффекты (см. раздел "Особые указания"):Очень редко: синдром Кушинга, кушингоидные симптомы, угнетение функции коры надпочечников, замедление роста, снижение минерализации костной ткани, катаракта, глаукома. Нарушения со стороны обмена веществ и питания Очень редко: гипергликемия. Нарушения психики Очень редко: тревога, нарушения сна и поведения, включая гиперактивность и раздражительность (преимущественно у детей). Нарушения со стороны дыхательной системы, органов грудной клетки и средостения Часто: охриплость голоса. У некоторых пациентов может отмечаться охриплость голоса: рекомендуется сразу после ингаляции полоскать рот и горло водой. Очень редко: парадоксальный бронхоспазм (см. раздел "Особые указания"). Нарушения со стороны кожи и подкожных тканей Часто: кровоподтеки. Передозировка: Острая передозировка препарата может привести к временному угнетению функции . гипоталамо-гипофизарно-надпочечниковой системы, что обычно не требует экстренной терапии, так как функция коры надпочечников восстанавливается в течение нескольких дней. При длительном приеме доз препарата, превышающих рекомендованные, возможно значимое подавление функции коры надпочечников. Были получены очень редкие сообщения о развитии острого адреналового криза у детей, получивших дозу флутиказона пропионата 1000 мкг в сутки и выше на протяжении нескольких месяцев или лет. У таких пациентов отмечалась гипогликемия, угнетение сознания и судороги. Острый адреналовый криз может развиваться на фоне следующих состояний: тяжёлая травма, хирургическое вмешательство, инфекции, резкое снижение дозы флутиказона пропионата. Лечение. Необходимо наблюдение пациентов, получающих высокие дозы, и постепенное снижение дозы флутиказона пропионата. Взаимодействие с другими ЛС: При ингаляционном пути введения флутиказона пропионата концентрации его в плазме крови очень низки вследствие активного метаболизма при первом прохождении и высокого системного клиренса в кишечнике и печени, с участием ферментов системы цитохрома Р450 ЗА4. Таким образом, клинически значимые лекарственные взаимодействия флутиказона пропионата маловероятны. Исследование лекарственного взаимодействия у здоровых добровольцев показало, что ритонавир (высокоактивный ингибитор цитохрома Р450 ЗА4) может значительно увеличивать концентрацию флутиказона пропионата в плазме, что соответственно приводит к снижению концентрации кортизола ' в сыворотке. В рамках пострегистрационного применения наблюдались клинически значимые лекарственные взаимодействия у пациентов, получающих флутиказона пропионат интраназально или ингаляционно совместно с ритонавиром, что приводило к системным эффектам кортикостероидов, включая синдром Кушинга и угнетение функции надпочечников. Таким образом, необходимо избегать сопутствующего применения препарата ритонавир и флутиказона пропионата, за исключением тех случаев, когда потенциальная польза для пациента перевешивает возможный риск системных побочных эффектов глюкокортикостероидов. Исследования других ингибиторов цитохрома Р450 ЗА4 продемонстрировали незначительное (эритромицин) и малое (кетоконазол) увеличение системной экспозиции флутиказона пропионата без какого-либо заметного снижения концентрации кортизола в сыворотке. Тем не менее, необходимо соблюдать осторожность при сопутствующем назначении мощных ингибиторов цитохрома Р450 ЗА4 (например, кетоконазол), поскольку существует возможность увеличения концентрации флутиказона пропионата в плазме. Фармакологическое действие и фармакокинетика Флутиказона пропионат относится к группе глюкокортикостероидов (ГКС) местного действия и при ингаляционном введении в рекомендуемых дозах оказывает выраженное противовоспалительное и противоаллергическое действие, что приводит к уменьшению выраженности , симптомов и снижению частоты обострений заболеваний, сопровождающихся обструкцией дыхательных путей (бронхиальная астма, хронический бронхит, эмфизема). Флутиказона пропионат ингибирует пролиферацию тучных клеток, эозинофилов, лимфоцитов, макрофагов, нейтрофилов, снижает продукцию и высвобождение медиаторов воспаления и других биологически активных веществ - гистамина, простагландинов, лейкотриенов, цитокинов. При хронической обструктивной болезни легких (ХОБЛ) подтверждена эффективность действия ингаляционного флутиказона пропионата на функцию легких, что характеризуется уменьшением выраженности симптомов заболевания, частоты и тяжести обострений, снижением необходимости назначения дополнительных курсов таблетированных ГКС и повышением качества жизни пациентов. Системное действие флутиказона выражено минимально: в терапевтических дозах практически не оказывает влияния на гипоталамо-гипофизарно-надпочечниковую систему. Препарат восстанавливает реакцию больного на бронходилататоры, позволяя уменьшить частоту их применения. Терапевтический эффект после ингаляционного применения флутиказона начинается в течение 24 ч, достигает максимума в течение 1-2 недели и более после начала лечения и сохраняется в течение нескольких дней после отмены. Фармакокинетика: Всасывание. После ингаляционного введения абсолютная биодоступность флутиказона пропионата составляет от 7,8% до 10,9% у здоровых добровольцев в зависимости от системы доставки препарата. У пациентов с хронической обструктивной болезнью легких (ХОБЛ) или . бронхиальной астмой системная экспозиция препарата меньше, чем у здоровых добровольцев. Системная абсорбция происходит преимущественно в легких, при этом всасывание первоначально быстрое с последующим замедлением. Часть ингалированной дозы может проглатываться, но ее системное действие минимально вследствие плохой растворимости препарата в воде и интенсивного пресистемного метаболизма. Биодоступность флутиказона пропионата при приеме внутрь составляет менее 1%. Существует линейная зависимость между величиной ингалированной дозы и системным действием флутиказона пропионата. Распределение. Флутиказона пропионат имеет большой объём распределения в равновесном состоянии (около 300 л). Связь с белками плазмы крови умеренно высокая, составляет 91%. Метаболизм Флутиказона пропионат имеет высокий плазменный клиренс (1150 мл/мин). Конечный период полувыведения составляет приблизительно 8 ч. Почечный клиренс флутиказона пропионата незначителен (менее 0,2%), и менее 5% выводится с мочой в виде метаболита. Особые указания Повышение частоты применения ингаляционных бетао-агонистов короткого действия для контроля симптомов бронхиальной астмы свидетельствует об ухудшении контроля над течением заболевания. В таком случае план лечения пациента требует пересмотра. Внезапное и прогрессирующее ухудшение контроля над течением бронхиальной астмы представляет собой потенциальную опасность для жизни пациента и требует повышения дозы ГКС. Пациентам, относящимся к группе риска, может быть назначено ежедневное проведение пикфлоуметрии. Резко прекращать лечение препаратом Фликсотид не рекомендуется. Следует соблюдать особую осторожность при лечении ингаляционными ГКС пациентов с активной или неактивной формами туберкулеза легких. Рекомендуется проверить, умеет ли пациент правильно пользоваться ингалятором, чтобы убедиться в том, что приведение ингалятора в действие проводится синхронно с вдохом для обеспечения оптимальной доставки действующего вещества в легкие. При длительном применении любых ингаляционных ГКС, особенно в высоких дозах, могут отмечаться системные эффекты, однако вероятность их развития значительно ниже, чем при приеме ГКС внутрь. Возможные системные эффекты включают синдром Кушинга, кушингоидные симптомы, угнетение функции надпочечников, снижение минеральной плотности костей, задержку роста у детей и подростков, катаракту, глаукому. Поэтому особенно важно, чтобы при достижении терапевтического эффекта доза ингаляционных ГКС была снижена до минимальной эффективной дозы, позволяющей контролировать течение заболевания. Рекомендуется регулярно следить за динамикой роста детей, получающих ингаляционные ГКС в течение длительного времени. Всегда необходимо учитывать вероятность надпочечниковой недостаточности в экстренных ситуациях (включая хирургическое вмешательство), а также при плановом вмешательстве, которое может послужить причиной стресса, особенно у пациентов, принимающих высокие дозы ГКС в течение длительного времени. При этом следует решить вопрос о необходимости дополнительного назначения ГКС в зависимости от клинической ситуации (см. раздел "Передозировка"), В связи с возможной надпочечниковой недостаточностью следует соблюдать особую осторожность и регулярно контролировать показатели функции коры надпочечников при переводе пациентов, принимавших ГКС внутрь, на лечение флутиказона пропионатом в форме аэрозоля для ингаляций. Отмену системных ГКС на фоне приема флутиказона пропионата в форме аэрозоля для ингаляций следует проводить постепенно, и пациенты должны носить с собой карточку, указывающую, что им может потребоваться дополнительный прием ГКС в период стресса. При переводе пациентов с приема системных ГКС на ингаляционную терапию также могут обостряться сопутствующие аллергические заболевания (например, аллергический ринит, экзема), которые раньше подавлялись системными препаратами. Как и при проведении другой ингаляционной терапии, существует вероятность развития парадоксального бронхоспазма с немедленным усилением одышки после ингаляции. Для купирования этого приступа необходимо немедленное применение ингаляционного бронходилататора быстрого и короткого действия. Ингаляцию флутиказона пропионатом следует немедленно прекратить, далее следует оценить состояние пациента и, при необходимости, назначить альтернативную терапию (см. раздел "Побочное действие"). Как и у большинства препаратов для ингаляций в аэрозольных упаковках, эффект снижается при охлаждении баллончика. Имеются очень редкие сообщения о повышении концентрации глюкозы в крови, и об этом следует помнить, назначая флутиказона пропионат больным сахарным диабетом. Было зарегистрировано увеличение случаев пневмонии у пациентов с ХОБЛ, получавших флутиказона пропионат в дозе 500 мкг. Следует помнить о возможности возникновения пневмонии у таких пациентов, поскольку клинические признаки пневмонии и обострения основного заболевания могут часто совпадать. Влияние на способность управлять транспортными средствами: Влияние флутиказона. пропионата на способность управлять автомобилем и работать с механизмами, требующими повышенной концентрации внимания, маловероятно. Условия хранения и отпуска из аптек Условия хранения:2 года. Не использовать после истечения срока годности. Отпуск из аптек: По рецепту Регистрационные данные Торговое название Фликсотид Международное непатентованное название:Флутиказон. Форма выпуска:аэрозоль для ингаляций дозированный. Состав:ТАБЛИЦЪ АТХ: Регистрация: Лекарственное средство П N015734/01 Фармгруппа: Глюкокортикостероид для местного применения. Дата регистрации: 18.05.2009. Окончание регстрации: . Описание:металлический ингалятор с вогнутым основанием и с дозирующим устройством, снабжённый распылителем. Поверхность ингалятора и клапан не должны иметь видимых дефектов. Содержимое ингалятора представляет собой белую или почти белую суспензию. Упаковка:Фликсотид аэрозоль/для ингаляций дозированный 50 мкг/доза,125 мкг/доза и 250 мкг/доза.' Для дозировки 50 мкг: по 120 доз в алюминиевый ингалятор, оснащённый пластмассовым дозирующим устройством с защитным колпачком. Ингалятор и дозирующее устройство в собранном виде вместе с инструкцией по медицинскому применению помещают в картонную пачку. Для дозировок 125мкг и 250 мкг по 60 или 120 доз в алюминиевый ингалятор, оснащённый пластмассовым дозирующим устройством с защитным колпачком. Ингалятор -и дозирующее устройство в собранном виде вместе с инструкцией по медицинскому применению помещают в картонную пачку. Срок годности:При температуре не выше 30 °С. Не замораживать и не допускать воздействия прямых солнечных лучей. Хранить в недоступном для детей месте. Владелец рег.удостоверения:Глаксо. Смит. Кляйн Трейдинг, ЗАО Производитель:Glaxo. Smith. Kline Pharmaceuticals, S.A. Представительство

Модель:
RUR 494
Показания Лечение острых и хронических психозов, включая шизофрению: - лечение маниакальных эпизодов при биполярном расстройстве. Противопоказания Противопоказания - Повышенная чувствительность к кветиапину или другим компонентам препарата: - период грудного вскармливания- дети и подростки до 18 лет (эффективность и безопасность не установлены). С осторожностью: Пациенты с кардиоваскулярными и цереброваскулярными заболеваниями или другими состояниями, предрасполагающими к артериальной гипотензии, врожденное увеличение интервала QT на электрокардиограмме (ЭКГ) или при наличии условий, потенциально способных вызвать увеличение интервала QT (одновременное назначение препаратов, удлиняющих интервал QT, застойная сердечная недостаточность, гипокалиемия, гипомагнезиемия), пожилой возраст, печеночная недостаточность, эпилепсия, судорожные припадки в анамнезе, беременность. Беременность Безопасность и эффективность кветиапина у беременных не установлены. Поэтому во время беременности кветиапин можно применять только, если ожидаемая польза оправдывает потенциальный риск. Степень экскреции кветиапина с молоком матери не установлена. Женщинам необходимо рекомендовать избегать грудного кормления во время приема кветиапина. Применение и дозы Внутрь, 2 раза в сутки независимо от приема пищи. Лечение острых и хронических психозов, включая шизофрению Суточная доза в первые 4 дня составляет: 1-й день - по 50 мг: 2-й день - 200 мг: 3-й день - 200 мг и 4-й день - 300 мг. Начиная с четвертого дня суточная доза рекомендована: 300 мг. В зависимости от клинического эффекта и переносимости препарата его доза может индивидуально варьировать от 150 мг/сут до 750 мг/сут. Максимальная суточная доза при лечении шизофрении - 750 мг. Лечение маниакальных эпизодов при биполярном расстройстве Кветиапин рекомендуется в качестве монотерапии или в качестве адъювантной терапии для стабилизации настроения. Суточная доза в первые 4 дня составляет: 1-й день - по 100 мг: 2-й день - 200мг: 3-й день - 300 мг и 4-й день - 400 мг. Увеличение суточной дозы в дальнейшем возможно по 200 мг в сутки и к 6-ому дню терапии составляет 800 мг. В зависимости от клинического эффекта и переносимости препарата его доза может индивидуально варьировать от 200 мг/сут до 800 мг/сут. Как правило, эффективная доза составляет от 400 до 800 мг/сут. Максимальная суточная доза по данному показанию - 800 мг. Пожилой возраст Т.к. плазменный клиренс кветиапина у лиц пожилого возраста снижен на 30-50%, назначать препарат следует с осторожностью, особенно в начале терапии. Стартовая доза - 25 мг/сут, с последующим увеличением на 25-50 мг до достижения эффективной дозы. Почечная и печеночная недостаточность У пациентов с почечной и печеночной недостаточностью рекомендуется начинать терапии с 25 мг/сут. В дальнейшем рекомендуется увеличивать дозу ежедневно на 25-50 мг до достижения эффективной дозы. Побочные эффекты и передозировка Побочные эффекты: Классификация частоты развития побочных эффектов (ВОЗ): очень часто ( 1/10): часто ( 1/100, <: 1/10): нечасто ( 1/1000, <:1/100): редко ( 1/10 000, <:1/1000): очень редко (<:1/10 000), включая отдельные сообщения. Со стороны органов кроветворения и лимфатической системы: часто - лейкопения: нечасто - эозинофилия: очень редко - нейтропения. Нарушения метаболизма и питания: часто - повышение массы тела (преимущественно в первые недели лечения): очень редко - гипергликемия или декомпенсация сахарного диабета. Со стороны центральной и периферической нервной системы: очень часто - головокружение, сонливость, головная боль: часто - синкопальные состояния: нечасто - тревожность, возбуждение, бессонница, акатизия, тремор, судороги, депрессия, парестезии: очень редко: поздняя дискинезия. Со стороны сердечно-сосудистой системы: часто - тахикардия, ортостатическая артериальная гипотензия, удлинение интервала QT на ЭКГ. Со стороны органов дыхания: ринит, фарингит. Со стороны желудочно-кишечного тракта: часто - сухость во рту, запор, диарея, диспепсия: редко - желтуха, тошнота, рвота, боль в животе: очень редко - гепатит. Аллергические реакции: нечасто - кожная сыпь, реакции повышенной чувствительности: очень редко - ангионевротический отек, синдром Стивенса-Джонсона. Со стороны репродуктивной системы и молочных желез: редко - приапизм (болезненная эрекция). Прочие: часто - периферические отеки, астения: редко - боль в пояснице, боль в грудной клетке, субфебрилитет, миалгия, сухость кожи, ослабление зрения, нейролептический злокачественный синдром (гипертермия, нарушение сознания, мышечная ригидность, вегето-сосудистые нарушения, увеличение концентрации креатинфосфокиназы). Лабораторные показатели: часто - повышение уровня сывороточных трансаминаз (ACT или АЛТ): нечасто - повышение сывороточного уровня ГГТ и содержания триглицеридов (не натощак), гиперхолестеринемия: снижение уровня гормонов щитовидной железы: общий Т4 и свободный Т4 (в первые 4 недели), а так же - общего Т3 и реверсивного Т3 (только при приеме высоких доз кветиапина). Передозировка: Данные о передозировке кветиапина ограничены. Описаны случаи приема кветиапина в дозе, превышающей 30 г. У большинства пациентов побочные эффекты не отмечались, в случаях же их развития побочные эффекты проходили самостоятельно. Зарегистрирован случай летального исхода при приеме 13,6 грамм кветиапина. Крайне редко сообщалось о случаях передозировки кветиапином, приводивших к удлинению интервала QT, коме или смерти. У пациентов с тяжелыми сердечно-сосудистыми заболеваниями в анамнезе риск развития побочных эффектов при передозировке может увеличиваться. Симптомы: чрезмерная седация, сонливость, тахикардия, снижение артериального давления. Лечение: симптоматическое: мероприятия, направленные на поддержание функции дыхания, сердечно-сосудистой системы, адекватная оксигенация и вентиляция легких. Специфических антидотов нет. Взаимодействие с другими ЛС: Кветиапин не вызывает индукцию ферментных систем печени, вовлеченных в метаболизм феназона и лития. Одновременное назначение кветиапина с препаратами, потенциально ингибирующими печеночные ферменты, такие как карбамазепин или фенитоин, а так же с барбитуратами, рифампицином, возможно снижение плазменных концентраций кветиапина, что может потребовать увеличения дозы Квентиакса, в зависимости от клинического эффекта. Это так же необходимо учитывать при отмене фенитоина или карбамазепина, или другого индуктора ферментной системы печени или замене на препарат, неиндуцирующий микросомальные ферменты печени (например, вальпроевая кислота). Основной фермент, отвечающий за метаболизм кветиапина цитохромом Р450, является CYP3A4. Фармакокинетика кветиапина не изменяется при одновременном применении как цимитидина (ингибитор Р450) или флуоксетина (ингибитор CYP3A4 и CYP2D6), антидепрессанта имипрамина (ингибитор CYP2D6). Рекомендуется соблюдать осторожность при одновременном применении кветиапина и системном применении ингибиторов CYP3A4 (противогрибковые средства группы азолов и макролидные антибиотики), т.к. плазменные концентрации кветиапина могут повышаться. Поэтому следует применять более низкие дозы кветиапина. Особое внимание должно быть уделено пожилым и ослабленным пациентам. Фармакокинетика кветиапина существенно не изменялась при одновременном введении с антипсихотическими средствами - рисперидоном или галоперидоном. Однако, одновременный прием кветиапина с тиоридазином приводил к повышению клиренса кветиапина. Лекарственные средства, угнетающие центральную нервную систему (ЦНС), и этанол повышают риск развития побочных эффектов. Фармакологическое действие и фармакокинетика Механизм действия Кветиапин является атипичным антипсихотическим препаратом, который проявляет более высокое сродство к рецепторам серотонина (5НТ2), чем к рецепторам дофамина D1 и D2 головного мозга. Кветиапин обладает сродством к гистаминовым и альфа 1-рецепторам, и меньшим сродством по отношению к альфа 2-рецепторам. Не обнаружено заметного сродства кветиапина к холинергическим мускариновым и бензодиазепиновым рецепторам. В стандартных тестах кветиапин проявляет антипсихотическую активность. Фармакодинамические эффекты Результаты изучения экстрапирамидных симптомов (ЭПС) у животных выявили, что кветиапин вызывает слабую каталепсию в дозе, эффективно блокирующей допаминовые D2 рецепторы. Кветиапин вызывает селективное уменьшение активности мезолимбических А10-дофаминергических нейронов, в сравнении с А9-нигростриатными нейронами, вовлеченными в двигательные функции. Клиническая эффективность Не выявлено различий между применением кветиапина (в дозе 75-750 мг/сут) и плацебо по частоте возникновения случаев экстрапирамидной симптоматики и по сопутствующему использованию антихолинергических препаратов. Не вызывает длительного повышения концентрации пролактина в плазме крови. Кветиапин длительно поддерживает клиническое улучшение у тех пациентов, у которых положительный эффект развивался в самом начале лечения. Длительность воздействия кветиапина на рецепторы 5НТ2-серотониновыми и D2-дофаминовыми рецепторами составляет менее 12 часов после приема препарата. Фармакокинетика: Абсорбция - высокая, прием пищи не влияет на биодоступность. Связь с белками плазмы - 83%. Фармакокинетика кветиапина имеет линейный характер и не различается у мужчин и женщин. Активно метаболизируется в печени с образованием фармакологически неактивных метаболитов под воздействием фермента CYP3A4 цитохрома Р450. Кветиапин и некоторые его метаболиты являются слабыми ингибиторами изоферментов 1А2, 2С9, 2С19, 2D6 и 3А4 цитохрома Р450 человека, но только в концентрациях, как минимум, в 10-50 раз превышающих концентрации препарата при применении в диапазоне эффективных доз от 300 до 450 мг/сут. Основываясь на результатах in vitro, не следует ожидать, что одновременное назначение кветиапина с другими препаратами приведет к клинически выраженному ингибированию цитохрома Р450 опосредованного метаболизма других лекарственных средств. Период полувыведения (Т1/2) составляет приблизительно 7 часов. Выводится почками примерно 73% и через кишечник - 21%. Менее 5% кветиапина не подвергается метаболизму и выводится в неизменном виде. Средний клиренс кветиапина у пожилых пациентов на 30-50% меньше, чем у пациентов в возрасте от 18 до 65 лет. Средний клиренс кветиапина плазмы у пациентов с тяжелой почечной недостаточностью (клиренс креатинина <:30 мл/мин/1,73 м 2) снижен примерно на 25% и у пациентов с поражением печени (стабилизированный алкогольный цирроз). Особые указания При резкой отмене высоких доз антипсихотических препаратов могут наблюдаться следующие острые реакции ("синдром отмены") - тошнота, рвота, редко бессонница. Сообщалось о случаях обострения психотических симптомов и появлении непроизвольных двигательных расстройств (акатизия, дистония, дискинезия), в связи с чем отмену препарата рекомендуется проводить постепенно. При назначении кветиапина одновременно с препаратами, удлиняющими интервал QT, необходимо соблюдать осторожность, особенно у лиц пожилого возраста. При застойной сердечной недостаточности, при гипокалиемии и гипомагнезиемии. Учитывая, что кветиапин влияет на центральную нервную систему, препарат должен быть использован с осторожностью в комбинации с другими препаратами, обладающими угнетающим действием на центральную нервную систему. Рекомендуется воздерживаться от употребления алкоголя. При появлении симптомов поздней дискинезии следует уменьшить дозу или прекратить использование кветиапина. Судорожные припадки В контролируемых клинических исследованиях не было установлено различий по частоте возникновения судорог между кветиапином и плацебо. Однако, так же как и при терапии другими антипсихотическими средствами рекомендуется соблюдать осторожность при лечении пациентов с наличием судорожных приступов в анамнезе. Злокачественный нейролептический синдром Злокачественный нейролептический синдром может быть связан с проводимым антипсихотическим лечением. Клинические проявления синдрома включают в себя: гипертермию, измененный ментальный статус, мышечную ригидность, нестабильность вегетативной нервной системы, увеличение уровня креатинфосфокиназы. При развитии этого синдрома кветиапин должен быть отменен и проведено соответствующее лечение. Влияние на способность управлять транспортными средствами: В период лечения кветиапином рекомендуется соблюдать осторожность при вождении автотранспорта и занятии другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций. Условия хранения и отпуска из аптек Условия хранения:Хранить при температуре не выше 30 °С. Хранить в недоступном для детей месте. Отпуск из аптек: По рецепту Регистрационные данные Торговое название Квентиакс Международное непатентованное название:Кветиапин. Форма выпуска:таблетки покрытые пленочной оболочкой. Состав:1 таблетка 25 мг содержит: Ядро: действующее вещество: кветиапина фумарат (кветиапина гемифумарат) 28,78 (эквивалентно кветиапину 25): вспомогательные вещества: лактозы моногидрат 4,50, кальция гидрофосфат дигидрат 2,50, целлюлоза микрокристаллическая 18,97, повидон 1,25, карбоксиметилкрахмал натрия (тип А) 5,00, магния стеарат 1,50. Оболочка пленочная: гипромеллоза 1,25, титана диоксид (Е 171) 0,425, макрогол-4000 0,20, краситель железа оксид желтый (Е 172) 0,075, краситель железа оксид красный (Е 172) 0,05. 1 таблетка 100 мг содержит: Ядро: действующее вещество: кветиапина фумарат (кветиапина гемифумарат) 115,13 (эквивалентно кветиапину 100): вспомогательные вещества: лактозы моногидрат 18,00, кальция гидрофосфат дигидрат 10,00, целлюлоза микрокристаллическая 75,87, повидон 5,00, карбоксиметилкрахмал натрия (тип А) 20,00, магния стеарат 6,00. Оболочка пленочная: гипромеллоза 5,00, титана диоксид (Е 171)1,85, макрогол-4000 1,00, краситель железа оксид желтый (Е 172) 0,15. 1 таблетка 150 мг содержит: Ядро: действующее вещество: кветиапина фумарат (кветиапина гемифумарат) 172,69 (эквивалентно кветиапину 150): вспомогательные вещества: лактозы моногидрат 27,00, кальция гидрофосфат дигидрат 15,00, целлюлоза микрокристаллическая 113,81, повидон 7,50, карбоксиметилкрахмал натрия (тип А) 30,00, магния стеарат 9,00. Оболочка пленочная: гипромеллоза 7,50, титана диоксид (Е 171) 3,00, макрогол-4000 1,50. 1 таблетка 200 мг содержит: Ядро:действующее вещество: кветиапина фумарат (кветиапина гемифумарат) 230,26 (эквивалентно кветиапину 200): вспомогательные вещества: лактозы моногидрат 36,00, кальция гидрофосфат дигидрат 20,00, целлюлоза микрокристаллическая 151,74, повидон 10,00, карбоксиметилкрахмал натрия (тип А) 40,00, магния стеарат 12,00. Оболочка пленочная: гипромеллоза 10,00, титана диоксид (Е 171) 4,00, макрогол-4000 2,00.1 таблетка 300 мг содержит: Ядро: действующее вещество: кветиапина фумарат (кветиапина гемифумарат) 345,39 (эквивалентно кветиапину 300): вспомогательные вещества: лактозы моногидрат 54,00, кальция гидрофосфат дигидрат 30,00, целлюлоза микрокристаллическая 227,61, повидон 15,00, карбоксиметилкрахмал натрия (тип А) 60,00, магния стеарат 18,00. Оболочка пленочная: гипромеллоза 15,00, титана диоксид (Е 171) 6,00, макрогол-4000 3,00. АТХ: Регистрация: ЛСР-005227/09 Фармгруппа: антипсихотическое средство (нейролептик)Дата регистрации: 30.06.2009. Окончание регстрации: . Описание: Таблетки 25 мг. Круглые, двояковыпуклые таблетки, покрытые пленочной оболочкой коричневато-красного цвета, с фаской. Вид таблетки на поперечном разрезе: белая шероховатая поверхность с оболочкой коричневато-красного цвета. Таблетки 100 мг. Круглые, двояковыпуклые таблетки, покрытые пленочной оболочкой светло-желтого цвета. Вид таблетки на поперечном разрезе: белая шероховатая поверхность с оболочкой светло-желтого цвета. Таблетки 150 мг. Круглые, двояковыпуклые таблетки, покрытые пленочной оболочкой белого цвета, с фаской. Вид таблетки на поперечном разрезе: белая шероховатая поверхность с оболочкой белого цвета. Таблетки 200 мг. Круглые, двояковыпуклые таблетки, покрытые пленочной оболочкой белого цвета. Вид таблетки на поперечном разрезе: белая шероховатая поверхность с оболочкой белого цвета. Таблетки 300 мг. Овальные, двояковыпуклые таблетки, покрытые пленочной оболочкой белого цвета. Вид таблетки на поперечном разрезе: белая шероховатая поверхность с оболочкой белого цвета. Упаковка:Таблетки, покрытые пленочной оболочкой, по 25 мг, 100 мг, 150 мг, 200 мг и 300 мг. По 10 таблеток в блистере (контурной ячейковой упаковке). 3, 6 или 9 блистеров (контурных ячейковых упаковок) вместе с инструкцией по применению в пачке картонной. Срок годности:5 лет. Не использовать препарат после истечения срока годности. Владелец рег.удостоверения:КРКА-РУС, ООО Производитель:KRKA, d.d. Представительство:КРКА
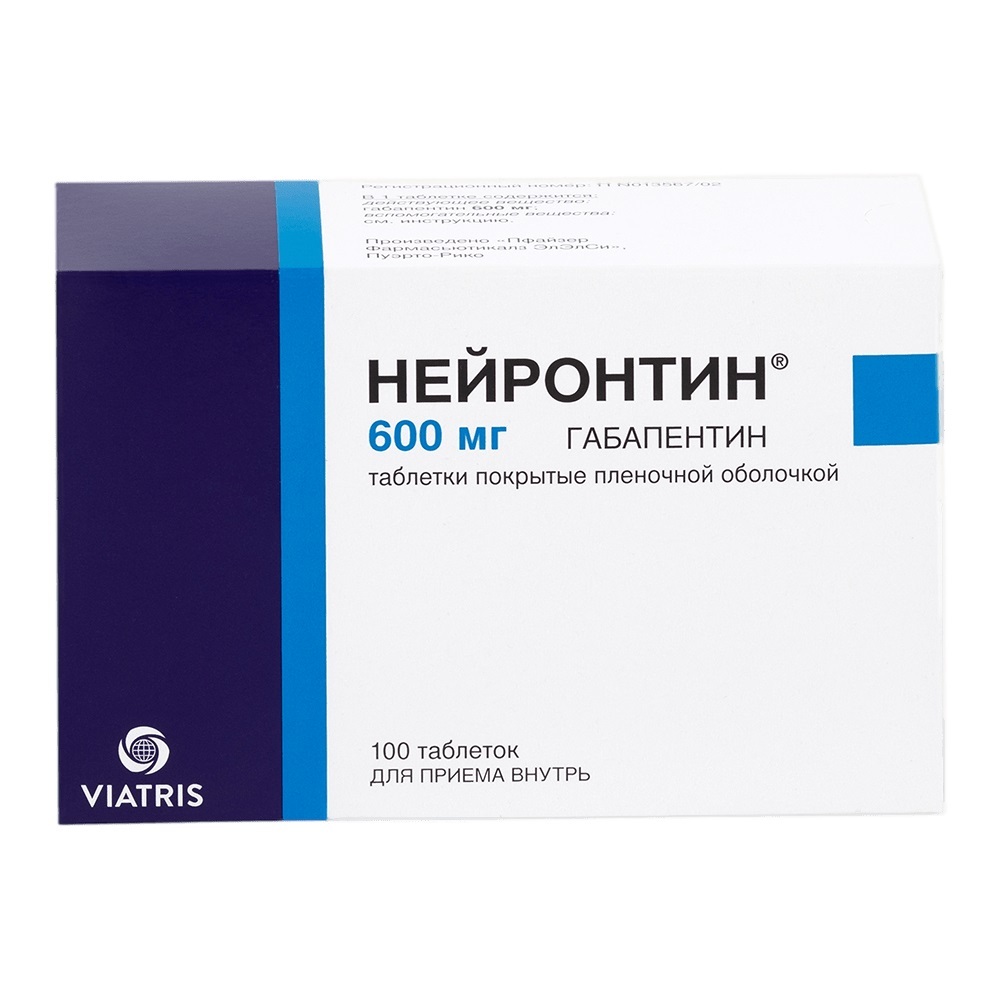
Модель:
RUR 2819
Показания Эпилепсия Монотерапия парциальных судорог с вторичной генерализацией и без нее у взрослых и детей в возрасте 12 лет и старше. Эффективность и безопасность монотерапии у детей в возрасте до 12 лет не установлены. Как дополнительное средство при лечении парциальных судорог с вторичной генерализацией и без нее у взрослых и детей в возрасте 3 лет и старше. Безопасность и эффективность дополнительной терапии габапентином у детей в возрасте менее 3 лет не установлены. Нейропатическая боль Лечение нейропатической боли у взрослых в возрасте 18 лет и старше. Эффективность и безопасность у пациентов в возрасте до 18 лет не установлены. Противопоказания Противопоказания Гиперчувствительность к габапентину или вспомогательным компонентам препарата. Эпилепсия Применение в качестве монотерапии парциальных судорог с вторичной генерализацией и без нее у детей в возрасте до 12 лет. Применение в качестве дополнительного средства при лечении парциальных судорог с вторичной генерализацией и без нее у детей в возрасте до 3 лет. Нейропатическая боль Для лечения нейропатической боли у детей и подростков в возрасте до 18 лет. С осторожностью: Почечная недостаточность (см. раздел "Способ применения и дозы"). Беременность Беременность Отсутствуют данные о применении препарата у беременных женщин. Общий риск, связанный с эпилепсией и противоэпилептическими препаратами Риск рождения детей с врожденными аномалиями у матерей, которые проходят лечение противосудорожными препаратами, увеличивается в 2-3 раза. Чаще всего наблюдается расщелина верхней губы и неба, пороки развития сердечно-сосудистой системы и дефекты нервной трубки. При этом прием нескольких противосудорожных препаратов может быть связан с большим риском пороков развития, чем в случае монотерапии. Поэтому, если это возможно, следует применять один из противосудорожных препаратов. Женщинам детородного возраста, а также всем женщинам, у которых возможно наступление беременности, следует проконсультироваться у квалифицированного специалиста. Если женщина планирует беременность, следует еще раз оценить необходимость продолжения противосудорожной терапии. При этом противосудорожные препараты не следует отменять резко, так как это может вести к возобновлению припадков с тяжелыми последствиями для матери и ребенка. В редких случаях у детей, матери которых страдают эпилепсией, наблюдалась задержка развития. При этом невозможно определить, связана ли задержка развития с генетическими или социальными факторами, болезнью матери или противосудорожной терапией. Риск, обусловленный габапентином В экспериментах на животных была показана токсичность препарата в отношении плода. В отношении возможного риска у людей данных нет. Поэтому габапентин следует применять во время беременности только в том случае, если предполагаемая польза для матери оправдывает возможный риск для плода. Невозможно сделать однозначное заключение о связи габапентина с повышенным риском врожденных аномалий при применении его во время беременности вследствие наличия самой эпилепсии и одновременного применения других противоэпилептических лекарственных препаратов в каждом зарегистрированном случае. Грудное вскармливание Габапентин выводится с грудным молоком, влияние его на вскармливаемого ребенка неизвестно, поэтому во время кормления грудью Нейронтин® следует назначать только в том случае, если польза для матери явно перевешивает риск для младенца. Фертильность В исследованиях на животных не отмечали влияния габапентина на фертильность. Применение и дозы Дозирование Для всех показаний схема титрации дозы для начала терапии представлена в таблице №1. Эта схема представлена для взрослых пациентов и подростков в возрасте 12 лет и старше. Схема титрации для детей в возрасте младше 12 лет представлена ниже под отдельным подзаголовком. Таблица №1 Схема титрации дозы препарата в начале терапии У пациентов с клиренсом креатинина <:15 мл/мин суточную дозу необходимо уменьшить пропорционально клиренсу креатинина (например, пациент с клиренсом креатинина 7,5 мл/мин должен получать половину дозы, которую получает пациент с клиренсом креатинина 15 мл/мин). Применение у пациентов, находящихся на гемодиализе Пациентам с анурией, находящимся на гемодиализе, которые ранее не принимали габапентин, препарат рекомендуется назначать в насыщающей дозе 300-400 мг, а затем применять его по 200-300 мг после каждых 4 ч гемодиализа. В дни, когда диализ не проводится, лечение проводить не следует. Для пациентов со сниженной функцией почек, проходящих диализ, поддерживающая доза габапентина должна подбираться в соответствии с рекомендациями, представленными в Таблице №2. В дополнение к поддерживающей терапии рекомендуется прием 200-300 мг габапентина после каждой 4-часовой процедуры диализа. Способ введения Нейронтин® назначают внутрь. Габапентин можно принимать вне зависимости от приема пищи, запивая достаточным количеством жидкости (например, стаканом воды). Допускается деление таблетки пополам. Побочные эффекты и передозировка Побочные эффекты: Нежелательные реакции, наблюдаемые в клинических исследованиях у пациентов с эпилепсией (при применении габапентина в качестве монотерапии или в комбинации с другими противосудорожными препаратами) или невропатическими болями, представлены ниже и распределены по системам органов и частоте. Категория частоты определялась следующим образом: очень часто ( 1/10): часто (от 1/100 до <:1/10): нечасто (от 1/1000 до <:1/100): редко (от 1/10000 до <:1/1000): очень редко (<: 1 /10000). Если категория частоты была различной в разных исследованиях, то нежелательной реакции присваивалась более высокая категория. Нежелательным реакциям, о которых сообщалось в процессе применения препарата после регистрации, присвоена категория частоты "неизвестно" (частоту нельзя рассчитать на основании имеющихся данных). В каждом разделе по частоте нежелательные реакции представлены в порядке уменьшения серьезности. Инфекционные и паразитарные заболевания: очень часто - вирусные инфекции: часто - пневмония, инфекция дыхательных путей, инфекция мочевыводящих путей, другие виды инфекции, средний отит. Нарушения со стороны крови и лимфатической системы: часто - лейкопения: неизвестно - тромбоцитопения. Нарушения со стороны иммунной системы: нечасто - аллергические реакции, включая крапивницу: неизвестно - гиперчувствительность, включая системные реакции, такие как лихорадка, высыпания, гепатит, лимфаденопатия, эозинофилия и другие. Нарушения со стороны обмена веществ и питания: часто - анорексия, повышение аппетита. Психические нарушения: часто - враждебность, спутанность сознания, депрессия, беспокойство, нервозность: нечасто - ухудшение психического состояния: неизвестно - галлюцинации. Нарушения со стороны нервной системы: очень часто - сонливость, головокружение, атаксия: часто - судороги, гиперкинезия, дизартрия, амнезия, тремор, бессонница, головная боль, нарушение чувствительности (например, парестезии, гипестезия), нарушение координации, нистагм, усиление, ослабление или отсутствие рефлексов: нечасто - гипокинезия: редко - потеря сознания: неизвестно - другие нарушения движения (например, хореоатетоз, дискинезия и дистония). Нарушения со стороны органа зрения: часто - нарушение зрения (такие как, амблиопия, диплопия). Нарушения со стороны органа слуха и лабиринтные нарушения: часто - вергиго, неизвестно - шум в ушах. Нарушения со стороны сердца: нечасто - ощущение сердцебиения. Нарушения со стороны сосудов: часто - симптомы вазодилатации или артериальная гипертензия. Нарушения со стороны дыхательной системы, органов грудной клетки и средостения: часто - одышка, бронхит, фарингит, кашель, ринит. Нарушения со стороны желудочно-кишечного тракта: часто - запор, диарея, сухость слизистой оболочки полости рта или глотки, диспепсия, метеоризм, тошнота, рвота, боль в животе, заболевания зубов, гингивит: неизвестно - панкреатит. Нарушения со стороны печени и желчевыводящих путей: неизвестно - гепатит, желтуха. Нарушения со стороны кожи и подкожных покровов: часто - отек лица, пурпура (чаще всего ее описывали как кровоподтеки, возникавшие при физической травме), кожная сыпь, акне, зуд кожи: неизвестно - синдром Стивенса-Джонсона, ангионевротический огек, анафилаксия, мультиформная эритема, алопеция, лекарственная кожная сыпь, включая эозинофилию и системные реакции (см. раздел "Особые указания"). Нарушения со стороны скелетно-мышечной и соединительной ткани: часто - миалгии, артралгия, боль в спине, подергивания мышц: неизвестно - рабдомиолиз, миоклонус. Нарушения со стороны почек и мочевыводящих путей: неизвестно - недержание мочи, острая почечная недостаточность. Нарушения со стороны половых органов и молочной железы: часто - импотенция: неизвестно - увеличение в объеме молочных желез, гинекомастия, половая дисфункция (включая изменения либидо, нарушения эякуляции и аноргазмию). Общие расстройства и нарушения в месте введения: очень часто - утомляемость, лихорадка: часто - периферические отеки, нарушение походки, астения, боль различной локализации, общее недомогание, гриппоподобный синдром: нечасто - генерализованный отек: неизвестно - синдром отмены (наиболее часто отмечались следующие нежелательные реакции: беспокойство, бессонница, тошнота, боли различной локализации и повышенное потоотделение), боль в груди. Зарегистрированы случаи внезапной необъяснимой смерти, связь которых с лечением габапентином не установлена. Лабораторные и инструментальные данные: часто - снижение концентрации белых кровяных телец, повышение массы тела: нечасто - повышение активности аланинаминотрансферазы, аспартатаминотрансферазы и концентрации билирубина в плазме крови, гипергликемия: редко - гипогликемия (преимущественно у пациентов с сахарным диабетом): неизвестно - гипонатриемия, повышение активности креатинфосфокиназы. Травмы, интоксикации и осложнения манипуляций: часто - травмы, переломы, ссадины, связанные с падениями. Имеются сообщения о развитии острого панкреатита на фоне терапии габапентином. Причинная связь с габапентином остается неясной (см. раздел "Особые указания"). Имеются сообщения о случаях миопатии с повышением активности креатинкиназы у пациентов с терминальной стадией почечной недостаточности, находящихся на гемодиализе. Случаи инфекции дыхательных путей, среднего отита, бронхита и судорог были отмечены только в клинических исследованиях. Кроме того, в клинических исследованиях сообщалось о случаях агрессивного поведения и гиперкинезов у детей. Передозировка: При однократном приеме 49 г габапентина наблюдались следующие симптомы: головокружение, двоение в глазах, нарушение речи, сонливость, потеря сознания, состояние заторможенности и диарея легкой степени, которые полностью исчезали при проведении симптоматической терапии. Следует учитывать, что после приема высоких доз габапентина, уменьшается его всасывание в кишечнике. При передозировке габапентином возможно развитие комы, особенно при одновременном применении других лекарственных препаратов, подавляющих ЦНС. Несмотря на то, что габапентин может выводиться при гемодиализе, имеющийся опыт показывает, что обычно подобной необходимости не возникает. Пациентам с тяжелой почечной недостаточностью может быть показан гемодиализ. В рамках экспериментов на мышах и крысах, которым препарат вводился в дозах до 8000 мг/кг, не удалось установить значение летальной дозы габапентина при пероральном введении. Признаки острой токсичности у животных включали атаксию, затруднение дыхания, птоз, гипоактивность или возбуждение. Взаимодействие с другими ЛС: Имеются сообщения о спонтанных случаях, а также по информации из литературных источников возможно угнетение дыхания и/или симптомы седации, связанные с приемом габапентина и опиоидных анальгетиков. В некоторых из этих случаев авторы связывали данные симптомы с одновременным применением габапентина и опиоидов, особенно у пожилых пациентов. В исследовании с участием здоровых добровольцев (N=12) при применении 600 мг габапентина через 2 часа после приема морфина в виде капсул с пролонгированным высвобождением по 60 мг отмечается увеличение среднего значения AUC габапентина на 44% по сравнению с монотерапией габапентином. В связи с этим пациенты, которым требуется проведение одновременной терапии с опиоидными анальгетиками, должны находиться под тщательным контролем на предмет развития признаков угнетения центральной нервной системы, таких как сонливость, седация и угнетение дыхания, а дозу габапентина и опиоидных анальгетиков следует соответствующим образом снизить. Взаимодействия между габапентином и фенобарбиталом, фенитоином, вальпроевой кислотой и карбамазепином не отмечено. Фармакокинетика габапентина в равновесном состоянии одинакова у здоровых людей и пациентов, получающих другие противосудорожные средства. Одновременное применение габапентина с пероральными контрацептивами, содержащими норэтистерон и/или этинилэстрадиол, не сопровождается изменениями фармакокинетики обоих компонентов. Одновременное применение габапентина с антацидами, содержащими алюминий и магний, сопровождается снижением биодоступности габапентина примерно на 24% (см. раздел "Особые указания"). Пробенецид не влияет на почечную экскрецию габапентина. Небольшое снижение (14%) почечной экскреции габапентина при одновременном приеме циметидина, вероятно, не имеет клинического значения. При одновременном применении напроксена (250 мг) и габапентина (125 мг) отмечалось повышение абсорбции габапентина с 12% до 15%. Габапентин не оказывает влияния на фармакокинетические параметры напроксена. Указанные дозы препаратов меньше минимальных терапевтических. Одновременное применение данных препаратов в больших дозах не изучалось. Фармакологическое действие и фармакокинетика Механизм действия Габапентин легко проникает в ткань головного мозга и предотвращает развитие судорог в различных животных моделях эпилепсии. Габапентин не обладает сродством к рецепторам ГАМКА (гамма-аминомасляная кислота) и ГАМКВ и не влияет на метаболизм ГАМК. Габапентин не связывается с рецепторами других нейромедиаторов, присутствующих в головном мозге и не влияет на натриевые каналы. Габапентин обладает высоким сродством и связывается с α-2-δ (альфа-2-дельта) субъединицей потенциалзависимых кальциевых каналов и предполагается, что связь габапентина с α-2-δ субъединицей участвует в механизме противосудорожного эффекта у животных. При скрининге большой группы молекул-мишеней для этого лекарственного препарата показано, что единственной мишенью для него является субъединица α 2δ. Результаты, полученные в нескольких доклинических моделях, показывают, что фармакологическая активность габапентина может реализовываться путем связывания с субъединицей α 2δ посредством подавления высвобождения возбуждающих нейромедиаторов в некоторых участках центральной нервной системы. Такая активность может лежать в основе противосудорожного действия габапентина. Значимость этих механизмов действия габапентина для его противосудорожных эффектов у людей все еще необходимо установить. Эффективность габапентина также показана в нескольких доклинических исследованиях на животных моделях болевого синдрома. Предполагают, что специфическое связывание габапентина с субъединицей α 2δ приводит к нескольким разным эффектам, которые могут отвечать за обезболивающее действие в животных моделях. Обезболивающее действие габапентина может проявляться на уровне спинного мозга, а также на уровне высших мозговых центров посредством взаимодействий с нисходящими путями, подавляющими передачу болевых импульсов. Значение этих свойств габапентина, выявленных в доклинических исследованиях, неизвестно. Клиническая эффективность и безопасность В рамках клинического исследования адъювантной терапии парциальных судорожных приступов у детей в возрасте от 3 до 12 лет было продемонстрировано наличие количественных, но статистически недостоверных различий по частоте снижения количества приступов на более чем 50% в группе габапентина по сравнению с группой плацебо. Дополнительный анализ частоты ответа на терапию в зависимости от возраста (при рассмотрении возраста как непрерывной переменной или при выделении двух возрастных подгрупп: 3-5 лет и 6 - 12 лет) не выявил статистически достоверного влияния возраста на эффективность терапии. Результаты данного дополнительного анализа представлены в таблице ниже. *Модифицированная популяция "по намерению лечить" (MITT) определялась как совокупность всех пациентов, рандомизированных в группу исследуемой терапии и имевших подлежащие оценке дневники судорожных приступов за период длительностью 28 дней в рамках исходной и двойной слепой фаз исследования. Фармакокинетика: Всасывание После приема внутрь максимальная концентрация габапентина в плазме достигается в течение 2- 3 часов. Биодоступность габапентина имеет тенденцию к снижению с увеличением дозы препарата. Абсолютная биодоступность при приеме капсул дозировки 300 мг составляет приблизительно 60%. Пища, в том числе с высоким содержанием жиров, не оказывает клинически значимого влияния на параметры фармакокинетики габапентина. Фармакокинетика габапентина не изменяется при многократном приеме препарата. Несмотря на то, что в рамках клинических исследований концентрация габапентина в плазме обычно варьировала в диапазоне 2-20 мкг/мл, она не позволяла прогнозировать ни эффективность, ни безопасность препарата. Параметры фармакокинетики представлены в таблице. Таблица. Сводные средние (CV,%) параметры фармакокинетики габапентина в равновесном состоянии при многократном приеме с интервалом дозирования длительностью восемь часов Распределение Габапентин не связывается с белками плазмы, и его объем распределения составляет 57,7 л. У пациентов с эпилепсией концентрация габапентина в спинномозговой жидкости (СМЖ) составляет приблизительно 20% от минимальной равновесной концентрации в плазме. Габапентин проникает в грудное молоко женщин, кормящих грудью. Биотрансформация Отсутствуют данные о метаболизме габапентина в организме человека. Габапентин не вызывает индукции неспецифических оксидаз печени, ответственных за метаболизм лекарственных средств. Выведение Габапентин выводится в неизмененном виде исключительно путем почечной экскреции. Период полувыведения габапентина не зависит от принятой дозы и составляет в среднем от 5 до 7 часов. У пожилых лиц и пациентов с нарушением функции почек клиренс габапентина из плазмы снижается. Константа элиминации, плазменный клиренс и почечный клиренс габапентина прямо пропорциональны клиренсу креатинина. Габапентин удаляется из плазмы при гемодиализе. Пациентам с нарушением функции почек или находящимся на гемодиализе рекомендуется коррекция дозы препарата (см. раздел "Способ применения и дозы"). Фармакокинетика габапентина у детей изучалась у 50 здоровых добровольцев в возрасте от 1 месяца до 12 лет. В целом, концентрация габапентина в плазме детей старше 5 лет аналогична таковой у взрослых при применении препарата в эквивалентной дозе на основании расчета мг/кг массы тела. В рамках исследования фармакокинетики у 24 здоровых детей в возрасте от 1 до 48 месяцев параметры экспозиции препарата (AUC) были приблизительно на 30% ниже, Сmах - ниже, а клиренс - выше при расчете на единицу массы тела по сравнению с доступными опубликованными данными по кинетике препарата у детей в возрасте старше 5 лет. Линейность/нелинейность параметров фармакокинетики Биодоступность габапентина снижается с увеличением принятой дозы, что влечет за собой нелинейность параметров фармакокинетики, которые включают в расчет показатель биодоступности (F), например Ае%, CL/F, Vd/F. Фармакокинетика элиминации (параметры параметров, не включающие F, такие как CLr и Т1/2) лучше описывается линейной моделью. Равновесные концентрации габапентина в плазме являются предсказуемыми на основе данных по кинетике при однократном приеме. Особые указания Суицидальные идеи и поведение Имеются сообщения о возникновении суицидальных мыслей или поведения у пациентов, получающих лечение противоэпилептическими препаратами по различным показаниям. Мета-анализ рандомизированных плацебо-контролируемых исследований противоэпилептических средств также продемонстрировал небольшое повышение риска появления суицидальных мыслей и поведения. Механизм повышения такого риска неизвестен и имеющиеся данные не исключают возможности такого повышения риска для габапентина. Поэтому пациентов, получающих эти препараты, следует тщательно наблюдать на предмет появления признаков суицидальных мыслей или поведения. У таких пациентов следует рассмотреть необходимость проведения соответствующего лечения. В случае появления признаков суицидальных мыслей или поведения пациентам или их попечителям следует обратиться к врачу. Острый панкреатит В случае развития острого панкреатита на фоне приема габапентина, следует оценить возможность отмены препарата. Судороги (синдром "отмены") Хотя синдром "отмены", сопровождающийся развитием судорог, при лечении габапентином не отмечен, резкое прекращение терапии противосудорожными препаратами у пациентов с эпилепсией может провоцировать развитие эпилептического статуса (см. раздел "Способ применения и дозы"). Как и при применении других противоэпилептических препаратов, на фоне применения габапентина может отмечаться увеличение частоты судорог или появление другого типа судорог. Так же как и в случае с другими противоэпилептическими средствами, попытки отменить все сопутствующие противоэпилептические средства, чтобы начать монотерапию габапентином в случае рефрактерности к лечению у пациентов, принимающих несколько противоэпилептических средств, в основном не заканчиваются успехом. Считается, что габапентин неэффективен при первичных генерализованных припадках, например, абсансах, и даже может усиливать такие припадки у некоторых пациентов. В связи с этим применять габапентин у пациентов со смешанными припадками, включая абсансы, следует с осторожностью. Опиоидные анальгетики Пациенты, которым требуется проведение одновременной терапии с опиоидными анальгетиками, должны находиться под тщательным контролем на предмет развития признаков угнетения центральной нервной системы, таких как сонливость, седация и угнетение дыхания. У пациентов, которые одновременно получают габапентин и морфин может наблюдаться повышение концентрации габапентина. Дозу габапентина и опиоидных анальгетиков следует соответствующим образом снизить (см. раздел "Взаимодействие с другими лекарственными средствами"). Пожилые пациенты Систематические исследования пациентов в возрасте 65 лет и старше, принимающих габапентин, не проводились. В двойном слепом исследовании применения габапентина при невропатической боли у пациентов в возрасте 65 лет и старше наблюдалась более высокая частота сонливости, периферических отеков и астении по сравнению с пациентами в возрасте младше 65 лет. За исключением этих результатов при клиническом обследовании данной группы пациентов было показано, что профиль нежелательных реакций у них не отличался от остальных. Дети Влияние длительной терапии (более 36 недель) габапентином на способность к обучению, интеллект и развитие детей и подростков достаточно не изучено. Следует оценить соотношение возможного риска и пользы при назначении длительной терапии. Злоупотребление и зависимость В базе данных пострегистрационных наблюдений имеются сообщения о случаях злоупотребления препаратом и зависимости от него. Как и в случаях назначения любого препарата, влияющего на ЦНС, врачам следует тщательно изучать анамнез пациентов на предмет злоупотребления препаратами и наблюдать за ними с целью выявления возможных признаков злоупотребления габапентином (например, стремление необоснованно получить препарат, развитие устойчивости к терапии габапентином, необоснованное повышение дозы препарата). DRESS-синдром (лекарственная реакция с эозинофилией и системными симптомами) На фоне приема противоэпилептических препаратов, в том числе габапентина, сообщалось о случаях развития тяжелых жизнеугрожающих реакций гиперчувствительности, таких как лекарственная сыпь с сопутствующей эозинофилией и системными симптомами. Необходимо помнить о том, что ранние признаки реакции гиперчувствительности, такие как повышение температуры тела, лимфаденопатия, могут развиваться даже в отсутствии кожной сыпи. В случае появления подобных симптомов, необходимо немедленное обследование пациента. Если не найдено других причин, кроме применения габапентина, применение препарата следует отменить. Анафилаксия Прием габапентина может привести к развитию анафилаксии. Следующие симптомы и признаки отмечали в случаях развития анафилаксии на фоне приема габапентина - затруднение дыхания, отек губ, горла и языка, также отмечалось выраженное снижение артериального давления, требующее срочного медицинского вмешательства. Следует предупредить пациентов о том, что при развитии признаков или симптомов развития анафилаксии следует прекратить прием препарата и обратиться за медицинской помощью. Лабораторные тесты При совместном применении габапентина и других противосудорожных средств были зарегистрированы ложноположительные результаты при определении белка в моче с помощью тест-полосок Ames N-Multistix SG®. Для определения белка в моче рекомендуется пользоваться более специфичным методом преципитации сульфосалициловой кислотой. Влияние на ЦНС Во время лечения габапентином наблюдались случаи головокружения и сонливости, которые могут увеличивать вероятность получения случайной травмы (при падении). В пострегистрационном периоде также сообщалось о случаях спутанности сознания, потери сознания и нарушения умственной деятельности. Поэтому пациентам следует рекомендовать соблюдать осторожность до тех пор, пока им не станут известны возможные эффекты этого лекарственного препарата. При одновременном применении с опиоидными анальгетиками может отмечаться повышение концентрации габапентина в плазме крови. В связи с этим пациент нуждается в тщательном наблюдении на предмет развития признаков угнетения центральной нервной системы (ЦНС), таких как сонливость, седация и угнетение функции дыхания. Дозы габапентина или опиоидных анальгетиков должны быть снижены соответствующим образом (см. раздел "Взаимодействие с другими лекарственными средствами"). Совместное применение с антацидами Габапентин рекомендуется принимать примерно через 2 ч после приема антацида. Влияние на способность управлять транспортными средствами: Во время приема препарата пациентам не рекомендуется управлять транспортными средствами или пользоваться потенциально опасной техникой до подтверждения отсутствия негативного влияния препарата на выполнение этих функций. Габапентин влияет на ЦНС и может вызывать головокружение, сонливость, спутанность сознания, потерю сознания или другие симптомы со стороны ЦНС. Даже при незначительной или умеренной выраженности эти нежелательные реакции могут представлять опасность для пациентов, управляющих транспортными средствами или другими механизмами. Особенно велика такая вероятность в начале лечения или после повышения дозы препарата Нейронтин®. Условия хранения и отпуска из аптек Условия хранения:При температуре не выше 25 °С. Хранить в недоступном для детей месте. Отпуск из аптек: По рецепту Регистрационные данные Торговое название Нейронтин® Международное непатентованное название:Габапентин. Форма выпуска:Таблетки, покрытые пленочной оболочкой. Состав:1 таблетка 600 мг содержит: Активное вещество: 600,0 мг габапентина. Вспомогательные вещества: полоксамер 407 80,0 мг, коповидон 64,8 мг, крахмал кукурузный 49,2 мг, магния стеарат 6,0 мг: пленочная оболочка: опадрай белый YS-1-18111 24,0 мг [тальк 17,4 мг, гипролоза 6,6 мг], воск травяной (канделила) 0,6 мг. 1 таблетка 800 мг содержит: Активное вещество: 800,0 мг габапентина. Вспомогательные вещества: полоксамер 407 106,7 мг, коповидон 86,4 мг, крахмал кукурузный 65,6 мг, магния стеарат 8,0 мг: пленочная оболочка: опадрай белый YS-1-18111 32,0 мг [тальк 23,2 мг, гипролоза 8,8 мг], воск травяной (канделила) 0,8 мг. АТХ: Регистрация: Лекарственное средство П N013567/02 Фармгруппа: противоэпилептическое средство. Дата регистрации: 06.10.2008 / 19.07.2013. Окончание регстрации: . Описание:Дозировка 600 мг: белые, эллиптической формы таблетки, покрытые пленочной оболочкой, с гравировкой "NT" и "16", риской между гравировкой на одной стороне и риской на другой стороне. Дозировка 800 мг: белые, эллиптической формы таблетки, покрытые пленочной оболочкой, с гравировкой "NT" и "26", риской между гравировкой на одной стороне и риской на другой стороне. Упаковка:Таблетки, покрытые пленочной оболочкой, 600 мг и 800 мг. По 10 таблеток в блистеры (контурная ячейковая упаковка) из ПВХ/ПЭ/ПВДХ/алюминиевой фольги с виниловым покрытием или по 10 таблеток в ПВХ/ПВДХ/ алюминиевый блистер. По 2, 5 или 10 блистеров с инструкцией по применению в картонную пачку. Срок годности:2 года. Не использовать после даты истечения срока годности. Владелец рег.удостоверения:Пфайзер Мэнюфэкчуринг Дойчленд ГмбХ Производитель:PFIZER MANUFACTURING DEUTSCHLAND, GmbH. Представительство:Пфайзер ООО. Информация предоставлена: Компанией ГЭОТАР - http://www.lsgeotar.ru/
Модель:
RUR 993
Показания Для лечения шизофрении- Для лечения маниакальных эпизодов в структуре биполярного расстройства- Для лечения депрессивных эпизодов от средней до выраженной степени тяжести в структуре биполярного расстройства. Препарат не показан для профилактики маниакальных и депрессивных эпизодов. Противопоказания Противопоказания Гиперчувствительность к любому из компонентов препарата, в том числе, лактазная недостаточность, глюкозо-галактозная мальабсорбция и непереносимость галактозы. Совместное применение с ингибиторами цитохрома Р450, такими как противогрибковые препараты группы азолов, эритромицин, кларитромицин и нефазодон, а также ингибиторы протеазы ВИЧ (см. раздел "Взаимодействие с другими лекарственными средствами и другие виды взаимодействия"). Несмотря на то, что эффективность и безопасность препарата Сероквель у детей и подростков в возрасте 10-17 лет изучались в клинических исследованиях, применение препарата Сероквель у пациентов в возрасте до 18 лет не показано. С осторожностью: У пациентов с кардиоваскулярными и цереброваскулярными заболеваниями или другими состояниями, предрасполагающими к артериальной гипотензии, пожилой возраст, печеночная недостаточность, судорожные припадки в анамнезе, риск развития инсульта и аспирационной пневмонии. Беременность Безопасность и эффективность кветиапина у беременных женщин не установлены. Поэтому, во время беременности кветиапин можно применять только, если ожидаемая польза для женщины оправдывает потенциальный риск для плода. При применении антипсихотических препаратов, в том числе кветиапина, в третьем триместре беременности у новорожденных появляется риск развития побочных реакций разной степени выраженности и длительности, включая ЭПС и/или синдром "отмены". Сообщалось о возбуждении, гипертонии, гипотонии, треморе, сонливости, респираторном дистресс-синдроме или нарушениях кормления. В связи с этим следует тщательно наблюдать за состоянием новорожденных. Опубликованы сообщения об экскреции кветиапина с грудным молоком, однако степень экскреции не установлена. Женщинам необходимо рекомендовать избегать грудного кормления во время приема кветиапина. Применение и дозы Препарат Сероквель может применяться независимо от приёма пищи. Взрослые. Лечение шизофрении. Препарат Сероквель назначается 2 раза в сутки. Суточная доза для первых 4 суток терапии составляет: 1-е сутки - 50 мг, 2-е сутки - 100 мг, 3-и сутки - 200 мг, 4-е сутки - 300 мг. Начиная с 4-х суток, доза должна подбираться до эффективной, обычно в пределах от 300 до 450 мг/сут. В зависимости от клинического эффекта и индивидуальной переносимости пациентом, доза может варьировать в пределах от 150 до 750 мг/сут. Максимальная рекомендованная суточная доза составляет 750 мг. Лечение маниакальных эпизодов в структуре биполярного расстройства Препарат Сероквель применяется в качестве монотерапии или в комбинации с препаратами, обладающими нормотимическим действием. Препарат Сероквель назначается 2 раза в сутки. Суточная доза для первых 4 суток терапии составляет: 1-е сутки - 100 мг, 2-е сутки - 200 мг, 3-и сутки - 300 мг, 4-е сутки - 400 мг. В дальнейшем к 6-му дню терапии суточная доза препарата может быть увеличена до 800 мг. Увеличение суточной дозы не должно превышать 200 мг в сутки. В зависимости от клинического эффекта и индивидуальной переносимости, доза может варьировать в пределах от 200 до 800 мг/сут. Обычно эффективная доза составляет от 400 до 800 мг/сут. Максимальная рекомендованная суточная доза составляет 800 мг. Лечение депрессивных эпизодов в структуре биполярного расстройства Препарат Сероквель назначается один раз в сутки на ночь. Суточная доза для первых 4-х суток терапии составляет: 1-е сутки - 50 мг, 2-е сутки - 100 мг, 3-и сутки - 200 мг, 4-е сутки - 300 мг. Рекомендуемая доза составляет 300 мг/сут. Максимальная рекомендованная суточная доза препарата Сероквель составляет 600 мг. Антидепрессивный эффект препарата Сероквель был подтвержден при использовании его в дозе 300 и 600 мг/сут. При краткосрочной терапии эффективность препарата Сероквель в дозах 300 и 600 мг/сут. была сопоставимой (см. раздел "Фармакодинамика"). ПожилыеУ пожилых пациентов начальная доза препарата Сероквель составляет 25 мг/сут. Дозу следует увеличивать ежедневно на 25-50 мг до достижения эффективной дозы, которая, вероятно, будет меньше, чем у молодых пациентов. Пациенты с почечной недостаточностью Коррекция дозы не требуется. Пациенты с печеночной недостаточностью. Кветиапин интенсивно метаболизируется в печени. Поэтому следует соблюдать осторожность при применении препарата Сероквель у пациентов с печеночной недостаточностью, особенно в начале терапии. Рекомендуется начинать терапию препаратом Сероквель с дозы 25 мг/сут. и увеличивать дозу ежедневно на 25-50 мг до достижения эффективной дозы. Побочные эффекты и передозировка Побочные эффекты: Наиболее частые побочные эффекты кветиапина (>:10%) - сонливость, головокружение, сухость во рту, синдром "отмены", повышение концентрации триглицеридов, повышение концентрации общего холестерина (главным образом, холестерина липопротеидов низкой плотности - ЛПНП), снижение концентрации холестерина липопротеидов высокой плотности (ЛПВП), увеличение массы тела, снижение концентрации гемоглобина и экстрапирамидные симптомы. Частота побочных реакций приведена в виде следующей градации: очень часто ( 1/10): часто ( 1/100, <:1/10): нечасто ( 1/1000, <:1/100): редко ( 1/10000, <:1/1000): очень редко (<:1/10000), неуточненной частоты. ТАБЛИЦЪ 1. См. раздел "Особые указания"2. Сонливость обычно возникает в течение первых 2 недель после начала терапии и, как правило, разрешается на фоне продолжающегося приема кветиапина.3. Возможно бессимптомное повышение ( 3 раза от верхней границы нормы при измерении в любое время) активности аспартатаминотрансферазы (ACT), аланинаминотрансферазы (АЛТ) и гамма-глутамилтранспептидазы (ГГТ) в сыворотке крови, как правило, обратимое на фоне продолжающегося приема кветиапина.4. Как и другие антипсихотические препараты с α 1-адреноблокирующим действием, кветиапин часто вызывает ортостатическую гипотензию, которая сопровождается головокружением, тахикардией, в некоторых случаях - обмороком, особенно в начале терапии (см. раздел "Особые указания").5. Отмечены очень редкие случаи декомпенсации сахарного диабета.6. Оценка частоты данного побочного эффекта производилась на основании результатов постмаркетингового наблюдения.7. Повышение концентрации глюкозы крови натощак 126 мг/дл ( 7,0 ммоль/л) или глюкозы крови после приема пищи 200 мг/дл ( 11,1 ммоль/л) хотя бы при однократном определении.8. Более высокая частота дисфагии на фоне кветиапина по сравнению с плацебо была отмечена только у пациентов с депрессией в структуре биполярного расстройства.9. Повышение исходной массы тела не менее чем на 7%. В основном, возникает в начале терапии у взрослых.10. При изучении синдрома "отмены" в краткосрочных плацебо-контролируемых клинических исследованиях кветиапина в режиме монотерапии были отмечены следующие симптомы: бессонница, тошнота, головная боль, диарея, рвота, головокружение и раздражительность. Частота синдрома "отмены" существенно снижалась через 1 неделю после прекращения приема препарата.11. Повышение концентрации триглицеридов 200 мг/дл ( 2,258 ммоль/л) у пациентов 18 лет или 150 мг/дл ( 1,694 ммоль/л) у пациентов <: 18 лет, хотя бы при однократном определении.12. Повышение концентрации общего холестерина 240 мг/дл ( 6,2064 ммоль/л) у пациентов 18 лет или 200 мг/дл ( 5,172 ммоль/л) у пациентов <: 18 лет, хотя бы при однократном определении.13. См. далее по тексту Инструкции.14. Снижение количества тромбоцитов 100 х 109/л, хотя бы при однократном определении.15. Без связи с злокачественным нейролептическим синдромом. По данным клинических исследований.16. Повышение концентрации пролактина у пациентов 18 лет: >:20 мкг/л ( 869,56 пмоль/л) у мужчин: >:30 мкг/л ( 1304,34 пмоль/л) у женщин.17. Может приводить к падению.18. Снижение концентрации холестерина ЛПВП <: 40 мг/дл (<: 1,03 ммоль/л) у мужчин и <: 50 мг/дл (<: 1,29 ммоль/л) у женщин.19. Данные явления часто отмечали на фоне тахикардии, головокружения, ортостатической гипотензии и/или сопутствующей патологии сердечнососудистой или дыхательной системы.20. На основании потенциально клинически значимых отклонений от нормального исходного уровня, отмеченных во всех клинических исследованиях. Изменения концентрации общего Т4, свободного Т4, общего ТЗ, свободного ТЗ до значений <: 80% от нижней границы нормы (пмоль/л) при измерении в любое время. Изменение концентрации ТТГ >: 5 мМЕд/л при измерении в любое время.21. На основании повышенной частоты возникновения рвоты у пожилых пациентов (возраст 65 лет).22. В краткосрочных клинических исследованиях монотерапии кветиапином у пациентов с количеством нейтрофилов до начала терапии 1,5 х 109 /л случаи нейтропении (количество нейтрофилов <:1,5 х 109 /л) отмечены у 1,9% пациентов в группе кветиапина против 1,5% в группе плацебо. Снижение количества нейтрофилов 0,5, но <: 1,0 х 109 /л отмечалось с частотой 0,2% в группе кветиапина и плацебо. Снижение количества нейтрофилов <:0,5 х 109 /л хотя бы при однократном определении отмечено у 0,21% пациентов в группе кветиапина против 0% в группе плацебо.23. Снижение концентрации гемоглобина 13 г/дл у мужчин и 12 г/дл у женщин, хотя бы при однократном определении отмечалось у 11% пациентов на фоне приема кветиапина во всех клинических исследованиях, включая длительную терапию. В краткосрочных плацебо-контролируемых исследованиях снижение концентрации гемоглобина 13 г/дл у мужчин и 12 г/дл у женщин, хотя бы при однократном определении, отмечалось у 8,3% пациентов в группе кветиапина по сравнению с 6,2% в группе плацебо.24. На основании потенциально клинически значимых отклонений от исходно нормального уровня, отмеченных во всех клинических исследованиях. Повышение количества эозинофилов 1 х 109 /л при измерении в любое время.25. На основании потенциально клинически значимых отклонений от исходно нормального уровня, отмеченных во всех клинических исследованиях. Снижение количества лейкоцитов 3 х 109 /л при измерении в любое время.26. Может развиться в момент или вскоре после начала терапии и сопровождаться гипотензией и/или обмороком. Частота установлена на основании сообщений о развитии брадикардии и связанных нежелательных явлений во всех клинических исследованиях кветиапина.27. На основании оценки частоты у пациентов, принимавших участие во всех клинических исследованиях кветиапина, у которых отмечалась тяжелая нейтропения (<:0,5 х 109/л) в сочетании с инфекциями.28. См. раздел "Беременность и лактация". Удлинение интервала QT, желудочковая аритмия, внезапная смерть, остановка сердца и двунаправленная желудочковая тахикардия считаются побочными эффектами, присущими нейролептикам. Частота ЭПС в краткосрочных клинических исследованиях у взрослых пациентов с шизофренией и манией в структуре биполярного расстройства была сопоставима в группе кветиапина и плацебо (пациенты с шизофренией: 7,8% в группе кветиапина и 8,0% в группе плацебо: мании в структуре биполярного расстройства: 11,2% в группе кветиапина и 11,4% в группе плацебо). Частота ЭПС в краткосрочных клинических исследованиях у взрослых пациентов с депрессией в структуре биполярного расстройства в группе кветиапина составила 8,9%, в группе плацебо - 3,8%. При этом частота отдельных симптомов ЭПС (таких как акатизия, экстрапирамидные расстройства, тремор, дискинезия, дистония, беспокойство, непроизвольные сокращения мышц, психомоторное возбуждение и мышечная ригидность), как правило, была низкой и не превышала 4% в каждой из терапевтических групп. В долгосрочных клинических исследованиях кветиапина при шизофрении и биполярном расстройстве у взрослых пациентов частота ЭПС была сопоставима в группах кветиапина и плацебо. На фоне терапии кветиапином может отмечаться дозозависимое снижение концентрации гормонов щитовидной железы. Частота потенциально клинически значимых изменений концентрации гормонов щитовидной железы в краткосрочных клинических исследованиях для общего Т4 составила 3,4% в группе кветиапина и 0,6% в группе плацебо: для свободного Т4 - 0,7% в группе кветиапина против 0,1% в группе плацебо: для общего ТЗ - 0,54% в группе кветиапина против 0,0% в группе плацебо: для свободного ТЗ -0,2% в группе кветиапина против 0,0% в группе плацебо. Изменение концентрации ТТГ отмечено с частотой 3,2% в группе кветиапина и 2,7% в группе плацебо. В краткосрочных клинических исследованиях монотерапии частота потенциально клинически значимых изменений концентрации ТЗ и ТТГ составила 0,0% в группе кветиапина и плацебо: для Т4 и ТТГ составила 0,1% в группе кветиапина против 0,0% в группе плацебо. Данные изменения, как правило, не связаны с клинически выраженным гипотиреозом. Максимальное снижение общего и свободного Т4 зарегистрировано на 6-ой неделе терапии кветиапином, без дальнейшего снижения концентрации гормонов при длительном лечении. Практически во всех случаях концентрация общего и свободного Т4 возвращалась к исходному уровню после прекращения терапии кветиапином, независимо от длительности лечения. Концентрация тироксинсвязывающего глобулина (ТСГ) при измерении у 8 пациентов оставалась неизменной. Передозировка: Сообщалось о летальном исходе при приеме 13,6 г кветиапина у пациента, участвовавшего в клиническом исследовании, а также о летальном исходе после приема 6 г кветиапина при постмаркетинговом изучении препарата. В то же время, описан случай приема кветиапина в дозе, превышающей 30 г, без летального исхода. Имеются сообщения о крайне редких случаях передозировки кветиапина, приводивших к увеличению QTC интервала, смерти или коме.У пациентов с тяжелыми сердечно-сосудистыми заболеваниями в анамнезе риск развития побочных эффектов при передозировке может увеличиваться (см. раздел "Особые указания"). Симптомы, отмеченные при передозировке, в основном, были следствием усиления известных фармакологических эффектов препарата, таких как сонливость и седация, тахикардия и снижение артериального давления. Лечение. Специфических антидотов к кветиапину нет. В случаях тяжелой интоксикации следует помнить о возможности передозировки несколькими лекарственными препаратами. Рекомендуется проводить мероприятия, направленные на поддержание функции дыхания и сердечно-сосудистой системы, обеспечение адекватной оксигенации и вентиляции. Опубликованы сообщения о разрешении тяжелых нежелательных эффектов со стороны центральной нервной системы, в том числе комы и делирия, после внутривенного введения физостигмина (в дозе 1-2 мг) под постоянным контролем ЭКГ.В случае возникновения рефрактерной гипотензии при передозировке кветиапина лечение следует осуществлять путем внутривенного введения жидкости и/или симпатомиметических препаратов (не следует назначать эпинефрин и дофамин, поскольку стимуляция β-адренорецепторов может вызвать усиление гипотензии на фоне блокады α-адренорецепторов кветиапином). Промывание желудка (после интубации, если пациент без сознания) и назначение активированного угля и слабительныхсредств может способствовать выведению неабсорбированного кветиапина, однако эффективность этих мер не изучена. Пристальное медицинское наблюдение должно продолжаться до улучшения состояния пациента. Взаимодействие с другими ЛС: Следует соблюдать осторожность при комбинированном применении кветиапина с другими препаратами, воздействующими на центральную нервную систему, а также с алкоголем. Изофермент цитохрома Р450 (CYP) ЗА4 является основным изоферментом, отвечающим за метаболизм кветиапина, осуществляющийся через систему цитохрома Р450. У здоровых добровольцев совместное применение кветиапина (в дозе 25 мг) с кетоконазолом, ингибитором изофермента CYP3A4, приводило к увеличению площади под кривой "концентрация- время" (AUC) кветиапина в 5-8 раз. Поэтому совместное применение кветиапина и ингибиторов изофермента CYP3A4 противопоказано. Также не рекомендовано принимать кветиапин вместе с грейпфрутовым соком.В фармакокинетическом исследовании с многократным приемом кветиапина до или одновременно с приемом карбамазепина приводило к значительному повышению клиренса кветиапина и, соответственно, уменьшению AUC, в среднем, на 13%, по сравнению с приемом кветиапина без карбамазепина. У некоторых пациентов снижение AUC было еще более выраженным. Такое взаимодействие сопровождается снижением концентрации кветиапина в плазме и может снижать эффективность терапии препаратом Сероквель. Совместное применение препарата Сероквель с фенитоином, другим индуктором микросомальных ферментов печени, сопровождалось еще более выраженным (примерно на 450%) повышением клиренса кветиапина. Применение препарата Сероквель пациентами, получающими индукторы микросомальных ферментов печени, возможно лишь в том случае, если ожидаемая польза от терапии препаратом Сероквель превосходит риск, связанный с отменой препарата-индуктора микросомальных ферментов печени. Изменение дозы препаратов-индукторов микросомальных ферментов печени должно быть постепенным. При необходимости, возможно их замещение препаратами, не индуцирующими микросомальные ферменты печени (например, препаратами вальпроевой кислоты). Фармакокинетика кветиапина существенно не изменялась при одновременном применении антидепрессанта имипрамина (ингибитор изофермента CYP2D6) или флуоксетина (ингибитор изоферментов CYP3A4 и CYP2D6). Фармакокинетика кветиапина существенно не изменяется при одновременном применении с антипсихотическими лекарственными средствами рисперидоном или галоперидолом. Однако одновременный прием препарата Сероквель и тиоридазина приводил к повышению клиренса кветиапина примерно на 70%. Фармакокинетика кветиапина существенно не изменяется при одновременном применении циметидина. При однократном приеме 2 мг лоразепама на фоне приема кветиапина в дозе 250 мг 2 раза в сутки клиренс лоразепама снижается примерно на 20%. Фармакокинетика препаратов лития не изменяется при одновременном применении препарата Сероквель. Не отмечено клинически значимых изменений фармакокинетики вальпроевой кислоты и кветиапина при совместном применении вальпроата семинатрия и препарата Сероквель (кветиапина). Фармакокинетические исследования по изучению взаимодействия препарата Сероквель с препаратами, применяемыми при сердечно-сосудистых заболеваниях, не проводились. Следует соблюдать осторожность при комбинированном применении кветиапина и препаратов, способных вызвать нарушение электролитного баланса и удлинение интервала QTc. Кветиапин не вызывал индукции микросомальных ферментов печени, участвующих в метаболизме феназона. У пациентов, принимавших кветиапин, были отмечены ложноположительные результаты скрининг-тестов на выявление метадона и трициклических антидепрессантов методом иммуноферментного анализа. Для подтверждения результатов скрининга рекомендуется проведение хроматографического исследования. Фармакологическое действие и фармакокинетика Механизм действия. Кветиапин является атипичным антипсихотическим препаратом. Кветиапин и его активный метаболит N-дезалкилкветиапин (норкветиапин) взаимодействуют с широким спектром нейтротрансмиттерных рецепторов головного мозга. Кветиапин и N-дезалкилкветиапин проявляют высокое сродство к 5HT2-серотониновым рецепторам и D1 - и D2-дофаминовым рецепторам головного мозга. Антагонизм к указанным рецепторам в сочетании с более высокой селективностью к 5HT2-серотониновым рецепторам, чем к D2- дофаминовым рецепторам, обуславливает клинические антипсихотические свойства препарата Сероквель и низкую частоту развития экстрапирамидных побочных эффектов. Кветиапин не обладает сродством к переносчику норадреналина и обладает низким сродством к 5HT1A-серотониновому рецептору, в то время как N-дезалкилкветиапин проявляет высокое сродство к обоим. Ингибирование переносчика норадреналина и частичный агонизм в отношении 5HT1A-серотониновых рецепторов, проявляемые N- дезалкилкветиапином, могут обуславливать антидепрессивное действие препарата Сероквель. Кветиапин и N-дезалкилкветиапин обладают высоким сродством к гистаминовым и α 1-адренорецепторам и умеренным сродством по отношению к α 2-адренорецепторам. Кроме того кветиапин не обладает или обладает низким сродством к мускариновым рецепторам, в то время как N-дезалкилкветиапин проявляет умеренное или высокое сродство к нескольким подтипам мускариновых рецепторов.В стандартных тестах кветиапин проявляет антипсихотическую активность. Удельный вклад метаболита N-дезалкилкветиапина в фармакологическую активность кветиапина не установлен. Результаты изучения экстрапирамидных симптомов (ЭПС) у животных выявили, что кветиапин вызывает слабую каталепсию в дозах, эффективно блокирующих D2 рецепторы. Кветиапин вызывает селективное уменьшение активности мезолимбических А10-дофаминергических нейронов в сравнении с А9-нигростриатными нейронами, вовлеченными в моторную функцию. Эффективность. Препарат Сероквель эффективен в отношении как позитивных, так и негативных симптомов шизофрении. Препарат Сероквель эффективен в качестве монотерапии при маниакальных эпизодах от умеренной до выраженной степени тяжести. Данные о длительном применении препарата Сероквель для профилактики последующих маниакальных и депрессивных эпизодов отсутствуют. Данные по применению препарата Сероквель в комбинации с вальпроатом семинатрия или препаратами лития при маниакальных эпизодах от умеренной до выраженной степени тяжести ограничены, однако данная комбинированная терапия, в целом, хорошо переносилась. Кроме того, препарат Сероквель в дозе 300 мг и 600 мг эффективен у больных с биполярным расстройством I и II типа от умеренной до выраженной степени тяжести. При этом эффективность препарата Сероквель при приеме в дозе 300 мг и 600 мг в сутки сопоставима. Препарат Сероквель эффективен у пациентов с шизофренией и манией при приеме препарата 2 раза в сутки, несмотря на то, что период полувыведения кветиапина составляет около 7 часов. Воздействие кветиапина на 5HT2- и D2- рецепторы продолжается до 12 часов после приема препарата. При приеме препарата Сероквель с титрованием дозы при шизофрении частота ЭПС и сопутствующего применения м-холиноблокаторов была сопоставима с таковой при приеме плацебо. При назначении препарата Сероквель в фиксированных дозах от 75 до 750 мг/сут. пациентам с шизофренией частота возникновения ЭПС и необходимость сопутствующего применения м-холиноблокаторов не увеличивались. При применении препарата Сероквель в дозах до 800 мг/сут. для лечения маниакальных эпизодов от умеренной до выраженной степени тяжести как в виде монотерапии, так и в комбинации с препаратами лития или вальпроатом семинатрия, частота ЭПС и сопутствующего применения м-холиноблокаторов была сопоставима с таковой при приеме плацебо. Фармакокинетика: При пероральном применении кветиапин хорошо всасывается из желудочно-кишечного тракта и активно метаболизируется в печени. Прием пищи существенно не влияет на биодоступность кветиапина. Приблизительно 83% кветиапина связывается с белками плазмы крови. Равновесная молярная концентрация активного метаболита N-дезалкил кветиапина составляет 35% от таковой кветиапина. Период полувыведения кветиапина и N-дезалкил кветиапина составляет около 7 и 12 часов, соответственно. Фармакокинетика кветиапина и N-дезалкил кветиапина линейная, различий фармакокинетических показателей у мужчин и женщин не наблюдается. Средний клиренс кветиапина у пожилых пациентов на 30-50% меньше, чем у пациентов в возрасте от 18 до 65 лет. Средний плазменный клиренс кветиапина снижается приблизительно на 25% у пациентов с тяжелой почечной недостаточностью (клиренс креатинина менее 30 мл/мин/1,73м 2), но индивидуальные показатели клиренса находятся в пределах значений, выявленных у здоровых добровольцев. У пациентов с печеночной недостаточностью (компенсированный алкогольный цирроз) средний плазменный клиренс кветиапина снижен приблизительно на 25%. Поскольку кветиапин интенсивно метаболизируется в печени, у пациентов с печеночной недостаточностью возможно повышение плазменной концентрации кветиапина, что требует корректировки дозы.В среднем менее 5% молярной дозы фракции свободного кветиапина и N-дезалкил кветиапина плазмы выводятся с мочой. Приблизительно 73% кветиапина выводится с мочой и 21% с фекалиями. Менее 5% кветиапина не подвергается метаболизму и выводится в неизменённом виде почками или с фекалиями. Установлено, что CYP3A4 является ключевым изоферментом метаболизма кветиапина, опосредованного цитохромом Р450. N-дезалкил кветиапин образуется с участием изофермента CYP3A4. Кветиапин и некоторые его метаболиты (включая N-дезалкил кветиапин) обладают слабой ингибирующей активностью по отношению к изоферментам цитохрома Р450 1А2, 2С9, 2С19, 2D6 и ЗА4, но только при концентрации, в 5-50 раз, превышающей концентрации, наблюдаемые при обычно используемой эффективной дозировке 300-800 мг/сут. Основываясь на результатах in vitro, не следует ожидать, что одновременное назначение кветиапина с другими препаратами приведет к клинически выраженному ингибированию метаболизма других лекарственных средств, опосредованного цитохромом Р450. Особые указания Дети и подростки (в возрасте от 10 до 17 лет)Препарат Сероквель не показан для применения у детей и подростков в возрасте до 18 лет в связи с недостаточностью данных по применению в этой возрастной группе. По результатам клинических исследований кветиапина некоторые побочные эффекты (повышение аппетита, повышение концентрации пролактина в сыворотке крови, рвота, насморк и обмороки) у детей и подростков наблюдали с большей частотой, чем у взрослых пациентов. Некоторые побочные эффекты (ЭПС) у детей и подростков могут иметь разные последствия по сравнению со взрослыми пациентами. Также отмечено повышение артериального давления, не наблюдавшееся у взрослых пациентов. У детей и подростков также наблюдали изменение функции щитовидной железы. Влияние на рост, половое созревание, умственное развитие и поведенческие реакции при длительном применении (более 26 недель) кветиапина не изучалось. В плацебо-контролируемых исследованиях у детей и подростков с шизофренией и манией в структуре биполярного расстройства частота развития ЭПС была выше при применении кветиапина по сравнению с плацебо. Суицид/суицидальные мысли или клиническое ухудшение. Депрессия при биполярном расстройстве связана с повышенным риском возникновения суицидальных мыслей, самоповреждения и суицида (событий, связанных с суицидом). Данный риск сохраняется до момента наступления выраженной ремиссии. Ввиду того, что до улучшения состояния пациента с начала лечения может пройти несколько недель или больше, пациенты должны находиться под пристальным медицинским наблюдением до наступления улучшения. По данным общепринятого клинического опыта, риск суицида может повыситься на ранних стадиях наступления ремиссии. Следует предупреждать пациентов (особенно относящихся к группе повышенного риска суицида) и их попечителей о необходимости контроля клинического ухудшения, суицидального поведения или мыслей, необычного изменения в поведении и необходимости немедленно обратиться к врачу в случае их появления. По данным клинических исследований у пациентов с депрессией при биполярном расстройстве риск развития событий, связанных с суицидом, составил 3,0% (7/233) для кветиапина и 0% (0/120) для плацебо у пациентов в возрасте 18-24 года: 1,8% (19/1616) для кветиапина и 1,8% (11/622) для плацебо для пациентов старше 25 лет. Другие психические расстройства, для терапии которых назначается кветиапин, также связаны с повышенным риском событий, связанных с суицидом. Кроме того, такие состояния могут быть коморбидными с депрессивным эпизодом. Таким образом, меры предосторожности, применяемые при терапии пациентов с депрессивным эпизодом, должны приниматься и при лечении пациентов с другими психическими расстройствами. При резком прекращении терапии кветиапином следует принимать во внимание потенциальный риск развития событий, связанных с суицидом. Пациенты с суицидальными событиями в анамнезе, а также пациенты, отчетливо высказывающие суицидальные мысли перед началом терапии, относятся к группе повышенного риска суицидальных намерений и суицидальных попыток и должны тщательно наблюдаться в процессе лечения. Проведенный FDA (Администрацией по пищевым продуктам и лекарственным средствам, США) метаанализ плацебо-контролируемых исследований антидепрессантов, обобщающий данные примерно 4400 детей и подростков и 7700 взрослых пациентов с психическими расстройствами, выявил повышенный риск суицидального поведения на фоне антидепрессантов по сравнению с плацебо у детей, подростков и взрослых пациентов в возрасте до 25 лет. Данный метаанализ не включает исследования, где использовался кветиапин (см. раздел "Фармакодинамика"). По данным кратковременных плацебо-контролируемых исследований по всем показаниям и во всех возрастных группах частота событий, связанных с суицидом, составила 0,8% как для кветиапина (76/9327), так и для плацебо (37/4845).В этих исследованиях у пациентов с шизофренией риск развития событий, связанных с суицидом, составил 1,4% (3/212) для кветиапина и 1,6% (1/62) для плацебо у пациентов в возрасте 18-24 года: 0,8% (13/1663) для кветиапина и 1,1% (5/463) для плацебо у пациентов старше 25 лет: 1,4% (2/147) для кветиапина и 1,3% (1/75) для плацебо у пациентов в возрасте до 18 лет.У пациентов с манией при биполярном расстройстве риск развития событий, связанных с суицидом, составил 0% (0/60) для кветиапина и 0% (0/58) для плацебо у пациентов в возрасте 18-24 года: 1,2% (6/496) для кветиапина и 1,2% (6/503) для плацебо у пациентов старше 25 лет: 1,0% (2/193) для кветиапина и 0% (0/90) для плацебо у пациентов в возрасте до 18 лет. Сонливость. Во время терапии препаратом Сероквель может отмечаться сонливость и связанные с ней симптомы, например, седация (см. раздел "Побочное действие"), В клинических исследованиях с участием пациентов с депрессией в структуре биполярного расстройства, сонливость, как правило, развивалась в течение первых трех дней терапии. Выраженность этого побочного эффекта, в основном, была незначительной или умеренной. При развитии выраженной сонливости пациентам с депрессией в структуре биполярного расстройства могут потребоваться более частые визиты к врачу в течение 2 недель с момента возникновения сонливости или до уменьшения выраженности симптомов. В некоторых случаях может потребоваться прекращение терапии препаратом Сероквель. Пациенты с сердечно-сосудистыми заболеваниями. Следует соблюдать осторожность при назначении кветиапина пациентам с сердечно-сосудистыми и цереброваскулярными заболеваниями, и другими состояниями, предрасполагающими к гипотензии. На фоне терапии кветиапином может возникать ортостатическая гипотензия, особенно во время титрования дозы в начале терапии. Ортостатическая гипотензия и связанное с ней головокружение могут повышать риск случайной травмы (падения), особенно у пациентов пожилого возраста. Пациентам следует соблюдать осторожность до тех пор, пока они не адаптируются к данным потенциальным побочным эффектам. При возникновении ортостатической гипотензии может потребоваться снижение дозы или более медленное ее титрование. Судорожные припадки. Не выявлено различий в частоте развития судорог у пациентов, принимавших кветиапин или плацебо. Однако, как и при терапии другими антипсихотическими лекарственными средствами, рекомендуется соблюдать осторожность при лечении пациентов с наличием судорожных приступов в анамнезе (см. раздел "Побочное действие"). Экстрапирамидные симптомы. Отмечено увеличение частоты возникновения ЭПС у пациентов с депрессией в структуре биполярного расстройства при приёме кветиапина по поводу депрессивных эпизодов по сравнению с плацебо (см. раздел "Побочное действие"). На фоне приема кветиапина может возникать акатизия, которая характеризуется неприятным чувством двигательного беспокойства и потребностью двигаться, и проявляется неспособностью пациента сидеть или стоять без движения. При возникновении подобных симптомов не следует увеличивать дозу кветиапина. Поздняя дискинезияВ случае развития симптомов поздней дискинезии рекомендуется снизить дозу препарата или постепенно его отменить (см. раздел "Побочное действие"). Симптомы поздней дискинезии могут усиливаться или даже возникать после прекращения приема препарата. Злокачественный нейролептический синдром. На фоне приема антипсихотических препаратов, в том числе, кветиапина, может развиваться злокачественный нейролептический синдром (см. раздел "Побочное действие"). Клинические проявления синдрома включают в себя гипертермию, измененный ментальный статус, мышечную ригидность, лабильность вегетативной нервной системы, увеличение активности креатинфосфокиназы. В таких случаях необходимо отменить кветиапин и провести соответствующее лечение. Тяжелая нейтропения и агранулоцитозВ

Модель:
RUR 889
Показания Атопический дерматит (экзема). Препарат показан для кратковременного и длительного лечения атопического дерматита у взрослых, подростков и детей (от 3 месяцев). Противопоказания Противопоказания Повышенная чувствительность к пимекролимусу или любым компонентам препарата. Детский возраст до 3 месяцев (т. к. безопасность и эффективность применения крема Элидел у детей младше 3 месяцев не изучалась). Крем Элидел не следует наносить на участки кожи, пораженные острой вирусной, бактериальной или грибковой и инфекцией. С осторожностью: Данных по безопасности применения крема Элидел у пациентов с синдромом Нетертона и генерализованной эритродермией нет. Учитывая возможный риск повышения системной абсорбции препарата, крем Элидел не рекомендуется применять у больных с синдромом Нетертона или при тяжелых формах воспаления или поражения кожи (например, при эритродермии). Так как эффективность и безопасность использования крема Элидел у пациентов с ослабленным иммунитетом не изучались, препарат не рекомендуется применять у данной категории больных. Данные по безопасности длительного применения крема Элидел отсутствуют. Поскольку влияние длительного применения препарата на иммунную защиту кожи и частоту развития злокачественных новообразований не изучено, крем Элидел не следует наносить на поврежденные участки кожного покрова с возможным озлокачествлением или диспластическими изменениями.В случае бактериального или грибкового поражения кожи применение крема Элидел на пораженных участках возможно только после излечения инфекции. Беременность Беременность. Данных по применению 1% крема Элидел у беременных женщин нет. В экспериментальных исследованиях при местном применении препарата прямого или опосредованного повреждающего действия Элидела на течение беременности, развитие эмбриона/плода, течение родов и постнатальное развитие потомства не выявлено. Следует соблюдать осторожность при назначении 1% крема Элидел беременным женщинам. Однако, учитывая минимальную степень всасывания пимекролимуса при местном применении, потенциальный риск у человека считается незначительным. Лактация. Выделение препарата с грудным молоком после местного применения на экспериментальных моделях не изучалось. Данных по содержанию пимекролимуса в грудном молоке у кормящих женщин нет. Поскольку многие препараты выделяются с грудным молоком, следует соблюдать осторожность при назначении 1% крема Элидел кормящим женщинам. Однако учитывая минимальную степень системного всасывания пимекролимуса при местном применении, потенциальный риск для человека считается незначительным. Кормящие женщины не должны наносить 1% крем Элидел на область молочных желез. Применение и дозы Лечение следует начинать при первых проявлениях заболевания для предотвращения резкого развития его обострения.1% крем Элидел 2 раза в день наносят тонким слоем на пораженную поверхность и осторожно втирают до полного впитывания.1% крем Элидел можно наносить на кожу любых частей тела, включая голову, лицо, шею, а также на области опрелостей. Крем Элидел следует применять 2 раза в сутки, до полного исчезновения симптомов заболевания. При сохранении выраженности симптомов через 6 недель применения препарата необходимо провести повторное обследование пациента для подтверждения диагноза атопического дерматита. После прекращения лечения, во избежание последующих обострений, при первых признаках рецидива атопического дерматита терапию следует возобновить. Смягчающие средства можно применять сразу после нанесения 1% крема Элидел. Однако после водных процедур смягчающие средства следует применять перед нанесением крема Элидел. Учитывая очень незначительное системное всасывание пимекролимуса, ограничений общей суточной дозы наносимого препарата, площади обрабатываемой поверхности кожи или длительности лечения не существует. Побочные эффекты и передозировка Побочные эффекты: Применение 1% крема Элидел может вызывать незначительные преходящие реакции в месте нанесения, такие как чувство тепла и/или жжения. При значительной выраженности этих реакций пациентам следует проконсультироваться у врача. Наиболее частые нежелательные явления - реакции в месте нанесения препарата отмечались у 19% больных, получавших лечение 1% кремом Элидел, и у 16% пациентов из контрольной группы. Эти реакции в основном возникали на раннем этапе лечения, были незначительными/умеренными и непродолжительными. Приведенные ниже нежелательные явления перечислены по частоте, начиная с самых частых. Частоту встречаемости нежелательных реакций оценивали следующим образом: возникающие "очень часто" - >:1/10, "часто" - >:1/100<:1/10, " иногда" - >:1/1000<:1/100, " редко" - >:1/10 000<:1/1000, "очень редко" - <:1/10 000, включая отдельные сообщения. Очень часто: жжение в месте нанесения крема. Часто: местные реакции (раздражение, зуд и покраснение кожи), кожные инфекции (фолликулит). Иногда: нагноение: ухудшение заболевания: простой герпес: дерматит, обусловленный вирусом простого герпеса (герпетическая экзема): контагиозный моллюск, местные реакции, такие как сыпь, боль, парестезии, шелушение, сухость, отечность, кожные папилломы, фурункулы. Представленные ниже нежелательные реакции отмечались при постмаркетинговом применении препарата (оценка частоты по количеству случаев развития НЯ в неустановленной популяции). Со стороны иммунной системы: очень редко - анафилактические реакции. Со стороны обмена веществ (метаболические нарушения): редко - непереносимость алкоголя. Со стороны кожи и ее придатков: редко- аллергические реакции (сыпь, крапивница, ангионевротический отек): изменения цвета кожи (гипопигментация, гиперпигментация).В большинстве случаев сразу же после приема алкоголя развивалось покраснение лица, сыпь, жжение, зуд или припухлость. При применении крема Элидел в редких случаях отмечалось развитие злокачественных новообразований, включая кожные и другие типы лимфом, рак кожи. Причинно-следственная связь между данными нежелательными явлениями и применением препарата не установлена. Передозировка: Случаи передозировки или случайного употребления 1% крема Элидел внутрь не наблюдались. Взаимодействие с другими ЛС: Потенциальные взаимодействия 1% крема Элидел с другими препаратами не изучались. Учитывая, что системная абсорбция пимекролимуса очень незначительна, какие-либо взаимодействия крема Элидел с препаратами для системного применения маловероятны. При применении крема Элидел у детей в возрасте 2-х лет и старше препарат не оказывал влияния на эффективность вакцинации. Не рекомендуется нанесение крема на области введения вакцины до полного исчезновения местных проявлений поствакцинальной реакции. Несовместимость. Поскольку исследования совместимости не проводились, не рекомендуется применять препарат совместно с другими местными средствами. Фармакологическое действие и фармакокинетика Пимекролимус является производным макролактама аскомицина и обладает противоспалительным действием. Пимекролимус селективно ингибирует продукцию и высвобождение цитокинов и медиаторов воспаления из Т-лимфоцитов и тучных клеток. Пимекролимус специфично связывается с цитозольным рецептором макрофилином-12 и ингибирует кальцийзависимую фосфатазу -кальциневрин. Ингибирование кальциневрина приводит к подавлению пролиферации Т-лимфоцитов и предотвращает транскрипцию и выработку в Т-хелперах 1 и 2 типа ранних цитокинов, таких как интерлейкин-2, интерферон-ϒ, интерлейкин-4, интерлейкин-5, интерлейкин-10, фактор некроза опухоли-α и гранулоцитарно-макрофагальный колониестимулирующий фактор. Пимекролимус и такролимус в равной степени подавляют вторичный иммунный ответ в изолированных клеточных колониях Т-хелперов кожи, полученных у больных с атопическим дерматитом. In vitro пимекролимус также предотвращает антиген/IgE-опосредованное высвобождение цитокинов и медиаторов воспаления из тучных клеток. Пимекролимус не влияет на рост кератиноцитов, фибробластов и эндотелиальных клеток и, в отличие от кортикостероидов, оказывает селективное действие на клетки иммунной системы и не вызывает нарушений функции, жизнеспособности, процессов дифференциации, созревания клеток Лангерганса мышей и дендритных клеток моноритарного происхождения у человека. Препарат не оказывает влияния на дифференцировку "наивных" Т-лимфоцитов в Т-эффекторные клетки под действием клеток Лангерганса и дендритных клеток, являющуюся одним из основных механизмов специфического иммунного ответа. На экспериментальных моделях кожного воспаления была продемонстрирована высокая противовоспалительная активность пимекролимуса после его местного и системного применения. При местном применении на экспериментальных моделях аллергического контактного дерматита (АКД) пимекролимус сопоставим поэффективности с высокоактивными кортикостероидами: клобетазолом- 17-пропионатом и флутиказоном, ингибирует воспалительную реакцию в ответ на воздействие кожных раздражителей, не вызывая изменения консистенции, уплотнения и атрофии кожи. Кроме того, при местном и пероральном применении наэкспериментальных моделями АКД острого течения пимекролимус эффективно уменьшает кожное воспаление, зуд и выраженность гистопатологических изменений. При местном применении степень проникновения в кожу такролимуса и пимекролимус одинаково хорошая. Однако способность пимекролимуса проникать через кожу меньше, чем у такролимуса и глюкокортикостероидов. Таким образом, пимекролимус обладает селективным действием на кожу. Уникальность механизма действия пимекролимуса состоит в сочетании селективного противовоспалительного действия на кожу с незначительным влиянием на системный иммунный ответ. При применении в течение 6 недель у детей от 3-х месяцев до 17 лет пимекролимус эффективно уменьшает зуд и кожное воспаление (эритему, инфильтрацию, экскориацию и лихенизацию). При длительном применении в течение 12 месяцев пимекролимус эффективно снижает частоту возникновения внезапных обострений АКД, не вызывая атрофии, раздражении и повышения гиперчувствительности кожи и не обладая фототоксическим или фотосенсибилизирующим действием. Фармакокинетика: Взрослые. Концентрацию пимекролимуса в крови определяли у 12 взрослых пациентов с атопическим дерматитом (экземой) при поражении 15-59% площади поверхности тела, получавших лечение 1% кремом Элидел 2 раза в сутки на протяжении 3 недель. В 77,5% наблюдений концентрация пимекролимуса в крови была ниже 0.5 нг/мл (минимальной определяемой концентрации), а в 99.8% - ниже 1 нг/мл. Максимальное значение концентрации пимекролимуса в крови, зарегистрированное у одного пациента, составило 1.4 нг/мл.У 98% из 40 взрослых больных с исходным поражением 14-62% площади поверхности тела после 1 года лечения Элиделом концентрации пимекролимуса в крови оставались на низком уровне и в большинстве случаев были ниже минимальной определяемой концентрации. Максимальное значение концентрации, составившее 0.8 нг/мл, было зарегистрировано после 6 недель лечения только у двух пациентов. Ни у одного из пациентов не было отмечено нарастания концентрации на протяжении 12 месяцев лечения. За 3-недельный период лечения Элиделом 2 раза в сутки у 13 взрослых пациентов с дерматитом кистей (при применении крема на область ладоней и тыльную сторону кистей и бинтованием на ночь) максимальное зарегистрированное значение концентрации пимекролимуса в крови составило 0.91 нг/мл.У 8 пациентов с содержанием пимекролимуса в крови выше минимальной определяемой концентрации значение AUC составляло от 2.5-11.4 нг/мл. Дети. Фармакокинетические исследования пимекролимуса были проведены у 58 детей в возрасте от 3 до 14 лет с атопическим дерматитом (экземой) при поражении 10-92% площади поверхности тела, получавших лечение 1% кремом Элидел 2 раза в сутки на протяжении 3 недель. Пятеро детей получали лечение в течение 1 года по мере необходимости. Концентрации пимекролимуса в крови были на стабильно низком уровне, независимо от площади поражения кожных покровов и длительности терапии, и находились в том же диапазоне значений, что и у взрослых пациентов, получавших терапию Элиделом в тех же дозах. В 97% случаев концентрации пимекролимуса в крови были ниже 2 нг/мл, а в 60% - ниже 0.5 нг/мл (минимальной определяемой концентрации). Максимальное значение концентрации пимекролимуса, зарегистрированное у двух пациентов в возрасте 8 месяцев и 14 лет, составило 2.0 нг/мл. Среди детей самого младшего возраста (от 3 до 23 месяцев) максимальное значение концентрации пимекролимуса, зарегистрированное у одного пациента, составило 2.6 нг/мл.У пяти детей, получавших лечение Элиделом в течение 1 года, концентрации пимекролимуса находились на стабильно низком уровне. Максимальное значение, зарегистрированное у одного ребенка, составило 1.94 нг/мл. На протяжении всего периода лечения рост концентраций препарата не наблюдался ни у одного из пациентов.У 8 детей в возрасте от 2 до 14 лет с содержанием пимекролимуса в крови выше минимальной определяемой концентрации при трехкратном измерении значение AUC составляло от 5.4-18.8 нг/мл. Значения AUC у пациентов с площадью поражения кожных покровов менее 40 % и более 40% были сопоставимы.В исследованиях in vitro связывание пимекролимуса с белками плазмы (в основном с различными липопротеинами) составило 99,6%. Поскольку при местном применении концентрации пимекролимуса в крови очень низкие, определение параметров метаболизма не представляется возможным. Применение у пожилых больных. Атопический дерматит (экзема) редко наблюдается у больных в возрасте от 65 лет и старше. Количество пациентов такого возраста в клинических исследованиях крема Элидел было недостаточным для того, чтобы выявить какие-либо различия в эффективности лечения по сравнению с молодыми пациентами. Применение у детей. Рекомендации по дозированию для младенцев (3-23 месяца), детей (2-11 лет) и подростков (12-17 лет) не отличаются от рекомендаций для взрослых пациентов. Особые указания При лечении ингибиторами кальциневрина местного применения, включая Элидел, в редких случаях отмечалось развитие злокачественных новообразований (например, кожных опухолей и лимфом). Причинно-следственная связь между данными нежелательными явлениями и применением препарата не установлена.В клинических исследованиях при применении крема Элидел у 0,9% пациентов (14 из 1544) отмечалось развитие лимфоаденопатии. Обычно лимфоаденопатия была обусловлена инфекционными заболеваниями и исчезала после проведения курса соответствующей антибиотикотерапии. У всех пациентов или удавалось выявить причину развития лимфоаденопатии или отмечалось исчезновение данного нежелательного явления. У больных, получающих лечение Элиделом, при развитии лимфоаденопатии необходимо установить этиологию процесса и обеспечить наблюдение за пациентами до полного исчезновения данного нежелательного явления. При неустановленной этиологии лимфоаденопатии или наличие у пациента острого мононуклеозного воспаления препарат следует отменить. При лечении кремом Элидел пациентам рекомендуется уменьшить до минимума искусственную или естественную инсоляцию кожи или полностью избегать ультрафиолетового облучения. Возможное влияние применения препарата при поражениях кожи, вызванных ультрафиолетовым облучением, неизвестно. Влияние на способность управлять транспортными средствами: Влияние применения крема Элидел на способность управлять автотранспортом или работать с механизмами не установлено. Условия хранения и отпуска из аптек Условия хранения:Хранить при температуре не выше 25°С, не замораживать. Препарат следует хранить в недоступном для детей месте. Отпуск из аптек: По рецепту Регистрационные данные Торговое название Элидел Международное непатентованное название:Пимекролимус. Форма выпуска:Крем для наружного применения . Состав: 1 г крема содержит 10 мг пимекролимуса, а также вспомогательные вещества: натрия гидроксид 0,20 мг, лимонная кислота безводная 0,50 мг, бензиловый спирт 10,00 мг, натрия цетостеарилсульфат 10,00 мг, моно и диглицериды 20,00 мг, цетиловый спирт 40,00 мг, стеариновый спирт 40,00 мг, пропиленгликоль 50,00 мг, олеиловый спирт 100,00 мг, триглицериды среднецепочечные 150,00 мг, вода очищенная 569,30 мг. АТХ: Регистрация: П N014689/01 Фармгруппа: противовоспалительное средство для местного применения. Дата регистрации: 01.10.2007. Окончание регстрации: . Описание:Гомогенный крем от белого до почти белого цвета. Упаковка:Крем для наружного применения 1% 15 г, 30 г и 100 г в алюминиевой тубе. 1 туба с инструкцией по применению в картонной пачке. Срок годности:2 года. Препарат не следует использовать после истечения срока годности. После первого вскрытия использовать в течении 1 года. Владелец рег.удостоверения:Меда Фарма ГмбХ и Ко.КГ Производитель:MEDA PHARMA, GmbH &: Co.KG : NOVARTIS PHARMA PRODUCTIONS, GmbH. Представительство

Модель:
RUR 1465
Показания Атопический дерматит (экзема). Препарат показан для кратковременного и длительного лечения атопического дерматита у взрослых, подростков и детей (от 3 месяцев). Противопоказания Противопоказания Повышенная чувствительность к пимекролимусу или любым компонентам препарата. Детский возраст до 3 месяцев (т. к. безопасность и эффективность применения крема Элидел у детей младше 3 месяцев не изучалась). Крем Элидел не следует наносить на участки кожи, пораженные острой вирусной, бактериальной или грибковой и инфекцией. С осторожностью: Данных по безопасности применения крема Элидел у пациентов с синдромом Нетертона и генерализованной эритродермией нет. Учитывая возможный риск повышения системной абсорбции препарата, крем Элидел не рекомендуется применять у больных с синдромом Нетертона или при тяжелых формах воспаления или поражения кожи (например, при эритродермии). Так как эффективность и безопасность использования крема Элидел у пациентов с ослабленным иммунитетом не изучались, препарат не рекомендуется применять у данной категории больных. Данные по безопасности длительного применения крема Элидел отсутствуют. Поскольку влияние длительного применения препарата на иммунную защиту кожи и частоту развития злокачественных новообразований не изучено, крем Элидел не следует наносить на поврежденные участки кожного покрова с возможным озлокачествлением или диспластическими изменениями.В случае бактериального или грибкового поражения кожи применение крема Элидел на пораженных участках возможно только после излечения инфекции. Беременность Беременность. Данных по применению 1% крема Элидел у беременных женщин нет. В экспериментальных исследованиях при местном применении препарата прямого или опосредованного повреждающего действия Элидела на течение беременности, развитие эмбриона/плода, течение родов и постнатальное развитие потомства не выявлено. Следует соблюдать осторожность при назначении 1% крема Элидел беременным женщинам. Однако, учитывая минимальную степень всасывания пимекролимуса при местном применении, потенциальный риск у человека считается незначительным. Лактация. Выделение препарата с грудным молоком после местного применения на экспериментальных моделях не изучалось. Данных по содержанию пимекролимуса в грудном молоке у кормящих женщин нет. Поскольку многие препараты выделяются с грудным молоком, следует соблюдать осторожность при назначении 1% крема Элидел кормящим женщинам. Однако учитывая минимальную степень системного всасывания пимекролимуса при местном применении, потенциальный риск для человека считается незначительным. Кормящие женщины не должны наносить 1% крем Элидел на область молочных желез. Применение и дозы Лечение следует начинать при первых проявлениях заболевания для предотвращения резкого развития его обострения.1% крем Элидел 2 раза в день наносят тонким слоем на пораженную поверхность и осторожно втирают до полного впитывания.1% крем Элидел можно наносить на кожу любых частей тела, включая голову, лицо, шею, а также на области опрелостей. Крем Элидел следует применять 2 раза в сутки, до полного исчезновения симптомов заболевания. При сохранении выраженности симптомов через 6 недель применения препарата необходимо провести повторное обследование пациента для подтверждения диагноза атопического дерматита. После прекращения лечения, во избежание последующих обострений, при первых признаках рецидива атопического дерматита терапию следует возобновить. Смягчающие средства можно применять сразу после нанесения 1% крема Элидел. Однако после водных процедур смягчающие средства следует применять перед нанесением крема Элидел. Учитывая очень незначительное системное всасывание пимекролимуса, ограничений общей суточной дозы наносимого препарата, площади обрабатываемой поверхности кожи или длительности лечения не существует. Побочные эффекты и передозировка Побочные эффекты: Применение 1% крема Элидел может вызывать незначительные преходящие реакции в месте нанесения, такие как чувство тепла и/или жжения. При значительной выраженности этих реакций пациентам следует проконсультироваться у врача. Наиболее частые нежелательные явления - реакции в месте нанесения препарата отмечались у 19% больных, получавших лечение 1% кремом Элидел, и у 16% пациентов из контрольной группы. Эти реакции в основном возникали на раннем этапе лечения, были незначительными/умеренными и непродолжительными. Приведенные ниже нежелательные явления перечислены по частоте, начиная с самых частых. Частоту встречаемости нежелательных реакций оценивали следующим образом: возникающие "очень часто" - >:1/10, "часто" - >:1/100<:1/10, " иногда" - >:1/1000<:1/100, " редко" - >:1/10 000<:1/1000, "очень редко" - <:1/10 000, включая отдельные сообщения. Очень часто: жжение в месте нанесения крема. Часто: местные реакции (раздражение, зуд и покраснение кожи), кожные инфекции (фолликулит). Иногда: нагноение: ухудшение заболевания: простой герпес: дерматит, обусловленный вирусом простого герпеса (герпетическая экзема): контагиозный моллюск, местные реакции, такие как сыпь, боль, парестезии, шелушение, сухость, отечность, кожные папилломы, фурункулы. Представленные ниже нежелательные реакции отмечались при постмаркетинговом применении препарата (оценка частоты по количеству случаев развития НЯ в неустановленной популяции). Со стороны иммунной системы: очень редко - анафилактические реакции. Со стороны обмена веществ (метаболические нарушения): редко - непереносимость алкоголя. Со стороны кожи и ее придатков: редко- аллергические реакции (сыпь, крапивница, ангионевротический отек): изменения цвета кожи (гипопигментация, гиперпигментация).В большинстве случаев сразу же после приема алкоголя развивалось покраснение лица, сыпь, жжение, зуд или припухлость. При применении крема Элидел в редких случаях отмечалось развитие злокачественных новообразований, включая кожные и другие типы лимфом, рак кожи. Причинно-следственная связь между данными нежелательными явлениями и применением препарата не установлена. Передозировка: Случаи передозировки или случайного употребления 1% крема Элидел внутрь не наблюдались. Взаимодействие с другими ЛС: Потенциальные взаимодействия 1% крема Элидел с другими препаратами не изучались. Учитывая, что системная абсорбция пимекролимуса очень незначительна, какие-либо взаимодействия крема Элидел с препаратами для системного применения маловероятны. При применении крема Элидел у детей в возрасте 2-х лет и старше препарат не оказывал влияния на эффективность вакцинации. Не рекомендуется нанесение крема на области введения вакцины до полного исчезновения местных проявлений поствакцинальной реакции. Несовместимость. Поскольку исследования совместимости не проводились, не рекомендуется применять препарат совместно с другими местными средствами. Фармакологическое действие и фармакокинетика Пимекролимус является производным макролактама аскомицина и обладает противоспалительным действием. Пимекролимус селективно ингибирует продукцию и высвобождение цитокинов и медиаторов воспаления из Т-лимфоцитов и тучных клеток. Пимекролимус специфично связывается с цитозольным рецептором макрофилином-12 и ингибирует кальцийзависимую фосфатазу -кальциневрин. Ингибирование кальциневрина приводит к подавлению пролиферации Т-лимфоцитов и предотвращает транскрипцию и выработку в Т-хелперах 1 и 2 типа ранних цитокинов, таких как интерлейкин-2, интерферон-ϒ, интерлейкин-4, интерлейкин-5, интерлейкин-10, фактор некроза опухоли-α и гранулоцитарно-макрофагальный колониестимулирующий фактор. Пимекролимус и такролимус в равной степени подавляют вторичный иммунный ответ в изолированных клеточных колониях Т-хелперов кожи, полученных у больных с атопическим дерматитом. In vitro пимекролимус также предотвращает антиген/IgE-опосредованное высвобождение цитокинов и медиаторов воспаления из тучных клеток. Пимекролимус не влияет на рост кератиноцитов, фибробластов и эндотелиальных клеток и, в отличие от кортикостероидов, оказывает селективное действие на клетки иммунной системы и не вызывает нарушений функции, жизнеспособности, процессов дифференциации, созревания клеток Лангерганса мышей и дендритных клеток моноритарного происхождения у человека. Препарат не оказывает влияния на дифференцировку "наивных" Т-лимфоцитов в Т-эффекторные клетки под действием клеток Лангерганса и дендритных клеток, являющуюся одним из основных механизмов специфического иммунного ответа. На экспериментальных моделях кожного воспаления была продемонстрирована высокая противовоспалительная активность пимекролимуса после его местного и системного применения. При местном применении на экспериментальных моделях аллергического контактного дерматита (АКД) пимекролимус сопоставим поэффективности с высокоактивными кортикостероидами: клобетазолом- 17-пропионатом и флутиказоном, ингибирует воспалительную реакцию в ответ на воздействие кожных раздражителей, не вызывая изменения консистенции, уплотнения и атрофии кожи. Кроме того, при местном и пероральном применении наэкспериментальных моделями АКД острого течения пимекролимус эффективно уменьшает кожное воспаление, зуд и выраженность гистопатологических изменений. При местном применении степень проникновения в кожу такролимуса и пимекролимус одинаково хорошая. Однако способность пимекролимуса проникать через кожу меньше, чем у такролимуса и глюкокортикостероидов. Таким образом, пимекролимус обладает селективным действием на кожу. Уникальность механизма действия пимекролимуса состоит в сочетании селективного противовоспалительного действия на кожу с незначительным влиянием на системный иммунный ответ. При применении в течение 6 недель у детей от 3-х месяцев до 17 лет пимекролимус эффективно уменьшает зуд и кожное воспаление (эритему, инфильтрацию, экскориацию и лихенизацию). При длительном применении в течение 12 месяцев пимекролимус эффективно снижает частоту возникновения внезапных обострений АКД, не вызывая атрофии, раздражении и повышения гиперчувствительности кожи и не обладая фототоксическим или фотосенсибилизирующим действием. Фармакокинетика: Взрослые. Концентрацию пимекролимуса в крови определяли у 12 взрослых пациентов с атопическим дерматитом (экземой) при поражении 15-59% площади поверхности тела, получавших лечение 1% кремом Элидел 2 раза в сутки на протяжении 3 недель. В 77,5% наблюдений концентрация пимекролимуса в крови была ниже 0.5 нг/мл (минимальной определяемой концентрации), а в 99.8% - ниже 1 нг/мл. Максимальное значение концентрации пимекролимуса в крови, зарегистрированное у одного пациента, составило 1.4 нг/мл.У 98% из 40 взрослых больных с исходным поражением 14-62% площади поверхности тела после 1 года лечения Элиделом концентрации пимекролимуса в крови оставались на низком уровне и в большинстве случаев были ниже минимальной определяемой концентрации. Максимальное значение концентрации, составившее 0.8 нг/мл, было зарегистрировано после 6 недель лечения только у двух пациентов. Ни у одного из пациентов не было отмечено нарастания концентрации на протяжении 12 месяцев лечения. За 3-недельный период лечения Элиделом 2 раза в сутки у 13 взрослых пациентов с дерматитом кистей (при применении крема на область ладоней и тыльную сторону кистей и бинтованием на ночь) максимальное зарегистрированное значение концентрации пимекролимуса в крови составило 0.91 нг/мл.У 8 пациентов с содержанием пимекролимуса в крови выше минимальной определяемой концентрации значение AUC составляло от 2.5-11.4 нг/мл. Дети. Фармакокинетические исследования пимекролимуса были проведены у 58 детей в возрасте от 3 до 14 лет с атопическим дерматитом (экземой) при поражении 10-92% площади поверхности тела, получавших лечение 1% кремом Элидел 2 раза в сутки на протяжении 3 недель. Пятеро детей получали лечение в течение 1 года по мере необходимости. Концентрации пимекролимуса в крови были на стабильно низком уровне, независимо от площади поражения кожных покровов и длительности терапии, и находились в том же диапазоне значений, что и у взрослых пациентов, получавших терапию Элиделом в тех же дозах. В 97% случаев концентрации пимекролимуса в крови были ниже 2 нг/мл, а в 60% - ниже 0.5 нг/мл (минимальной определяемой концентрации). Максимальное значение концентрации пимекролимуса, зарегистрированное у двух пациентов в возрасте 8 месяцев и 14 лет, составило 2.0 нг/мл. Среди детей самого младшего возраста (от 3 до 23 месяцев) максимальное значение концентрации пимекролимуса, зарегистрированное у одного пациента, составило 2.6 нг/мл.У пяти детей, получавших лечение Элиделом в течение 1 года, концентрации пимекролимуса находились на стабильно низком уровне. Максимальное значение, зарегистрированное у одного ребенка, составило 1.94 нг/мл. На протяжении всего периода лечения рост концентраций препарата не наблюдался ни у одного из пациентов.У 8 детей в возрасте от 2 до 14 лет с содержанием пимекролимуса в крови выше минимальной определяемой концентрации при трехкратном измерении значение AUC составляло от 5.4-18.8 нг/мл. Значения AUC у пациентов с площадью поражения кожных покровов менее 40 % и более 40% были сопоставимы.В исследованиях in vitro связывание пимекролимуса с белками плазмы (в основном с различными липопротеинами) составило 99,6%. Поскольку при местном применении концентрации пимекролимуса в крови очень низкие, определение параметров метаболизма не представляется возможным. Применение у пожилых больных. Атопический дерматит (экзема) редко наблюдается у больных в возрасте от 65 лет и старше. Количество пациентов такого возраста в клинических исследованиях крема Элидел было недостаточным для того, чтобы выявить какие-либо различия в эффективности лечения по сравнению с молодыми пациентами. Применение у детей. Рекомендации по дозированию для младенцев (3-23 месяца), детей (2-11 лет) и подростков (12-17 лет) не отличаются от рекомендаций для взрослых пациентов. Особые указания При лечении ингибиторами кальциневрина местного применения, включая Элидел, в редких случаях отмечалось развитие злокачественных новообразований (например, кожных опухолей и лимфом). Причинно-следственная связь между данными нежелательными явлениями и применением препарата не установлена.В клинических исследованиях при применении крема Элидел у 0,9% пациентов (14 из 1544) отмечалось развитие лимфоаденопатии. Обычно лимфоаденопатия была обусловлена инфекционными заболеваниями и исчезала после проведения курса соответствующей антибиотикотерапии. У всех пациентов или удавалось выявить причину развития лимфоаденопатии или отмечалось исчезновение данного нежелательного явления. У больных, получающих лечение Элиделом, при развитии лимфоаденопатии необходимо установить этиологию процесса и обеспечить наблюдение за пациентами до полного исчезновения данного нежелательного явления. При неустановленной этиологии лимфоаденопатии или наличие у пациента острого мононуклеозного воспаления препарат следует отменить. При лечении кремом Элидел пациентам рекомендуется уменьшить до минимума искусственную или естественную инсоляцию кожи или полностью избегать ультрафиолетового облучения. Возможное влияние применения препарата при поражениях кожи, вызванных ультрафиолетовым облучением, неизвестно. Влияние на способность управлять транспортными средствами: Влияние применения крема Элидел на способность управлять автотранспортом или работать с механизмами не установлено. Условия хранения и отпуска из аптек Условия хранения:Хранить при температуре не выше 25°С, не замораживать. Препарат следует хранить в недоступном для детей месте. Отпуск из аптек: По рецепту Регистрационные данные Торговое название Элидел Международное непатентованное название:Пимекролимус. Форма выпуска:Крем для наружного применения . Состав: 1 г крема содержит 10 мг пимекролимуса, а также вспомогательные вещества: натрия гидроксид 0,20 мг, лимонная кислота безводная 0,50 мг, бензиловый спирт 10,00 мг, натрия цетостеарилсульфат 10,00 мг, моно и диглицериды 20,00 мг, цетиловый спирт 40,00 мг, стеариновый спирт 40,00 мг, пропиленгликоль 50,00 мг, олеиловый спирт 100,00 мг, триглицериды среднецепочечные 150,00 мг, вода очищенная 569,30 мг. АТХ: Регистрация: П N014689/01 Фармгруппа: противовоспалительное средство для местного применения. Дата регистрации: 01.10.2007. Окончание регстрации: . Описание:Гомогенный крем от белого до почти белого цвета. Упаковка:Крем для наружного применения 1% 15 г, 30 г и 100 г в алюминиевой тубе. 1 туба с инструкцией по применению в картонной пачке. Срок годности:2 года. Препарат не следует использовать после истечения срока годности. После первого вскрытия использовать в течении 1 года. Владелец рег.удостоверения:Меда Фарма ГмбХ и Ко.КГ Производитель:MEDA PHARMA, GmbH &: Co.KG : NOVARTIS PHARMA PRODUCTIONS, GmbH. Представительство

Модель:
RUR 917
Показания Купирование приступов мигрени с аурой или без нее. Противопоказания Противопоказания - Гиперчувствительность к любому компоненту препарата- дефицит лактазы, непереносимость лактозы, глюкозо-галактозная мальабсорбция- гемиплегическая, базилярная и офтальмоплегическая формы мигрени- ишемическая болезнь сердца (ИБС) (в т.ч. инфаркт миокарда, постинфарктный кардиосклероз, стенокардия Принцметала), а также наличие симптомов, позволяющих предположить наличие ИБС- окклюзионные заболевания периферических сосудов- инсульт или транзиторная ишемическая атака (в т.ч. в анамнезе)- артериальная гипертензия II-III степени тяжести- неконтролируемая артериальная гипертензия- одновременный прием с эрготамином или его производными (включая метизергид)- одновременный прием с другими триптанами/агонистами рецептора 5-НТ1- применение на фоне приема ингибиторов моноаминоксидазы (МАО) или ранее, чем через 2 недели после их отмены- выраженные нарушения функции печени и/или почек- возраст до 18 лет и старше 65 лет (безопасность и эффективность не установлена)- беременность- период лактации. С осторожностью: Беременность Применение суматриптана противопоказано при беременности. На время лечения следует прекратить грудное вскармливание. В случае приема препарата грудное вскармливание возможно не ранее чем через 24 часа. Применение и дозы Внутрь, во время приёма пищи или натощак, препарат следует проглатывать целиком, запивая водой. Рекомендуемая доза составляет 50 мг. Некоторым пациентам может потребоваться более высокая доза - 100 мг. Если симптомы мигрени не исчезают и не уменьшаются после приема первой дозы, то для купирования этого же приступа повторно принимать препарат не следует. В этом случае лечение можно осуществлять с помощью парацетамола, ацетилсалициловой кислоты, нестероидных противовоспалительных препаратов. Однако препарат можно применять для купирования последующих приступов мигрени. Если пациент почувствовал улучшение после первой дозы, а затем симптомы возобновились, можно принять вторую дозу в течение следующих 24 ч, при условии, что интервал между приемом составляет не менее 2 ч. Максимальная суточная доза суматриптана не должна превышать 300 мг. Пациенты с печеночной недостаточностью Рекомендованная доза - 50 мг. Дети и подростки (в возрасте до 18 лет) Суматриптан не рекомендуется для применения у детей и подростков из-за недостатка данных о безопасности и эффективности. Пациенты пожилого возраста (старше 65 лет)Опыт применения суматриптана у пациентов в возрасте старше 65 лет ограничен. Фармакокинетика препарата существенно не отличается от таковой у более молодых пациентов, однако, до получения дополнительных клинических данных, применение суматриптана у пациентов в возрасте старше 65 лет не рекомендуется. Меры предосторожности при применении. Суматриптан следует назначать только в том случае, если диагноз мигрени не вызывает сомнения, при этом применять его следует как можно раньше после начала приступа мигрени, хотя он одинаково эффективен при использовании на любой стадии приступа. Препарат нельзя использовать в профилактических целях. Суматриптан следует принимать с осторожностью при контролируемой артериальной гипертензии: заболеваниях, при которых могут изменяться всасывание, метаболизм или выведение препарата (например, нарушение функции почек или печени). Имеются очень редкие сообщения, полученные в результате постмаркетингового наблюдения, о развитии серотонинового синдрома (включая расстройства психики, вегетативную лабильность и нервно-мышечные нарушения) в результате сопутствующего применения селективных ингибиторов обратного захвата серотонина (СИОЗС) и суматриптана. Также сообщалось о развитии серотонинового синдрома на фоне одновременного назначения триптанов с селективными ингибиторами обратного захвата серотонина и норадреналина (СИОЗСН). В случае одновременного назначения с препаратами из группы СИОЗС/СИОЗСН следует тщательно контролировать состояние пациента. Суматриптан следует принимать с осторожностью при эпилепсии и любых состояниях со снижением порога судорожной готовности. Сопутствующее применение других триптанов/5-HT1 агонистов с суматриптаном не рекомендуется.У пациентов с гиперчувствительностью к сульфаниламидам применение суматриптана может вызвать аллергические реакции, выраженность которых варьирует от кожных проявлений до анафилаксии. Данные о перекрестной чувствительности ограничены, однако следует соблюдать осторожность при назначении суматриптана таким пациентам. Как и при применении других противомигренозных средств, при назначении суматриптана у пациентов с ранее недиагностированной мигренью или у пациентов с атипичной мигренью необходимо исключить другие потенциально серьезные неврологические состояния. Следует отметить, что у пациентов с мигренью повышен риск развития определенных цереброваскулярных осложнений (инсульта или преходящего нарушения мозгового кровообращения). Суматриптан не следует назначать пациентам с предполагаемым заболеванием сердца без предварительного обследования с целью исключения сердечно-сосудистой патологии. К таким пациентам относятся женщины в постменопаузальном периоде, мужчины в возрасте старше 40 лет и пациенты с факторами риска развития ИБС. Хотя проведенное обследование не всегда позволяет выявить заболевание сердца у некоторых пациентов, в очень редких случаях у них развиваются побочные эффекты со стороны сердечно-сосудистой системы. После приема суматриптана могут возникать преходящие интенсивные боли и стеснение в груди, распространяющееся на область шеи. Если есть основания полагать, что эти симптомы являются проявлением ИБС, необходимо провести соответствующее диагностическое обследование. Злоупотребление лекарственными препаратами, предназначенными для купирования приступов мигрени, ассоциировано с усилением головных болей у чувствительных пациентов (головная боль, связанная со злоупотреблением лекарственными препаратами). При этом следует рассмотреть возможность отмены препарата. Нельзя превышать рекомендуемую дозу суматриптана. Побочные эффекты и передозировка Побочные эффекты: В зависимости от частоты возникновения выделяют следующие группы побочных эффектов: очень часто: >:1/10: часто: >:1/100, <:1/10: нечасто: >:1/1000, <:1/100: редко: >:1/10000, <:1/1000: очень редко: <:1/10000, включая отдельные случаи: частота неизвестна: частоту развития невозможно оценить по имеющимся данным. Со стороны нервной системы: часто - головокружение, сонливость, нарушения чувствительности, включая парестезии и гипестезии: частота неизвестна - судорожные приступы (в ряде случаев они наблюдались у пациентов с судорогами в анамнезе или при состояниях, предрасполагающих к возникновению судорог: у части пациентов предрасполагающих факторов выявлено не было), тремор, дистония, нистагм, скотома: тревога. Со стороны органа зрения: частота неизвестна - диплопия, мелькание перед глазами, снижение остроты зрения, частичная преходящая или стойкая потеря зрения. Однако следует иметь в виду, что нарушения зрения могут быть связаны с самим приступом мигрени. Со стороны сердечно-сосудистой системы: часто - преходящее повышение артериального давления (наблюдающееся вскоре после приема суматриптана), "приливы": частота неизвестна - брадикардия, тахикардия, снижение артериального давления, нарушения сердечного ритма, преходящие изменения ЭКГ по ишемическому типу, инфаркт миокарда, спазм коронарных артерий, стенокардия, синдром Рейно: ощущение сердцебиения. Со стороны желудочно-кишечного тракта: часто - тошнота, рвота: очень редко - дисфагия, ощущение дискомфорта в области живота: частота неизвестна - ишемический колит, диарея. Со стороны опорно-двигательного аппарата: часто - чувство тяжести (обычно преходящее, может быть интенсивным и возникать в любой части тела, включая грудную клетку и горло), миалгия: нечасто - боль в суставах: частота неизвестна - ригидность затылочных мышц, артралгия. Со стороны дыхательной системы и органов грудной клетки: часто - одышка: легкое, преходящее раздражение слизистой или чувство жжения в носовой полости или горле, носовое кровотечение. Лабораторные показатели: очень редко - незначительные изменения активности "печеночных" трансаминаз. Аллергические реакции: очень редко - реакции гиперчувствительности варьируют от кожных проявлений (сыпь, крапивница, зуд, эритема) до случаев анафилаксии. Со стороны кожи и подкожной клетчатки: частота неизвестна - гипергидроз. Прочие: часто - ощущение жара или холода, боль, чувство сдавления или тяжести (являются преходящими и способны возникать в любой части тела, включая грудную клетку и горло), ощущение слабости, чувство усталости, обычно выражены слабо или умеренно и так же носят преходящий характер. Могут возникать преходящие интенсивные боли и стеснение в груди, распространяющееся на область шеи. Передозировка: Симптомы. Прием суматриптана внутрь в дозе более 400 мг не вызывал каких-либо побочных эффектов, помимо перечисленных выше. Лечение: в случае передозировки следует наблюдать за состоянием пациентов не менее 10 часов и при необходимости проводить симптоматическую терапию. Нет данных о влиянии гемодиализа или перитонеального диализа на концентрацию суматриптана в плазме. Взаимодействие с другими ЛС: Не отмечено взаимодействие суматриптана с пропранололом, флунаризином, пизотифеном и этиловым спиртом. При одновременном приеме с эрготамином или с иными триптанами/агонистами рецептора 5-HT1, отмечался длительный спазм сосудов. Суматриптан можно назначать не раньше, чем через 24 ч после приема препаратов, содержащих эрготамин или иные триптаны/агонисты рецептора 5-HT1, наоборот, препараты, содержащие эрготамин, можно назначать не раньше, чем через 6 ч после приема суматриптана, а триптаны/агонисты рецептора 5-HT1, - не раньше, чем через 24 часа после приема суматриптана. Возможно взаимодействие между суматриптаном и ингибиторами МАО, их одновременное применение противопоказано. Имеются очень редкие сообщения, полученные в результате постмаркетингового наблюдения, о развитии серотонинового синдрома (включая расстройства психики, вегетативную лабильность и нервно- мышечные нарушения) в результате сопутствующего применения селективных ингибиторов обратного захвата серотонина (СИОЗС) и суматриптана. Также сообщалось о развитии серотонинового синдрома на фоне одновременного назначения триптанов с селективными ингибиторами обратного захвата серотонина и норадреналина (СИОЗСН). Фармакологическое действие и фармакокинетика Суматриптан- специфический селективный агонист сосудистых 5-гидрокситриптамин-1- рецепторов (5НТID), не влияет на другие подтипы 5НТ-серотониновых рецепторов (5НТ2- 5НТ7). Рецепторы 5НТID расположены, главным образом, в кровеносных сосудах головного мозга, и их стимуляция приводит к сужению этих сосудов. Снижает чувствительность тройничного нерва. Оба эти эффекта могут лежать в основе противомигренозного действия суматриптана. Клинический эффект отмечается обычно через 30 мин после приема препарата внутрь. Фармакокинетика: После приема внутрь суматриптан быстро всасывается, 70% от максимальной концентрации в плазме (Сmах) достигается через 45 мин. После приема 100 мг Сmах в плазме крови составляет в среднем 54 нг/мл. Биодоступность составляет 14% вследствие интенсивного пресистемного метаболизма и неполной абсорбции. Связывание с белками плазмы невелико и составляет 14-21%. Суматриптан метаболизируется при участии моноаминоксидазы (МАО) типа А. Основной метаболит- индолуксусный аналог суматриптана, который выводится преимущественно почками, в виде свободной кислоты и конъюгата с глюкуроновой кислотой. Этот метаболит не обладает активностью по отношению к 5HT1- и 5НТ2-серотониновым рецепторам. Приступы мигрени, по-видимому, не оказывают существенного влияния на фармакокинетику суматриптана, принимаемого внутрь. Особые указания Суматриптан следует назначать только в том случае, если диагноз мигрени не вызывает сомнения, при этом применять его следует как можно раньше после начала приступа мигрени, хотя он одинаково эффективен при использовании на любой стадии приступа. Препарат нельзя использовать в профилактических целях. Суматриптан следует принимать с осторожностью при контролируемой артериальной гипертензии I степени тяжести, так как в отдельных случаях на фоне приема наблюдалось транзиторное повышение артериального давления и периферического сопротивления сосудов: заболеваниях, при которых могут изменяться всасывание, метаболизм или выведение препарата (например, нарушение функции почек или печени). Имеются очень редкие сообщения, полученные в результате постмаркетингового наблюдения, о развитии серотонинового синдрома (включая расстройства психики, вегетативную лабильность и нервно- мышечные нарушения) в результате сопутствующего применения селективных ингибиторов обратного захвата серотонина (СИОЗС) и суматриптана. Также сообщалось о развитии серотонинового синдрома на фоне одновременного назначения триптанов с селективными ингибиторами обратного захвата серотонина и норадреналина (СИОЗСН). В случае одновременного назначения с препаратами из группы СИОЗС/СИОЗСН следует тщательно контролировать состояние пациента. Суматриптан следует принимать с осторожностью при эпилепсии и наличии других факторов риска в анамнезе, сопровождающихся снижением порога судорожной готовности, поскольку у таких пациентов возможно развитие судорог на фоне приема суматриптана. Сопутствующее применение других триптанов/агонистов рецептора 5HT1 с суматриптаном не рекомендуется. У пациентов с гиперчувствительностью к сульфаниламидам применение суматриптана может вызвать аллергические реакции, выраженность которых варьирует от кожных проявлений до анафилаксии. Данные о перекрестной чувствительности ограничены, однако следует соблюдать осторожность при назначениисуматриптана таким пациентам. Как и при применении других противомигренозных средств, при назначении суматриптана у пациентов с ранее недиагностированной мигренью или у пациентов с атипичной мигренью необходимо исключить другие потенциально серьезные неврологические состояния. Следует отметить, что у пациентов с мигренью повышен риск развития определенныхцереброваскулярных осложнений (инсульта или транзиторной ишемической атаки). Суматриптан не следует назначать пациентам группы риска сердечнососудистых заболеваний без предварительного обследования с целью исключения сердечно-сосудистой патологии. К таким пациентам относятся женщины в постменопаузальном периоде, мужчины в возрасте старше 40 лет, пациенты с факторами риска развития ИБС, а также курящие и использующие никотинзаместительную терапию. Хотя проведенное обследование не всегда позволяет выявить заболевание сердца у некоторых пациентов, в очень редких случаях у них развиваются побочные эффекты со стороны сердечно-сосудистой системы. После приема суматриптана могут возникать преходящие интенсивные боли и стеснение в груди, распространяющееся на область шеи. Если есть основания полагать, что эти симптомы являются проявлением ИБС, следует приостановить прием препарата и провести соответствующее диагностическое обследование. Злоупотребление лекарственнымипрепаратами, предназначенными для купирования приступов мигрени, ассоциировано с усилением головных болей у чувствительных пациентов (головная боль, связанная со злоупотреблением лекарственными препаратами). В случае развития или подозрения на головную боль, связанную со злоупотреблением лекарственными препаратами, необходимо обратиться к врачу. При этом следует рассмотреть возможность отмены препарата. Нежелательные эффекты могут чаще наблюдаться во время применения триптанов и растительных препаратов, содержащих зверобой продырявленный (Hypericum perforatum). Нельзя превышать рекомендуемую дозу суматриптана. Влияние на способность управлять транспортными средствами: У пациентов с мигренью может возникать сонливость, связанная, как с самим заболеванием, так и с приемом суматриптана, поэтому они должны быть особенно осторожными при управлении автомобилем и работе с движущимися механизмами. Условия хранения и отпуска из аптек Условия хранения:При температуре не выше 25°С. Хранить в недоступном для детей месте. Отпуск из аптек: По рецепту Регистрационные данные Торговое название Сумамигрен Международное непатентованное название:Суматриптан. Форма выпуска:Таблетки, покрытые пленочной оболочкой. Состав:1 таблетка содержит:Активное вещество: суматриптана сукцинат (эквивалентно суматриптану) 70,00 (50,00) мг или 140,00(100,00) мг. Вспомогательные вещества:Для таблеток 50 мг: целлюлоза микрокристаллическая - 100,00 мг, лактозы моногидрат - 123,50 мг, кроскармеллоза натрия - 1,50 мг, магния стеарат - 3,00 мг, тальк - 1,50 мг, кремния диоксид коллоидный - 0,50 мг. Оболочка: гипромеллоза - 3,07 мг, макрогол 6000 - 1,20 мг, тальк - 1,31 мг, титана диоксид - 0,90 мг, триэтилцитрат - 0,98 мг, краситель пунцовый [Понсо 4 R] - 0,040 мг. Для таблеток 100 мг: целлюлоза микрокристаллическая - 200,00 мг, лактозы моногидрат - 247,00 мг, кроскармеллоза натрия - 3,00 мг, магния стеарат - 6,00 мг, тальк - 3,00 мг, кремния диоксид коллоидный - 1,00 мг. Оболочка: гипромеллоза - 4,10 мг, макрогол 6000 - 1,60 мг, тальк - 1,80 мг, титана диоксид -1,20 мг, триэтилцитрат - 1,30 мг. АТХ: Регистрация: Лекарственное средство ЛС-001522 Фармгруппа: Противомигренозное средство. Дата регистрации: 15.09.2011. Окончание регстрации: . Описание:Таблетки 50 мг - продолговатые, двояковыпуклые таблетки, покрытые пленочной оболочкой светло-розового цвета, с делительной риской с одной стороны, на изломе белого цвета. Таблетки 100 мг- продолговатые, двояковыпуклые таблетки, покрытые пленочной оболочкой белого цвета, на изломе белого цвета. Упаковка:Таблетки, покрытые пленочной оболочкой 50 мг, 100 мг. По 2 или 6 таблеток в блистер из фольги алюминиевой твердой, покрытой лаком, и ламината для холодного формования. 1 блистер вместе с инструкцией по применению помещают в картонную пачку. Срок годности:5 лет. Не применять препарат после истечения срока годности. Владелец рег.удостоверения:Фармацевтический завод "ПОЛЬФАРМА" АО Производитель:POLPHARMA PHARMACEUTICAL WORKS, S.A. Представительство:АКРИХИН ОАО
Модель:
RUR 1850
Показания Большие депрессивные эпизоды у взрослых (лечение). Противопоказания Противопоказания гиперчувствительность к активному веществу или какому-либо компоненту препарата; одновременное применение с неселективными ингибиторами МАО (ИМАО) или селективными ИМАО А (см. «Взаимодейтвие»); детский и подростковый возраст до 18 лет (безопасность и эффективность не установлены). С осторожностью: тяжелая почечная и печеночная недостаточность; мания и гипомания; фармакологически неконтролируемая эпилепсия, судорожные припадки в анамнезе; выраженное суицидальное поведение; цирроз печени; склонность к кровотечениям; одновременный прием с ингибиторами МАО В (селегилин, разагилин), серотонинергическими лекарственными препаратами, препаратами, снижающими порог судорожной готовности, литием, триптофаном, лекарственными препаратами, содержащими зверобой продырявленный, пероральными антикоагулянтами и лекарственными препаратами, влияющими на тромбоцитарную функцию, препаратами, способными вызвать гипонатриемию; электросудорожная терапия; пожилой возраст. Беременность Данные по применению вортиоксетина у беременных женщин ограничены. Исследования на животных выявили репродуктивную токсичность вортиоксетина (см. «Фармакокинетика»). У новорожденных, матери которых получают серотонинергические препараты на поздних сроках беременности, могут наблюдаться следующие симптомы: респираторный дистресс, цианоз, апноэ, судороги, нестабильность температуры, трудности с приемом пищи, рвота, гипогликемия, гипертония, гипотония, гиперрефлексия, тремор, повышенная нервно-рефлекторная возбудимость, раздражительность, летаргический сон, постоянный плач, сонливость и плохой сон. Эти симптомы могут быть связаны как с синдромом отмены, так и с избыточной серотонинергической активностью. В большинстве случаев подобные осложнения начинаются немедленно либо вскоре (< 24 ч) после рождения. Данные эпидемиологических исследований позволяют предположить, что применение СИОЗС во время беременности, особенно на поздних сроках, может повысить риск развития устойчивой легочной гипертензии у новорожденных (PPHN). Хотя на сегодняшний день возможность взаимосвязи данного состояния с применением вортиоксетина не изучалась, принимая во внимание механизм его действия (повышение концентрации серотонина), возможный риск не может быть исключен. Препарат Бринтелликс не должен применяться во время беременности, если того не потребует клиническое состояние самой женщины. Доступные фармакодинамические и токсикологические данные у животных показали, что вортиоксетин и его метаболиты проникают в грудное молоко. Вероятно, вортиоксетин также проникает в грудное молоко у человека (см. «Фармакокинетика»). Риск для ребенка при грудном вскармливании не может быть исключен. Решение о прекращении грудного вскармливания или воздержания от применения препарата Бринтелликс должно приниматься с учетом оценки относительной пользы грудного вскармливания для ребенка и необходимости терапии для матери. Фертильность. Исследования фертильности на самцах и самках крыс показали, что вортиоксетин не оказывает влияние на фертильность, качество спермы или способность к спариванию (см. «Фармакоктнетика»). Случаи применения у человека лекарственных препаратов, относящихся к соответствующему фармакологическому классу антидепрессантов (СИОЗС), показали наличие воздействия на качество спермы, которое носит обратимый характер. Влияние на фертильность человека на настоящий момент не наблюдалось. Применение и дозы Внутрь, вне зависимости от приема пищи. Режим дозирования. Начальная и рекомендуемая доза препарата Бринтелликс у взрослых пациентов младше 65 лет составляет 10 мг однократно в сутки. В зависимости от индивидуальной реакции пациента, суточная доза вортиоксетина может быть увеличена до максимальной дозы — 20 мг/сут или снижена до минимальной дозы — 5 мг/сут. После полного разрешения симптомов депрессии рекомендовано продолжать лечение в течение по крайней мере 6 мес для закрепления антидепрессивного эффекта. Прекращение лечения. Пациенты, получающие лечение препаратом Бринтелликс, могут одномоментно прекратить его прием без необходимости постепенного понижения дозы (см. «Фармакодинамика»). Особые группы пациентов Пожилые пациенты. У пациентов 65 лет в качестве начальной дозы всегда следует использовать минимальную эффективную дозу препарата Бринтелликс 5 мг однократно в сутки. Необходимо соблюдать осторожность при лечении пациентов 65 лет с применением доз выше 10 мг вортиоксетина однократно в сутки, т.к. данные о применении препарата у этой группы пациентов ограничены (см. «Особые указания»). Ингибиторы цитохрома Р450. В зависимости от индивидуальной реакции пациента, может потребоваться снижение дозы препарата Бринтелликс в случае присоединения терапии сильными ингибиторами изофермента CYP2D6 (например бупропион, хинидин, флуоксетин, пароксетин) (см. «Взаимодействие»). Индукторы цитохрома Р450. В зависимости от индивидуальной реакции пациента, может потребоваться коррекция дозы препарата Бринтелликс в случае присоединения терапии индукторами цитохрома Р450 широкого спектра (например рифампицин, карбамазепин, фенитоин) (см. «Взаимодействие»). Дети и подростки (младше 18 лет). Безопасность и эффективность препарата Бринтелликс у детей и подростков до 18 лет не установлена. Данных по этой группе пациентов нет (см. «Особые указания»). Побочные эффекты и передозировка Побочные эффекты: Наиболее частой нежелательной реакцией была тошнота. Нежелательные реакции обычно были слабо или умеренно выраженными и отмечались лишь на протяжении первых 2 нед лечения. Нежелательные реакции обычно носили временный характер и, в общем, не являлись причиной отмены препарата. Нежелательные побочные реакции со стороны ЖКТ, такие как тошнота, чаще наблюдались у женщин, чем у мужчин. Нежелательные реакции, перечисленные ниже, распределены по частоте следующим образом: очень часто ( 1/10); часто (от 1/100 до < 1/10); нечасто (от 1/1000 до < 1/100); редко (от 1/10000 до < 1/1000); очень редко (< 1/10000), частота неизвестна (частота не может быть оценена на основании имеющихся данных). Описание отдельных нежелательных реакций Пожилые пациенты. Для доз вортиоксетина 10 мг и выше 1 раз в сутки уровень выбывания из исследований был выше у пациентов в возрасте 65 лет. Для дозы вортиоксетина 20 мг/сут случаи возникновения тошноты и запоров были выше у пациентов в возрасте 65 лет (42 и 15% соответственно) по сравнению с пациентами < 65 лет (27 и 4% соответственно) (см. «Особые указания»). Сексуальная дисфункция. В клинических исследованиях сексуальная дисфункция оценивалась с использованием ASEX. Дозы от 5 до 15 мг не демонстрировали отличие от плацебо. Однако прием дозы вортиоксетина 20 мг ассоциировался с повышением частоты возникновения TESD (см. «Фармакодинамика»). Класс-специфический эффект. Эпидемиологические исследования преимущественно с участием пациентов в возрасте 50 лет и старше показали существование повышенного риска костных переломов у пациентов, принимающих лекарственные препараты, относящиеся к соответствующим фармакологическим классам антидепрессантов (трициклических (ТЦА) и СИОЗС). Механизм, приводящий к этому риску, неизвестен, также как неизвестно, относится ли этот риск к приему вортиоксетина. Передозировка: В настоящее время имеется лишь ограниченный опыт по передозировке вортиоксетина. Симптомы: прием внутрь вортиоксетина в дозе от 40 до 75 мг приводил к усилению следующих нежелательных реакций: тошнота, постуральное головокружение, диарея, неприятные ощущения в животе, генерализованный зуд, сонливость и приливы. Лечение: в случае возникновения передозировки необходимо установить наблюдение за пациентом и проводить симптоматическое лечение. Также рекомендуется осуществлять последующее медицинское наблюдение в специализированных условиях. Взаимодействие с другими ЛС: Вортиоксетин подвергается экстенсивному метаболизму в печени главным образом за счет окисления, катализируемого изоферментом CYP2D6, и в меньшей степени — изоферментами CYP3A4/5 и CYP2C9 (см. «Фармакокинетика»). Возможное влияние других препаратов на фармакологическое действие вортиоксетина Необратимые неселективные ИМАО. Из-за риска возникновения СС вортиоксетин противопоказано применять в сочетании с необратимыми неселективными ИМАО. Вортиоксетин может быть назначен не ранее чем через 14 дней после отмены необратимых неселективных ИМАО. Вортиоксетин необходимо отменить не менее чем за 14 дней до начала применения необратимых неселективных ИМАО (см. «Противопоказания»). Обратимые селективные ИМАО А (моклобемид). Одновременное применение вортиоксетина с обратимыми селективными ИМАО А, такими как моклобемид, противопоказано (см. «Противопоказания»). В случае доказанной необходимости одновременного применения присоединяемый препарат следует применять в минимальных дозах и при тщательном клиническом наблюдении на предмет возникновения СС (см. «Особые указания»). Обратимые неселективные ИМАО (линезолид). Одновременное применение вортиоксетина со слабым обратимым неселективным ИМАО, таким как антибиотик линезолид, противопоказано (см. «Противопоказания»). В случае доказанной необходимости одновременного применения присоединяемый препарат должен применяться в минимальных дозах при тщательном клиническом мониторинге на предмет возникновения СС (см. «Особые указания»). Необратимые селективные ИМАО В (селегилин, разагилин). Хотя риск возникновения СС при одновременном применении вортиоксетина и селективных ИМАО В ниже, чем при одновременном применении вортиоксетина и селективных ИМАО А, комбинированное применение вортиоксетина с необратимыми ИМАО В, такими, как селегилин или разагилин должно осуществляться с осторожностью. В случае одновременного применения необходимо тщательное наблюдение за пациентом на предмет возникновения СС (см. «Особые указания»). Серотонинергические препараты. Одновременное применение вортиоксетина и других ЛС с серотонинергическим эффектом (например трамадол, суматриптан и другие триптаны) может привести к развитию СС (см. «Особые указания»). Зверобой продырявленный. Одновременное применение антидепрессантов с серотонинергическим эффектом с препаратами, содержащими зверобой продырявленный (Hypericum perforatum), может привести к увеличению частоты возникновения нежелательных реакций, включая СС (см. «Особые указания»). Препараты, снижающие порог судорожной готовности. Антидепрессанты с серотонинергическим эффектом могут снижать порог судорожной готовности. Одновременное применение с препаратами, снижающими порог судорожной готовности (например антидепрессанты (ТЦА, СИОЗС, СИОЗСН), нейролептики (фенотиазины, тиоксантены, бутирофеноны), мефлохин, бупропион, трамадол), должно осуществляться с осторожностью (см. «Особые указания»). Электросудорожная терапия (ЭСТ). В настоящее время клинический опыт одновременного применения вортиоксетина и ЭСТ отсутствует, поэтому при таком применении следует соблюдать осторожность. Ингибиторы изофермента CYP2D6. В случае применения вортиоксетина в дозе 10 мг/сут одновременно с бупропионом (сильным ингибитором изофермента CYP2D6) в дозе 150 мг дважды в сутки в течение 14 дней у здоровых субъектов экспозиция вортиоксетина (AUC) возросла в 2,3 раза. Нежелательные реакции чаще наблюдались при присоединении бупропиона к текущей терапии вортиоксетином, чем при присоединении вортиоксетина к текущей терапии бупропионом. В зависимости от индивидуальной реакции пациента, при присоединении к текущей терапии вортиоксетином сильного ингибитора изофермента CYP2D6 (например бупропион, хинидин, флуоксетин, пароксетин) следует рассмотреть возможность снижения дозы вортиоксетина (см. «Способ применения и дозы»). Ингибиторы изоферментов CYP3A4 и CYP2C9. Присоединение вортиоксетина через 6 дней после начала применения кетоконазола в дозе 400 мг/сут (ингибитор изоферментов CYP3A4/5 и Р-gp) или через 6 дней после начала применения флуконазола в дозе 200 мг/сут (ингибитор изоферментов CYP2C9, CYP2C19 и CYP3A4/5) у здоровых субъектов экспозиция (AUC) вортиоксетина возросла в 1,3 и 1,5 раза соответственно. Коррекция дозы не требуется. Взаимодействия у пациентов со слабой активностью изофермента CYP2D6. Специальных исследований применения вортиоксетина одновременно с сильными ингибиторами изофермента CYP3A4 (такими как итраконазол, вориконазол, кларитромицин, телитромицин, нефазодон, кониваптан и многие ингибиторы протеазы ВИЧ) и ингибиторами изофермента CYP2C9 (такими как флуконазол и амиодарон) у пациентов со сниженной активностью изофермента CYP2D6 (см. «Фармакокинетика») не проводилось, тем не менее можно ожидать, что у этих пациентов такое применение приведет к более выраженной экспозиции вортиоксетина по сравнению с умеренным действием, описанным выше. Прием однократной дозы омепразола 40 мг (ингибитор изофермента СYP2C19) на фоне повторных доз вортиоксетина не изменял фармакокинетику последнего у здоровых субъектов. Индукторы цитохрома Р450. При приеме однократной дозы вортиоксетина 20 мг через 10 дней после начала применения рифампицина в дозе 600 мг/сут (индуктор изоферментов CYP широкого спектра) здоровыми субъектами экспозиция (AUC) вортиоксетина снизилась на 72%. В зависимости от индивидуальной реакции пациента, при присоединении к текущей терапии вортиоксетином сильного индуктора изоферментов цитохрома Р450 широкого спектра (например рифампицин, карбамазепин, фенитоин) следует рассмотреть возможность коррекции дозы вортиоксетина (см. «Способ применения и дозы»). Алкоголь. При одновременном приеме однократных доз вортиоксетина (20 и 40 мг) и этанола (0,6 г/кг) здоровыми субъектами не наблюдались изменения фармакокинетики вортиоксетина или этанола и значительные нарушения когнитивных функций в сравнении с плацебо. Однако во время терапии антидепрессантами прием алкоголя не рекомендуется. Ацетилсалициловая кислота. Многократное введение ацетилсалициловой кислоты в дозе 150 мг/сут не изменяло фармакокинетику многократных доз вортиоксетина у здоровых субъектов. Возможное влияние вортиоксетина на фармакологическое действие других препаратов Антикоагулянты и антиагреганты. Не наблюдалось значимое влияние вортиоксетина в сравнении с плацебо на параметры протромбина, MHO или соотношение R-/S-варфарина в плазме крови при одновременном применении многократных доз вортиоксетина с фиксированной дозой варфарина у здоровых субъектов. Также не наблюдалось значимое ингибирующее влияние вортиоксетина на агрегацию тромбоцитов и фармакокинетику ацетилсалициловой и салициловой кислоты в сравнении с плацебо при одновременном применении ацетилсалициловой кислоты в дозе 150 мг/сут после многократных доз вортиоксетина у здоровых субъектов. Тем не менее, как и в случае применения других серотонинергических препаратов следует соблюдать осторожность при одновременном применении вортиоксетина и пероральных антикоагулянтов или антиагрегантов из-за потенциального риска возникновения кровотечений, вызванных фармакодинамическим взаимодействием (см. «Особые указания»). Субстраты цитохрома Р450. Исследования in vitro не выявили у вортиоксетина способность ингибировать или индуцировать изоферменты системы цитохрома Р450 (см. «Фармакокинетика»). После применения многократных доз вортиоксетина у здоровых субъектов не было обнаружено его ингибирующего влияния на активность изоферментов системы цитохрома Р450 CYP2C19 (омепразол, диазепам), CYP3A4/5 (этинилэстрадиол, мидазолам), CYP2B6 (бупропион), CYP2C9 (толбутамид, S-варфарин), CYP1A2 (кофеин) или CYP2D6 (декстрометорфан). Фармакодинамических взаимодействий также не наблюдалось. Не было обнаружено значимого нарушения когнитивных функций в сравнении с плацебо при применении вортиоксетина в комбинации с однократной дозой диазепама 10 мг. Не было обнаружено значимого влияния вортиоксетина в сравнении с плацебо на уровень половых гормонов после его применения совместно с комбинированным оральным контрацептивом (этинилэстрадиол 30 мкг + левоноргестрел 150 мкг). Литий, триптофан. У здоровых субъектов не были выявлены какие-либо клинически значимые изменения при одновременном применении лития и многократных доз вортиоксетина. Тем не менее, в связи с тем, что были описаны случаи усиления действия серотонинергических антидепрессантов при одновременном применении с литием или триптофаном, применение вортиоксетина в комбинации с этими препаратами должно осуществляться с осторожностью. Фармакологическое действие и фармакокинетика Механизм действия вортиоксетина, по-видимому, связан с его прямой модулирующей серотонинергической активностью и ингибированием белка-переносчика серотонина. Доклинические исследования показывают, что вортиоксетин выступает в роли антагониста 5-НТ3, 5-НТ7- и 5-НТ1D-рецепторов, частичного агониста 5-НТ1B-рецепторов и полного агониста 5-НТ1A-рецепторов, а также ингибирует 5-НТ-транспортер, модулируя тем самым нейротрансмиссию в нескольких системах, прежде всего серотонинергическую, но, вероятно, также и норадренергическую, дофаминергическую, нейротрансмиссию, опосредованную гистамином, ацетилхолином, ГАМК и глутаматом. Такая мультимодальная фармакологическая активность, по-видимому, лежит в основе антидепрессивных и анксиолитических свойств вортиоксетина, а также определяет улучшение когнитивных функций, обучения и памяти, наблюдаемое в исследованиях на животных. Однако поскольку индивидуальный вклад каждой фармакологической мишени в наблюдаемый фармакодинамический профиль вортиоксетина остается неясным, экстраполяция приведенных доклинических данных на человека должна осуществляться с осторожностью. В двух исследованиях с использованием позитронной эмиссионной томографии у людей с целью количественного определения степени занятости переносчиков 5-НТ (с использованием лигандов 11C-MADAM или 11C-DASB), при различном уровне дозирования вортиоксетина, получены следующие данные: среднее количество переносчиков 5-НТ, связанных с вортиоксетином, составляло примерно 50% при дозе 5 мг/сут, 65% при дозе 10 мг/сут и повышалось до 80% при увеличении дозы до 20 мг/сут. Фармакокинетика: Всасывание. Вортиоксетин медленно, но хорошо всасывается после перорального приема. Tmax в плазме — 7–11 ч. После многократного применения в дозах 5, 10 или 20 мг/сут средняя плазменная Cmax составляет 9–33 нг/мл. Абсолютная биодоступность составляет 75%. Прием пищи не оказывает влияние на фармакокинетику препарата (см. «Способ применения и дозы»). Распределение. Средний Vss составляет 2600 л, что свидетельствует об экстенсивном внесосудистом распределении. Степень связывания с белками плазмы — высокая (98–99%) и, по-видимому, не зависит от концентрации вортиоксетина в плазме. Биотрансформация. Вортиоксетин экстенсивно метаболизируется в печени главным образом за счет окисления с помощью изофермента CYP2D6 и в меньшей степени — изоферментов CYP3A4/5 и CYP2C9 и последующей конъюгации с глюкуроновой кислотой. В исследованиях лекарственного взаимодействия не обнаружено ингибирующего или индуцирующего влияния вортиоксетина на изоферменты CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP2E1 или CYP3A4/5 (см. «Взаимодействие»). Вортиоксетин является слабым ингибитором и субстратом Р-gp. Основной метаболит вортиоксетина фармакологически неактивен. Выведение. Средний T1/2 и оральный клиренс составляют 66 ч и 33 л/ч соответственно. Около 2/3 неактивного метаболита вортиоксетина выводится с мочой и около 1/3 — с калом. Лишь незначительное количество вортиоксетина выводится с калом в неизмененном виде. Плазменная Css достигается приблизительно через 2 нед. Линейность/нелинейность. Фармакокинетика носит линейный характер и не зависит от времени в изучавшемся диапазоне доз (2,5–60 мг/сут). В соответствии с T1/2 на основании AUC0–24 после многократных доз 5–20 мг/сут индекс накопления составляет от 5 до 6. Влияние на способность управлять транспортными средствами: Условия хранения и отпуска из аптек Условия хранения:В защищенном от света месте при температуре не выше 25 °С. Хранить в недоступном для детей месте. Отпуск из аптек: По рецепту Регистрационные данные Торговое название Бринтелликс Международное непатентованное название: вортиоксетин Форма выпуска:Таблетки, покрытые пленочной оболочкой, 5 мг, 10 мг, 15 мг и 20 мг. По 14 табл. в контурной ячейковой упаковке (блистере) из ПВХ /ПВДХ и фольги алюминиевой. 1 или 2 бл. помещают в картонную пачку. Состав:Одна таблетка содержит: Активное вещество: вортиоксетина гидробромид - 6,355/12,71/19,065/25,42 мг, эквивалентно 5/10/15/20 мг вортиоксетина АТХ: Регистрация: Лекарственное средство Фармгруппа: Антидепрессаент