теоретическая поэтика

Модель:
RUR 43
Показания Раствор натрия хлорида применяют при больших потерях внеклеточной жидкости или недостаточном ее поступлении (токсическая диспепсия, холера, диарея, неукротимая рвота, обширные ожоги с сильной экссудацией и др.): гипохлоремия и гипонатриемия с обезвоживанием, кишечная непроходимость, интоксикация, для региональной перфузии, совместно с гепарином, противоопухолевыми и другими лекарственными средствами. Противопоказания Противопоказания Гипернатриемия, ацидоз, гиперхлоремия, гипокалиемия, внеклеточная гипергидратация, циркуляторные нарушения, угрожающие отеком головного мозга и лепшх, отек головного , мозга: отек легких, острая левожелудочковая недостаточность, сопутствующее применение глюкокортикостероидов в больших дозах. С осторожностью: екомпенсированная хроническая сердечная недостаточность, хроническая почечная недостаточность (олигоанурия). Беременность не описано Применение и дозы Раствор натрия хлорида для инфузий вводят внутривенно (обычно капельно). Перед введением раствор нагревают до 36-38 °С, доза определяется в зависимости от потери организмом жидкости, ионов натрия и хлора - в среднем составляет 1000 мл/сутки. При больших потерях жидкости и выраженной интоксикации возможно введение до 3000 мл/сутки. Скорость введения - 540 мл/ч (180 кап/мин): при необходимости - скорость введения увеличивают. Детям при шоковой дегидратации (без определения лабораторных параметров) вводят 20- 30 мл/кг. В дальнейшем режим дозирования корректируется в зависимости от лабораторных показателей. Побочные эффекты и передозировка Побочные эффекты: Введение больших объемов (более 3000 мл/сутки) раствора натрия хлорида может привести к хлоридному ацидозу и гипергидратации, а также гипокалиемии. Передозировка: Гипернатриемия, гиперхлоремия и гипергидратация с последующим отеком легких и головного мозга. Взаимодействие с другими ЛС: Совместно с коллоидными гемодинамическими кровезаменителями (взаимное усиление эффекта). При смешивании с другими лекарственными средствами необходимо визуально контролировать совместимость (тем не менее возможна невидимая и терапевтическая несовместимость). Фармакологическое действие и фармакокинетика Оказывает дезинтоксикационное и регидратирующее действие. Восполняет дефицит натрия и хлора при различных патологических состояниях организма и временно увеличивает объем жидкости, циркулирующей в сосудах. Фармакокинетика: Быстро выводится почками без изменений. Особые указания Возможно замораживание препарата при условии сохранности герметичности контейнера. При длительном введении больших доз раствора натрия хлорида необходимо проводить контроль кислотно-основного состояния и концентрации электролитов в плазме крови и моче. Влияние на способность управлять транспортными средствами: не описано Условия хранения и отпуска из аптек Условия хранения:В недоступном для детей месте при температуре не выше 25 °С. Допускается замораживание при транспортировании. Отпуск из аптек: По рецепту Регистрационные данные Торговое название Натрия хлорид Международное непатентованное название:Натрия хлорид. Форма выпуска:раствор для инфузий. Состав:Активные вещества: Натрия хлорид - 9,0 г Вспомогательные вещества: Вода для инъекций - до 1,0 л. Ионный состав: В 1 л препарата содержится: Иона натрия (Na+) - 154 ммоль Иона хлора (СГ) -154 ммоль Теоретическая осмолярность 308 м. Осмоль/л. АТХ: Регистрация: Р N003758/01 Фармгруппа: регидратирующее средство. Дата регистрации: 29.12.2006. Окончание регстрации: . Описание:прозрачная бесцветная жидкость. Упаковка:Раствор для инфузий 0,9 % по 50, 100, 200, 250, 400, 500, 1000, 1500, 2000 или 4500 мл в контейнерах полимерных с одним или двумя портами для инфузионных растворов однократного применения из поливинилхлоридной или из полиолефиновой пленок, или в пакетах для внутривенных инфузий. Каждый контейнер или каждый пакет для внутривенных инфузий упакован во вторичный пакет с нанесенной на него инструкцией поприменению. Вторичный пакет изготовлен из полипропилена или полиэтилена. Контейнеры или пакеты для внутривенных инфузий во вторичной упаковке помещены в транспортную тару (ящики из гофрированного картона). Контейнеры из полиолефиновой пленки могут быть упакованы в транспортную тару (ящики из гофрированного картона) без вторичного пакета (для стационаров). В ящик с контейнерами вкладывают инструкции по применению в количестве, равном количеству контейнеров. контейнеры полимерные из ПВХ(1)-пакеты полимерныеконтейнеры полиолефиновые(1)-пакеты полимерныеконтейнеры полиолефиновые-ящики картонныепакеты инфузионные(1)-пакеты полимерные Срок годности:3 года. Не использовать по истечении срока годности, указанного на упаковке. Владелец рег.удостоверения:Дальхимфарм ОАО Производитель. Дальхимфарм ОАО Представительство. Дальхимфарм ОАО

Модель:
RUR 1005
Для лечения алопеции и стабилизации процесса выпадения волос у мужчин и женщин. Спрей для наружного применения ALERANA®: улучшает микроциркуляцию в коже головы, стимулирует переход волосяных фолликулов в активную фазу роста, снижает воздействие андрогенов на волосяные фолликулы. Клинически доказано: повышенное выпадение волос прекращается уже через 6 недель лечения в 87% случаев Механизм действия Спреи ALERANA® воздействуют непосредственно на корни волос. Спреи увеличивают микроциркуляцию в коже головы, восстанавливают нормальное питание волосяных фолликулов. Благодаря этому они останавливают интенсивное выпадение и стимулируют рост новых волос. Состав 1 мл препарата содержит: действующее вещество: миноксидил - 50,0 мг; вспомогательные вещества: пропиленгликоль - 0,5 мл, этанол 95 % (этиловый спирт 95 %) - 0,3 мл, вода очищенная - до 1,0 мл. Показания Рекомендован для лечения интенсивного выпадения волос восстанавливает нормальное развитие волосяных фолликулов останавливает интенсивное выпадение волос стимулирует рост новых волос увеличивает продолжительность фазы активного роста волоса способствует увеличению толщины волоса повышает густоту волос препарат эффективен при лечении андрогенной алопеции. Противопоказания повышенная чувствительность к миноксидилу или другим компонентам препарата; возраст младше 18 лет; нарушение целостности кожных покровов, дерматозы волосистой части головы. С осторожностью: пожилой возраст - старше 65 лет (при местном применении). Применение при беременности и кормлении грудью Препарат Алерана®не следует применять во время беременности и лактации. Применение у детей противопоказано: возраст младше 18 лет. Применение у пожилых пациентов С осторожностью: пожилой возраст - старше 65 лет (при местном применении). Особые указания Не наносить препарат на другие участки тела. Наносите препарат Алерана® только на сухую кожу волосистой части головы после купания или подождите около 4 ч после нанесения препарата перед купанием. Не давайте голове намокнуть ранее, чем через 4 ч после нанесения препарата. Если Вы наносили препарат с помощью кончиков пальцев, после обработки головы руки следует тщательно вымыть. Мыть волосы при применении препарата Алерана® рекомендуется в привычном режиме. Лак для волос и другие средства ухода за волосами могут использоваться в период применения препарата Алерана® . Перед нанесением средств для ухода за волосами необходимо сначала нанести препарат Алерана® и подождать, пока обработанный участок кожи полностью не высохнет. Не имеется данных о том, что окраска волос, выполнение химической завивки или использование смягчителей для волос может каким-либо образом снижать эффективность препарата. Однако, для предотвращения возможного раздражения волосистой части головы необходимо убедиться в том, что препарат был полностью смыт с волос и волосистой части кожи головы перед использованием данных химических средств. Перед тем как начать лечение препаратом Алерана®, пациенты должны пройти общее обследование, включающее сбор и изучение медицинского анамнеза. Врач должен убедиться в том, что кожа волосистой части головы здорова. При появлении системных побочных эффектов или тяжелых кожных реакций пациентам следует отменить препарат и обратиться к врачу. В состав препарата Алерана® входит этиловый спирт, который может вызывать воспаление и раздражение глаз. В случае попадания препарата на чувствительные поверхности (глаза, раздраженную кожу, слизистые оболочки) необходимо промыть участок большим количеством холодной воды. Передозировка Случайный прием внутрь препарата Алерана® может вызвать системные побочные эффекты, обусловленные сосудорасширяющими свойствами миноксидила (5 мл 2%-го раствора содержат 100 мг миноксидила - максимальную рекомендованную дозу для взрослых при лечении артериальной гипертензии; 5 мл 5%-го раствора содержат 250 мг миноксидила, т.е. дозу в 2.5 раза превышающую максимальную рекомендованную суточную дозу для взрослых при лечении артериальной гипертензии). Признаки передозировки: задержка жидкости, снижение артериального давления, тахикардия. Лечение: для устранения задержки жидкости при необходимости могут быть назначены диуретики; для лечения тахикардии - бета-адреноблокаторы. Для лечения гипотензии следует ввести внутривенно 0.9% раствор натрия хлорида. Не следует назначать симпатомиметические средства, например, норэпинефрин и эпинефрин, обладающие чрезмерной кардиостимулирующей активностью. Лекарственное взаимодействие Существует теоретическая возможность усиления ортостатической гипотензии у пациентов, получающих сопутствующее лечение периферическими сосудорасширяющими средствами, не получившая, однако, клинического подтверждения. Нельзя исключить очень незначительное повышение содержания миноксидила в крови пациентов, страдающих артериальной гипертензией и принимающих миноксидил внутрь в случае одновременного использования препарата Алерана®, хотя соответствующие клинические исследования не проводились. Установлено, что миноксидил для наружного применения может взаимодействовать с некоторыми другими лекарственными средствами для наружного применения. Одновременное использование раствора миноксидила для наружного применения и крема, содержащего бетаметазон (0.05%) приводит к снижению системного всасывания миноксидила. Одновременное использование крема, содержащего третиноин (0.05%), приводит к повышенному всасыванию миноксидила. Одновременное нанесение на кожу миноксидила и препаратов для наружного применения, таких как третиноин и дитранол, которые вызывают изменения защитных функций кожи, может привести к увеличению всасывания миноксидила. Фармакологическое действие При местном применении миноксидила отмечено его стимулирующее влияние на рост волос у лиц с андрогенной алопецией (поредением волос, облысением). Улучшает микроциркуляцию, стимулирует переход волосяных фолликулов в активную растущую фазу, изменяет воздействие андрогенов на волосяные мешочки. Уменьшает образование 5-альфа-дегидростерона (возможно, опосредованно), который играет существенную роль в формировании облысения. Наилучший эффект оказывает при небольшой давности заболевания (не более 10 лет), молодом возрасте пациентов, лысине в области темени не более 10 см, наличии в центре лысины более 100 пушковых и терминальных волос. Проявление признаков роста волос отмечается через 4 и более месяцев применения препарата. Начало и степень выраженности эффекта могут колебаться у разных больных. 5%-ый раствор препарата стимулирует рост волос сильнее, чем 2%-ый раствор, что было отмечено по увеличению роста пушковых волос. После прекращения применения препарата Алерана® рост новых волос приостанавливается, и в течение 3-4 месяцев возможно восстановление исходного внешнего вида. Точный механизм действия препарата Алерана® при лечении андрогенетической алопеции неизвестен. Миноксидил неэффективен в случае облысения, вызванного приемом лекарственного средства, неправильным питанием (дефицит железа (Fe), витамина А), в результате укладки волос в "тугие" прически. Фармакокинетика При наружном применении миноксидил плохо всасывается через нормальную неповрежденную кожу: в среднем 1.5% (0.3–4.5%) общей нанесенной дозы поступает в системный кровоток. Влияние сопутствующих кожных заболеваний на всасывание миноксидила неизвестно. После прекращения применения препарата примерно 95% миноксидила, попавшего в системный кровоток, выводится в течение 4 дней. Профиль метаболической биотрансформации миноксидила после наружного применения препарата Алерана® до настоящего времени полностью не изучен. Миноксидил не связывается с белками плазмы и выводится почками посредством клубочковой фильтрации. Миноксидил не проникает через гематоэнцефалический барьер. Экскретируются преимущественно с мочой. Миноксидил и его метаболиты выводятся с помощью гемодиализа. Побочные действия Нарушения со стороны нервной системы: часто – головная боль; очень редко – головокружение. Нарушения со стороны кожи и подкожных тканей: часто – кожный зуд, сыпь; редко – дерматит, проявляющийся в виде покраснения, шелушения и воспаления; очень редко – временное выпадение волос, изменение цвета волос, нарушение текстуры волос, гипертрихоз (нежелательный рост волос вне места применения), реакции в месте применения (эти реакции могут распространяться на уши и лицо, включают: кожный зуд, раздражение, боль, сыпь, отек, сухость кожи, эритему; однако в некоторых случаях реакции могут быть более тяжелыми, включая: эксфолиацию, дерматит, образование пузырей, кровотечение, изъязвление). Нарушения со стороны иммунной системы: очень редко – ангионевротический отек (проявлениями ангионевротического отека могут быть: отек губ, отек тканей ротовой полости, отек ротоглотки, отек глотки и отек языка), гиперчувствительность (проявлениями гиперчувствительности могут быть: генерализованная эритема, генерализованный кожный зуд, отек лица и чувство стеснения в горле), аллергический контактный дерматит. Нарушения со стороны органа зрения: очень редко – раздражение глаз. Нарушения со стороны сердца: очень редко: тахикардия, ощущение сердцебиения. Нарушения со стороны дыхательной системы, органов грудной клетки и средостения: очень редко – одышка. Нарушения со стороны желудочно-кишечного тракта: очень редко – тошнота, рвота. Общие расстройства и нарушения в месте введения: очень редко – периферический отек, боль в грудной клетке. Нарушение со стороны сосудов: нечасто – снижение артериального давления. Если любые из указанных в инструкции побочных эффектов усугубляются, или Вы заметили любые другие побочные эффекты, не указанные в инструкции, сообщите об этом врачу. Режим дозирования Наружно. Независимо от размера обрабатываемого участка следует наносить 1 мл раствора с помощью дозатора (7 нажатий) 2 раза в день на пораженные участки волосистой части головы, начиная с центра проблемной зоны. После применения необходимо вымыть руки. Суммарная суточная доза не должна превышать 2 мл (доза не зависит от размера пораженной области). Пациентам, у которых при применении 2%-го раствора не наблюдается косметически удовлетворительного роста волос, и пациентам, для которых желателен более быстрый рост волос, можно использовать 5%-ый раствор. Для мужчин Алерана® наиболее эффективна при выпадении волос на макушке, для женщин - при выпадении волос в области срединного пробора. Наносите препарат Алерана® только на сухую кожу волосистой части головы. Раствор не требует смывания. Появление первых признаков стимуляции роста волос возможно после применения препарата 2 раза в сут в течение 4 месяцев или более. Начало и степень выраженности роста волос, а также качество волос могут колебаться у различных больных. Согласно единичным сообщениям в течение 3-4 месяцев после прекращения лечения можно ожидать восстановления исходного внешнего вида. Срок лечения в среднем - около 1 года Рекомендации по использованию насадок: Закрепленный на флаконе дозатор лучше подходит для нанесения раствора на большие проблемные участки волосистой части головы. Для нанесения препарата под длинные волосы или на небольшие участки кожи головы удобнее использовать удлиненную распылительную насадку. Для этого необходимо снять закрепленный на флаконе дозатор и укрепить удлиненную распылительную насадку
Модель:
RUR 1058
Показания Лечение андрогенной алопеции (восстановление волосяного покрова) и стабилизация процесса выпадения волос у мужчин и женщин. Противопоказания Противопоказания Повышенная чувствительность к миноксидилу или другим компонентам препарата: возраст младше 18 лет: нарушение целостности кожных покровов, дерматозы волосистой части головы. С осторожностью: Пожилой возраст - старше 65 лет. Беременность Не следует применять препарат при беременности и кормлении грудью. Применение и дозы Наружно. Независимо от размера обрабатываемого участка необходимо наносить 1 мл раствора с помощью дозатора (7 нажатий) 2 раза в день на пораженные участки волосистой части головы, начиная с центра проблемной зоны. После применения необходимо вымыть руки. Суммарная суточная доза не должна превышать 2 мг (доза не зависит от размера пораженной области). Пациентам, у которых при применении 2 %-го раствора не наблюдается удовлетворительного роста волос, и пациентам, для которых желателен более быстрый рост волос, можно использовать 5 %-ый раствор. Для мужчин препарат Генеролон® наиболее эффективен при выпадении волос на макушке, для женщин - при выпадении волос в области срединного пробора. Препарат Генеролон® наносится только на сухую кожу волосистой части головы. Раствор не требует смывания. Появление первых признаков стимуляции роста волос возможно после применения препарата 2 раза в сутки в течение 4 месяцев, или более. Начало и степень выраженности роста волос, а также качество волос могут колебаться у разных больных. Согласно единичным сообщениям, в течение 3-4 месяцев после прекращения лечения можно ожидать восстановления исходного внешнего вида. Длительность лечения в среднем - около 1 года. Подготовка к применению: Снять навинчивающуюся крышку и закрепить мерный насос. На трубку сверху насоса укрепить удлиненную насадку для распыления. Нажать на распылительную насадку 3-4 раза для,того, чтобы насос наполнился раствором, после чего препарат можно применять. Побочные эффекты и передозировка Побочные эффекты: Местные побочные эффекты: Наиболее часто встречающимся побочным эффектом является дерматит волосистой части головы. Реже наблюдаются более выраженные случаи дерматита, проявляющиеся в виде покраснения, шелушения и воспаления. В редких случаях отмечается зуд головы, аллергический контактный дерматит, фолликулит, гипертрихоз (нежелательный рост волос на теле, включая рост волос на лице у женщин), себорея. Применение миноксидила может вызвать усиление выпадения волос при.переходе от фазы покоя к фазе роста волос, при этом старые волосы выпадают и на их месте вырастают новые. Это временное явление обычно наблюдается спустя 2-6 недель после начала лечения и постепенно, в течение 2 последующих недель, прекращается (появление первых признаков действия миноксидила). Системные побочные эффекты (при случайном проглатывании препарата): Дерматологические заболевания: неспецифические аллергические реакции (кожная сыпь, крапивница), отек лица. Дыхательная система: одышка, аллергический ринит. Нервная система: головная боль, головокружение, вертиго, неврит. Сердечно-сосудистая система: боль в грудной клетке, колебания артериального давления, учащенное сердцебиение, изменение ритма сердечных сокращений, отеки. Передозировка: Случайный прием внутрь препарата Генеролон® может вызвать системные побочные эффекты, обусловленные сосудорасширяющими свойствами миноксидила (5 мл 2 %-го раствора содержит 100 мг миноксидила - максимальную рекомендованную дозу для взрослых при приеме внутрь при лечении артериальной гипертензии: (5 мл 5 %-го раствора содержит 250 мг миноксидила, то есть дозу в 2,5 раза превышающую максимальную рекомендованную суточную дозу для взрослых при приеме внутрь при лечении артериальной гипертензии). Признаки передозировки: задержка жидкости, снижение артериального давления, тахикардия. Лечение: для устранения задержки жидкости при необходимости могут быть назначены диуретики: для лечения тахикардии - бета-адреноблокаторы. Для лечения гипотензии следует ввести внутривенно 0,9 % раствор натрия хлорида. Не следует назначать симпатомиметические средства, например, норэпинефрин и эпинефрин, обладающие чрезмерной кардиостимулирующей активностью. Взаимодействие с другими ЛС: Существует теоретическая возможность (клиническое подтверждение отсутствует) усиления ортостатической гипотензии у пациентов, получающих сопутствующее лечение периферическими сосудорасширяющими средствами. Нельзя исключить очень незначительное повышение содержания миноксидила в крови пациентов, страдающих артериальной гипертензией и принимающих миноксидил внутрь в случае одновременного использования препарата Генеролон®, хотя соответствующие клинические исследования не проводились. Установлено, что миноксидил для наружного применения может, взаимодействовать с некоторыми лекарственными средствами для наружного применения. Одновременное использование раствора миноксидила для наружного применения и крема, содержащего бетаметазон (0,05 %) приводит к снижению системного всасывания миноксидила. Одновременное использование крема, содержащего третиноин (0,05 %), приводит к повышенному всасыванию миноксидила. Одновременное нанесение на кожу миноксидила и препаратов для наружного применения, таких как третиноин и дитранол, которые вызывают изменение защитных фикций кожи, может привести к увеличению всасывания миноксидила. Фармакологическое действие и фармакокинетика При местном применении миноксидила стимулирует рост волос у лиц с андрогенной алопецией (поредением волос, облысением). Улучшает микроциркуляцию, стимулирует переход волосяных клеток в активную растущую фазу, изменяет воздействие андрогенов на волосяные мешочки. Уменьшает образование 5-альфа-дегидростерона (возможно, опосредованно), который играет существенную роль в формировании облысения. Наилучший эффект оказывает при небольшой давности заболевания (не более 10 лет), молодом возрасте пациентов, лысине в области темени не более 10 см, наличии в центре лысины более 100 пушковых и терминальных волос. Проявление признаков роста волос отмечается через 4 и более месяцев применения препарата. Начало и степень выраженности эффекта могут колебаться у разных больных. 5 %-ый раствор препарата стимулирует рост волос сильнее, чем 2 %-ый растврр, что было отмечено по увеличению роста пушковых волос: После прекращения применения препарата Генеролон® рост новых волос приостанавливается, и в течение 3-4 месяцев-возможно восстановления исходного внешнего вида. Точный механизм действия препарата Генеролон® при лечении андрогенной алопеции неизвестен. Миноксидил неэффективен в случае облысения, вызванного приемом лекарственного средства, неправильным питанием (дефицит железа (Fе), витамина А), в результате укладки волос в "тугие" прически. Фармакокинетика: При наружном применении миноксидил плохо всасывается через нормальную неповрежденную кожу: в среднем 1,5 % (0,3 - 4,5 %) общей нанесенной дозы поступает в системный кровоток. Влияние сопутствующих кожных заболеваний на всасывание миноксидила неизвестно. После прекращения применения препарата примерно 95 % миноксидила, попавшего в системный кровоток, выводится в течение 4 дней. Профиль метаболической биотрансформации миноксидила после наружного применения препарата Генеролон® до настоящего времени полностью не изучен. Миноксидил не связывается с белками плазмы и выводится почками посредством клубочковой фильтрации. Миноксидил не проникает через гематоэнцефалический барьер. Экскретируется преимущественно с мочой. Миноксидил и его метаболиты выводятся с помощью гемодиализа. Особые указания Не наносить препарат на другие участки тела. Препарат Генеролон® наносят только на сухую кожу волосистой части головы после купания или следует подождать около 4 часов после нанесения препарата перед купанием. Не давайте голове намокнуть ранее, чем через 4 часа после нанесения препарата. Мыть волосы при применении препарата Генеролон® рекомендуется в привычном режиме. В период применения препарат Генеролон® можно пользоваться лаком для волос и другими средствами ухода за волосами. Перед нанесением средств для ухода за волосами необходимо сначала нанести препарат Генеролон® и подождать, пока обработанный участок кожи полностью не высохнет. Нет данных о том, что окраска волос, выполнение химической завивки или использование смягчителей для волос может снижать эффективность препарата. Однако, для предотвращения возможного раздражения волосистой части головы необходимо убедиться в том, что препарат был полностью смыт с волос и волосистой части кожи головы перед использованием данных химических средств. Перед началом лечения препаратом Генеролон® пациенты должны пройти общее обследование, включающее сбор и изучение медицинского анамнеза. Врач должен убедиться в том, что кожа волосистой части головы здорова. При появлении системных побочных эффектов или тяжелых кожных реакций пациентам следует отменить препарат и обратиться к врачу. В состав препарата Генеролон® входит этиловый спирт, который может вызвать воспаление и раздражение глаз. В случае попадания препарата на чувствительные поверхности (глаза, раздраженную кожу, слизистые оболочки) необходимо промыть участок большим количеством холодной воды. Следует избегать вдыхания препарата при распылении. После применения препарата следует тщательно вымыть руки. Влияние на способность управлять транспортными средствами: Условия хранения и отпуска из аптек Условия хранения:При температуре не выше 25 °С. Хранить в недоступном для детей месте! Отпуск из аптек: Без рецепта Регистрационные данные Торговое название Генеролон® Международное непатентованное название:Миноксидил. Форма выпуска:спрей для наружного применения. Состав:1 мл раствора содержит: активное вещество: миноксидил - 20,00 мг или 50,00 мг: вспомогательные вещества: этанол (96 %) - 571,00 / 243,00 мг, пропиленгликоль - 104,00 / 520,00 мг, вода - до 1 мл. АТХ: Регистрация: Лекарственное средство ЛП-001609 Фармгруппа: Средство лечения алопеции. Дата регистрации: 23.03.2012 / 19.04.2016. Окончание регстрации: . Описание:Бесцветный или слегка окрашенный с желтоватым оттенком, прозрачный водно-спиртовой раствор с запахом спирта. Упаковка:Спрей для наружного применения 2% и 5%. 60 мл раствора во флаконе белого цвета из полиэтилена высокой плотности (ПЭВП) с завинчивающейся крышкой полипропиленовой (ПП) белого цвета, оснащенной пластиковым кольцом контроля первого вскрытия.1 или 2 флакона в комплекте с 1 пластиковым мерным насосом и 1 насадкой для распыления в защитном пакетике и инструкцией по применению помещают в картонную пачку.3 флакона в комплекте с 2 пластиковыми мерными насосами и 2 насадками для распыления в защитном пакетике и инструкцией по применению помещают в картонную пачку. Срок годности:Спрей для наружного применения 2% - 3 года. Спрей для наружного применения 5% - 4 года. Не применять по истечении срока годности. Владелец рег.удостоверения:БЕЛУПО, лекарства и косметика д.д. Производитель:BELUPO, Pharmaceuticals &: Cosmetics, d.d. Представительство:БЕЛУПО, лекарства и косметика д.д. Информация предоставлена: Компанией ГЭОТАР - http://www.lsgeotar.ru/
Модель:
RUR 1075
Показания Контрацепция. Противопоказания Противопоказания Препарат МИДИАНА® не должен назначаться при наличии какого-либо из состояний, перечисленных ниже. Если какие-либо из этих состояний развиваются впервые на фоне приема препарата, требуется его немедленная отмена: - наличие тромбозов вен в настоящее время или в анамнезе (тромбоз глубоких вен, тромбоэмболия легочной артерии): - наличие тромбозов артерий в настоящее время или в анамнезе (например, инфаркт миокарда) или предшествующих состояний (например, стенокардия и транзиторная ишемическая атака): - осложненные поражения клапанного аппарата сердца, фибрилляция предсердий, неконтролируемая артериальная гипертензия: - серьезное хирургическое вмешательство с длительной иммобилизацией: - курение в возрасте старше 35 лет: - печеночная недостаточность: - цереброваскулярные заболевания в настоящее время или в анамнезе: - наличие тяжелых или множественных факторов риска артериального тромбоза: сахарный диабет с сосудистыми осложнениями: выраженная артериальная гипертензия: выраженная дислипопротеинемия: - наследственная или приобретенная предрасположенность к венозным или артериальным тромбозам, такая как резистентность к АПС (активированному протеину С), недостаточность антитромбина III, недостаточность протеина С, недостаточность протеина S, гипергомоцистеинемия и наличие антифосфолипидных антител (антитела к кардиолипину, волчаночный антикоагулянт): - панкреатит, в том числе в анамнезе, если отмечалась выраженная гипертриглицеридемия: - тяжелые заболевания печени (до нормализации печеночных проб) в настоящее время или в анамнезе: - выраженная хроническая почечная недостаточность или острая почечная недостаточность: - опухоли печени (доброкачественные или злокачественные), в настоящее время или в анамнезе: - гормонозависимые злокачественные заболевания половой системы (половых органов, молочных желез) или подозрение на них: - кровотечение из влагалища неясного генеза: - мигрень с очаговой неврологической симптоматикой в анамнезе: - беременность или подозрение на нее: - период лактации: - гиперчувствительность к препарату или любому его компоненту: - наследственная непереносимость галактозы, лактазная недостаточность, глюкозо-галактозная мальабсорбция/ С осторожностью: Факторы риска развития тромбоза и тромбоэмболий: курение в возрасте до 35 лет, ожирение, дислипопротеинемия, контролируемая артериальная гипертензия, мигрень без очаговой неврологической симптоматики, неосложненные пороки клапанов сердца, наследственная предрасположенность к тромбозу (тромбозы, инфаркт миокарда или нарушение мозгового кровообращения в молодом возрасте у кого-либо из ближайших родственников): заболевания, при которых могут отмечаться нарушения периферического кровообращения: сахарный диабет, системная красная волчанка (СКВ), гемолитико-уремический синдром, болезнь Крона, язвенный колит, серповидно-клеточная анемия, флебит поверхностных вен: наследственный ангионевротический отек, гипертриглицеридемия, заболевания печени: заболевания, впервые возникшие или усугубившиеся во время беременности или на фоне предыдущего приема половых гормонов (в т.ч. желтуха и/или зуд, связанные с холестазом, холелитиаз, отосклероз с ухудшением слуха, порфирия, герпес во время беременности в анамнезе, малая хорея (болезнь Сиденгама), хлоазма, послеродовый период. Беременность Во время беременности и лактации применение препарата МИДИАНА® противопоказано. Если беременность наступила на фоне гормональной контрацепции, необходима немедленная отмена препарата. Имеющиеся немногочисленные данные о непреднамеренном, по неосторожности, приеме комбинированных пероральных контрацептивов свидетельствуют об отсутствии тератогенного эффекта и увеличении риска для детей и женщин во время родов. Комбинированные пероральные контрацептивы влияют на лактацию, могут уменьшать количество и изменять состав грудного молока. Небольшие количества гормональных контрацептивов или их метаболитов обнаруживаются в молоке во время гормональной контрацепции и могут оказывать воздействие на ребенка. Применение комбинированных пероральных контрацептивов возможно после полного прекращения грудного вскармливания. Применение и дозы Таблетки необходимо принимать каждый день примерно в одно и то же время, при необходимости запивая небольшим количеством жидкости, в последовательности, указанной на блистерной упаковке. Необходимо принимать по одной таблетке в день в течение 21 дня подряд. Прием таблеток из каждой последующей упаковки должен начинаться после 7-дневного интервала в приеме таблеток, в течение которого обычно наступает менструальноподобное кровотечение. Оно обычно начинается через 2-3 дня после приема последней таблетки и может не закончиться к моменту начала следующей упаковки. Как принимать препарат МИДИАНА® Если ранее гормональные контрацептивы не применялись (в последний месяц): Прием комбинированных пероральных контрацептивов начинается в первый день естественного менструального цикла женщины (то есть в первый день менструального кровотечения). В случае замены другого комбинированного перорального контрацептива, вагинального кольца или трансдермального пластыря: Для женщины предпочтительно начать прием препарата МИДИАНА® на следующий день после приема последней активной таблетки предыдущего комбинированного перорального контрацептива: в таких случаях прием лекарственного средства МИДИАНА® не должен начинаться позднее следующего дня после обычного перерыва в приеме таблеток или приема неактивных таблеток ее предыдущего комбинированного перорального контрацептива. При замене вагинального кольца или трансдермального пластыря прием перорального контрацептива МИДИАНА® желательно начинать в день удаления предыдущего средства: в таких случаях прием препарата МИДИАНА® должен начаться не позднее дня намеченной процедуры замены. В случае замены метода с применением только прогестинов (мини-пили, инъекционные формы, имплантаты) или внутриматочных контрацептивов с высвобождением прогестинов: Женщина может перейти с мини-пили в любой день (с имплантата или внутриматочного контрацептива - в день его удаления, с инъекционной формы - со дня, когда должна была быть сделана следующая инъекция). Однако во всех этих случаях желательно использовать дополнительно барьерный метод контрацепции в течение первых 7 дней приема таблеток. После прерывания беременности в первом триместре: Женщина может начать прием немедленно. При соблюдении этого условия нет необходимости в дополнительных мерах контрацепции. После родов или прерывания беременности во втором триместре: Женщине желательно начать прием препарата МИДИАНА® на 21-28 день после родов или прерывания беременности во втором триместре. Если прием начат позднее, необходимо использовать дополнительно барьерный метод контрацепции в течение первых 7 дней приема таблеток. В случае наличия полового контакта до начала приема препарата должна быть исключена беременность или необходимо дождаться первой менструации. Прием пропущенных таблеток Если опоздание в приеме таблетки составило менее 12 часов, контрацептивная защита не снижается. Женщине необходимо принять таблетку как можно скорее, следующие таблетки принимаются в обычное время. Если опоздание в приеме таблеток составило более 12 часов, контрацептивная защита может быть снижена. Тактика при пропуске приема препарата основывается на следующих двух простых правилах: 1. Прием таблеток нельзя прекращать более чем на 7 дней: 2. Чтобы достичь адекватного подавления гипоталамо-гипофизарно-яичниковой системы, необходимо 7 дней непрерывного приема таблеток. Соответственно в ежедневной практике можно давать следующие советы: Неделя 1 Необходимо принять последнюю пропущенную таблетку как можно скорее, даже если это означает прием двух таблеток одновременно. Следующую таблетку принимают в обычное время. Дополнительно должен быть использован барьерный метод контрацепции в течение следующих 7 дней. Если половое сношение имело место в течение 7 дней перед пропуском таблетки, необходимо учитывать вероятность наступления беременности. Чем больше таблеток пропущено и чем ближе этот пропуск к 7-дневному перерыву в приеме препарата, тем выше риск наступления беременности. Неделя 2 Необходимо принять последнюю пропущенную таблетку как можно скорее, даже если это означает прием двух таблеток одновременно. Следующую таблетку принимают в обычное время. Если женщина в течение предшествующих 7 дней принимала таблетки правильно, нет необходимости использовать дополнительные средства контрацепции. Однако если она пропустила более чем 1 таблетку, необходимо использовать дополнительные меры контрацепции в следующие 7 дней. Неделя 3 Вероятность снижения контрацептивного эффекта значительна из-за предстоящего 7-дневного перерыва в приеме таблеток. Однако корректируя расписание приема таблеток, можно предотвратить снижение контрацептивной защиты. Если следовать любому из двух следующих советов, дополнительных способов контрацепции не понадобится, если в течение предшествующих 7 дней перед пропуском таблетки женщина принимала все таблетки правильно. Если это не так, она должна следовать первому из двух способов и также использовать дополнительные меры контрацепции в течение следующих 7 дней. 1. Необходимо принять последнюю пропущенную таблетку как можно скорее, даже если это означает прием двух таблеток одновременно. Следующую таблетку принимают в обычное время. Прием таблеток из новой упаковки должен быть начат, как только закончится текущая упаковка, то есть без перерыва между приемом двух упаковок. Вероятнее всего, кровотечения "отмены" не будет до конца второй упаковки, но могут наблюдаться мажущие кровянистые выделения или прорывное маточное кровотечение в дни приема таблеток. 2. Женщине можно рекомендовать прекратить прием таблеток из данной упаковки. Затем необходимо прекратить прием таблеток на 7 дней, включая дни, когда она забывала принимать таблетки, и потом начать прием таблеток из новой упаковки. В случае пропуска в приеме таблеток и отсутствия в первый свободный от приема препарата интервал кровотечения "отмены" необходимо исключить беременность. Советы в случае расстройств желудочно-кишечного тракта В случае тяжелых реакций со стороны желудочно-кишечного тракта (таких как рвота или диарея), всасывание может быть неполным, и необходимо применять дополнительные меры контрацепции. В случае рвоты в течение 3-4 часов после приема таблетки, необходимо как можно скорее принять новую, заменяющую таблетку. Новую таблетку при возможности необходимо принять в течение 12 часов после обычного времени приема. Если пропущено больше 12 часов, по возможности необходимо соблюдать правила приема препарата, Прием пропущенных таблеток Если пациентка не хочет изменять нормальный режим приема препарата, она должна принять дополнительную таблетку (или несколько таблеток) из другой упаковки. Как отсрочить кровотечение "отмены" Для отсрочки дня начала кровотечения "отмены" необходимо продолжить прием препарата МИДИАНА® из новой упаковки без перерыва в приеме. Отсрочка возможна до окончания таблеток во второй упаковке. Во время удлинения цикла могут отмечаться мажущие кровянистые выделения из влагалища или прорывные маточные кровотечения. Возобновить прием препарата МИДИАНА® из новой пачки следует после обычного 7-дневного перерыва. Для переноса дня начала кровотечения "отмены" на другой день недели обычного расписания следует укоротить ближайший перерыв в приеме таблеток на столько дней, на сколько это необходимо. Чем короче интервал, тем выше риск того, что кровотечения "отмены" не будет, а во время приема таблеток из второй упаковки будут отмечаться мажущие кровянистые выделения и прорывные маточные кровотечения (так же как в случае отсрочки начала кровотечения "отмены"). Побочные эффекты и передозировка Побочные эффекты: Во время одновременного применения дроспиренона и этинилэстрадиола сообщалось о следующих побочных реакциях: ТАБЛИЦЪ Передозировка: Сведений о передозировке дроспиренон и этинилэстрадиол-содержащих препаратов не имеется. Однако возможно возникновение тошноты, рвоты и кровянистых выделений/кровотечений из влагалища. Специфического антидота нет. Следует проводить симптоматическое лечение. Взаимодействие с другими ЛС: Взаимодействие между пероральными контрацептивами и другими лекарственными препаратами может приводить к прорывному маточному кровотечению и/или снижению контрацептивной надежности. В литературе описаны следующие виды взаимодействий: Влияние на метаболизм в печени Некоторые препараты вследствие индукции микросомальных ферментов способны увеличивать клиренс половых гормонов (фенитоин, барбитураты, примидон, карбамазепин и рифампицин: возможно такое же влияние окскарбазепина, топирамата, фелбамата, ритонавира, гризеофульвина и растительного средства на основе зверобоя продырявленного (Hypericum perforatum). Сообщалось о возможном действии ингибиторов ВИЧ-протеазы (например, ритонавира) и ненуклеозидных ингибиторов обратной транскриптазы (например, невирапина) и их сочетаний на метаболизм в печени. Влияние на кишечно-печеночную рециркуляцию Клинические наблюдения показывают, что одновременное применение с некоторыми антибиотиками, такими как пенициллины и тетрациклины, снижает кишечно-печеночную рециркуляцию эстрогенов, что может приводить к снижению концентрации этинилэстрадиола. Женщины, принимающие любые из вышеупомянутых классов лекарственных препаратов, должны использовать барьерный метод контрацепции в дополнение к препарату МИДИАНА® или перейти на любой другой метод контрацепции. Женщины, получающие постоянное лечение препаратами, содержащими активные вещества, влияющие на микросомальные ферменты печени, в течение 28 дней после их отмены дополнительно должны использовать негормональный метод контрацепции. Женщины, принимающие антибиотики (кроме рифампицина или гризеофульвина), должны временно использовать барьерный метод контрацепции в дополнение к комбинированному пероральному контрацептиву, как во время приема препарата, так и в течение 7 дней после его отмены. Если сопутствующее применение препарата начато в конце приема упаковки препарата МИДИАНА®, следующая упаковка должна быть начата без обычного перерыва в приеме. Основной метаболизм дроспиренона в плазме человека осуществляется без вовлечения системы цитохрома Р450. Ингибиторы этой ферментной системы, таким образом, не влияют на метаболизм дроспиренона. Влияние препарата МИДИАНА® на другие лекарственные препараты Пероральные контрацептивы могут влиять на метаболизм других лекарственных средств. Кроме того, могут изменяться их концентрации в плазме и тканях - как повышаться (например, циклоспорин), так и снижаться (например, ламотриджин). Основываясь на результатах исследований ингибирования in vitro и исследований взаимодействия in vivo у женщин-добровольцев, принимающих омепразол, симвастатин и мидазолам в качестве индикаторов-субстратов, влияние дроспиренона в дозе 3 мг на метаболизм других активных веществ маловероятно. Другие взаимодействия Имеется теоретическая возможность повышения концентрации сывороточного калия у женщин, получающих пероральные контрацептивы одновременно с другими лекарственными средствами, увеличивающими концентрацию калия в сыворотке крови: ингибиторы ангиотензинпревращающего фермента (АПФ), антагонисты рецепторов ангиотензина II, некоторые нестероидные противовоспалительные препараты (например, индометацин), калийсберегающие диуретики и антагонисты альдостерона. Однако в исследовании, оценивающем взаимодействие ингибитора АПФ с комбинацией дроспиренон+этинилэстрадиол у женщин с умеренной артериальной гипертензией, не было выявлено достоверного различия между сывороточными концентрациями калия у женщин, получавших эналаприл и плацебо. Лабораторные исследования Прием гормональных контрацептивов может влиять на результаты отдельных лабораторных тестов, включая биохимические показатели функции печени, щитовидной железы, надпочечников и почек, а также концентрацию транспортных белков плазмы, таких как кортикостероидсвязывающий глобулин и липидно/липопротеиновые фракции, показатели углеводного обмена, свертывания крови и фибринолиза. Изменения обычно происходят в пределах лабораторных норм. Вследствие своей небольшой антиминералокортикоидной активности дроспиренон повышает активность ренина и концентрации альдостерона плазмы крови. Фармакологическое действие и фармакокинетика Контрацептивный эффект препарата МИДИАНА® основывается на взаимодействии различных факторов, наиболее важными из которых являются торможение овуляции и изменения эндометрия. Препарат МИДИАНА® - это комбинированный пероральный контрацептив, содержащий этинилэстрадиол и дроспиренон. В терапевтической дозе дроспиренон также обладает антиандрогенными и слабыми антиминералокортикоидными свойствами. Он лишен какой-либо эстрогенной, глюкокортикоидной и антиглюкокортикоидной активности. Это обеспечивает дроспиренону фармакологический профиль, сходный с натуральным прогестероном. Имеются данные о снижении риска развития рака эндометрия и яичников при применении комбинированных пероральных контрацептивов. Фармакокинетика: Дроспиренон (3 мг) Всасывание При пероральном приеме дроспиренон быстро и почти полностью абсорбируется. Максимальная концентрация активного вещества в сыворотке, равная 37 нг/мл, достигается через 1-2 часа после однократного приема. Во время одного цикла приема максимальная равновесная концентрация дроспиренона в сыворотке составляет около 60 нг/мл и достигается через 7-14 часов. Биодоступность колеблется от 76% до 85%. Прием пищи не влияет на биодоступность дроспиренона. Распределение После перорального приема наблюдается двухфазное снижение концентрации дроспиренона в сыворотке, которое характеризуется периодом полувыведения 1,6±0,7 часа и 27,0±7,5 часа, соответственно. Дроспиренон связывается с сывороточным альбумином и не связывается с глобулином, связывающим половые гормоны (ГСПГ) и кортикостероидсвязывающим глобулином (транскортином). Только 3-5% от общей сывороточной концентрации активного вещества представляет собой свободный гормон. Индуцированное этинилэстрадиолом повышение ГСПГ не влияет на связывание дроспиренона белками сыворотки. Средний кажущийся объем распределения составляет 3,7±1,2 л/кг. Биотрансформация После перорального приема дроспиренон подвергается значительному метаболизму. Большинство метаболитов в плазме представлены кислотными формами дроспиренона, полученными при раскрытии лактонового кольца, и 4,5-дигидро-дроспиренон-3-сульфатом, которые образуются без вовлечения системы цитохрома Р450. По данным исследований in vitro дроспиренон метаболизируется при незначительном участии цитохрома Р450. Элиминация Скорость метаболического клиренса дроспиренона в сыворотке составляет 1,5±0,2 мл/мин/кг. Дроспиренон экскретируется только в следовых количествах в неизмененном виде. Метаболиты дроспиренона экскретируются почками и через кишечник в соотношении примерно 1,2:1,4. Период полувыведения при экскреции метаболитов почками и через кишечник составляет примерно 40 часов. Равновесная концентрация Во время одного цикла лечения максимальная равновесная концентрация дроспиренона в сыворотке (примерно 60 нг/мл) достигается через 7-14 часов. Отмечается 2-3-х кратное увеличение концентрации дроспиренона. Дальнейшее увеличение сывороточной концентрации дроспиренона отмечается через 1-6 циклов приёма, после чего увеличения концентрации не наблюдается. Этинилэстрадиол (30 мкг) Всасывание Этинилэстрадиол после перорального приема быстро и полностью абсорбируется. Максимум сывороточной концентрации после однократного приема 30 мкг достигается через 1-2 часа и составляет около 100 пг/мл. Для этинилэстрадиол а выражен значительный эффект "первого прохождения" с высокой индивидуальной вариабельностью. Абсолютная биодоступность варьируется и составляет приблизительно 45%. Распределение Кажущийся объем распределения составляет около 5 л/кг, связь с белками плазмы крови - около 98%. Этинилэстрадиол индуцирует синтез ГСПГ и транскортина в печени. При ежедневном приеме 30 мкг этинилэстрадиола плазменная концентрация ГСПГ повышается с 70 нмоль/л до примерно 350 нмоль/л. Этинилэстрадиол в небольших количествах попадает в грудное молоко (примерно 0,02% от дозы). Биотрансформация Этинилэстрадиол полностью метаболизируется. (Скорость метаболического клиренса составляет 5 мл/мин/кг). Элиминация Этинилэстрадиол практически не экскретируется в неизмененном виде. Метаболиты этинилэстрадиола экскретируются почками и через кишечник в соотношении 4:6. Период полувыведения для экскреции метаболитов составляет примерно 1 день. Элиминационный период полувыведения составляет 20 часов. Равновесная концентрация Состояние равновесной концентрации достигается в течение второй половины цикла лечения. Отдельные категории населения Влияние на функцию почек Равновесная концентрация дроспиренона в сыворотке у женщин со слабой степенью почечной недостаточности (клиренс креатинина (КК) = 50-80 мл/минуту) была сравнима с таковой у женщин с нормальной функцией почек (КК >: 80 мл/минуту). Концентрация дроспиренона в сыворотке в среднем была на 37% выше у женщин со средней степенью почечной недостаточности (КК = 30-50 мл/минуту) по сравнению с таковой у женщин с нормальной функцией почек. Терапия дроспиреноном хорошо переносилась женщинами и со слабой и со средней степенью почечной недостаточности. Лечение дроспиреноном не оказало клинически значимого влияния на концентрацию калия в сыворотке. Влияние на функцию печени У женщин с умеренной печеночной недостаточностью (класс В по классификации Чайлд-Пью) кривая средней концентрации в плазме не соответствовала таковой у женщин с нормальной функцией печени. Значения максимальной концентрации (Сmax), наблюдаемые в фазе абсорбции и распределения, были одинаковыми. Во время окончания фазы распределения снижение концентрации дроспиренона было примерно в 1,8 раз выше у добровольцев с умеренной печеночной недостаточностью в сравнении с людьми с нормальной функцией печени. После однократного приема общий клиренс (Cl/F) у добровольцев с умеренной печеночной недостаточностью был примерно на 50% снижен в сравнении с людьми с нормальной функцией печени. Отмеченное снижение клиренса дроспиренона у добровольцев с умеренной печеночной недостаточностью не приводит к каким-либо значимым различиям в отношении концентрации калия в сыворотке. Даже при сахарном диабете и одновременном лечении спиронолактоном (два фактора, которые могут спровоцировать гиперкалиемию у пациента) не отмечалось увеличения концентрации калия в сыворотке выше верхней границы нормы. Можно заключить, что комбинация дроспиренон/этинилэстрадиол хорошо переносится пациентами с умеренной печеночной недостаточностью (класс В по классификации Чайлд-Пью). Особые указания Меры предосторожности Если какие-либо из состояний/факторов риска, указанных ниже, имеются в настоящее время, то следует тщательно взвешивать потенциальный риск и ожидаемую пользу применения комбинированного перорального контрацептива в каждом индивидуальном случае и обсудить его с женщиной до того, как она решит начать прием препарата. В случае утяжеления, усиления или первого проявления любого из этих состояний или факторов риска, женщина должна проконсультироваться со своим врачом, который может принять решение о необходимости отмены комбинированного перорального контрацептива. Нарушения системы кровообращения Частота венозной тромбоэмболии (ВТЭ) при использовании комбинированного перорального контрацептива с низкой дозой эстрогенов (<: 50 мкг этинилэстрадиола, такие как, препарат МИДИАНА®) составляет примерно от 20 до 40 случаев на 100 000 женщин в год, что несколько выше, чем у женщин, не применяющих гормональные контрацептивы (от 5 до 10 случаев на 100 000 женщин), но ниже, чем у женщин во время беременности (60 случаев на 100 000 беременностей). Дополнительный риск ВТЭ отмечается в течение первого года применения комбинированного перорального контрацептива. ВТЭ приводит к летальному исходу в 1-2% случаев. Эпидемиологические исследования также выявили связь между применением комбинированного перорального контрацептива и увеличением риска тромбоэмболии артерий. Описаны крайне редкие случаи тромбоза других кровеносных сосудов, например, печеночных, мезентериальных, почечных, сосудов головного мозга и сетчатки, как артерий, так и вен, у принимавших пероральные гормональные контрацептивы. Причинно-следственная связь возникновения данных побочных эффектов с приемом комбинированных пероральных контрацептивов не доказана. Симптомы венозного или артериального тромбоза/тромбоэмболии или цереброваскулярного заболевания могут включать: - необычную одностороннюю боль и/или отек конечности: - внезапную сильную боль в груди, с или без иррадиации в левую руку: - внезапную одышку: - внезапный приступ кашля: - любую необычную, сильную, длительную головную боль: - внезапную частичную или полную потерю зрения: - диплопию: - нечленораздельную речь или афазию: - головокружение: - потерю сознания с или без судорожного припадка: - слабость или очень значительную потерю чувствительности, внезапно появившуюся с одной половины или в одной части тела: - двигательные нарушения: - симптом "острого живота". Риск осложнений, связанных с ВТЭ при приеме комбинированного перорального контрацептива, увеличивается: - с возрастом: - при наличии семейного анамнеза (венозной или артериальной тромбоэмболии у близких родственников или родителей в относительно молодом возрасте): если предполагается наследственная предрасположенность, женщине необходима консультация специалиста перед назначением комбинированного перорального контрацептива: - после длительной иммобилизации, серьезного хирургического вмешательства, любой операции на ногах или обширной травмы. В этих ситуациях рекомендуется прекратить прием препарата (в случае плановой операции, по крайней мере, за четыре недели до нее) и не возобновлять прием в течение двух недель после окончания иммобилизации. Дополнительно возможно назначение антитромботической терапии, если прием пероральных гормональных контрацептивов не был прекращен в рекомендуемые сроки: - при ожирении (индекс массы тела более 30 мг/м 2): Риск артериального тромбоза и тромбоэмболии при приеме комбинированного перорального контрацептива увеличивается: - с возрастом: - у курящих (женщинам старше 35 лет строго не рекомендуется курить, если они хотят применять комбинированные пероральные контрацептивы): - при дислипопротеинемии: - при артериальной гипертензии: - при мигрени: - при заболеваниях клапанов сердца: - при фибрилляции предсердий. Наличие одного из серьезных факторов риска или множественных факторов риска заболевания артерий или вен, соответственно, может быть противопоказанием. Женщины, применяющие комбинированные пероральные контрацептивы, должны немедленно обращаться к врачу при возникновении симптомов возможного тромбоза. В случаях подозрения на тромбоз или подтвержденного тромбоза прием комбинированного перорального контрацептива необходимо прекратить. Необходимо подобрать адекватный метод контрацепции вследствие тератогенности антикоагулянтной терапии (кумарины). Следует учитывать повышенный риск тромбоэмболий в послеродовом периоде. Другие заболевания, которые связаны с тяжелой сосудистой патологией, включают сахарный диабет, системную красную волчанку, гемолитико-уремический синдром, хронические воспалительные заболевания кишечника (болезнь Крона или язвенный колит) и серповидно-клеточную анемию. Увеличение частоты и тяжести мигрени во время применения комбинированных пероральных контрацептивов (что может предшествовать цереброваскулярным нарушениям) может быть основанием для немедленного прекращения приема этих препаратов. Опухоли Самым значительным фактором риска развития рака шейки матки является инфицирование вирусом папилломы человека. В некоторых эпидемиологических исследованиях сообщалось о повышенном риске развития рака шейки матки при длительном применении комбинированных пероральных контрацептивов, однако сохраняются противоречивые мнения относительно того, в какой степени эти находки относятся к сопутствующим факторам, например, исследованию на наличие рака шейки матки или использованию барьерных методов контрацепции. Мета-анализ 54 эпидемиологических исследований продемонстрировал, что имеется несколько повышенный относительный риск (ОР = 1,24) развития рака молочной железы, диагностированного у женщин, которые на момент исследования применяли комбинированные пероральные контрацептивы. Избыточный риск постепенно снижается в течение 10 лет после прекращения приема комбинированных пероральных контрацептивов. Поскольку рак молочной железы редко встречается у женщин моложе 40 лет, увеличение количества диагностированного в последние годы у женщин, принимавших или принимающих комбинированные пероральные контрацептивы, рака молочной железы является небольшим по отношению к общему риску развития рака молочной железы. Эти исследования не подтверждают причинно-следственной связи между приемом комбинированных пероральных контрацептивов и раком молочной железы. Наблюдаемое повышение риска может быть следствием более ранней диагностики рака молочной железы у женщин, применяющих комбинированные пероральные контрацептивы, биологическим эффектом комбинированных пероральных контрацептивов или комбинацией обоих вариантов. Раковые опухоли молочных желез у женщин, когда-либо принимавших комбинированные пероральные контрацептивы, были клинически менее выражены, чем у женщин, никогда их не принимавших. В редких случаях на фоне применения комбинированных пероральных контрацептивов наблюдалось развитие доброкачественных опухолей печени, а в еще более редких - злокачественных. В отдельных случаях эти опухоли вызывали опасное для жизни внутрибрюшное кровотечение. При дифференциальной диагностике опухоли печени, нужно учитывать при появлении у женщины, принимающей комбинированные пероральные контрацептивы, сильной боли в верхних отделах живота, увеличения печени или признаков внутрибрюшного кровотечения. Другие состояния Прогестероновый компонент в препарате МИДИАНА® является антагонистом альдостерона, со свойством задерживать калий. В большинстве случаев не отмечается увеличения концентрации калия. Однако в клиническом исследовании у некоторых пациентов со слабой или умеренной почечной недостаточностью и одновременным назначением задерживающих калий лекарственных препаратов, при приеме дроспиренона концентрация калия в сыворотке незначительно, но увеличивалась. Таким образом, рекомендуется проверять концентрацию калия в сыворотке крови в первом цикле приема препарата у пациентов с почечной недостаточностью и значениями концентрации калия до лечения на верхней границе нормы, а также при одновременном применении лекарственных препаратов, задерживающих калий в организме. У женщин с гипертриглицеридемией или семейным анамнезом по гипертриглицеридемии нельзя исключить повышение риска развития панкреатита во время приема комбинированных пероральных контрацептивов. Хотя небольшое повышение артериального давления было описано у многих женщин, принимающих комбинированные пероральные контрацептивы, клинически значимые повышения отмечались редко. Только в редких случаях необходимо немедленное прекращение приема комбинированных пероральных контрацептивов. Если во время приема комбинированных пероральных контрацептивов у пациенток с артериальной гипертензией, значения артериального давления постоянно повышены или не снижаются при приеме гипотензивных препаратов, прием комбинированных пероральных контрацептивов необходимо прекратить. При необходимости, прием комбинированных пероральных контрацептивов может быть продолжен, если с помощью гипотензивной терапии достигнуты нормальные значения артериального давления. Следующие состояния развиваются или ухудшаются как во время беременности, так и при приеме комбинированных пероральных контрацептивов, но их связь с приемом комбинированных пероральных контрацептивов не доказана: желтуха и/или зуд, связанный с холестазом: формирование камней в желчном пузыре: порфирия: системная красная волчанка: гемолитико-уремический синдром: хорея Сиденгама: герпес во время беременности в анамнезе: потеря слуха, связанная с отосклерозом. У женщин с наследственным ангионевротическим отеком экзогенные эстрогены могут вызвать или усилить симптомы ангионевротического отека. При острых или хронических нарушения функции печени может потребоваться прекращение применения комбинированных пероральных контрацептивов до тех пор, пока показатели функции печени не вернутся в норму. Рецидивирующая холестатическая желтуха и/или вызванный холестазом зуд, которые развивается впервые во время беременности или предыдущего приема половых гормонов, требует прекращения приема комбинированных пероральных контрацептивов. Хотя комбинированные пероральные кон
Модель:
RUR 794
Показания Лечение андрогенной алопеции (восстановление волосяного покрова) и стабилизация процесса выпадения волос у мужчин и женщин. Противопоказания Противопоказания Повышенная чувствительность к миноксидилу или другим компонентам препарата: возраст младше 18 лет: нарушение целостности кожных покровов, дерматозы волосистой части головы. С осторожностью: Пожилой возраст - старше 65 лет. Беременность Не следует применять препарат при беременности и кормлении грудью. Применение и дозы Наружно. Независимо от размера обрабатываемого участка необходимо наносить 1 мл раствора с помощью дозатора (7 нажатий) 2 раза в день на пораженные участки волосистой части головы, начиная с центра проблемной зоны. После применения необходимо вымыть руки. Суммарная суточная доза не должна превышать 2 мг (доза не зависит от размера пораженной области). Пациентам, у которых при применении 2 %-го раствора не наблюдается удовлетворительного роста волос, и пациентам, для которых желателен более быстрый рост волос, можно использовать 5 %-ый раствор. Для мужчин препарат Генеролон® наиболее эффективен при выпадении волос на макушке, для женщин - при выпадении волос в области срединного пробора. Препарат Генеролон® наносится только на сухую кожу волосистой части головы. Раствор не требует смывания. Появление первых признаков стимуляции роста волос возможно после применения препарата 2 раза в сутки в течение 4 месяцев, или более. Начало и степень выраженности роста волос, а также качество волос могут колебаться у разных больных. Согласно единичным сообщениям, в течение 3-4 месяцев после прекращения лечения можно ожидать восстановления исходного внешнего вида. Длительность лечения в среднем - около 1 года. Подготовка к применению: Снять навинчивающуюся крышку и закрепить мерный насос. На трубку сверху насоса укрепить удлиненную насадку для распыления. Нажать на распылительную насадку 3-4 раза для,того, чтобы насос наполнился раствором, после чего препарат можно применять. Побочные эффекты и передозировка Побочные эффекты: Местные побочные эффекты: Наиболее часто встречающимся побочным эффектом является дерматит волосистой части головы. Реже наблюдаются более выраженные случаи дерматита, проявляющиеся в виде покраснения, шелушения и воспаления. В редких случаях отмечается зуд головы, аллергический контактный дерматит, фолликулит, гипертрихоз (нежелательный рост волос на теле, включая рост волос на лице у женщин), себорея. Применение миноксидила может вызвать усиление выпадения волос при.переходе от фазы покоя к фазе роста волос, при этом старые волосы выпадают и на их месте вырастают новые. Это временное явление обычно наблюдается спустя 2-6 недель после начала лечения и постепенно, в течение 2 последующих недель, прекращается (появление первых признаков действия миноксидила). Системные побочные эффекты (при случайном проглатывании препарата): Дерматологические заболевания: неспецифические аллергические реакции (кожная сыпь, крапивница), отек лица. Дыхательная система: одышка, аллергический ринит. Нервная система: головная боль, головокружение, вертиго, неврит. Сердечно-сосудистая система: боль в грудной клетке, колебания артериального давления, учащенное сердцебиение, изменение ритма сердечных сокращений, отеки. Передозировка: Случайный прием внутрь препарата Генеролон® может вызвать системные побочные эффекты, обусловленные сосудорасширяющими свойствами миноксидила (5 мл 2 %-го раствора содержит 100 мг миноксидила - максимальную рекомендованную дозу для взрослых при приеме внутрь при лечении артериальной гипертензии: (5 мл 5 %-го раствора содержит 250 мг миноксидила, то есть дозу в 2,5 раза превышающую максимальную рекомендованную суточную дозу для взрослых при приеме внутрь при лечении артериальной гипертензии). Признаки передозировки: задержка жидкости, снижение артериального давления, тахикардия. Лечение: для устранения задержки жидкости при необходимости могут быть назначены диуретики: для лечения тахикардии - бета-адреноблокаторы. Для лечения гипотензии следует ввести внутривенно 0,9 % раствор натрия хлорида. Не следует назначать симпатомиметические средства, например, норэпинефрин и эпинефрин, обладающие чрезмерной кардиостимулирующей активностью. Взаимодействие с другими ЛС: Существует теоретическая возможность (клиническое подтверждение отсутствует) усиления ортостатической гипотензии у пациентов, получающих сопутствующее лечение периферическими сосудорасширяющими средствами. Нельзя исключить очень незначительное повышение содержания миноксидила в крови пациентов, страдающих артериальной гипертензией и принимающих миноксидил внутрь в случае одновременного использования препарата Генеролон®, хотя соответствующие клинические исследования не проводились. Установлено, что миноксидил для наружного применения может, взаимодействовать с некоторыми лекарственными средствами для наружного применения. Одновременное использование раствора миноксидила для наружного применения и крема, содержащего бетаметазон (0,05 %) приводит к снижению системного всасывания миноксидила. Одновременное использование крема, содержащего третиноин (0,05 %), приводит к повышенному всасыванию миноксидила. Одновременное нанесение на кожу миноксидила и препаратов для наружного применения, таких как третиноин и дитранол, которые вызывают изменение защитных фикций кожи, может привести к увеличению всасывания миноксидила. Фармакологическое действие и фармакокинетика При местном применении миноксидила стимулирует рост волос у лиц с андрогенной алопецией (поредением волос, облысением). Улучшает микроциркуляцию, стимулирует переход волосяных клеток в активную растущую фазу, изменяет воздействие андрогенов на волосяные мешочки. Уменьшает образование 5-альфа-дегидростерона (возможно, опосредованно), который играет существенную роль в формировании облысения. Наилучший эффект оказывает при небольшой давности заболевания (не более 10 лет), молодом возрасте пациентов, лысине в области темени не более 10 см, наличии в центре лысины более 100 пушковых и терминальных волос. Проявление признаков роста волос отмечается через 4 и более месяцев применения препарата. Начало и степень выраженности эффекта могут колебаться у разных больных. 5 %-ый раствор препарата стимулирует рост волос сильнее, чем 2 %-ый растврр, что было отмечено по увеличению роста пушковых волос: После прекращения применения препарата Генеролон® рост новых волос приостанавливается, и в течение 3-4 месяцев-возможно восстановления исходного внешнего вида. Точный механизм действия препарата Генеролон® при лечении андрогенной алопеции неизвестен. Миноксидил неэффективен в случае облысения, вызванного приемом лекарственного средства, неправильным питанием (дефицит железа (Fе), витамина А), в результате укладки волос в "тугие" прически. Фармакокинетика: При наружном применении миноксидил плохо всасывается через нормальную неповрежденную кожу: в среднем 1,5 % (0,3 - 4,5 %) общей нанесенной дозы поступает в системный кровоток. Влияние сопутствующих кожных заболеваний на всасывание миноксидила неизвестно. После прекращения применения препарата примерно 95 % миноксидила, попавшего в системный кровоток, выводится в течение 4 дней. Профиль метаболической биотрансформации миноксидила после наружного применения препарата Генеролон® до настоящего времени полностью не изучен. Миноксидил не связывается с белками плазмы и выводится почками посредством клубочковой фильтрации. Миноксидил не проникает через гематоэнцефалический барьер. Экскретируется преимущественно с мочой. Миноксидил и его метаболиты выводятся с помощью гемодиализа. Особые указания Не наносить препарат на другие участки тела. Препарат Генеролон® наносят только на сухую кожу волосистой части головы после купания или следует подождать около 4 часов после нанесения препарата перед купанием. Не давайте голове намокнуть ранее, чем через 4 часа после нанесения препарата. Мыть волосы при применении препарата Генеролон® рекомендуется в привычном режиме. В период применения препарат Генеролон® можно пользоваться лаком для волос и другими средствами ухода за волосами. Перед нанесением средств для ухода за волосами необходимо сначала нанести препарат Генеролон® и подождать, пока обработанный участок кожи полностью не высохнет. Нет данных о том, что окраска волос, выполнение химической завивки или использование смягчителей для волос может снижать эффективность препарата. Однако, для предотвращения возможного раздражения волосистой части головы необходимо убедиться в том, что препарат был полностью смыт с волос и волосистой части кожи головы перед использованием данных химических средств. Перед началом лечения препаратом Генеролон® пациенты должны пройти общее обследование, включающее сбор и изучение медицинского анамнеза. Врач должен убедиться в том, что кожа волосистой части головы здорова. При появлении системных побочных эффектов или тяжелых кожных реакций пациентам следует отменить препарат и обратиться к врачу. В состав препарата Генеролон® входит этиловый спирт, который может вызвать воспаление и раздражение глаз. В случае попадания препарата на чувствительные поверхности (глаза, раздраженную кожу, слизистые оболочки) необходимо промыть участок большим количеством холодной воды. Следует избегать вдыхания препарата при распылении. После применения препарата следует тщательно вымыть руки. Влияние на способность управлять транспортными средствами: Условия хранения и отпуска из аптек Условия хранения:При температуре не выше 25 °С. Хранить в недоступном для детей месте! Отпуск из аптек: Без рецепта Регистрационные данные Торговое название Генеролон® Международное непатентованное название:Миноксидил. Форма выпуска:спрей для наружного применения. Состав:1 мл раствора содержит: активное вещество: миноксидил - 20,00 мг или 50,00 мг: вспомогательные вещества: этанол (96 %) - 571,00 / 243,00 мг, пропиленгликоль - 104,00 / 520,00 мг, вода - до 1 мл. АТХ: Регистрация: Лекарственное средство ЛП-001609 Фармгруппа: Средство лечения алопеции. Дата регистрации: 23.03.2012 / 19.04.2016. Окончание регстрации: . Описание:Бесцветный или слегка окрашенный с желтоватым оттенком, прозрачный водно-спиртовой раствор с запахом спирта. Упаковка:Спрей для наружного применения 2% и 5%. 60 мл раствора во флаконе белого цвета из полиэтилена высокой плотности (ПЭВП) с завинчивающейся крышкой полипропиленовой (ПП) белого цвета, оснащенной пластиковым кольцом контроля первого вскрытия.1 или 2 флакона в комплекте с 1 пластиковым мерным насосом и 1 насадкой для распыления в защитном пакетике и инструкцией по применению помещают в картонную пачку.3 флакона в комплекте с 2 пластиковыми мерными насосами и 2 насадками для распыления в защитном пакетике и инструкцией по применению помещают в картонную пачку. Срок годности:Спрей для наружного применения 2% - 3 года. Спрей для наружного применения 5% - 4 года. Не применять по истечении срока годности. Владелец рег.удостоверения:БЕЛУПО, лекарства и косметика д.д. Производитель:BELUPO, Pharmaceuticals &: Cosmetics, d.d. Представительство:БЕЛУПО, лекарства и косметика д.д. Информация предоставлена: Компанией ГЭОТАР - http://www.lsgeotar.ru/
Модель:
RUR 2234
Показания Лечение андрогенной алопеции (восстановление волосяного покрова) и стабилизация процесса выпадения волос у мужчин и женщин. Противопоказания Противопоказания Повышенная чувствительность к миноксидилу или другим компонентам препарата: возраст младше 18 лет: нарушение целостности кожных покровов, дерматозы волосистой части головы. С осторожностью: Пожилой возраст - старше 65 лет. Беременность Не следует применять препарат при беременности и кормлении грудью. Применение и дозы Наружно. Независимо от размера обрабатываемого участка необходимо наносить 1 мл раствора с помощью дозатора (7 нажатий) 2 раза в день на пораженные участки волосистой части головы, начиная с центра проблемной зоны. После применения необходимо вымыть руки. Суммарная суточная доза не должна превышать 2 мг (доза не зависит от размера пораженной области). Пациентам, у которых при применении 2 %-го раствора не наблюдается удовлетворительного роста волос, и пациентам, для которых желателен более быстрый рост волос, можно использовать 5 %-ый раствор. Для мужчин препарат Генеролон® наиболее эффективен при выпадении волос на макушке, для женщин - при выпадении волос в области срединного пробора. Препарат Генеролон® наносится только на сухую кожу волосистой части головы. Раствор не требует смывания. Появление первых признаков стимуляции роста волос возможно после применения препарата 2 раза в сутки в течение 4 месяцев, или более. Начало и степень выраженности роста волос, а также качество волос могут колебаться у разных больных. Согласно единичным сообщениям, в течение 3-4 месяцев после прекращения лечения можно ожидать восстановления исходного внешнего вида. Длительность лечения в среднем - около 1 года. Подготовка к применению: Снять навинчивающуюся крышку и закрепить мерный насос. На трубку сверху насоса укрепить удлиненную насадку для распыления. Нажать на распылительную насадку 3-4 раза для,того, чтобы насос наполнился раствором, после чего препарат можно применять. Побочные эффекты и передозировка Побочные эффекты: Местные побочные эффекты: Наиболее часто встречающимся побочным эффектом является дерматит волосистой части головы. Реже наблюдаются более выраженные случаи дерматита, проявляющиеся в виде покраснения, шелушения и воспаления. В редких случаях отмечается зуд головы, аллергический контактный дерматит, фолликулит, гипертрихоз (нежелательный рост волос на теле, включая рост волос на лице у женщин), себорея. Применение миноксидила может вызвать усиление выпадения волос при.переходе от фазы покоя к фазе роста волос, при этом старые волосы выпадают и на их месте вырастают новые. Это временное явление обычно наблюдается спустя 2-6 недель после начала лечения и постепенно, в течение 2 последующих недель, прекращается (появление первых признаков действия миноксидила). Системные побочные эффекты (при случайном проглатывании препарата): Дерматологические заболевания: неспецифические аллергические реакции (кожная сыпь, крапивница), отек лица. Дыхательная система: одышка, аллергический ринит. Нервная система: головная боль, головокружение, вертиго, неврит. Сердечно-сосудистая система: боль в грудной клетке, колебания артериального давления, учащенное сердцебиение, изменение ритма сердечных сокращений, отеки. Передозировка: Случайный прием внутрь препарата Генеролон® может вызвать системные побочные эффекты, обусловленные сосудорасширяющими свойствами миноксидила (5 мл 2 %-го раствора содержит 100 мг миноксидила - максимальную рекомендованную дозу для взрослых при приеме внутрь при лечении артериальной гипертензии: (5 мл 5 %-го раствора содержит 250 мг миноксидила, то есть дозу в 2,5 раза превышающую максимальную рекомендованную суточную дозу для взрослых при приеме внутрь при лечении артериальной гипертензии). Признаки передозировки: задержка жидкости, снижение артериального давления, тахикардия. Лечение: для устранения задержки жидкости при необходимости могут быть назначены диуретики: для лечения тахикардии - бета-адреноблокаторы. Для лечения гипотензии следует ввести внутривенно 0,9 % раствор натрия хлорида. Не следует назначать симпатомиметические средства, например, норэпинефрин и эпинефрин, обладающие чрезмерной кардиостимулирующей активностью. Взаимодействие с другими ЛС: Существует теоретическая возможность (клиническое подтверждение отсутствует) усиления ортостатической гипотензии у пациентов, получающих сопутствующее лечение периферическими сосудорасширяющими средствами. Нельзя исключить очень незначительное повышение содержания миноксидила в крови пациентов, страдающих артериальной гипертензией и принимающих миноксидил внутрь в случае одновременного использования препарата Генеролон®, хотя соответствующие клинические исследования не проводились. Установлено, что миноксидил для наружного применения может, взаимодействовать с некоторыми лекарственными средствами для наружного применения. Одновременное использование раствора миноксидила для наружного применения и крема, содержащего бетаметазон (0,05 %) приводит к снижению системного всасывания миноксидила. Одновременное использование крема, содержащего третиноин (0,05 %), приводит к повышенному всасыванию миноксидила. Одновременное нанесение на кожу миноксидила и препаратов для наружного применения, таких как третиноин и дитранол, которые вызывают изменение защитных фикций кожи, может привести к увеличению всасывания миноксидила. Фармакологическое действие и фармакокинетика При местном применении миноксидила стимулирует рост волос у лиц с андрогенной алопецией (поредением волос, облысением). Улучшает микроциркуляцию, стимулирует переход волосяных клеток в активную растущую фазу, изменяет воздействие андрогенов на волосяные мешочки. Уменьшает образование 5-альфа-дегидростерона (возможно, опосредованно), который играет существенную роль в формировании облысения. Наилучший эффект оказывает при небольшой давности заболевания (не более 10 лет), молодом возрасте пациентов, лысине в области темени не более 10 см, наличии в центре лысины более 100 пушковых и терминальных волос. Проявление признаков роста волос отмечается через 4 и более месяцев применения препарата. Начало и степень выраженности эффекта могут колебаться у разных больных. 5 %-ый раствор препарата стимулирует рост волос сильнее, чем 2 %-ый растврр, что было отмечено по увеличению роста пушковых волос: После прекращения применения препарата Генеролон® рост новых волос приостанавливается, и в течение 3-4 месяцев-возможно восстановления исходного внешнего вида. Точный механизм действия препарата Генеролон® при лечении андрогенной алопеции неизвестен. Миноксидил неэффективен в случае облысения, вызванного приемом лекарственного средства, неправильным питанием (дефицит железа (Fе), витамина А), в результате укладки волос в "тугие" прически. Фармакокинетика: При наружном применении миноксидил плохо всасывается через нормальную неповрежденную кожу: в среднем 1,5 % (0,3 - 4,5 %) общей нанесенной дозы поступает в системный кровоток. Влияние сопутствующих кожных заболеваний на всасывание миноксидила неизвестно. После прекращения применения препарата примерно 95 % миноксидила, попавшего в системный кровоток, выводится в течение 4 дней. Профиль метаболической биотрансформации миноксидила после наружного применения препарата Генеролон® до настоящего времени полностью не изучен. Миноксидил не связывается с белками плазмы и выводится почками посредством клубочковой фильтрации. Миноксидил не проникает через гематоэнцефалический барьер. Экскретируется преимущественно с мочой. Миноксидил и его метаболиты выводятся с помощью гемодиализа. Особые указания Не наносить препарат на другие участки тела. Препарат Генеролон® наносят только на сухую кожу волосистой части головы после купания или следует подождать около 4 часов после нанесения препарата перед купанием. Не давайте голове намокнуть ранее, чем через 4 часа после нанесения препарата. Мыть волосы при применении препарата Генеролон® рекомендуется в привычном режиме. В период применения препарат Генеролон® можно пользоваться лаком для волос и другими средствами ухода за волосами. Перед нанесением средств для ухода за волосами необходимо сначала нанести препарат Генеролон® и подождать, пока обработанный участок кожи полностью не высохнет. Нет данных о том, что окраска волос, выполнение химической завивки или использование смягчителей для волос может снижать эффективность препарата. Однако, для предотвращения возможного раздражения волосистой части головы необходимо убедиться в том, что препарат был полностью смыт с волос и волосистой части кожи головы перед использованием данных химических средств. Перед началом лечения препаратом Генеролон® пациенты должны пройти общее обследование, включающее сбор и изучение медицинского анамнеза. Врач должен убедиться в том, что кожа волосистой части головы здорова. При появлении системных побочных эффектов или тяжелых кожных реакций пациентам следует отменить препарат и обратиться к врачу. В состав препарата Генеролон® входит этиловый спирт, который может вызвать воспаление и раздражение глаз. В случае попадания препарата на чувствительные поверхности (глаза, раздраженную кожу, слизистые оболочки) необходимо промыть участок большим количеством холодной воды. Следует избегать вдыхания препарата при распылении. После применения препарата следует тщательно вымыть руки. Влияние на способность управлять транспортными средствами: Условия хранения и отпуска из аптек Условия хранения:При температуре не выше 25 °С. Хранить в недоступном для детей месте! Отпуск из аптек: Без рецепта Регистрационные данные Торговое название Генеролон® Международное непатентованное название:Миноксидил. Форма выпуска:спрей для наружного применения. Состав:1 мл раствора содержит: активное вещество: миноксидил - 20,00 мг или 50,00 мг: вспомогательные вещества: этанол (96 %) - 571,00 / 243,00 мг, пропиленгликоль - 104,00 / 520,00 мг, вода - до 1 мл. АТХ: Регистрация: Лекарственное средство ЛП-001609 Фармгруппа: Средство лечения алопеции. Дата регистрации: 23.03.2012 / 19.04.2016. Окончание регстрации: . Описание:Бесцветный или слегка окрашенный с желтоватым оттенком, прозрачный водно-спиртовой раствор с запахом спирта. Упаковка:Спрей для наружного применения 2% и 5%. 60 мл раствора во флаконе белого цвета из полиэтилена высокой плотности (ПЭВП) с завинчивающейся крышкой полипропиленовой (ПП) белого цвета, оснащенной пластиковым кольцом контроля первого вскрытия.1 или 2 флакона в комплекте с 1 пластиковым мерным насосом и 1 насадкой для распыления в защитном пакетике и инструкцией по применению помещают в картонную пачку.3 флакона в комплекте с 2 пластиковыми мерными насосами и 2 насадками для распыления в защитном пакетике и инструкцией по применению помещают в картонную пачку. Срок годности:Спрей для наружного применения 2% - 3 года. Спрей для наружного применения 5% - 4 года. Не применять по истечении срока годности. Владелец рег.удостоверения:БЕЛУПО, лекарства и косметика д.д. Производитель:BELUPO, Pharmaceuticals &: Cosmetics, d.d. Представительство:БЕЛУПО, лекарства и косметика д.д. Информация предоставлена: Компанией ГЭОТАР - http://www.lsgeotar.ru/

Модель:
RUR 1398
Показания Лечение андрогенной алопеции (восстановление волосяного покрова) и стабилизация процесса выпадения волос у мужчин и женщин. Противопоказания Противопоказания Повышенная чувствительность к миноксидилу или другим компонентам препарата: возраст младше 18 лет: нарушение целостности кожных покровов, дерматозы волосистой части головы. С осторожностью: Пожилой возраст - старше 65 лет. Беременность Не следует применять препарат при беременности и кормлении грудью. Применение и дозы Наружно. Независимо от размера обрабатываемого участка необходимо наносить 1 мл раствора с помощью дозатора (7 нажатий) 2 раза в день на пораженные участки волосистой части головы, начиная с центра проблемной зоны. После применения необходимо вымыть руки. Суммарная суточная доза не должна превышать 2 мг (доза не зависит от размера пораженной области). Пациентам, у которых при применении 2 %-го раствора не наблюдается удовлетворительного роста волос, и пациентам, для которых желателен более быстрый рост волос, можно использовать 5 %-ый раствор. Для мужчин препарат Генеролон® наиболее эффективен при выпадении волос на макушке, для женщин - при выпадении волос в области срединного пробора. Препарат Генеролон® наносится только на сухую кожу волосистой части головы. Раствор не требует смывания. Появление первых признаков стимуляции роста волос возможно после применения препарата 2 раза в сутки в течение 4 месяцев, или более. Начало и степень выраженности роста волос, а также качество волос могут колебаться у разных больных. Согласно единичным сообщениям, в течение 3-4 месяцев после прекращения лечения можно ожидать восстановления исходного внешнего вида. Длительность лечения в среднем - около 1 года. Подготовка к применению: Снять навинчивающуюся крышку и закрепить мерный насос. На трубку сверху насоса укрепить удлиненную насадку для распыления. Нажать на распылительную насадку 3-4 раза для,того, чтобы насос наполнился раствором, после чего препарат можно применять. Побочные эффекты и передозировка Побочные эффекты: Местные побочные эффекты: Наиболее часто встречающимся побочным эффектом является дерматит волосистой части головы. Реже наблюдаются более выраженные случаи дерматита, проявляющиеся в виде покраснения, шелушения и воспаления. В редких случаях отмечается зуд головы, аллергический контактный дерматит, фолликулит, гипертрихоз (нежелательный рост волос на теле, включая рост волос на лице у женщин), себорея. Применение миноксидила может вызвать усиление выпадения волос при.переходе от фазы покоя к фазе роста волос, при этом старые волосы выпадают и на их месте вырастают новые. Это временное явление обычно наблюдается спустя 2-6 недель после начала лечения и постепенно, в течение 2 последующих недель, прекращается (появление первых признаков действия миноксидила). Системные побочные эффекты (при случайном проглатывании препарата): Дерматологические заболевания: неспецифические аллергические реакции (кожная сыпь, крапивница), отек лица. Дыхательная система: одышка, аллергический ринит. Нервная система: головная боль, головокружение, вертиго, неврит. Сердечно-сосудистая система: боль в грудной клетке, колебания артериального давления, учащенное сердцебиение, изменение ритма сердечных сокращений, отеки. Передозировка: Случайный прием внутрь препарата Генеролон® может вызвать системные побочные эффекты, обусловленные сосудорасширяющими свойствами миноксидила (5 мл 2 %-го раствора содержит 100 мг миноксидила - максимальную рекомендованную дозу для взрослых при приеме внутрь при лечении артериальной гипертензии: (5 мл 5 %-го раствора содержит 250 мг миноксидила, то есть дозу в 2,5 раза превышающую максимальную рекомендованную суточную дозу для взрослых при приеме внутрь при лечении артериальной гипертензии). Признаки передозировки: задержка жидкости, снижение артериального давления, тахикардия. Лечение: для устранения задержки жидкости при необходимости могут быть назначены диуретики: для лечения тахикардии - бета-адреноблокаторы. Для лечения гипотензии следует ввести внутривенно 0,9 % раствор натрия хлорида. Не следует назначать симпатомиметические средства, например, норэпинефрин и эпинефрин, обладающие чрезмерной кардиостимулирующей активностью. Взаимодействие с другими ЛС: Существует теоретическая возможность (клиническое подтверждение отсутствует) усиления ортостатической гипотензии у пациентов, получающих сопутствующее лечение периферическими сосудорасширяющими средствами. Нельзя исключить очень незначительное повышение содержания миноксидила в крови пациентов, страдающих артериальной гипертензией и принимающих миноксидил внутрь в случае одновременного использования препарата Генеролон®, хотя соответствующие клинические исследования не проводились. Установлено, что миноксидил для наружного применения может, взаимодействовать с некоторыми лекарственными средствами для наружного применения. Одновременное использование раствора миноксидила для наружного применения и крема, содержащего бетаметазон (0,05 %) приводит к снижению системного всасывания миноксидила. Одновременное использование крема, содержащего третиноин (0,05 %), приводит к повышенному всасыванию миноксидила. Одновременное нанесение на кожу миноксидила и препаратов для наружного применения, таких как третиноин и дитранол, которые вызывают изменение защитных фикций кожи, может привести к увеличению всасывания миноксидила. Фармакологическое действие и фармакокинетика При местном применении миноксидила стимулирует рост волос у лиц с андрогенной алопецией (поредением волос, облысением). Улучшает микроциркуляцию, стимулирует переход волосяных клеток в активную растущую фазу, изменяет воздействие андрогенов на волосяные мешочки. Уменьшает образование 5-альфа-дегидростерона (возможно, опосредованно), который играет существенную роль в формировании облысения. Наилучший эффект оказывает при небольшой давности заболевания (не более 10 лет), молодом возрасте пациентов, лысине в области темени не более 10 см, наличии в центре лысины более 100 пушковых и терминальных волос. Проявление признаков роста волос отмечается через 4 и более месяцев применения препарата. Начало и степень выраженности эффекта могут колебаться у разных больных. 5 %-ый раствор препарата стимулирует рост волос сильнее, чем 2 %-ый растврр, что было отмечено по увеличению роста пушковых волос: После прекращения применения препарата Генеролон® рост новых волос приостанавливается, и в течение 3-4 месяцев-возможно восстановления исходного внешнего вида. Точный механизм действия препарата Генеролон® при лечении андрогенной алопеции неизвестен. Миноксидил неэффективен в случае облысения, вызванного приемом лекарственного средства, неправильным питанием (дефицит железа (Fе), витамина А), в результате укладки волос в "тугие" прически. Фармакокинетика: При наружном применении миноксидил плохо всасывается через нормальную неповрежденную кожу: в среднем 1,5 % (0,3 - 4,5 %) общей нанесенной дозы поступает в системный кровоток. Влияние сопутствующих кожных заболеваний на всасывание миноксидила неизвестно. После прекращения применения препарата примерно 95 % миноксидила, попавшего в системный кровоток, выводится в течение 4 дней. Профиль метаболической биотрансформации миноксидила после наружного применения препарата Генеролон® до настоящего времени полностью не изучен. Миноксидил не связывается с белками плазмы и выводится почками посредством клубочковой фильтрации. Миноксидил не проникает через гематоэнцефалический барьер. Экскретируется преимущественно с мочой. Миноксидил и его метаболиты выводятся с помощью гемодиализа. Особые указания Не наносить препарат на другие участки тела. Препарат Генеролон® наносят только на сухую кожу волосистой части головы после купания или следует подождать около 4 часов после нанесения препарата перед купанием. Не давайте голове намокнуть ранее, чем через 4 часа после нанесения препарата. Мыть волосы при применении препарата Генеролон® рекомендуется в привычном режиме. В период применения препарат Генеролон® можно пользоваться лаком для волос и другими средствами ухода за волосами. Перед нанесением средств для ухода за волосами необходимо сначала нанести препарат Генеролон® и подождать, пока обработанный участок кожи полностью не высохнет. Нет данных о том, что окраска волос, выполнение химической завивки или использование смягчителей для волос может снижать эффективность препарата. Однако, для предотвращения возможного раздражения волосистой части головы необходимо убедиться в том, что препарат был полностью смыт с волос и волосистой части кожи головы перед использованием данных химических средств. Перед началом лечения препаратом Генеролон® пациенты должны пройти общее обследование, включающее сбор и изучение медицинского анамнеза. Врач должен убедиться в том, что кожа волосистой части головы здорова. При появлении системных побочных эффектов или тяжелых кожных реакций пациентам следует отменить препарат и обратиться к врачу. В состав препарата Генеролон® входит этиловый спирт, который может вызвать воспаление и раздражение глаз. В случае попадания препарата на чувствительные поверхности (глаза, раздраженную кожу, слизистые оболочки) необходимо промыть участок большим количеством холодной воды. Следует избегать вдыхания препарата при распылении. После применения препарата следует тщательно вымыть руки. Влияние на способность управлять транспортными средствами: Условия хранения и отпуска из аптек Условия хранения:При температуре не выше 25 °С. Хранить в недоступном для детей месте! Отпуск из аптек: Без рецепта Регистрационные данные Торговое название Генеролон® Международное непатентованное название:Миноксидил. Форма выпуска:спрей для наружного применения. Состав:1 мл раствора содержит: активное вещество: миноксидил - 20,00 мг или 50,00 мг: вспомогательные вещества: этанол (96 %) - 571,00 / 243,00 мг, пропиленгликоль - 104,00 / 520,00 мг, вода - до 1 мл. АТХ: Регистрация: Лекарственное средство ЛП-001609 Фармгруппа: Средство лечения алопеции. Дата регистрации: 23.03.2012 / 19.04.2016. Окончание регстрации: . Описание:Бесцветный или слегка окрашенный с желтоватым оттенком, прозрачный водно-спиртовой раствор с запахом спирта. Упаковка:Спрей для наружного применения 2% и 5%. 60 мл раствора во флаконе белого цвета из полиэтилена высокой плотности (ПЭВП) с завинчивающейся крышкой полипропиленовой (ПП) белого цвета, оснащенной пластиковым кольцом контроля первого вскрытия.1 или 2 флакона в комплекте с 1 пластиковым мерным насосом и 1 насадкой для распыления в защитном пакетике и инструкцией по применению помещают в картонную пачку.3 флакона в комплекте с 2 пластиковыми мерными насосами и 2 насадками для распыления в защитном пакетике и инструкцией по применению помещают в картонную пачку. Срок годности:Спрей для наружного применения 2% - 3 года. Спрей для наружного применения 5% - 4 года. Не применять по истечении срока годности. Владелец рег.удостоверения:БЕЛУПО, лекарства и косметика д.д. Производитель:BELUPO, Pharmaceuticals &: Cosmetics, d.d. Представительство:БЕЛУПО, лекарства и косметика д.д. Информация предоставлена: Компанией ГЭОТАР - http://www.lsgeotar.ru/
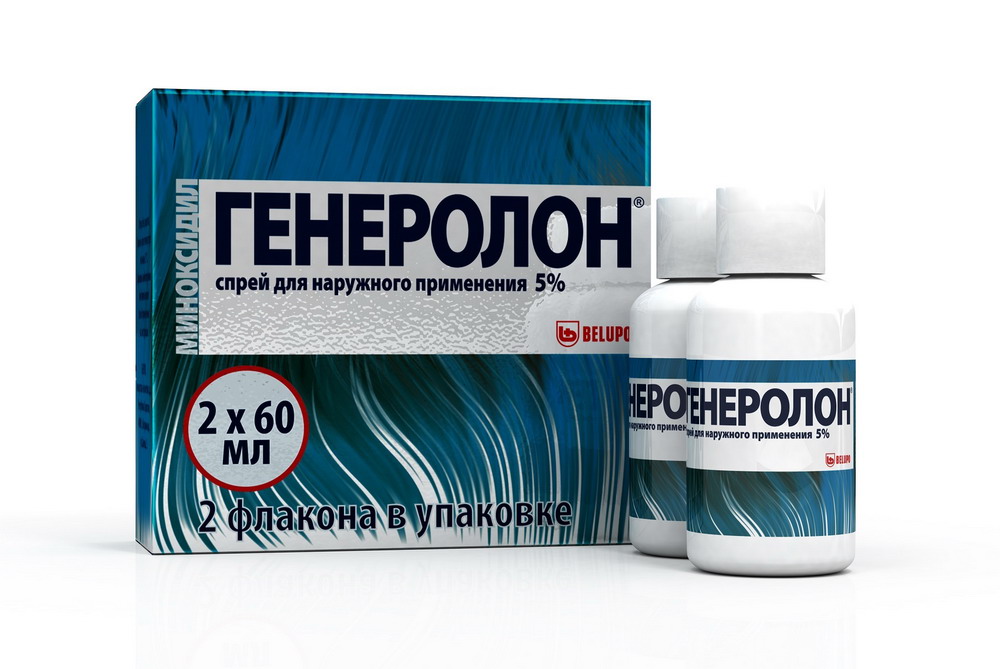
Модель:
RUR 1609
Показания Лечение андрогенной алопеции (восстановление волосяного покрова) и стабилизация процесса выпадения волос у мужчин и женщин. Противопоказания Противопоказания Повышенная чувствительность к миноксидилу или другим компонентам препарата: возраст младше 18 лет: нарушение целостности кожных покровов, дерматозы волосистой части головы. С осторожностью: Пожилой возраст - старше 65 лет. Беременность Не следует применять препарат при беременности и кормлении грудью. Применение и дозы Наружно. Независимо от размера обрабатываемого участка необходимо наносить 1 мл раствора с помощью дозатора (7 нажатий) 2 раза в день на пораженные участки волосистой части головы, начиная с центра проблемной зоны. После применения необходимо вымыть руки. Суммарная суточная доза не должна превышать 2 мг (доза не зависит от размера пораженной области). Пациентам, у которых при применении 2 %-го раствора не наблюдается удовлетворительного роста волос, и пациентам, для которых желателен более быстрый рост волос, можно использовать 5 %-ый раствор. Для мужчин препарат Генеролон® наиболее эффективен при выпадении волос на макушке, для женщин - при выпадении волос в области срединного пробора. Препарат Генеролон® наносится только на сухую кожу волосистой части головы. Раствор не требует смывания. Появление первых признаков стимуляции роста волос возможно после применения препарата 2 раза в сутки в течение 4 месяцев, или более. Начало и степень выраженности роста волос, а также качество волос могут колебаться у разных больных. Согласно единичным сообщениям, в течение 3-4 месяцев после прекращения лечения можно ожидать восстановления исходного внешнего вида. Длительность лечения в среднем - около 1 года. Подготовка к применению: Снять навинчивающуюся крышку и закрепить мерный насос. На трубку сверху насоса укрепить удлиненную насадку для распыления. Нажать на распылительную насадку 3-4 раза для,того, чтобы насос наполнился раствором, после чего препарат можно применять. Побочные эффекты и передозировка Побочные эффекты: Местные побочные эффекты: Наиболее часто встречающимся побочным эффектом является дерматит волосистой части головы. Реже наблюдаются более выраженные случаи дерматита, проявляющиеся в виде покраснения, шелушения и воспаления. В редких случаях отмечается зуд головы, аллергический контактный дерматит, фолликулит, гипертрихоз (нежелательный рост волос на теле, включая рост волос на лице у женщин), себорея. Применение миноксидила может вызвать усиление выпадения волос при.переходе от фазы покоя к фазе роста волос, при этом старые волосы выпадают и на их месте вырастают новые. Это временное явление обычно наблюдается спустя 2-6 недель после начала лечения и постепенно, в течение 2 последующих недель, прекращается (появление первых признаков действия миноксидила). Системные побочные эффекты (при случайном проглатывании препарата): Дерматологические заболевания: неспецифические аллергические реакции (кожная сыпь, крапивница), отек лица. Дыхательная система: одышка, аллергический ринит. Нервная система: головная боль, головокружение, вертиго, неврит. Сердечно-сосудистая система: боль в грудной клетке, колебания артериального давления, учащенное сердцебиение, изменение ритма сердечных сокращений, отеки. Передозировка: Случайный прием внутрь препарата Генеролон® может вызвать системные побочные эффекты, обусловленные сосудорасширяющими свойствами миноксидила (5 мл 2 %-го раствора содержит 100 мг миноксидила - максимальную рекомендованную дозу для взрослых при приеме внутрь при лечении артериальной гипертензии: (5 мл 5 %-го раствора содержит 250 мг миноксидила, то есть дозу в 2,5 раза превышающую максимальную рекомендованную суточную дозу для взрослых при приеме внутрь при лечении артериальной гипертензии). Признаки передозировки: задержка жидкости, снижение артериального давления, тахикардия. Лечение: для устранения задержки жидкости при необходимости могут быть назначены диуретики: для лечения тахикардии - бета-адреноблокаторы. Для лечения гипотензии следует ввести внутривенно 0,9 % раствор натрия хлорида. Не следует назначать симпатомиметические средства, например, норэпинефрин и эпинефрин, обладающие чрезмерной кардиостимулирующей активностью. Взаимодействие с другими ЛС: Существует теоретическая возможность (клиническое подтверждение отсутствует) усиления ортостатической гипотензии у пациентов, получающих сопутствующее лечение периферическими сосудорасширяющими средствами. Нельзя исключить очень незначительное повышение содержания миноксидила в крови пациентов, страдающих артериальной гипертензией и принимающих миноксидил внутрь в случае одновременного использования препарата Генеролон®, хотя соответствующие клинические исследования не проводились. Установлено, что миноксидил для наружного применения может, взаимодействовать с некоторыми лекарственными средствами для наружного применения. Одновременное использование раствора миноксидила для наружного применения и крема, содержащего бетаметазон (0,05 %) приводит к снижению системного всасывания миноксидила. Одновременное использование крема, содержащего третиноин (0,05 %), приводит к повышенному всасыванию миноксидила. Одновременное нанесение на кожу миноксидила и препаратов для наружного применения, таких как третиноин и дитранол, которые вызывают изменение защитных фикций кожи, может привести к увеличению всасывания миноксидила. Фармакологическое действие и фармакокинетика При местном применении миноксидила стимулирует рост волос у лиц с андрогенной алопецией (поредением волос, облысением). Улучшает микроциркуляцию, стимулирует переход волосяных клеток в активную растущую фазу, изменяет воздействие андрогенов на волосяные мешочки. Уменьшает образование 5-альфа-дегидростерона (возможно, опосредованно), который играет существенную роль в формировании облысения. Наилучший эффект оказывает при небольшой давности заболевания (не более 10 лет), молодом возрасте пациентов, лысине в области темени не более 10 см, наличии в центре лысины более 100 пушковых и терминальных волос. Проявление признаков роста волос отмечается через 4 и более месяцев применения препарата. Начало и степень выраженности эффекта могут колебаться у разных больных. 5 %-ый раствор препарата стимулирует рост волос сильнее, чем 2 %-ый растврр, что было отмечено по увеличению роста пушковых волос: После прекращения применения препарата Генеролон® рост новых волос приостанавливается, и в течение 3-4 месяцев-возможно восстановления исходного внешнего вида. Точный механизм действия препарата Генеролон® при лечении андрогенной алопеции неизвестен. Миноксидил неэффективен в случае облысения, вызванного приемом лекарственного средства, неправильным питанием (дефицит железа (Fе), витамина А), в результате укладки волос в "тугие" прически. Фармакокинетика: При наружном применении миноксидил плохо всасывается через нормальную неповрежденную кожу: в среднем 1,5 % (0,3 - 4,5 %) общей нанесенной дозы поступает в системный кровоток. Влияние сопутствующих кожных заболеваний на всасывание миноксидила неизвестно. После прекращения применения препарата примерно 95 % миноксидила, попавшего в системный кровоток, выводится в течение 4 дней. Профиль метаболической биотрансформации миноксидила после наружного применения препарата Генеролон® до настоящего времени полностью не изучен. Миноксидил не связывается с белками плазмы и выводится почками посредством клубочковой фильтрации. Миноксидил не проникает через гематоэнцефалический барьер. Экскретируется преимущественно с мочой. Миноксидил и его метаболиты выводятся с помощью гемодиализа. Особые указания Не наносить препарат на другие участки тела. Препарат Генеролон® наносят только на сухую кожу волосистой части головы после купания или следует подождать около 4 часов после нанесения препарата перед купанием. Не давайте голове намокнуть ранее, чем через 4 часа после нанесения препарата. Мыть волосы при применении препарата Генеролон® рекомендуется в привычном режиме. В период применения препарат Генеролон® можно пользоваться лаком для волос и другими средствами ухода за волосами. Перед нанесением средств для ухода за волосами необходимо сначала нанести препарат Генеролон® и подождать, пока обработанный участок кожи полностью не высохнет. Нет данных о том, что окраска волос, выполнение химической завивки или использование смягчителей для волос может снижать эффективность препарата. Однако, для предотвращения возможного раздражения волосистой части головы необходимо убедиться в том, что препарат был полностью смыт с волос и волосистой части кожи головы перед использованием данных химических средств. Перед началом лечения препаратом Генеролон® пациенты должны пройти общее обследование, включающее сбор и изучение медицинского анамнеза. Врач должен убедиться в том, что кожа волосистой части головы здорова. При появлении системных побочных эффектов или тяжелых кожных реакций пациентам следует отменить препарат и обратиться к врачу. В состав препарата Генеролон® входит этиловый спирт, который может вызвать воспаление и раздражение глаз. В случае попадания препарата на чувствительные поверхности (глаза, раздраженную кожу, слизистые оболочки) необходимо промыть участок большим количеством холодной воды. Следует избегать вдыхания препарата при распылении. После применения препарата следует тщательно вымыть руки. Влияние на способность управлять транспортными средствами: Условия хранения и отпуска из аптек Условия хранения:При температуре не выше 25 °С. Хранить в недоступном для детей месте! Отпуск из аптек: Без рецепта Регистрационные данные Торговое название Генеролон® Международное непатентованное название:Миноксидил. Форма выпуска:спрей для наружного применения. Состав:1 мл раствора содержит: активное вещество: миноксидил - 20,00 мг или 50,00 мг: вспомогательные вещества: этанол (96 %) - 571,00 / 243,00 мг, пропиленгликоль - 104,00 / 520,00 мг, вода - до 1 мл. АТХ: Регистрация: Лекарственное средство ЛП-001609 Фармгруппа: Средство лечения алопеции. Дата регистрации: 23.03.2012 / 19.04.2016. Окончание регстрации: . Описание:Бесцветный или слегка окрашенный с желтоватым оттенком, прозрачный водно-спиртовой раствор с запахом спирта. Упаковка:Спрей для наружного применения 2% и 5%. 60 мл раствора во флаконе белого цвета из полиэтилена высокой плотности (ПЭВП) с завинчивающейся крышкой полипропиленовой (ПП) белого цвета, оснащенной пластиковым кольцом контроля первого вскрытия.1 или 2 флакона в комплекте с 1 пластиковым мерным насосом и 1 насадкой для распыления в защитном пакетике и инструкцией по применению помещают в картонную пачку.3 флакона в комплекте с 2 пластиковыми мерными насосами и 2 насадками для распыления в защитном пакетике и инструкцией по применению помещают в картонную пачку. Срок годности:Спрей для наружного применения 2% - 3 года. Спрей для наружного применения 5% - 4 года. Не применять по истечении срока годности. Владелец рег.удостоверения:БЕЛУПО, лекарства и косметика д.д. Производитель:BELUPO, Pharmaceuticals &: Cosmetics, d.d. Представительство:БЕЛУПО, лекарства и косметика д.д. Информация предоставлена: Компанией ГЭОТАР - http://www.lsgeotar.ru/
Модель:
RUR 74
Состав Противопоказания Дозировка Показания к применению Взаимодействие с другими лекарственными средствами Передозировка Фармакологическое действие Беременность и кормление грудью Условия отпуска из аптек Побочные явления Особые указания Условия хранения Способ применения и дозы Информация Состав Активное вещество: 1 л 5% раствора содержит: декстрозы моногидрат (в пересчете на безводную) – 50,0 г; 1 л 10% раствора содержит: декстрозы моногидрат (в пересчете на безводную) – 100,0 г; 1 л 20% раствора содержит: декстрозы моногидрат (в пересчете на безводную) – 200,0 г. Вспомогательные вещества: Натрия хлорид – 0,26 г; вода для инъекций – до 1 л. Теоретическая осмолярность: 5% раствор-286 м. Осм/л. 10 % раствор-564 м. Осм/л 20% раствор-1120 м. Осм/л. Описание: Прозрачная бесцветная (5 % и 10 % растворы) или слегка желтоватая (20 % раствор) жидкость. Форма выпуска: Раствор для инфузий 5 %, 10 % и 20 %. По 100, 200, 250, 400, 500 или 1000 мл во флаконах полипропиленовых со шкалой и петлей-держателем, укупоренных приваренными полипропиленовыми колпачками. Один флакон вместе с инструкцией по применению в пачке из картона. Для стационаров От 1 до 40 флаконов по 100, 200, 250, 400, 500 или 1000 мл вместе с инструкцией по применению в количестве равном количеству флаконов в гофрокоробе из картона. Противопоказания Гиперчувствительность, гипергликемия, гиперлактацидемия, гипергидратация, послеоперационные нарушения утилизации декстрозы; циркуляторные нарушения, угрожающие отеком головного мозга, отеком легких, острая левожелудочковая недостаточность, гиперосмолярная кома, декомпенсированный сахарный диабет, непереносимость декстрозы, в т.ч. метаболический стресс. С осторожностью Декомпенсированная хроническая сердечная недостаточность, хроническая почечная недостаточность (олиго, анурия), гипонатриемия, сахарный диабет. Дозировка 50 мг/мл Показания к применению 5 %, 10 %, 20 % растворы глюкозы применяют для восполнения объема жидкости при изотонической внеклеточной дегидратации и в качестве источника углеводов. 5 % раствор глюкозы может применяться как самостоятельно, так и для разведения и транспорта различных лекарственных средств, которые вводятся парентерально. Взаимодействие с другими лекарственными средствами При комбинации с другими лекарственными средствами необходимо визуально контролировать фармацевтическую совместимость. Передозировка Симптомы: Гипергликемия, глюкозурия, гипергликемическая гиперосмолярная кома; гипергидратация, нарушение водно-электролитного баланса. Лечение: Прекратить введение декстрозы, ввести инсулин, симптоматическая терапия. Фармакологическое действие Фармакологическая группа: Питания углеводного средство. Фармакодинамика: Участвует в различных процессах обмена веществ в организме. Вливание растворов декстрозы частично восполняет водный дефицит. Декстроза, поступая в ткани, фосфорилируется, превращаясь в глюкозо-6-фосфат, который активно включается во многие звенья обмена веществ организма. 5 % раствор декстрозы изотоничен плазме крови. Гипертонические (10 % и 20 %) растворы повышают осмотическое давление крови, увеличивают диурез. Фармакокинетика: Усваивается полностью организмом, почками не выводится (появление в моче является патологическим признаком). Беременность и кормление грудью Растворы глюкозы во время беременности и лактации могут быть использованы только при условии контроля со стороны врача. 5 % раствор глюкозы может быть использован по показаниям при беременности и в период кормления грудью. В настоящее время достаточных клинических данных о применении 10 % и 20 % растворов глюкозы в период беременности и в период кормления грудью нет, поэтому возможно применение препарата у беременных и в период кормления грудью только в случаях, когда ожидаемая польза от лечения препаратом превышает возможный риск развития осложнений. При использовании раствора в качестве транспорта других лекарственных средств, следует оценивать влияние этих дополнительных средств при беременности и лактации. Условия отпуска из аптек По рецепту. Побочные явления Нарушения со стороны иммунной системы: повышенная чувствительность, анафилактические реакции (возможные проявления у больных с аллергией на кукурузу). Нарушения со стороны обмена веществ и питания: гипокалиемия, гипомагниемия, гипофосфатемия, обезвоживание, гиперволемия, гипергликемия. Нарушения со стороны сердца: острая желудочковая недостаточность. Нарушения со стороны сосудов: тромбоз вен, флебит. Нарушения со стороны почек и мочевыводящих путей: полиурия. Общие расстройства и нарушения в месте введения: озноб, лихорадка, развитие инфекции в месте введения, легкая болезненность и тромбофлебит в месте внутривенного введения. Особые указания Для более полного усвоения декстрозы одновременно с ней можно ввести подкожно от 4 до 5 ЕД инсулина короткого действия из расчета 1 ЕД инсулина короткого действия на 4-5 г декстрозы. Допускается замораживание при транспортировании. Влияние на способность управления транспортными средствами и механизмами Клинических исследований по оценке влияния препарата на способность к управлению транспортными средствами и механизмами не проводилось. Условия хранения Хранить при температуре не выше 25 С. Хранить в недоступном для детей месте. Способ применения и дозы Внутривенно капельно. Концентрация и доза раствора декстрозы определяется несколькими факторами, включая возраст, массу тела и общее состояние пациентов. 5 % раствор вводят с максимальной скоростью до 7 мл (150 кап/мин) (400 мл/ч); максимальная суточная доза для взрослых – 2 л; 10 % раствор глюкозы – до 60 кап/мин (3 мл/мин); максимальная суточная доза для взрослых – 1 л; 20 % раствор глюкозы – до 30 - 40 кап/мин (1,5-2 мл/мин); максимальная суточная доза для взрослых – 500 мл. У взрослых с нормальным обменом веществ суточная доза вводимой декстрозы не должна превышать 4 - 6 г/кг, т.е. около 250 - 450 г (при снижении интенсивности обмена веществ – 30 - 40 мл/кг). Детям для парентерального питания, наряду с жирами и аминокислотами, в первый день вводят 6 г декстрозы/кг/сут, в последующем – до 15 г/кг/сут. При расчете дозы декстрозы при введении 5 % и 10 % растворов нужно принимать во внимание допустимый объем вводимой жидкости: для детей с массой 2 - 10 кг – 100 - 165 мл/кг/сут, детям с массой 10 - 40 кг – 45 - 100 мл/кг/сут. Скорость введения: при нормальном состоянии обмена веществ максимальная скорость введения декстрозы взрослым - 0,25 - 0,5 г/кг/ч (при снижении интенсивности обмена веществ скорость введения снижают до 0,125 - 0,25 г/кг/ч). У детей скорость введения не должна превышать 0,5 г/кг/ч; что составляет для 5 % раствора – около 10 мл/мин или 200 кап/мин (20 кап = 1 мл). При использовании раствора глюкозы в качестве растворителя, рекомендуемая доза составляет 50-250 мл на дозу растворяемого лекарственного средства, характеристики которого определяют и скорость введения. Для более полного усвоения декстрозы, вводимой в больших дозах, одновременно с ней вводят инсулин короткого действия из расчета 1 ЕД инсулина на 4 - 5 г декстрозы. Содержание глюкозы в крови следует тщательно контролировать. Во избежание гипергликемии нельзя превышать уровень возможного окисления глюкозы. Больным сахарным диабетом декстрозу вводят под контролем ее содержания в крови и моче. Информация Внешний вид товара может отличаться от изображённого на фотографии. Имеются противопоказания. Необходимо ознакомиться с инструкцией или проконсультироваться со специалистом
Модель:
RUR 62
Состав Противопоказания Дозировка Показания к применению Взаимодействие с другими лекарственными средствами Передозировка Фармакологическое действие Беременность и кормление грудью Условия отпуска из аптек Побочные явления Особые указания Условия хранения Способ применения и дозы Информация Состав Активное вещество: 1 л 5% раствора содержит: декстрозы моногидрат (в пересчете на безводную) – 50,0 г; 1 л 10% раствора содержит: декстрозы моногидрат (в пересчете на безводную) – 100,0 г; 1 л 20% раствора содержит: декстрозы моногидрат (в пересчете на безводную) – 200,0 г. Вспомогательные вещества: Натрия хлорид – 0,26 г; вода для инъекций – до 1 л. Теоретическая осмолярность: 5% раствор-286 м. Осм/л. 10 % раствор-564 м. Осм/л 20% раствор-1120 м. Осм/л. Описание: Прозрачная бесцветная (5 % и 10 % растворы) или слегка желтоватая (20 % раствор) жидкость. Форма выпуска: Раствор для инфузий 5 %, 10 % и 20 %. По 100, 200, 250, 400, 500 или 1000 мл во флаконах полипропиленовых со шкалой и петлей-держателем, укупоренных приваренными полипропиленовыми колпачками. Один флакон вместе с инструкцией по применению в пачке из картона. Для стационаров От 1 до 40 флаконов по 100, 200, 250, 400, 500 или 1000 мл вместе с инструкцией по применению в количестве равном количеству флаконов в гофрокоробе из картона. Противопоказания Гиперчувствительность, гипергликемия, гиперлактацидемия, гипергидратация, послеоперационные нарушения утилизации декстрозы; циркуляторные нарушения, угрожающие отеком головного мозга, отеком легких, острая левожелудочковая недостаточность, гиперосмолярная кома, декомпенсированный сахарный диабет, непереносимость декстрозы, в т.ч. метаболический стресс. С осторожностью Декомпенсированная хроническая сердечная недостаточность, хроническая почечная недостаточность (олиго, анурия), гипонатриемия, сахарный диабет. Дозировка 50 мг/мл Показания к применению 5 %, 10 %, 20 % растворы глюкозы применяют для восполнения объема жидкости при изотонической внеклеточной дегидратации и в качестве источника углеводов. 5 % раствор глюкозы может применяться как самостоятельно, так и для разведения и транспорта различных лекарственных средств, которые вводятся парентерально. Взаимодействие с другими лекарственными средствами При комбинации с другими лекарственными средствами необходимо визуально контролировать фармацевтическую совместимость. Передозировка Симптомы: Гипергликемия, глюкозурия, гипергликемическая гиперосмолярная кома; гипергидратация, нарушение водно-электролитного баланса. Лечение: Прекратить введение декстрозы, ввести инсулин, симптоматическая терапия. Фармакологическое действие Фармакологическая группа: Питания углеводного средство. Фармакодинамика: Участвует в различных процессах обмена веществ в организме. Вливание растворов декстрозы частично восполняет водный дефицит. Декстроза, поступая в ткани, фосфорилируется, превращаясь в глюкозо-6-фосфат, который активно включается во многие звенья обмена веществ организма. 5 % раствор декстрозы изотоничен плазме крови. Гипертонические (10 % и 20 %) растворы повышают осмотическое давление крови, увеличивают диурез. Фармакокинетика: Усваивается полностью организмом, почками не выводится (появление в моче является патологическим признаком). Беременность и кормление грудью Растворы глюкозы во время беременности и лактации могут быть использованы только при условии контроля со стороны врача. 5 % раствор глюкозы может быть использован по показаниям при беременности и в период кормления грудью. В настоящее время достаточных клинических данных о применении 10 % и 20 % растворов глюкозы в период беременности и в период кормления грудью нет, поэтому возможно применение препарата у беременных и в период кормления грудью только в случаях, когда ожидаемая польза от лечения препаратом превышает возможный риск развития осложнений. При использовании раствора в качестве транспорта других лекарственных средств, следует оценивать влияние этих дополнительных средств при беременности и лактации. Условия отпуска из аптек По рецепту. Побочные явления Нарушения со стороны иммунной системы: повышенная чувствительность, анафилактические реакции (возможные проявления у больных с аллергией на кукурузу). Нарушения со стороны обмена веществ и питания: гипокалиемия, гипомагниемия, гипофосфатемия, обезвоживание, гиперволемия, гипергликемия. Нарушения со стороны сердца: острая желудочковая недостаточность. Нарушения со стороны сосудов: тромбоз вен, флебит. Нарушения со стороны почек и мочевыводящих путей: полиурия. Общие расстройства и нарушения в месте введения: озноб, лихорадка, развитие инфекции в месте введения, легкая болезненность и тромбофлебит в месте внутривенного введения. Особые указания Для более полного усвоения декстрозы одновременно с ней можно ввести подкожно от 4 до 5 ЕД инсулина короткого действия из расчета 1 ЕД инсулина короткого действия на 4-5 г декстрозы. Допускается замораживание при транспортировании. Влияние на способность управления транспортными средствами и механизмами Клинических исследований по оценке влияния препарата на способность к управлению транспортными средствами и механизмами не проводилось. Условия хранения Хранить при температуре не выше 25 С. Хранить в недоступном для детей месте. Способ применения и дозы Внутривенно капельно. Концентрация и доза раствора декстрозы определяется несколькими факторами, включая возраст, массу тела и общее состояние пациентов. 5 % раствор вводят с максимальной скоростью до 7 мл (150 кап/мин) (400 мл/ч); максимальная суточная доза для взрослых – 2 л; 10 % раствор глюкозы – до 60 кап/мин (3 мл/мин); максимальная суточная доза для взрослых – 1 л; 20 % раствор глюкозы – до 30 - 40 кап/мин (1,5-2 мл/мин); максимальная суточная доза для взрослых – 500 мл. У взрослых с нормальным обменом веществ суточная доза вводимой декстрозы не должна превышать 4 - 6 г/кг, т.е. около 250 - 450 г (при снижении интенсивности обмена веществ – 30 - 40 мл/кг). Детям для парентерального питания, наряду с жирами и аминокислотами, в первый день вводят 6 г декстрозы/кг/сут, в последующем – до 15 г/кг/сут. При расчете дозы декстрозы при введении 5 % и 10 % растворов нужно принимать во внимание допустимый объем вводимой жидкости: для детей с массой 2 - 10 кг – 100 - 165 мл/кг/сут, детям с массой 10 - 40 кг – 45 - 100 мл/кг/сут. Скорость введения: при нормальном состоянии обмена веществ максимальная скорость введения декстрозы взрослым - 0,25 - 0,5 г/кг/ч (при снижении интенсивности обмена веществ скорость введения снижают до 0,125 - 0,25 г/кг/ч). У детей скорость введения не должна превышать 0,5 г/кг/ч; что составляет для 5 % раствора – около 10 мл/мин или 200 кап/мин (20 кап = 1 мл). При использовании раствора глюкозы в качестве растворителя, рекомендуемая доза составляет 50-250 мл на дозу растворяемого лекарственного средства, характеристики которого определяют и скорость введения. Для более полного усвоения декстрозы, вводимой в больших дозах, одновременно с ней вводят инсулин короткого действия из расчета 1 ЕД инсулина на 4 - 5 г декстрозы. Содержание глюкозы в крови следует тщательно контролировать. Во избежание гипергликемии нельзя превышать уровень возможного окисления глюкозы. Больным сахарным диабетом декстрозу вводят под контролем ее содержания в крови и моче. Информация Внешний вид товара может отличаться от изображённого на фотографии. Имеются противопоказания. Необходимо ознакомиться с инструкцией или проконсультироваться со специалистом

Модель:
RUR 675
Состав: Активные компоненты, мг/пакетик: Парацетамол 325,0 Фенирамина малеат 20,0 Фенилэфрина гидрохлорид 10,0 Вспомогательные компоненты Сахароза 10 000,0 Ацесульфам калия 13,0 Краситель красный очаровательный Е129 (краситель FD&C красный No 40) 2,400 Краситель бриллиантовый голубой Е133 (краситель FD&C синий No 1) 0,300 Мальтодекстрин М 100 26,0 Кремния диоксид 13,0 Ароматизатор малиновый натуральный WONF Durarome (860385 TD0994) 165,0 Ароматизатор клюквенный Durarome натуральный (861149 TD2590) 55,0 Лимонная кислота 725,0 Натрия цитрат дигидрат 180,0 Кальция фосфат 35,0 Магния стеарат 3,2 Теоретическая масса содержимого пакетика 11572,9 мг Показания к применению: Симптоматическая терапия инфекционно-воспалительных заболеваний: ОРВИ, в том числе гриппа и «простуды», сопровождающихся высокой температурой, ознобом, головной болью, болью в горле, насморком, заложенностью носа, чиханием и болями в мышцах. Противопоказания к применению: Повышенная чувствительность к отдельным компонентам препарата, одновременный прием трициклических антидепрессантов, бета-адреноблокаторов или других симпатомиметических препаратов (таких, как деконгестанты, препараты для подавления аппетита и амфетаминподобные средства), одновременный или в течение предшествующих 2 недель прием ингибиторов моноаминоксидазы (МАО), портальная гипертензия, алкоголизм, сахарный диабет, дефицит сахаразы/изомальтазы, непереносимость фруктозы, глюкозо-галактозная мальабсорбция, беременность, период грудного вскармливания, детский возраст до 12 лет, тяжелые сердечно-сосудистые заболевания, артериальная гипертензия, гипертиреоз, закрытоугольная глаукома, феохромоцитома. Способ применения: Внутрь. Не превышайте рекомендованную дозу. Следует применять наименьшую дозу, необходимую для достижения эффекта, в течение максимально короткого срока лечения. Взрослые (включая пожилых) и дети 12 лет и старше По одному пакетику каждые 4–6 часов, по мере необходимости, но не более 4 доз в течение 24 часов. Один пакетик растворяют в стакане горячей, но не кипящей воды. Принимают в горячем виде. Тера. Флю можно применять в любое время суток, но наилучший эффект приносит прием препарата перед сном, на ночь. Если не наблюдается облегчения симптомов в течение 3 дней после начала приема препарата, необходимо обратиться к врачу. Пациентам не следует принимать Тера. Флю более 5 дней. Особые группы пациентов Печеночная недостаточность: пациентам с нарушенной функцией печени или синдромом Жильбера необходимо уменьшить дозу или увеличить интервал между приемами Тера. Флю. Почечная недостаточность: При наличии острой почечной недостаточности (клиренс креатинина

Модель:
RUR 550
Показания Лечение андрогенетической алопеции у мужчин и женщин. Противопоказания Противопоказания Повышенная чувствительность к миноксидилу или другим компонентам препарата. Возраст младше 18 лет и старше 65 лет. Нарушение целостности кожных покровов, дерматозы волосистой части головы. Одновременное применение других лекарственных средств для нанесения на кожу головы. Беременность, период грудного вскармливания. С осторожностью: Пациентам с сердечно-сосудистыми заболеваниями и аритмией, пациентам с почечной и печеночной недостаточностью перед началом лечения препаратом необходимо проконсультироваться с врачом. Беременность Препарат противопоказан женщинам во время беременности в период грудного вскармливания. Применение и дозы Только для наружного применения. Независимо от размера наносить 1 мл раствора с помощью дозатора (7 нажатий) 2 раза в день на пораженные участки волосистой части головы, начиная с центра пораженной зоны. После применения необходимо вымыть руки. Суммарная суточная доза не должна превышать 2 мл (доза не зависит от размера пораженной области). Для мужчин препарат Ревасил наиболее эффективен при выпадении волос на макушке, для женщин - при выпадении волос в области срединного пробора. Наносите препарат Ревасил только на сухую кожу волосистой части головы. Раствор не требует смывания. Появление первых признаков приостановления выпадения волос и восстановления роста волос возможно после применения лекарственного препарата Ревасил 2 раза в сутки в течение 2-4 месяцев. Для достижения и поддержания достигнутого эффекта восстановления роста волос пациент не должен прерывать применение препарата, иначе выпадение волос возобновится. Повышение дозы препарата или более частое его применение не приведет к улучшению результатов терапии. Если после применения лекарственного препарата Ревасил в течение 16 недель усиление роста волос не отмечается, то применение препарата следует прекратить. После начала применения лекарственного препарата Ревасил может отмечаться усиленное выпадение волос. Данный эффект вызван влиянием миноксидила. Он выражается в стимулировании перехода волос из фазы покоя (телоген) в фазу роста (анаген). Таким образом, отмечается выпадение старых волос, на месте которых вырастают новые. Временное усиление выпадения волос обычно продолжается в течение 2-6 недель с момента начала лечения, а затем уменьшается в течение 2 недель. Если повышенное выпадение волос продолжается, то применение препарата следует прекратить и проконсультироваться с врачом. Для эффективности препарата и его достижения волосяных фолликулов важно наносить препарат на кожу волосистой части головы, а не на волосы. Не наносить препарат Ревасил на другие участки тела. Особые группы пациентов. Нет рекомендаций по дозированию препарата Ревасил для применения у пациентов с почечной и печеночной недостаточностью. Побочные эффекты и передозировка Побочные эффекты: Классификация частоты развития побочных эффектов согласно рекомендациям Всемирной организации здравоохранения (ВОЗ): очень часто >:1/10: часто от >:1/100 до <:1/10: нечасто >:1/1000 до <:1/100: редко от >:1/10000 до <:1/1000: очень редко <:1/10000, включая отдельные сообщения: частота неизвестна - по имеющимся данным установить частоту возникновения не представляется возможным. Нарушения со стороны нервной системы: часто - головная боль: очень редко - головокружение. Нарушения со стороны кожи и подкожных тканей: часто - кожный зуд, сыпь: редко - дерматит, проявляющийся в виде покраснения, шелушения и воспаления: очень редко - временное выпадение волос, изменение цвета волос, нарушение текстуры волос, гипертрихоз (нежелательный рост волос вне места применения), реакции в месте применения (эти реакции могут распространяться на уши и лицо, включают: кожный зуд, раздражение, боль, сыпь, отек, сухость кожи, эритему: однако в некоторых случаях реакции могут быть более тяжелыми, включая: эксфолиацию, дерматит, образование пузырей, кровотечение, изъязвление) Нарушения со стороны иммунной системы: очень редко - ангионевротический отек (проявлениями ангионевротического отека могут быть: отек губ, отек тканей ротовой полости, отек ротоглотки, отек глотки и отек языка), гиперчувствительность (проявлениями гиперчувствительности могут быть: генерализованная эритема, генерализованный кожный зуд, отек лица и чувство стеснения в горле), аллергический контактный дерматит. Нарушения со стороны органа зрения: очень редко - раздражение глаз. Нарушения со стороны сердца: очень редко - тахикардия, ощущение сердцебиения. Нарушения со стороны дыхательной системы, органов грудной клетки и средостения: очень редко - одышка. Нарушения со стороны желудочно- кишечного тракта: очень редко - тошнота, рвота. Общие расстройства и нарушения в месте введения: очень редко - периферический отек, боль в грудной клетке. Нарушения со стороны сосудов: нечасто - снижение артериального давления. Если любые из указанных в инструкции побочных эффектов усугубляются, или Вы заметили любые другие побочные эффекты, не указанные в инструкции, сообщите об этом врачу. Передозировка: Если дозы, превышающие рекомендованные, наносятся на более обширные участки тела или другие участки тела, помимо волосистой части головы, возможно увеличение системной абсорбции миноксидила, что, следовательно, может привести к развитию нежелательных явлений. Симптомы: задержка жидкости, снижение артериального давления, тахикардия, головокружение. Лечение: для устранения задержки жидкости при необходимости могут быть назначены диуретики: для лечения тахикардии - бета-адреноблокаторы. Для лечения артериальной гипотензии следует ввести внутривенно 0,9 % раствор натрия хлорида. Не следует назначать симптоматические средства, например, норэпинефрин и эпинефрин, обладающие чрезмерной кардиостимулирующей активностью. Взаимодействие с другими ЛС: Существует теоретическая возможность усиления ортостатической гипотензии у пациентов, получающих сопутствующее лечение периферическими сосудорасширяющими средствами, не получившая, однако, клинического подтверждения. Нельзя исключить очень незначительное повышение содержание миноксидила в крови пациентов, страдающих артериальной гипертензией и принимающих миноксидил внутрь в случае одновременного применения препарата Ревасил, хотя соответствующие клинические исследования не проводились. Установлено, что миноксидил при наружном применении может взаимодействовать с некоторыми другими лекарственными средствами для наружного применения. Одновременное применение раствора миноксидила для наружного применения и крема, содержащего бетаметазон (0,05 %) приводит к снижению системного всасывания миноксидила. Одновременное применение крема, содержащего третиноин (0,05 %), приводит к повышенному всасыванию миноксидила. Одновременное нанесение на кожу миноксидила и препаратов для наружного применения, таких как третиноин и дитранол, которые вызывают изменения защитных функций кожи, может привести к увеличению всасыванияминоксидила. Фармакологическое действие и фармакокинетика Являясь периферическим вазодилататором, миноксидил при наружном применении усиливает микроциркуляцию в области волосяныхфолликулов. Миноксидил стимулирует фактор роста эндотелия сосудов (ФРЭС), который, как предполагается, ответственен за повышение проницаемости капилляров, что свидетельствует о высокой метаболической активности, наблюдаемой в фазе анагена. Миноксидил стимулирует рост волос у пациентов с наследственной потерей волос (андрогенная алопеция) в начальной стадии. Точный механизм действия миноксидила для наружного применения при выпадении волос до конца не изучен. Фармакокинетика: Всасывание. При наружном применении миноксидил плохо всасывается через неповрежденную кожу: в среднем 1,5% (1-2%) общей нанесенной дозы поступает в системный кровоток. Средние значения площади под кривой "концентрация-время" (AUC) и максимальной концентрации (Сmах) составляют примерно 18,71 нг*ч/мл и 2,13 нг/мл, соответственно. Время до достижения максимальной концентрации миноксидила (ТСmах) составляет 5,79 ч. Влияние миноксидила на гемодинамику не выражено до тех пор, пока средняя сывороточная концентрация миноксидила не достигнет 21,7 нг/мл. Распределение. Хотя ранее сообщалось о том, что миноксидил не связывается с белками плазмы крови, позднее методом ультрафильтрации in vitro было продемонстрировано его обратимое связывание с белками крови человека в диапазоне 37-39 %. Поскольку абсорбируется только 1-2% миноксидила при наружном применении, степень его связывания с белками плазмы, клинически незначимо. Метаболизм. Примерно 60% миноксидила, метаболизируется с образованием миноксидила глюкуронида, преимущественно в печени. Выведение. Период полувыведения миноксидила при наружном применении в среднем составляет 22 ч. 97 % миноксидила и его метаболитов экскретируются почками и 3 % - через кишечник. После прекращения применения препарата примерно 95% миноксидила, нанесенного наружно, выводится в течение 4-х дней. Особые указания Не наносить препарат на другие участки тела. Наносите препарат Ревасил только на сухую кожу волосистой части головы после купания или подождите около 4 часов после нанесения препарата перед купанием. Не давайте голове намокнуть ранее, чем через 4 часа после нанесения препарата. Если Вы наносили препарат с помощью кончиков пальцев, после обработки головы руки следует тщательно вымыть. Мыть волосы при применении препарата Ревасил рекомендуется в привычном режиме. Лак для волос и другие средства ухода за волосами могут использоваться в период применения препарата Ревасил. Перед нанесением средств для ухода за волосами необходимо сначала нанести препарат Ревасил и подождать, пока обработанный участок кожи полностью не высохнет. Не имеется данных о том, что окраска для волос, выполнение химической завивки или использование смягчителей для волос может каким-либо образом снижать эффективность препарата. Однако, для предотвращения возможного раздражения кожи волосистой части головы необходимо убедиться в том, что препарат был полностью смыт с волос и кожи волосистой части головы перед применением данных химических средств. Перед тем, как начать лечение препаратом Ревасил, пациенты должны пройти общее обследование, включающее сбор и изучение медицинского анамнеза. Врач должен убедиться в том, что кожа волосистой части головы здорова. При появлении системных побочных эффектов или тяжелых кожных реакций пациентам следует отменить препарат и обратиться к врачу. В состав препарата Ревасил входит этиловый спирт, который может вызывать воспаление и раздражение глаз. В случае попадания препарата на чувствительные поверхности (глаза, раздраженную кожу, слизистые оболочки) необходимо промыть участок большим количеством холодной воды. Лекарственный препарат не будет эффективен при использовании: фена после нанесения препарата на кожу головы: средств по уходу за волосами, которые могут вызвать образование рубцов, а также глубокие ожоги кожи головы: методов ухода за волосами, требующих сильного оттягивания волос от кожи головы (например, плетение "тугих" кос (брейдинг) или прическа "конский хвост"). Наносить лекарственный препарат Ревасил следует только на здоровую кожу волосистой части головы. Нельзя использовать его при воспалении, инфицировании, раздражении, болезненности кожи, а также одновременно с другими лекарственными препаратами, наносимыми на кожу волосистой части головы. Не следует применять лекарственный препарат Ревасил в случаях внезапного выпадения волос, очаговой алопеции, когда алопеция развивается после родов, в случае облысения, вызванного приемом лекарственных средств, неправильным питанием (дефицит железа, витамина А), в результате укладки волос в "тугие" прически, а также в том случае, когда причина выпадения волос неизвестна. Случайный прием препарата внутрь может привести к развитию серьезных нежелательных явлений со стороны сердца. Поэтому данный препарат следует хранить в местах, недоступных для детей. Влияние на способность управлять транспортными средствами: Условия хранения и отпуска из аптек Условия хранения:При температуре не выше 25 °С. Хранить в недоступном для детей месте. Отпуск из аптек: Без рецепта Регистрационные данные Торговое название Ревасил Международное непатентованное название:Миноксидил. Форма выпуска:Спрей для наружного применения. Состав:100 мл препарата содержат: активное вещество: миноксидил - 2,0 г: вспомогательные вещества: этанол (этиловый спирт) 95 % - 51,7 г, пропиленгликоль - 20,7 г, вода очищенная - до 100 мл. АТХ: Регистрация: Лекарственное средство ЛП-000232 Фармгруппа: Алопеции средство лечения. Дата регистрации: 16.02.2011 / 09.06.2016. Окончание регстрации: . Описание:Прозрачная бесцветная или желтоватая, или розоватая жидкость. Упаковка:Спрей для наружного применения 2%. По 50 мл или 100 мл во флакон стеклянный, завинченный головкой-распылителем (помпой) с крышкой из пластмассы. Каждый флакон вместе с инструкцией по применению препарата в пачке из картона. Срок годности:4 года. Не использовать по истечении срока годности. Владелец рег.удостоверения:ПАТЕНТ-ФАРМ, ЗАО Производитель:АЛТАЙВИТАМИНЫ, ЗАО. Представительство

Модель:
RUR 2379
Купить Клексан раствор для инъекций 4000 анти-Ха МЕ/0,4мл шприц №9 Препарат относится к классу прямых антикоагулянтов (низкомолекулярных гепаринов). Показанием для введения раствора для инъекций «Клексан» является профилактика образования тромбов глубоких вен вследствие сердечной и дыхательной недостаточности, острых инфекционных и ревматических заболеваний. Дозировка и периодичность инъекций описаны в инструкции по применению. Заказать лекарство можно в интернет-аптеке «Алоэ». Его доставят в выбранный вами пункт нашей аптечной сети. Необходим рецепт. Оплатить заказ можно наличными, банковской картой, по системе быстрых платежей. Инструкция по применению Клексан Состав Состав на один шприц: Активное вещество: эноксапарин натрия 40 мг* Растворитель: вода для инъекций до 0,4 мл * - масса рассчитана на основании содержания используемого эноксапарина натрия (теоретическая активность 100 анти-Ха МЕ/мг). Фармакологический эффект Антикоагулянтное средство прямого действия. Характеристика Эноксапарин натрия - низкомолекулярный гепарин со средней молекулярной массой около 4,500 дальтон: менее 2000 дальтон - 68%, более 8000 дальтон -

Модель:
RUR 4399
Показания стабильная стенокардия Противопоказания Противопоказания - повышенная чувствительность к действующему веществу или любому из вспомогательных веществ (см. раздел Состав)'- дефицит лактазы, наследственная непереносимость лактозы, синдром глюкозогалактозной мальабсорбции (только для дозировки 1000 мг): - тяжелая почечная недостаточность (клирейс креатинина <:30 мл/мин): печеночная недостаточность средней (7-9 баллов по шкале Чайлд-Пью) или тяжелой (более 9 баллов по шкале Чайлд-Пью) степени тяжести: - одновременное применение с сильными ингибиторами изофермента CYP3A4 (итраконазол, кетоконазол, вориконазол, позаконазол, ингибиторы ВИЧ-протеазы, кларитромицин, телитромицин, нефазодон): - одновременное применение с антиаритмическими средствами класса IA (например, хинидин) или класса III (например, дофетилид), кроме амиодарона: с соталолом. - дети до 18 лет (эффективность и безопасность препарата не установлены): беременность: период грудного вскармливания. С осторожностью: - печеночная недостаточность легкой степени тяжести (5-6 баллов по классификации Чайлд-Пью): почечная недостаточность легкой или средней степени тяжести (клиренс креатинина 30-80 мл/мин): возраст старше 75 лет: масса тела менее 60 кг: хроническая сердечная недостаточность (III-IV функциональные классы по классификации NYHA): синдром врожденного удлиненного интервала QT в анамнезе, в семейном анамнезе: диагностированное приобретенное удлинение интервала QT: недостаточность изофермента CYP2D6: одновременное применение с ингибиторами изофермента CYP3A4 средней силы действия (дилтиазем, флуконазол, эритромицин): одновременное применение с индукторами активности изофермента CYP3A4 (рифампицин, фенитоин, фенобарбитал, карбамазепин, зверобой продырявленный (Hypericum perforatum)): одновременное применение с ингибиторами P-gp (Р-гликопротеин) (верапамил, циклоспорин). Беременность Данных о применении ранолазина у беременных женщин не имеется. Проникновение ранолазина в грудное молоко не исследовалось. В связи с отсутствием данных применение препарата Ранекса® при беременности и в период грудного вскармливания противопоказано. Применение и дозы Рекомендованная начальная доза препарата Ранекса® для взрослых составляет 500 мг 2 раза в сутки. Через 2-4 недели доза при необходимости может быть увеличена до 1000 мг 2 раза в сутки. Максимальная суточная доза составляет 2000 мг. При появлении побочных эффектов, вызванных приемом препарата Ранекса® (например, головокружение, тошнота или рвота), необходимо уменьшить разовую дозу до 500 мг. Если после этого симптомы не исчезнут, применение препарата должно быть прекращено. Таблетки следует проглатывать целиком, запивая достаточным количеством жидкости, не измельчая, не разламывая и не разжевывая. Прием пищи не влияет на биодоступность препарата, поэтому его можно принимать вне зависимости от приемов пищи. Для пациентов с ХСН (III-IV функциональные классы по классификации NYHA), с почечной недостаточностью легкой и средней степенями тяжести (клиренс креатинина 30-80 мл/мин), печеночной недостаточностью легкой степени тяжести (5-6 баллов по классификации Чайлд-Пью), а также для пациентов с массой тела менее 60 кг и пациентов старше 75 лет рекомендуется титрация дозы препарата. Побочные эффекты и передозировка Побочные эффекты: Побочные эффекты, наблюдаемые у пациентов, принимающих препарат Ранекса®, в большинстве случаев характеризуются легкой или средней степенью выраженности и развиваются обычно в течение первых 2-х недель применения. Ниже перечислены побочные эффекты, для которых была признана возможная связь с применением препарата Ранекса®. Частоту возникновения побочных эффектов определяли как: очень часто (>: 1/10), часто (>: 1/100: <: 1/10), нечасто (>: 1/1000: <: 1/100), редко ( >: 1/10 000: <: 1/1000) и очень редко (<: 1/10 000). Со стороны обмена веществ и питания: Нечасто: снижение аппетита, анорексия, дегидратация. Со стороны психики: Нечасто: тревога, бессонница, помутнение сознания, галлюцинации. Редко: дезориентация. Со стороны нервной системы: Часто: головокружение, головная боль. Нечасто: заторможенность, обморок, гипе- стезия, сонливость, тремор, постуральное головокружение, парестезия. Редко: амнезия, спутанность сознания, потеря сознания, нарушения координации движений, нарушения походки, паросмия. Со стороны органа зрения: Нечасто: нечеткость зрения, зрительные расстройства, диплопия. Со стороны органов слуха и лабиринтные нарушения: Нечасто: вертиго, шум в ушах. Редко: снижение слуха. Со стороны сердечно-сосудистой системы: Нечасто: "приливы" крови к лицу, выраженное снижение АД. Редко: похолодание конечностей, ортостатическая гипотензия. Со стороны дыхательной системы, органов грудной клетки и средостения: Нечасто: одышка, кашель, носовые кровотечения. Редко: ощущение сдавления в горле. Со стороны пищеварительного тракта: Часто: запор, тошнота, рвота. Нечасто: боль в животе, сухость слизистой оболочки полости рта, диспепсия, метеоризм, дискомфорт в области желудка. Редко: панкреатит, эрозивный дуоденит, гипе- стезия полости рта. Со стороны кожных покровов и подкожных тканей: Нечасто: кожный зуд, гипергидроз. Редко: аллергический дерматит, крапивница, холодный пот, кожная сыпь, ангионевротический отек. Со стороны опорно-двигательного аппарата: Нечасто: боль в конечностях, мышечные спазмы, припухлость суставов. Редко: мышечная слабость. Со стороны почек и мочевыводящих путей: Нечасто: дизурия, гематурия, хроматурия. Редко: острая почечная недостаточность, задержка мочи. Со стороны мочеполовой системы: Редко: эректильная дисфункция. Общие расстройства: Часто: астения. Нечасто: повышенная утомляемость, периферические отеки. Прочие нарушения: Нечасто: повышение концентрации креатинина в плазме крови, повышение концентрации мочевины в плазме крови, удлинение корригированного интервала QTc, тромбоцитоз и лейкоцитоз, снижение массы тела. Редко . повышение активности "печеночных" ферментов. Передозировка: Симптомы: головокружение, тошнота и рвота. При внутривенном введении ранолазина были дополнительно отмечены следующие симптомы: диплопия, заторможенность, обморок. Выраженность симптомов может усиливаться при увеличении дозы. Лечение: симптоматическое под тщательным наблюдением врача. В течение 30 мин после приема препарата можно предпринять меры по предотвращению его всасывания из желудочно-кишечного тракта (промывание желудка, прием активированного угля). Гемодиализ малоэффективен. Взаимодействие с другими ЛС: Ранолазин является субстратом цитохрома CYP3A4. Одновременное применение ранолазина с ингибиторами изофермента CYP3A4 Индукторы изофермента CYP3A4 Не следует начинать прием ранолазина пациентам, получающим лечение индукторами изофермента CYP3A4 (рифампицин, фенитоин, фенобарбитал, карбамазепин, Зверобой продырявленный (Hypericum perforatum)). Так как, например, рифампицин (600 мг один раз в сутки) снижает равновесную концентрацию ранолазина в плазме крови примерно на 95 %. Ингибиторы изофермента CYP2D6 Ранолазин частично метаболизируется изоферментом CYP2D6. Одновременное применение ранолазина с ингибиторами изофермента CYP2D6 может приводить к повышению концентрации ранолазина в плазме крови. Одновременное применение ранолазина 1000 мг 2 раза в сутки с сильным ингибитором изофермента CYP2D6 пароксетином 20 мг 1 раз в сутки повышает среднюю концентрацию ранолазина в плазме крови в равновесном состоянии примерно в 1,2 раза. Коррекции дозы не требуется. Одновременное применение ранолазина 500 мг 2 раза в сутки и сильного ингибитора изофермента CYP2D6 может привести к повышению AUC ранолазина приблизительно на 62 %. Ингибиторы/субстраты P-sp (Р-гликопротеин) Ранолазин является субстратом P-gp. Ингибиторы P-gp (например, циклоспорин, верапамил) повышают концентрацию в плазме крови. Верапамил (120 мг три раза в сутки) повышает равновесную концентрацию ранолазина в 2,2 раза. Для пациентов, получающих лечение ингибиторами P-gp, рекомендуется титрация дозы ранолазина. Может потребоваться снижение дозы ранолазина. С другой стороны, ранолазин является умеренным ингибитором P-gp и может увеличивать концентрацию субстратов P-gp в плазме крови. Тканевое распределение лекарственных веществ, которые транспортируются с помощью P-gp, может быть увеличено. Субстраты изофермента CYP2D6 Имеются данные, что ранолазин является слабым ингибитором изофермента CYP2D6. Прием ранолазина по 750 мг 2 раза в день повышает концентрацию метопролола в плазме крови в 1,8 раз. Поэтому, при одновременном применении с ранолазином, может усиливаться действие метопролола или других субстратов изофермента CYP2D6 (например, пропафенон и флекаинид, в меньшей степени, трициклические антидепрессанты и нейролептики), вследствие чего может потребоваться снижение дозы этих лекарственных средств. Субстраты изофермента CYP2B6 Потенциал к ингибированию изофермента CYP2B6 не установлен. Во время назначения совместно с субстратами изофермента CYP2B6 (например, бупропион, эфавиренц, циклофосфамид) рекомендуется соблюдать осторожность. Дигоксин Имеются данные о повышении концентрации дигоксина в плазме крови в среднем в 1,5 раза при одновременном применении дигоксина и ранолазина. Поэтому необходим контроль концентрации дигоксина в начале и после окончания терапии с применением ранолазина. Субстраты изофермента CYP3A4 Ранолазин является слабым ингибитором изофермента CYP3A4, что может привести к повышению концентрации субстратов изофермента CYP3A4 в плазме крови и потребовать коррекции дозы чувствительных субстратов изофермента CYP3A4 (например, симваста- тин, ловастатин) и субстратов изофермента CYP3A4 с узким терапевтическим диапазоном (например, циклоспорин, такролимус, сиролимус, эверолимус). Симвастатин Метаболизм и клиренс симвастатина в высокой степени зависят от изофермента CYP3A4. Прием ранолазина по 1000 мг 2 раза в день повышает концентрацию лактона симвастатина и симвастатиновой кислоты в плазме крови приблизительно в 2 раза. Прием симвастатина в высоких дозах ассоциирован с развитием рабдомиолиза, также были описаны случаи развития рабдомиолиза при одновременном применении ранолазина и симвастатина. Максимальная доза симвастатина для пациентов, одновременно принимающих ранолазин, не должна превышать 20 мг/сутки. Аторвастатин Одновременное применение ранолазина 1000 мг 2 раза в сутки и аторвастатина 80 мг 1 раз в сутки увеличивает Стах и AUC аторвастатина в 1,4 и в 1,3 раза соответственно, Стах и AUC метаболитов аторвастатина изменяются не более чем на 35 %. При одновременном применении ранолазина и аторвастатина может потребоваться снижение дозы аторвастатина и проведение надлежащего клинического контроля. Для других статинов, метаболизирующихся с участием изофермента CYP3A4 (ловастатин), может потребоваться корректировка дозы. Такролимус, циклоспорин, сиролимус, эверолимус Увеличение концентрации в плазме крови такролимуса, субстрата изофермента CYP3A4, было отмечено у пациентов на фоне применения ранолазина. При одновременном применении такролимуса и ранолазина рекомендуется проводить мониторинг концентрации такролимуса в плазме крови и, при необходимости, проводить корректировку дозы. Такой подход рекомендован и для других субстратов изофермента CYP3A4 с узким терапевтическим диапазоном (например, циклоспорин, сиролимус, эверолимус). Субстраты транспортера органических катионов 2 (ОСТ2) При одновременном применении ранолазина 500 мг и 1000 мг 2 раза в сутки и метформина 1000 мг 2 раза в сутки, концентрация метформина в плазме крови у пациентов с сахарным диабетом 2 типа повышается в 1,4 и в 1,8 раз соответственно. Возможно повышение концентрации в плазме крови других субстратов ОСТ2, включая пиндолол и варениклин, при одновременном применении с ранолазином. Препараты, удлиняющие интервал ОТс Существует 'теоретическая вероятность того, что при одновременном применении ранолазина и других лекарственных средств, удлиняющих интервал QTc, может возникнуть фармакодинамическое взаимодействие и повыситься риск развития желудочковых аритмий. К числу таких лекарственных средств относятся определенные антигистаминные препараты (например, терфенадин, астемизол, мизоластин), определенные антиаритмические средства (например, хинидин, дизопирамид, прокаинамид), а также эритромицин и трициклические антидепрессанты (например, имипрамин, доксепин, амитриптилин), Фармакологическое действие и фармакокинетика Ранолазин - действующее вещество препарата Ранекса® - является ингибитором позднего тока ионов натрия в клетки миокарда. Снижение внутриклеточного накопления натрия ведет к уменьшению избытка внутриклеточных ионов кальция. Это уменьшает внутриклеточный ионный дисбаланс при ишемии. Снижение избытка внутриклеточного кальция способствует расслаблению миокарда и, таким образом, снижает диастолическое напряжение стенки желудочков. Клиническим свидетельством торможения позднего натриевого тока под действием ранолазина служит значительное укорочение интервала QTc (QTc - корригированное значение QT с учетом частоты сердечных сокращений (ЧСС)) и положительное влияние на диастолическое расслабление, выявленное в открытом исследовании с участием пациентов с синдромом удлиненного интервала QT (пациенты с синдромом LQT-3, имеющие мутации гена SCN5A AKPQ). Эти эффекты препарата не зависят от изменений ЧСС, артериального давления (АД) или от степени расширения сосудов. При применении ранолазина достоверно снижаются частота развития приступов стенокардии в неделю и потребление нитроглицерина для подъязычного применения в сравнении с плацебо, независимо от пола пациентов. Во время лечения развитие толерантности к ранолазину не происходит. После резкого прекращения приема препарата частота развития приступов стенокардии не увеличивается. Ранолазин имеет значимое преимущество по сравнению с плацебо в увеличении времени до возникновения приступа стенокардии и до появления депрессии сегмента ST на 1 мм при приеме 500 - 1000 мг 2 раза в сутки. Препарат значительно улучшает переносимость физических нагрузок. Для ранолазина зафиксирована зависимость "доза-эффект": при приеме более высокой дозы антиангинальный эффект был выше, чем при приеме более низкой дозы. При добавлении ранолазина (по 1500 мг или 2000 мг в сутки, разделенные на 2 приема, в сравнении с плацебо на протяжении 12 недель) к лечению атенололом 50 мг/сутки, либо амлодипином 5 мг/сутки, либо дилтиаземом 180 мг/сутки, доказана эффективность препарата Ранекса®, превосходящая плацебо в от-ношении длительности выполняемых физических нагрузок для обеих исследуемых доз препарата (на 24 секунды больше по сравнению с плацебо). Однако различий в длительности переносимых физических нагрузок между двумя дозами препарата Ранекса® не отмечено. Эффекты, выявляемые при электрокардиографии: У пациентов, получавших лечение препаратом Ранекса®, отмечались зависящее от дозы и концентрации ранолазина в плазме крови, удлинение интервала QTc (около 6 мс при приеме 1000 мг 2 раза в сутки), снижение амплитуды зубца Т и, в некоторых случаях, двугорбые зубцы Т. Показатели электрокардиограммы у пациентов, принимающих ранолазин, являются результатом как ингибирования препаратом скорости быстро выпрямляющего калиевого тока, что удлиняет желудочковый потенциал действия, так и ингибирования позднего натриевого тока, что укорачивает желудочковый потенциал действия. Популяционный анализ показал, что применение ранолазина как у пациентов со стабильной стенокардией, так и у здоровых добровольцев приводит к удлинению QTc относительно исходного уровня в среднем на 2,4 мс при концентрации ранолазина в плазме 1000 нг/мл. В случае наличия у пациентов клинически значимой печеночной недостаточности скорость удлинения QTc была выше. У пациентов, получавших ранолазин, отмечена достоверно меньшая частота возникновения аритмий по сравнению с плацебо, включая желудочковую тахикардию типа "пируэт" >: 8 сокращений на 1 эпизод. Воздействие на гемодинамику: У пациентов, получавших лечение ранолазином в монотерапии или в комбинации с другими антианги- нальными средствами, отмечено незначительное урежение ЧСС (<: 2 уд./мин.) и снижение систолического АД (<: 3 мм рт.ст.) Фармакокинетика: Всасывание: После приема ранолазина внутрь максимальная концентрация ранолазина в плазме крови (Сmax), как правило, достигается через 2 - 6 ч. При приеме ранолазина 2 раза в сутки равновесная концентрация обычно достигается в течение 3 дней. Средняя абсолютная биодоступность ранолазина после приема препарата внутрь составляет 35-50 %, с высокой степенью индивидуальной вариабельности. При повышении дозы от 500 до 1000 мг 2 раза в сутки наблюдается 2,5-3 кратное повышение AUC (площадь под кривой "концентрация-время") в равновесном состоянии. У здоровых добровольцев Сmax в равновесном состоянии составляет приблизительно 1770 нг/мл, в равновесном состоянии AUC0-12 в среднем равна 13700 нг х ч/мл после приема препарата по 500 мг 2 раза в день. Прием пищи не влияет на скорость и полноту всасывания ранолазина. Распуеделение: Приблизительно 62 % ранолазина связывается с белками плазмы крови, в основном с альфа-1 кислыми гликопротеинами и незначительно с альбумином. Средний объем распределения в равновесном состоянии (Vss) составляет около 180 л. Метаболизм: Ранолазин подвергается быстрому и практически полному метаболизму преимущественно в печени. Наиболее важными путями метаболизма ранолазина являются О-деметилирование и N-деалкилирование. Ранолазин метаболизируется главным образом изоферментом CYP3A4, а также изоферментом CYP2D6. При приеме по 500 мг 2 раза в сутки у людей с недостаточной активностью изофермента CYP2D6, показатель AUC превышает аналогичную величину для людей с нормальной скоростью метаболизма на 62 %. Аналогичная разница для дозы 1000 мг 2 раза в сутки составила 25 %. Выделение: В неизмененном виде почками и через кишечник выделяется менее 5 % от принятой дозы ранолазина. Клиренс ранолазина зависит от дозы, снижаясь при ее повышении. Период полувыведения ранолазина в равновесном состоянии после приема внутрь составляет около 7 ч. Особые группы пациентов Хроническая сердечная недостаточность (III - IV функциональные классы по классификации NYHA) При хронической сердечной недостаточности (ХСН) происходит повышение концентрации ранолазина в плазме крови приблизительно в 1,3 раза. Почечная недостаточность У пациентов с почечной недостаточностью легкой, средней и тяжелой степени тяжести, по сравнению со здоровыми добровольцами, показатель AUC ранолазина был в среднем в 1,7-2 раза выше. Была отмечена значительная индивидуальная вариабельность величины AUC у добровольцев с почечной недостаточностью. AUC фармакологически активных метаболитов повышалась в 5 раз у пациентов с почечной недостаточностью тяжелой степени тяжести. Длительность нахождения ранолазина в плазме крови увеличивается в 1,2 раза у пациентов с почечной недостаточностью средней степени тяжести (клиренс креатинина 30-60 мл/мин). У пациентов с почечной недостаточностью тяжелой степени тяжести (клиренс креатинина <:30 мл/мин) было обнаружено увеличение длительности нахождения ранолазина в плазме крови в 1,3-1,8 раз. Влияние диализа на фармакокинетику ранолазина не изучалось. Печеночная недостаточность Показатель AUC ранолазина не изменяется у пациентов с печеночной недостаточностью легкой степени тяжести, однако повышается в 1,8 раз в случае печеночной недостаточности средней степени тяжести (7-9 баллов по шкале Чайлд-Пью): у таких пациентов было более выражено удлинение интервала QTc. Опыт применения ранолазина у пациентов с печеночной недостаточностью тяжелой степени тяжести (более 9 баллов по шкале Чайлд-Пью) отсутствует. Пожилой возраст Клинически значимых изменений фармакокинетических параметров ранолазина в зависимости от возраста не наблюдалось. У пожилых пациентов вследствие возрастного снижения функции почек возможно усиление воздействия ранолазина. Масса тела У пациентов с массой тела 40 кг было отмечено, что действие ранолазина в 1,4 раза превышает его действие у пациентов с массой тела 70 кг. Особые указания Препарат Ранекса® применяется длительно. Почечная недостаточность Для пациентов с почечной недостаточностью легкой или средней степени тяжести (клиренс креатинина 30-80 мл/мин) рекомендуется титрация дозы. Препарат Ранекса® противопоказан пациентам с почечной недостаточностью тяжелой степени тяжести (клиренс креатинина <: 30 мл/мин). Учитывая возможность снижения функции почек с возрастом, у пациентов пожилого и старческого возраста необходимо регулярно проводить мониторинг оценки состояния функции почек при длительном применении препарата Ранекса®. Печеночная недостаточность Для пациентов с печеночной недостаточностью легкой степени тяжести (5-6 баллов по шкале Чайлд-Пью) рекомендуется титрация дозы. Препарат Ранекса® противопоказан пациентам с печеночной недостаточностью средней (7-9 баллов по шкале Чайлд-Пью) или тяжелой (более 9 баллов по шкале Чайлд-Пью) степени тяжести. Пожилой возраст (старше 65 лет) У пациентов пожилого возраста может наблюдаться усиление действия препарата Ранекса® из-за возрастного снижения функции почек. Отмечается повышенная частота возникновения побочных эффектов. Масса тела (менее 60 кг) Подбор дозы для пациентов с массой тела менее 60 кг должен проводиться с осторожностью, т.к. случаи побочных эффектов у таких пациентов наблюдались чаще. Хроническая сердечная недостаточность Подбор дозы для пациентов с ХСН средней или тяжелой степени тяжести (III-IV функциональные классы по классификации NYHA) должен проводиться с осторожностью. Необходимо проводить регулярный мониторинг развития побочных эффектов, при необходимости должна быть снижена доза препарата или отменено лечение. Удлинение интервала QT Популяционный анализ объединенных данных, полученных при исследовании пациентов и здоровых добровольцев, показал, что зависимость длительности интервала QTc от концентрации в плазме крови может быть оценена как 2,4 мс на 1000 нг/мл, что приблизительно равно повышению с 2 до 7 мс для диапазона концентраций в плазме крови, соответствующего дозе от 500 до 1000 мг ранолазина, принимаемой 2 раза в сутки. Следовательно, необходимо соблюдать осторожность при лечении пациентов с синдромом врожденного удлинения интервала QT в анамнезе, наличием удлинения интеовала QT в семейном анамнезе, пациентов с известным приобретенным удлинением интервала QT, а также пациентов, получающих лечение препаратами, влияющими на интервал QTc. Недостаточная активность изофермента CYP2D6: Риск увеличения частоты возникновения побочных эффектов в указанных группах повышается у пациентов с недостаточной активностью изофермента CYP2D6 (пациенты с "медленным" метаболизмом) по сравнению с пациентами с нормальной способностью к метаболизации изофермента CYP2D6 (пациенты с "быстрым" метаболизмом). Меры предосторожности разработаны с учетом риска для пациентов с "медленным" метаболизмом изофермента CYP2D6 и являются необходимыми в случае, если статус метаболизма изофермента CYP2D6 неизвестен. Для пациентов с "быстрым" метаболизмом изофермента CYP2D6 нет необходимости в таких мерах предосторожности. У пациентов, с выявленным (например, путем генотипирования) или известным ранее интенсивным статусом метаболизма изофермента CYP2D6, препарат Ранекса® должен применяться с осторожностью в случае, если у пациента имеется сочетание нескольких из вышеперечисленных факторов риска. Влияние на способность управлять транспортными средствами: Исследований о влиянии препарата Ранекса® на способность к вождению транспортными средствами и управлению механизмами не проводилось. Учитывая возможность развития таких побочных эффектов как головокружение, нечеткость зрения, диплопия, спутанность сознания, нарушение координации движений и галлюцинации, следует соблюдать осторожность при управлении транспортными средствами и механизмами, а также при занятиях потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций. Условия хранения и отпуска из аптек Условия хранения: Хранить при температуре не выше 25°С. ' Лекарственное средство хранить в недоступном для детей месте! Отпуск из аптек: По рецепту Регистрационные данные Торговое название Ранекса® Международное непатентованное название:Ранолазин. Форма выпуска:таблетки пролонгированного действия покрытые пленочной оболочкой. Состав: Таблетки 500 мг Ядро: Действующее вещество: ранолазин - 500,0 мг. Вспомогательные вещества: целлюлоза микрокристаллическая - 70,67 мг, сополимер метакриловой кислоты и этилакрилата (1:1) - 66,67 мг, гипромеллоза - 13,33 мг, магния стеарат -13,33 мг, натрия гидроксид - 2,667 мг: х Оболочка: Опадрай II оранжевый 85F93265 [макрогол 3350 - .4,04 мг, спирт поливиниловый частично гидролизованный - 8,00.мг, тальк - 2,96 мг, титана диоксид - 4,86 мг, краситель железа оксид желтый, (Е 172) - 0,118 мг, краситель железа оксид красный, (Е 172) - 0,022 мг, воск карнаубский (следовые количества)]. Таблетки 1000 мг Ядро: Действующее вещество: ранолазин - 1000,0 мг. Вспомогательные вещества: целлюлоза микрокристаллическая - 141,34 мг, сополимер метакриловой кислоты и этилакрилата (1:1) - 133,34 мг, гипромеллоза - 26,66 мг, магния стеарат -26,66 мг, натрия гидроксид - 5,334 мг: Оболочка: Опадрай II желтый 33G92144 [триацетин - 2,40 мг, гипромеллоза 6сР - 16,00 мг, лактозы моногидрат - 8,40 мг, макрогол 3350 - 3,20 мг, титана диоксид - 9,19 мг, краситель железа оксид желтый, (Е 172) - 0,81 мг, воск карнаубский (следовые количества)]. АТХ: Регистрация: ЛП-001978 Фармгруппа: антиангинальное средство. Дата регистрации: 23.01.2013. Окончание регстрации: . Описание:Описание Таблетки 500 мг. Таблетки покрытые пленочной оболочкой, двояковыпуклые, овальной формы, светло - оранжевого цвета с тиснением "500" или "GSI500" на одной стороне. Таблетки 1000 мг. Таблетки покрытые пленочной оболочкой, двояковыпуклые, овальной формы, бледно - желтого цвета с тиснением "1000" или "GSI1000" на одной стороне. Упаковка:Таблетки пролонгированного действия покрытые пленочной оболочкой, 500 мг. По 10, 15 или 20 таблеток в контурной ячейковой упаковке (блистер) из ПВХ/ПВДХ/фольга алюминиевая. По 3, 6, 10 блистеров по 10 таблеток или по 2 блистера по 15 таблеток или по 3, 5 блистеров по 20 таблеток с инструкцией по применению в картонной пачке. Таблетки пролонгированного действия покрытые пленочной оболочкой, 1000 мг. По 10 или 15 таблеток в контурной ячейковой упаковке (блистер) из ПВХ/ПВДХ/фольга алюминиевая. По 3, 6, 10 блистеров по 10 таблеток или по 2, 4 блистера по 15 таблеток с инструкцией по применению в картонной пачке. Таблетки пролонгированного действия покрытые пленочной оболочкой, 500 мг. По 10, 15 или 20 таблеток в контурной ячейковой упаковке (блистер) из ПВХ/ПВДХ/фольга алюминиевая. По 3, 6, 10 блистеров по 10 таблеток или по 2 блистера по 15 таблеток или по 3, 5 блистеров по 20 таблеток с инструкцией по применению в картонной пачке. Таблетки пролонгированного действия покрытые пленочной оболочкой, 1000 мг. По 10 или 15 таблеток в контурной ячейковой упаковке (блистер) из ПВХ/ПВДХ/фольга алюминиевая. По 3, 6, 10 блистеров по 10 таблеток или по 2, 4 блистера по 15 таблеток с инструкцией по применению в картонной пачке. Срок годности: 4 года. Не применять после истечения срока годности, указанного на упаковке. Владелец рег.удостоверения:БЕРЛИН-ФАРМА, ЗАО Производитель:DSM Pharmaceuticals, Inc. Представительство:БЕРЛИН-ХЕМИ/МЕНАРИНИ ФАРМА ГмбХ
Модель:
RUR 753
Показания Дерматозы, поддающиеся глюкокортикостероидной терапии, осложненные вторичной бактериальной и/или грибковой инфекцией (особенно вызванной грибами рода Candida). Противопоказания Противопоказания - гиперчувствительность к компонентам препарата. - туберкулез кожи, кожные проявления сифилиса, вирусные инфекции кожи, кожные поствакцинальные реакции, открытые раны, язвы. - угревая болезнь, розацеа, ихтиоз. - аногенитальный зуд, опухоли кожи. С осторожностью: С осторожностью применяют при туберкулезе (системное поражение) У детей в возрасте до 1 года У пациентов имеющих в анамнезе указания на поражение IX пары ЧМН на фоне применения аминогликозидов. При наличии перфорации барабанной перепонки и прямом воздействии неомицина на среднее ухо существует риск ототоксического действия. Беременность При назначении препарата в период беременности необходимо учитывать теоретический риск ототоксического действия неомицина, в связи с чем нельзя применять препарат длительно и наносить его под окклюзионные повязки. Применение и дозы ТАБЛИЦЪ В форме крема препарат рекомендуется для терапии острых и подострых дерматозов, в т.ч. сопровождающихся мокнутием. Мазь предназначена для терапии подострых и хронических дерматозов, особенно при наличии выраженной сухости кожи, лихенификации, себорее или в тех случаях, когда необходимы окклюзионные свойства мази. Побочные эффекты и передозировка Побочные эффекты: Побочные эффекты при наружном применении Пимафукорта, как и при применении других глюкокортикостероидов, развиваются редко и носят обратимый характер. -Редко может развиться реакция гиперчувствительности (зуд, жжение, покраснение или сухость кожи) -Крайне редко - атрофия и истончение кожи, телеангиэктазии, стрии, пурпура, розацеаподобный и периоральный дерматит, замедление заживления ран, депигментация, гипертрихоз, синдром отмены после прекращения лечения. -При применении наружных глюкокортикостероидов в течение длительного времени, на обширных участках кожи, или при использовании окклюзионных повязок, особенно у детей могут развиться побочные эффекты, характерные для глюкокортикостероидов системного действия, такие как подавление функции коры надпочечников. - Контактный дерматит на неомицин. Передозировка: Сведений о передозировке препарата нет. Существует теоретическая возможность ототоксического действия неомицина в случае нанесения препарата на область наружного слухового прохода при наличии перфорации барабанной перепонки и прямом воздействии неомицина на среднее ухо. Взаимодействие с другими ЛС: Лекарственных взаимодействий не описано. Может отмечаться перекрестная гиперчувствительность между неомицином и препаратами сходной химической структуры, например канамицином, паромомицином, гентамицином и перекрестная устойчивость между неомицином и другими антибиотиками группы аминогликозидов. Фармакологическое действие и фармакокинетика Комбинированный препарат, оказывающий антибактериальное, противогрибковое, местное противовоспалительное действие. Неомицин является антибиотиком широкого спектра действия из группы аминогликозидов, активен в отношении ряда грамположительных (Staphylococcus spp, Enterococcus spp.) и грамотрицательных (Klebsiella spp, Proteus spp, Escherichia coli и др.) бактерий. Натамицин относится к противогрибковым препаратам полиенового ряда, оказывает фунгицидное действие в отношении дрожжевых и дрожжеподобных грибов, особенно Candida spp. Дерматомицеты к натамицину менее чувствительны. Гидрокортизон обладает противовоспалительным.и сосудосуживающим действием. Устраняет воспалительные явления и зуд, сопровождающие различные виды дерматозов. Фармакокинетика: Натамицин и неомицин практически не абсорбируются через неповрежденную кожу и слизистые оболочки. Возможна абсорбция неомицина через поврежденную кожу, при попадании препарата на раны, язвы. Через неповрежденную кожу абсорбируется от 1 до 3% гидрокортизона: при дерматите количество абсорбируемого гидрокортизона увеличивается в 2 раза, при инфекционных поражениях кожи может возрастать до 5 раз. У детей абсорбция гидрокортизона через неповрежденную кожу выше, чем у взрослых, степень абсорбции препарата в системный кровоток с возрастом уменьшается. Особые указания При нанесении Пимафукорта на область век и периорбитальную область существует риск увеличения внутриглазного давления, развития катаракты При применении препарата на обширных поверхностях у детей или под повязками необходимо иметь в виду возможность подавления функции гипоталамо-гипофизарно- надпочечниковой системы. В случае продолжительного лечения, при наличии ран и язв существует теоретический риск ототоксического и нефротоксического действия неомицина. При появлении суперинфекции или чрезмерном росте грибов следует прекратить применение препарата и принять соответствующие меры. Влияние на способность управлять транспортными средствами: не описано Условия хранения и отпуска из аптек Условия хранения:При температуре не выше 25°С, Хранить в недоступном для детей месте. Отпуск из аптек: Без рецепта Регистрационные данные Торговое название Пимафукорт Международное непатентованное название:Гидрокортизон + Натамицин + Неомицин. Форма выпуска:Крем для наружного применения. Мазь для наружного применения. Состав:Крем: 1 г крема содержит: Активные вещества: натамицин 10 мг неомицин (в виде неомицина сульфата) 3500 ЕД гидрокортизон микронизированный 10 мг Вспомогательные вещества: Натрия цитрат 14,0 мг, эмульгатор F 115,0 мг, сорбитана стеарат 30,0 мг, воск цетилэфирный 60,0 мг, цетиол V 150,0, макрогола стеарат 100 20,0 мг, метилпарагидроксибензоат 2,0 мг, пропилпарагидроксибензоат 0,50 мг, вода очищенная до 1000,0 мг. Мазь: 1 г мази содержит: Активные вещества: Натамицин 10 мг неомицин (в виде неомицина сульфата) 3500 ЕД гидрокортизон микронизированный 10 мг Вспомогательные вещества: Полиэтиленовая мазевая основа (95% жидкий парафин, 5 % полиэтилен) 976,5 мг. АТХ: Регистрация: П N012689/02 Фармгруппа: глюкокортикоиды + антибиотик-аминогликозид + противогрибковое средство. Дата регистрации: 13.10.2008. Окончание регстрации: . Описание:Крем: крем от белого до белого с желтоватым оттенком цвета. Мазь: мазь от белого до желтого цвета. Упаковка: ТАБЛИЦЪ По 1 тубе вместе с инструкцией по применению в картонную пачку. Срок годности:крема - 3 года, мази - 5 лет. Не использовать после истечения срока годности. Владелец рег.удостоверения:Астеллас Фарма Юроп Б.В. Производитель:TEMMLER ITALIA, S.r.L. Представительство:АСТЕЛЛАС ФАРМА ЮРОП Б.В

Модель:
RUR 4228
Показания стабильная стенокардия Противопоказания Противопоказания - повышенная чувствительность к действующему веществу или любому из вспомогательных веществ (см. раздел Состав)'- дефицит лактазы, наследственная непереносимость лактозы, синдром глюкозогалактозной мальабсорбции (только для дозировки 1000 мг): - тяжелая почечная недостаточность (клирейс креатинина <:30 мл/мин): печеночная недостаточность средней (7-9 баллов по шкале Чайлд-Пью) или тяжелой (более 9 баллов по шкале Чайлд-Пью) степени тяжести: - одновременное применение с сильными ингибиторами изофермента CYP3A4 (итраконазол, кетоконазол, вориконазол, позаконазол, ингибиторы ВИЧ-протеазы, кларитромицин, телитромицин, нефазодон): - одновременное применение с антиаритмическими средствами класса IA (например, хинидин) или класса III (например, дофетилид), кроме амиодарона: с соталолом. - дети до 18 лет (эффективность и безопасность препарата не установлены): беременность: период грудного вскармливания. С осторожностью: - печеночная недостаточность легкой степени тяжести (5-6 баллов по классификации Чайлд-Пью): почечная недостаточность легкой или средней степени тяжести (клиренс креатинина 30-80 мл/мин): возраст старше 75 лет: масса тела менее 60 кг: хроническая сердечная недостаточность (III-IV функциональные классы по классификации NYHA): синдром врожденного удлиненного интервала QT в анамнезе, в семейном анамнезе: диагностированное приобретенное удлинение интервала QT: недостаточность изофермента CYP2D6: одновременное применение с ингибиторами изофермента CYP3A4 средней силы действия (дилтиазем, флуконазол, эритромицин): одновременное применение с индукторами активности изофермента CYP3A4 (рифампицин, фенитоин, фенобарбитал, карбамазепин, зверобой продырявленный (Hypericum perforatum)): одновременное применение с ингибиторами P-gp (Р-гликопротеин) (верапамил, циклоспорин). Беременность Данных о применении ранолазина у беременных женщин не имеется. Проникновение ранолазина в грудное молоко не исследовалось. В связи с отсутствием данных применение препарата Ранекса® при беременности и в период грудного вскармливания противопоказано. Применение и дозы Рекомендованная начальная доза препарата Ранекса® для взрослых составляет 500 мг 2 раза в сутки. Через 2-4 недели доза при необходимости может быть увеличена до 1000 мг 2 раза в сутки. Максимальная суточная доза составляет 2000 мг. При появлении побочных эффектов, вызванных приемом препарата Ранекса® (например, головокружение, тошнота или рвота), необходимо уменьшить разовую дозу до 500 мг. Если после этого симптомы не исчезнут, применение препарата должно быть прекращено. Таблетки следует проглатывать целиком, запивая достаточным количеством жидкости, не измельчая, не разламывая и не разжевывая. Прием пищи не влияет на биодоступность препарата, поэтому его можно принимать вне зависимости от приемов пищи. Для пациентов с ХСН (III-IV функциональные классы по классификации NYHA), с почечной недостаточностью легкой и средней степенями тяжести (клиренс креатинина 30-80 мл/мин), печеночной недостаточностью легкой степени тяжести (5-6 баллов по классификации Чайлд-Пью), а также для пациентов с массой тела менее 60 кг и пациентов старше 75 лет рекомендуется титрация дозы препарата. Побочные эффекты и передозировка Побочные эффекты: Побочные эффекты, наблюдаемые у пациентов, принимающих препарат Ранекса®, в большинстве случаев характеризуются легкой или средней степенью выраженности и развиваются обычно в течение первых 2-х недель применения. Ниже перечислены побочные эффекты, для которых была признана возможная связь с применением препарата Ранекса®. Частоту возникновения побочных эффектов определяли как: очень часто (>: 1/10), часто (>: 1/100: <: 1/10), нечасто (>: 1/1000: <: 1/100), редко ( >: 1/10 000: <: 1/1000) и очень редко (<: 1/10 000). Со стороны обмена веществ и питания: Нечасто: снижение аппетита, анорексия, дегидратация. Со стороны психики: Нечасто: тревога, бессонница, помутнение сознания, галлюцинации. Редко: дезориентация. Со стороны нервной системы: Часто: головокружение, головная боль. Нечасто: заторможенность, обморок, гипе- стезия, сонливость, тремор, постуральное головокружение, парестезия. Редко: амнезия, спутанность сознания, потеря сознания, нарушения координации движений, нарушения походки, паросмия. Со стороны органа зрения: Нечасто: нечеткость зрения, зрительные расстройства, диплопия. Со стороны органов слуха и лабиринтные нарушения: Нечасто: вертиго, шум в ушах. Редко: снижение слуха. Со стороны сердечно-сосудистой системы: Нечасто: "приливы" крови к лицу, выраженное снижение АД. Редко: похолодание конечностей, ортостатическая гипотензия. Со стороны дыхательной системы, органов грудной клетки и средостения: Нечасто: одышка, кашель, носовые кровотечения. Редко: ощущение сдавления в горле. Со стороны пищеварительного тракта: Часто: запор, тошнота, рвота. Нечасто: боль в животе, сухость слизистой оболочки полости рта, диспепсия, метеоризм, дискомфорт в области желудка. Редко: панкреатит, эрозивный дуоденит, гипе- стезия полости рта. Со стороны кожных покровов и подкожных тканей: Нечасто: кожный зуд, гипергидроз. Редко: аллергический дерматит, крапивница, холодный пот, кожная сыпь, ангионевротический отек. Со стороны опорно-двигательного аппарата: Нечасто: боль в конечностях, мышечные спазмы, припухлость суставов. Редко: мышечная слабость. Со стороны почек и мочевыводящих путей: Нечасто: дизурия, гематурия, хроматурия. Редко: острая почечная недостаточность, задержка мочи. Со стороны мочеполовой системы: Редко: эректильная дисфункция. Общие расстройства: Часто: астения. Нечасто: повышенная утомляемость, периферические отеки. Прочие нарушения: Нечасто: повышение концентрации креатинина в плазме крови, повышение концентрации мочевины в плазме крови, удлинение корригированного интервала QTc, тромбоцитоз и лейкоцитоз, снижение массы тела. Редко . повышение активности "печеночных" ферментов. Передозировка: Симптомы: головокружение, тошнота и рвота. При внутривенном введении ранолазина были дополнительно отмечены следующие симптомы: диплопия, заторможенность, обморок. Выраженность симптомов может усиливаться при увеличении дозы. Лечение: симптоматическое под тщательным наблюдением врача. В течение 30 мин после приема препарата можно предпринять меры по предотвращению его всасывания из желудочно-кишечного тракта (промывание желудка, прием активированного угля). Гемодиализ малоэффективен. Взаимодействие с другими ЛС: Ранолазин является субстратом цитохрома CYP3A4. Одновременное применение ранолазина с ингибиторами изофермента CYP3A4 Индукторы изофермента CYP3A4 Не следует начинать прием ранолазина пациентам, получающим лечение индукторами изофермента CYP3A4 (рифампицин, фенитоин, фенобарбитал, карбамазепин, Зверобой продырявленный (Hypericum perforatum)). Так как, например, рифампицин (600 мг один раз в сутки) снижает равновесную концентрацию ранолазина в плазме крови примерно на 95 %. Ингибиторы изофермента CYP2D6 Ранолазин частично метаболизируется изоферментом CYP2D6. Одновременное применение ранолазина с ингибиторами изофермента CYP2D6 может приводить к повышению концентрации ранолазина в плазме крови. Одновременное применение ранолазина 1000 мг 2 раза в сутки с сильным ингибитором изофермента CYP2D6 пароксетином 20 мг 1 раз в сутки повышает среднюю концентрацию ранолазина в плазме крови в равновесном состоянии примерно в 1,2 раза. Коррекции дозы не требуется. Одновременное применение ранолазина 500 мг 2 раза в сутки и сильного ингибитора изофермента CYP2D6 может привести к повышению AUC ранолазина приблизительно на 62 %. Ингибиторы/субстраты P-sp (Р-гликопротеин) Ранолазин является субстратом P-gp. Ингибиторы P-gp (например, циклоспорин, верапамил) повышают концентрацию в плазме крови. Верапамил (120 мг три раза в сутки) повышает равновесную концентрацию ранолазина в 2,2 раза. Для пациентов, получающих лечение ингибиторами P-gp, рекомендуется титрация дозы ранолазина. Может потребоваться снижение дозы ранолазина. С другой стороны, ранолазин является умеренным ингибитором P-gp и может увеличивать концентрацию субстратов P-gp в плазме крови. Тканевое распределение лекарственных веществ, которые транспортируются с помощью P-gp, может быть увеличено. Субстраты изофермента CYP2D6 Имеются данные, что ранолазин является слабым ингибитором изофермента CYP2D6. Прием ранолазина по 750 мг 2 раза в день повышает концентрацию метопролола в плазме крови в 1,8 раз. Поэтому, при одновременном применении с ранолазином, может усиливаться действие метопролола или других субстратов изофермента CYP2D6 (например, пропафенон и флекаинид, в меньшей степени, трициклические антидепрессанты и нейролептики), вследствие чего может потребоваться снижение дозы этих лекарственных средств. Субстраты изофермента CYP2B6 Потенциал к ингибированию изофермента CYP2B6 не установлен. Во время назначения совместно с субстратами изофермента CYP2B6 (например, бупропион, эфавиренц, циклофосфамид) рекомендуется соблюдать осторожность. Дигоксин Имеются данные о повышении концентрации дигоксина в плазме крови в среднем в 1,5 раза при одновременном применении дигоксина и ранолазина. Поэтому необходим контроль концентрации дигоксина в начале и после окончания терапии с применением ранолазина. Субстраты изофермента CYP3A4 Ранолазин является слабым ингибитором изофермента CYP3A4, что может привести к повышению концентрации субстратов изофермента CYP3A4 в плазме крови и потребовать коррекции дозы чувствительных субстратов изофермента CYP3A4 (например, симваста- тин, ловастатин) и субстратов изофермента CYP3A4 с узким терапевтическим диапазоном (например, циклоспорин, такролимус, сиролимус, эверолимус). Симвастатин Метаболизм и клиренс симвастатина в высокой степени зависят от изофермента CYP3A4. Прием ранолазина по 1000 мг 2 раза в день повышает концентрацию лактона симвастатина и симвастатиновой кислоты в плазме крови приблизительно в 2 раза. Прием симвастатина в высоких дозах ассоциирован с развитием рабдомиолиза, также были описаны случаи развития рабдомиолиза при одновременном применении ранолазина и симвастатина. Максимальная доза симвастатина для пациентов, одновременно принимающих ранолазин, не должна превышать 20 мг/сутки. Аторвастатин Одновременное применение ранолазина 1000 мг 2 раза в сутки и аторвастатина 80 мг 1 раз в сутки увеличивает Стах и AUC аторвастатина в 1,4 и в 1,3 раза соответственно, Стах и AUC метаболитов аторвастатина изменяются не более чем на 35 %. При одновременном применении ранолазина и аторвастатина может потребоваться снижение дозы аторвастатина и проведение надлежащего клинического контроля. Для других статинов, метаболизирующихся с участием изофермента CYP3A4 (ловастатин), может потребоваться корректировка дозы. Такролимус, циклоспорин, сиролимус, эверолимус Увеличение концентрации в плазме крови такролимуса, субстрата изофермента CYP3A4, было отмечено у пациентов на фоне применения ранолазина. При одновременном применении такролимуса и ранолазина рекомендуется проводить мониторинг концентрации такролимуса в плазме крови и, при необходимости, проводить корректировку дозы. Такой подход рекомендован и для других субстратов изофермента CYP3A4 с узким терапевтическим диапазоном (например, циклоспорин, сиролимус, эверолимус). Субстраты транспортера органических катионов 2 (ОСТ2) При одновременном применении ранолазина 500 мг и 1000 мг 2 раза в сутки и метформина 1000 мг 2 раза в сутки, концентрация метформина в плазме крови у пациентов с сахарным диабетом 2 типа повышается в 1,4 и в 1,8 раз соответственно. Возможно повышение концентрации в плазме крови других субстратов ОСТ2, включая пиндолол и варениклин, при одновременном применении с ранолазином. Препараты, удлиняющие интервал ОТс Существует 'теоретическая вероятность того, что при одновременном применении ранолазина и других лекарственных средств, удлиняющих интервал QTc, может возникнуть фармакодинамическое взаимодействие и повыситься риск развития желудочковых аритмий. К числу таких лекарственных средств относятся определенные антигистаминные препараты (например, терфенадин, астемизол, мизоластин), определенные антиаритмические средства (например, хинидин, дизопирамид, прокаинамид), а также эритромицин и трициклические антидепрессанты (например, имипрамин, доксепин, амитриптилин), Фармакологическое действие и фармакокинетика Ранолазин - действующее вещество препарата Ранекса® - является ингибитором позднего тока ионов натрия в клетки миокарда. Снижение внутриклеточного накопления натрия ведет к уменьшению избытка внутриклеточных ионов кальция. Это уменьшает внутриклеточный ионный дисбаланс при ишемии. Снижение избытка внутриклеточного кальция способствует расслаблению миокарда и, таким образом, снижает диастолическое напряжение стенки желудочков. Клиническим свидетельством торможения позднего натриевого тока под действием ранолазина служит значительное укорочение интервала QTc (QTc - корригированное значение QT с учетом частоты сердечных сокращений (ЧСС)) и положительное влияние на диастолическое расслабление, выявленное в открытом исследовании с участием пациентов с синдромом удлиненного интервала QT (пациенты с синдромом LQT-3, имеющие мутации гена SCN5A AKPQ). Эти эффекты препарата не зависят от изменений ЧСС, артериального давления (АД) или от степени расширения сосудов. При применении ранолазина достоверно снижаются частота развития приступов стенокардии в неделю и потребление нитроглицерина для подъязычного применения в сравнении с плацебо, независимо от пола пациентов. Во время лечения развитие толерантности к ранолазину не происходит. После резкого прекращения приема препарата частота развития приступов стенокардии не увеличивается. Ранолазин имеет значимое преимущество по сравнению с плацебо в увеличении времени до возникновения приступа стенокардии и до появления депрессии сегмента ST на 1 мм при приеме 500 - 1000 мг 2 раза в сутки. Препарат значительно улучшает переносимость физических нагрузок. Для ранолазина зафиксирована зависимость "доза-эффект": при приеме более высокой дозы антиангинальный эффект был выше, чем при приеме более низкой дозы. При добавлении ранолазина (по 1500 мг или 2000 мг в сутки, разделенные на 2 приема, в сравнении с плацебо на протяжении 12 недель) к лечению атенололом 50 мг/сутки, либо амлодипином 5 мг/сутки, либо дилтиаземом 180 мг/сутки, доказана эффективность препарата Ранекса®, превосходящая плацебо в от-ношении длительности выполняемых физических нагрузок для обеих исследуемых доз препарата (на 24 секунды больше по сравнению с плацебо). Однако различий в длительности переносимых физических нагрузок между двумя дозами препарата Ранекса® не отмечено. Эффекты, выявляемые при электрокардиографии: У пациентов, получавших лечение препаратом Ранекса®, отмечались зависящее от дозы и концентрации ранолазина в плазме крови, удлинение интервала QTc (около 6 мс при приеме 1000 мг 2 раза в сутки), снижение амплитуды зубца Т и, в некоторых случаях, двугорбые зубцы Т. Показатели электрокардиограммы у пациентов, принимающих ранолазин, являются результатом как ингибирования препаратом скорости быстро выпрямляющего калиевого тока, что удлиняет желудочковый потенциал действия, так и ингибирования позднего натриевого тока, что укорачивает желудочковый потенциал действия. Популяционный анализ показал, что применение ранолазина как у пациентов со стабильной стенокардией, так и у здоровых добровольцев приводит к удлинению QTc относительно исходного уровня в среднем на 2,4 мс при концентрации ранолазина в плазме 1000 нг/мл. В случае наличия у пациентов клинически значимой печеночной недостаточности скорость удлинения QTc была выше. У пациентов, получавших ранолазин, отмечена достоверно меньшая частота возникновения аритмий по сравнению с плацебо, включая желудочковую тахикардию типа "пируэт" >: 8 сокращений на 1 эпизод. Воздействие на гемодинамику: У пациентов, получавших лечение ранолазином в монотерапии или в комбинации с другими антианги- нальными средствами, отмечено незначительное урежение ЧСС (<: 2 уд./мин.) и снижение систолического АД (<: 3 мм рт.ст.) Фармакокинетика: Всасывание: После приема ранолазина внутрь максимальная концентрация ранолазина в плазме крови (Сmax), как правило, достигается через 2 - 6 ч. При приеме ранолазина 2 раза в сутки равновесная концентрация обычно достигается в течение 3 дней. Средняя абсолютная биодоступность ранолазина после приема препарата внутрь составляет 35-50 %, с высокой степенью индивидуальной вариабельности. При повышении дозы от 500 до 1000 мг 2 раза в сутки наблюдается 2,5-3 кратное повышение AUC (площадь под кривой "концентрация-время") в равновесном состоянии. У здоровых добровольцев Сmax в равновесном состоянии составляет приблизительно 1770 нг/мл, в равновесном состоянии AUC0-12 в среднем равна 13700 нг х ч/мл после приема препарата по 500 мг 2 раза в день. Прием пищи не влияет на скорость и полноту всасывания ранолазина. Распуеделение: Приблизительно 62 % ранолазина связывается с белками плазмы крови, в основном с альфа-1 кислыми гликопротеинами и незначительно с альбумином. Средний объем распределения в равновесном состоянии (Vss) составляет около 180 л. Метаболизм: Ранолазин подвергается быстрому и практически полному метаболизму преимущественно в печени. Наиболее важными путями метаболизма ранолазина являются О-деметилирование и N-деалкилирование. Ранолазин метаболизируется главным образом изоферментом CYP3A4, а также изоферментом CYP2D6. При приеме по 500 мг 2 раза в сутки у людей с недостаточной активностью изофермента CYP2D6, показатель AUC превышает аналогичную величину для людей с нормальной скоростью метаболизма на 62 %. Аналогичная разница для дозы 1000 мг 2 раза в сутки составила 25 %. Выделение: В неизмененном виде почками и через кишечник выделяется менее 5 % от принятой дозы ранолазина. Клиренс ранолазина зависит от дозы, снижаясь при ее повышении. Период полувыведения ранолазина в равновесном состоянии после приема внутрь составляет около 7 ч. Особые группы пациентов Хроническая сердечная недостаточность (III - IV функциональные классы по классификации NYHA) При хронической сердечной недостаточности (ХСН) происходит повышение концентрации ранолазина в плазме крови приблизительно в 1,3 раза. Почечная недостаточность У пациентов с почечной недостаточностью легкой, средней и тяжелой степени тяжести, по сравнению со здоровыми добровольцами, показатель AUC ранолазина был в среднем в 1,7-2 раза выше. Была отмечена значительная индивидуальная вариабельность величины AUC у добровольцев с почечной недостаточностью. AUC фармакологически активных метаболитов повышалась в 5 раз у пациентов с почечной недостаточностью тяжелой степени тяжести. Длительность нахождения ранолазина в плазме крови увеличивается в 1,2 раза у пациентов с почечной недостаточностью средней степени тяжести (клиренс креатинина 30-60 мл/мин). У пациентов с почечной недостаточностью тяжелой степени тяжести (клиренс креатинина <:30 мл/мин) было обнаружено увеличение длительности нахождения ранолазина в плазме крови в 1,3-1,8 раз. Влияние диализа на фармакокинетику ранолазина не изучалось. Печеночная недостаточность Показатель AUC ранолазина не изменяется у пациентов с печеночной недостаточностью легкой степени тяжести, однако повышается в 1,8 раз в случае печеночной недостаточности средней степени тяжести (7-9 баллов по шкале Чайлд-Пью): у таких пациентов было более выражено удлинение интервала QTc. Опыт применения ранолазина у пациентов с печеночной недостаточностью тяжелой степени тяжести (более 9 баллов по шкале Чайлд-Пью) отсутствует. Пожилой возраст Клинически значимых изменений фармакокинетических параметров ранолазина в зависимости от возраста не наблюдалось. У пожилых пациентов вследствие возрастного снижения функции почек возможно усиление воздействия ранолазина. Масса тела У пациентов с массой тела 40 кг было отмечено, что действие ранолазина в 1,4 раза превышает его действие у пациентов с массой тела 70 кг. Особые указания Препарат Ранекса® применяется длительно. Почечная недостаточность Для пациентов с почечной недостаточностью легкой или средней степени тяжести (клиренс креатинина 30-80 мл/мин) рекомендуется титрация дозы. Препарат Ранекса® противопоказан пациентам с почечной недостаточностью тяжелой степени тяжести (клиренс креатинина <: 30 мл/мин). Учитывая возможность снижения функции почек с возрастом, у пациентов пожилого и старческого возраста необходимо регулярно проводить мониторинг оценки состояния функции почек при длительном применении препарата Ранекса®. Печеночная недостаточность Для пациентов с печеночной недостаточностью легкой степени тяжести (5-6 баллов по шкале Чайлд-Пью) рекомендуется титрация дозы. Препарат Ранекса® противопоказан пациентам с печеночной недостаточностью средней (7-9 баллов по шкале Чайлд-Пью) или тяжелой (более 9 баллов по шкале Чайлд-Пью) степени тяжести. Пожилой возраст (старше 65 лет) У пациентов пожилого возраста может наблюдаться усиление действия препарата Ранекса® из-за возрастного снижения функции почек. Отмечается повышенная частота возникновения побочных эффектов. Масса тела (менее 60 кг) Подбор дозы для пациентов с массой тела менее 60 кг должен проводиться с осторожностью, т.к. случаи побочных эффектов у таких пациентов наблюдались чаще. Хроническая сердечная недостаточность Подбор дозы для пациентов с ХСН средней или тяжелой степени тяжести (III-IV функциональные классы по классификации NYHA) должен проводиться с осторожностью. Необходимо проводить регулярный мониторинг развития побочных эффектов, при необходимости должна быть снижена доза препарата или отменено лечение. Удлинение интервала QT Популяционный анализ объединенных данных, полученных при исследовании пациентов и здоровых добровольцев, показал, что зависимость длительности интервала QTc от концентрации в плазме крови может быть оценена как 2,4 мс на 1000 нг/мл, что приблизительно равно повышению с 2 до 7 мс для диапазона концентраций в плазме крови, соответствующего дозе от 500 до 1000 мг ранолазина, принимаемой 2 раза в сутки. Следовательно, необходимо соблюдать осторожность при лечении пациентов с синдромом врожденного удлинения интервала QT в анамнезе, наличием удлинения интеовала QT в семейном анамнезе, пациентов с известным приобретенным удлинением интервала QT, а также пациентов, получающих лечение препаратами, влияющими на интервал QTc. Недостаточная активность изофермента CYP2D6: Риск увеличения частоты возникновения побочных эффектов в указанных группах повышается у пациентов с недостаточной активностью изофермента CYP2D6 (пациенты с "медленным" метаболизмом) по сравнению с пациентами с нормальной способностью к метаболизации изофермента CYP2D6 (пациенты с "быстрым" метаболизмом). Меры предосторожности разработаны с учетом риска для пациентов с "медленным" метаболизмом изофермента CYP2D6 и являются необходимыми в случае, если статус метаболизма изофермента CYP2D6 неизвестен. Для пациентов с "быстрым" метаболизмом изофермента CYP2D6 нет необходимости в таких мерах предосторожности. У пациентов, с выявленным (например, путем генотипирования) или известным ранее интенсивным статусом метаболизма изофермента CYP2D6, препарат Ранекса® должен применяться с осторожностью в случае, если у пациента имеется сочетание нескольких из вышеперечисленных факторов риска. Влияние на способность управлять транспортными средствами: Исследований о влиянии препарата Ранекса® на способность к вождению транспортными средствами и управлению механизмами не проводилось. Учитывая возможность развития таких побочных эффектов как головокружение, нечеткость зрения, диплопия, спутанность сознания, нарушение координации движений и галлюцинации, следует соблюдать осторожность при управлении транспортными средствами и механизмами, а также при занятиях потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций. Условия хранения и отпуска из аптек Условия хранения: Хранить при температуре не выше 25°С. ' Лекарственное средство хранить в недоступном для детей месте! Отпуск из аптек: По рецепту Регистрационные данные Торговое название Ранекса® Международное непатентованное название:Ранолазин. Форма выпуска:таблетки пролонгированного действия покрытые пленочной оболочкой. Состав: Таблетки 500 мг Ядро: Действующее вещество: ранолазин - 500,0 мг. Вспомогательные вещества: целлюлоза микрокристаллическая - 70,67 мг, сополимер метакриловой кислоты и этилакрилата (1:1) - 66,67 мг, гипромеллоза - 13,33 мг, магния стеарат -13,33 мг, натрия гидроксид - 2,667 мг: х Оболочка: Опадрай II оранжевый 85F93265 [макрогол 3350 - .4,04 мг, спирт поливиниловый частично гидролизованный - 8,00.мг, тальк - 2,96 мг, титана диоксид - 4,86 мг, краситель железа оксид желтый, (Е 172) - 0,118 мг, краситель железа оксид красный, (Е 172) - 0,022 мг, воск карнаубский (следовые количества)]. Таблетки 1000 мг Ядро: Действующее вещество: ранолазин - 1000,0 мг. Вспомогательные вещества: целлюлоза микрокристаллическая - 141,34 мг, сополимер метакриловой кислоты и этилакрилата (1:1) - 133,34 мг, гипромеллоза - 26,66 мг, магния стеарат -26,66 мг, натрия гидроксид - 5,334 мг: Оболочка: Опадрай II желтый 33G92144 [триацетин - 2,40 мг, гипромеллоза 6сР - 16,00 мг, лактозы моногидрат - 8,40 мг, макрогол 3350 - 3,20 мг, титана диоксид - 9,19 мг, краситель железа оксид желтый, (Е 172) - 0,81 мг, воск карнаубский (следовые количества)]. АТХ: Регистрация: ЛП-001978 Фармгруппа: антиангинальное средство. Дата регистрации: 23.01.2013. Окончание регстрации: . Описание:Описание Таблетки 500 мг. Таблетки покрытые пленочной оболочкой, двояковыпуклые, овальной формы, светло - оранжевого цвета с тиснением "500" или "GSI500" на одной стороне. Таблетки 1000 мг. Таблетки покрытые пленочной оболочкой, двояковыпуклые, овальной формы, бледно - желтого цвета с тиснением "1000" или "GSI1000" на одной стороне. Упаковка:Таблетки пролонгированного действия покрытые пленочной оболочкой, 500 мг. По 10, 15 или 20 таблеток в контурной ячейковой упаковке (блистер) из ПВХ/ПВДХ/фольга алюминиевая. По 3, 6, 10 блистеров по 10 таблеток или по 2 блистера по 15 таблеток или по 3, 5 блистеров по 20 таблеток с инструкцией по применению в картонной пачке. Таблетки пролонгированного действия покрытые пленочной оболочкой, 1000 мг. По 10 или 15 таблеток в контурной ячейковой упаковке (блистер) из ПВХ/ПВДХ/фольга алюминиевая. По 3, 6, 10 блистеров по 10 таблеток или по 2, 4 блистера по 15 таблеток с инструкцией по применению в картонной пачке. Таблетки пролонгированного действия покрытые пленочной оболочкой, 500 мг. По 10, 15 или 20 таблеток в контурной ячейковой упаковке (блистер) из ПВХ/ПВДХ/фольга алюминиевая. По 3, 6, 10 блистеров по 10 таблеток или по 2 блистера по 15 таблеток или по 3, 5 блистеров по 20 таблеток с инструкцией по применению в картонной пачке. Таблетки пролонгированного действия покрытые пленочной оболочкой, 1000 мг. По 10 или 15 таблеток в контурной ячейковой упаковке (блистер) из ПВХ/ПВДХ/фольга алюминиевая. По 3, 6, 10 блистеров по 10 таблеток или по 2, 4 блистера по 15 таблеток с инструкцией по применению в картонной пачке. Срок годности: 4 года. Не применять после истечения срока годности, указанного на упаковке. Владелец рег.удостоверения:БЕРЛИН-ФАРМА, ЗАО Производитель:DSM Pharmaceuticals, Inc. Представительство:БЕРЛИН-ХЕМИ/МЕНАРИНИ ФАРМА ГмбХ