биохимический анализатор easytouch gcu
Модель:
RUR 1760
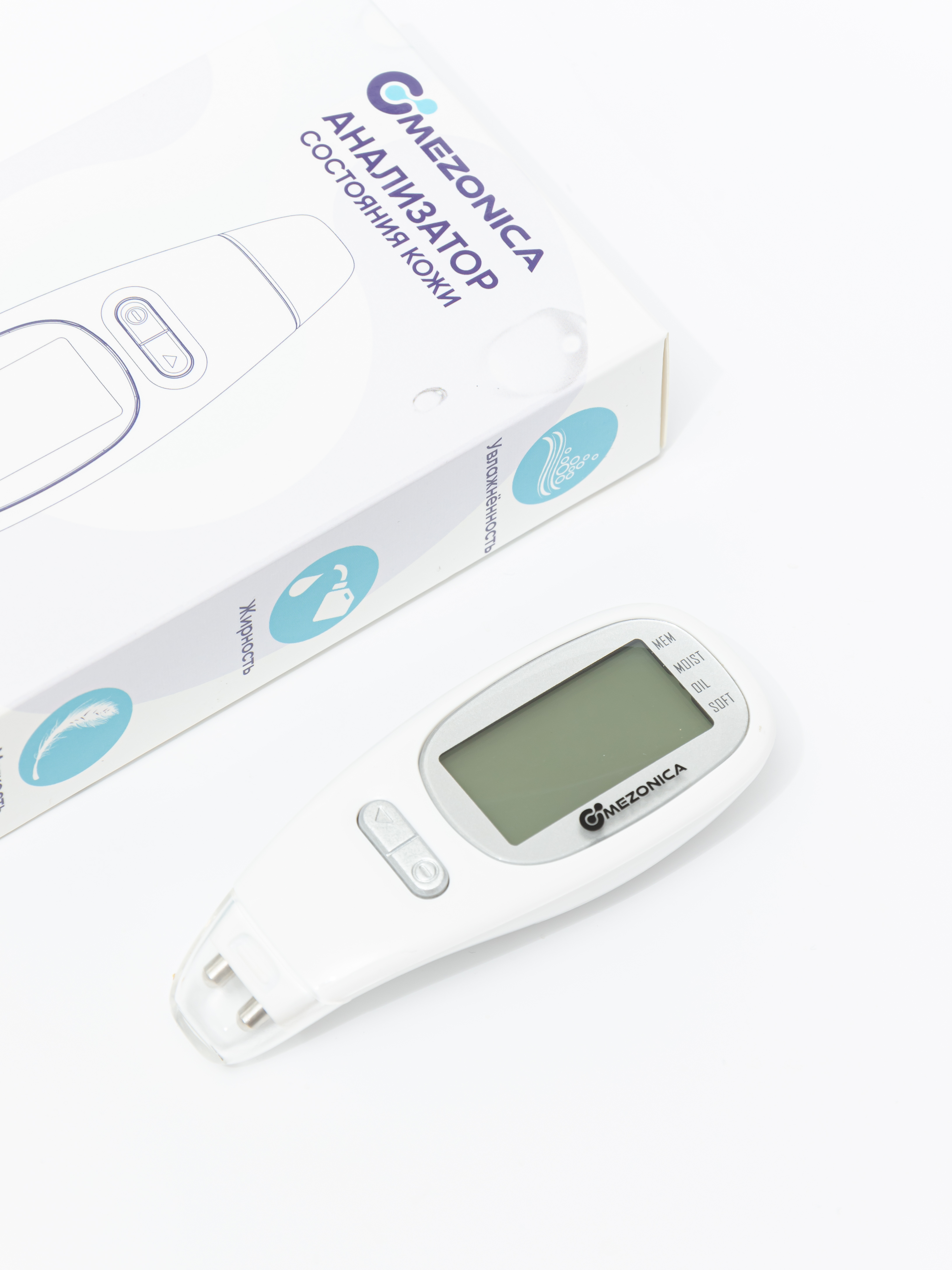
Mezonica SKIN ANALYZER Косметический аппарат Анализатор состояния кожи / степени её увлажнения Этот компактный бьюти гаджет представляет из себя портативный цифровой анализатор кожи лица с ЖК (LCD) дисплеем. Анализатор степени увлажнения кожи немедленно определяет состояние кожи с помощью современной технологии — анализа биоэлектрического импеданса (BIA). Высокочувствительный зонд обеспечивает более точный результат тестирования. Управление одной кнопкой обеспечивает более удобное использование. Прибор подает на кожу слабый электрический ток, не ощущаемый пользователем, и по величине сопротивления току определяется уровень содержания жира и влаги в тканях кожи. Узнав о состоянии вашей кожи, вы сможете сохранить ее молодой и здоровой, если будете правильно использовать средства по уходу. Если использовать прибор в течение определенного периода времени, вы сможете отслеживать изменения и наблюдать, как улучшается состояние кожи. ХАРАКТЕРИСТИКИ: - Большой ЖК дисплей - Определите степень увлажненности, жирности и мягкости вашей кожи - Функция памяти: сохраняются результаты последних пяти измерений - Подсветка - Индикатор заряда показывает уровень заряда батареек В комплекте поставки: аппарат, руководство пользователя, 3 батарейки L1154f

Модель:
RUR 1444
Показания Первичная гиперхолестеринемия (тип IIа по классификации Фредриксона), включая гетерозиготную наследственную гиперхолестеринемию или смешанная (комбинированная) гиперлипидемия (типа IIb по классификации Фредриксона), в качестве дополнения к диете и другимнемедикаментозным мероприятиям (физическая нагрузка и снижение массы тела)- Гомозиготная форма наследственной гиперхолестеринемии при недостаточной эффективности диетотерапии и других видов лечения, направленных на снижение концентрации липидов (например, ЛПНП-аферез) или, если такие виды лечения не подходят пациенту- Гипертриглицеридемия (тип IV по классификации Фредриксона) в качестве дополнения к диете- Для замедления прогрессирования атеросклероза в качестве дополнения к диете у пациентов, которым показана терапия для снижения концентрации общего холестерина и холестерина-ЛПНП- Первичная профилактика основных сердечно-сосудистых осложнений (инсульта, инфаркта, артериальной реваскуляризации) у взрослых пациентов без клинических признаков ишемической болезни сердца (ИБС), но с повышенным риском ее развития (возраст старше 50 лет для мужчин и старше 60 лет для женщин, повышенная концентрация С-реактивного белка ( 2 мг/л) при наличии, как минимум одного из дополнительных факторов риска, таких как артериальная гипертензия, низкая концентрация холестерина-ЛПВП, курение, семейный анамнез раннего начала ИБС). Противопоказания Противопоказания Противопоказания для препарата Розарт в суточной дозе 5, 10 и 20 мг: - Повышенная чувствительность к розувастатину или другим компонентам препарата: - Заболевания печени в активной фазе, включая стойкое повышение сывороточной активности "печеночных" трансаминаз (более чем в 3 раза по сравнению с верхней границей нормы (ВГН)): - Тяжелые нарушения функции почек (КК менее 30 мл/мин): - Миопатия: - Одновременный прием циклоспорина: - Применение у женщин репродуктивного возраста, не пользующихся адекватными методами контрацепции: - Беременность и период грудного вскармливания: - Возраст до 18 лет (эффективность и безопасность не установлены): - Непереносимость лактозы, дефицит лактазы, глюкозо-галактозная мальабсорбция (препарат содержит лактозы моногидрат). Противопоказания для препарата Розарт в суточной дозе 40 мг: - Повышенная чувствительность к розувастатину или другим компонентам препарата: - Заболевания печени в активной фазе, включая стойкое повышение сывороточной активности "печеночных" трансаминаз (более чем в 3 раза по сравнению с ВГН): - Миопатия: - Одновременный прием циклоспорина: - Применение у женщин репродуктивного возраста, не пользующихся адекватными методами контрацепции: - Беременность и период грудного вскармливания: - Возраст до 18 лет (эффективность и безопасность не установлены): - Непереносимость лактозы, дефицит лактазы, глюкозо-галактозная мальабсорбция (препарат содержит лактозы моногидрат): - Миотоксичность на фоне приема других ингибиторов ГМГ-КоА-редуктазы или фибратов в анамнезе: - Гипотиреоз: - Почечная недостаточность тяжелой и средней степени тяжести (КК менее 60 мл/мин): - Чрезмерное употребление алкоголя: - Состояния, которые могут приводить к повышению плазменной концентрации розувастатина: - Одновременный прием фибратов: - Применение у пациентов монголоидной расы: - Семейный или личный анамнез наследственных мышечных заболеваний. С осторожностью: Для препарата Розарт в суточной дозе 5, 10 и 20 мг: Наличие факторов риска развития миопатии и/или рабдомиолиза - почечная недостаточность (КК более 30 мл/мин), гипотиреоз, личный или семейный анамнез наследственных мышечных заболеваний и предшествующий анамнез миотоксичности при применении других ингибиторов ГМГ-КоА-редуктазы или фибратов: чрезмерное употребление алкоголя, возраст старше 70 лет: состояния, при которых отмечено повышение плазменной концентрации розувастатина: расовая принадлежность (монголоидная раса), одновременное применение с фибратами, заболевания печени в анамнезе, сепсис, артериальная гипотензия, обширные хирургические вмешательства, травмы, тяжелые метаболические, эндокринные или водно-электролитные нарушения или неконтролируемая эпилепсия. Для препарата Розарт в суточной дозе 40 мг: Наличие факторов риска развития миопатии и/или рабдомиолиза - почечная недостаточность (КК более 60 мл/мин), возраст старше 70 лет, заболевания печени в анамнезе, сепсис, артериальная гипотензия, обширные хирургические вмешательства, травмы, тяжелые метаболические, эндокринные или водно-электролитные нарушения или неконтролируемая эпилепсия. Беременность Препарат Розарт противопоказан при беременности и в период лактации. Применение препарата Розарт у женщин репродуктивного возраста возможно только в случае использования надежных методов контрацепции и если пациентка информирована о возможном риске лечения для плода. Поскольку холестерин и вещества, синтезируемые из холестерина важны для развития плода, потенциальный риск ингибирования ГМГ-КоА-редуктазы превышает пользу от применения препарата во время беременности. В случае диагностирования беременности в процессе терапии препаратом Розарт, прием препарата должен быть немедленно прекращен, а пациентки предупреждены о потенциальном риске для плода. Данные в отношении выделения розувастатина с грудным молоком отсутствуют, поэтому при необходимости применения препарата в период лактации, учитывая возможность нежелательных явлений у грудных детей, следует решить вопрос о прекращении грудного вскармливания. Применение и дозы Внутрь, не разжевывая, не измельчая, проглатывая целиком, запивая водой, независимо от времени суток и приема пищи. До начала терапии препаратом Розарт пациент должен начать соблюдать стандартную гиполипидемическую диету и продолжать соблюдать ее во время лечения. Дозу препарата следует подбирать индивидуально в зависимости от показаний и терапевтического ответа, принимая во внимание текущие общепринятые рекомендации по целевым концентрациям липидов. Рекомендуемая начальная доза препарата Розарт для пациентов, начинающих принимать препарат, или для пациентов, переведенных с приема других ингибиторов ГМГ-КоА-редуктазы, составляет 5 или 10 мг 1 раз/сут. При выборе начальной дозы следует руководствоваться концентрацией холестерина у пациента и принимать во внимание риск развития сердечно-сосудистых осложнений, а также необходимо оценивать потенциальный риск развития побочных реакций. В случае необходимости через 4 недели доза препарата может быть увеличена. В связи с возможным развитием побочных эффектов при приеме дозы 40 мг по сравнению с более низкими дозами препарата (см. раздел "Побочное действие"), окончательное титрование до максимальной дозы 40 мг следует проводить только у пациентов с тяжелой формой гиперхолестеринемии и высоким риском сердечно-сосудистых осложнений (особенно у пациентов с наследственной гиперхолестеринемией), у которых при приеме дозы 20 мг не была достигнута целевая концентрация холестерина, и которые будут находиться под врачебным наблюдением. Рекомендуется особенно тщательное наблюдение за пациентами, получающими препарат в дозе 40 мг. После 2-4-х недель терапии и/или повышения дозы препарата необходим контроль показателей липидного обмена. У пожилых пациентов старше 70 лет рекомендуемая начальная доза препарата Розарт составляет 5 мг, иной коррекции дозы не требуется. У пациентов с печеночной недостаточностью по шкале Чайлд-Пью ниже 7 баллов коррекции дозы препарата не требуется. У пациентов со значениями 8 и 9 баллов по шкале Чайлд-Пью должна быть проведена предварительная оценка функции почек. Опыт применения розувастатина у пациентов с печеночной недостаточностью выше 9 баллов по шкале Чайлд-Пью отсутствует. Розувастатин противопоказан у пациентов с заболеванием печени в активной фазе. При почечной недостаточности легкой или средней степени тяжести коррекции дозы не требуется. Рекомендуется начальная доза препарата 5 мг для пациентов с почечной недостаточностью средней степени тяжести (КК менее 60 мл/мин). Пациентам с почечной недостаточностью средней степени тяжести (КК менее 30-60 мл/мин) назначение препарата в дозе 40 мг противопоказано. Прием препарата Розарт противопоказан в любых дозах пациентам с тяжелой степенью почечной недостаточности (КК менее 30 мл/мин). Этнические группы У пациентов монголоидной расы возможно повышение системной концентрации розувастатина. Начальная рекомендуемая доза препарата для пациентов монголоидной расы составляет 5 мг. Применение препарата в дозе 40 мг таким пациентам противопоказано. Генетический полиморфизм Известны разновидности генетического полиморфизма, который может привести к увеличению системной концентрации розувастатина. У пациентов с выявленным специфическим полиморфизмом рекомендуются более низкие суточные дозы розувастатина. Пациенты, предрасположенные к развитию миопатии Начальная рекомендуемая доза для таких пациентов составляет 5 мг. Применение препарата в дозе 40 мг у таких пациентов противопоказано. Комбинированная терапия Розувастатин является субстратом для различных транспортных белков (например, ОАТР1В1 и BCRP). Повышается риск развития миопатии, включая рабдомиолиз, при одновременном приеме розувастатина с лекарственными препаратами, повышающими концентрацию розувастатина в плазме крови за счет их взаимодействия с транспортными белками. К данной группе веществ относятся циклоспорин, ингибиторы ВИЧ-протеаз, включая комбинацию ритонавира с атазанавиром, лопинавир и/или типранавир: см. раздел Особые указания и Взаимодействие с другими лекарственными препаратами). В случае, когда это возможно, следует принять решение о назначении альтернативной терапии и, в случае необходимости, временно прекратить прием розувастатина. В случае, когда одновременного приема избежать нельзя, следует тщательно оценить возможный риск взаимодействия и потенциальную пользу от совместного лечения (см. раздел Взаимодействие с другими лекарственными препаратами). Побочные эффекты и передозировка Побочные эффекты: Согласно данным клинических исследований розувастатина, а также данным его постмаркетингового применения, у пациентов наблюдались перечисленные ниже побочные реакции. Частота побочных реакций распределяется следующим образом: очень часто - более 1/10: часто - от более 1/100 до менее 1/10: нечасто - от более 1/1000 до менее 1/100: редко - от более 1/10000 до менее 1/1000: очень редко - от менее 1/10000: частота неизвестна - по имеющимся данным установить частоту возникновения не представляется возможным. Со стороны крови и лимфатической системы: редко - тромбоцитопения. Со стороны нервной системы: часто - головная боль, головокружение, астенический синдром: очень редко - полинейропатия, снижение памяти: частота неизвестна - депрессия, периферическая нейропатия, нарушения сна, включая бессонницу и кошмарные сновидения. Со стороны пищеварительной системы: часто - запор, тошнота, боль в животе: редко - панкреатит: очень редко - гепатит, желтуха: частота неизвестна - диарея. Со стороны дыхательной системы: частота неизвестна - кашель, одышка, интерстициальное заболевание легких. Со стороны эндокринной системы: часто - сахарный диабет 1. Со стороны опорно-двигательного аппарата: часто - миалгия: редко - миопатия (включая миозиты), рабдомиолиз: очень редко артралгия: частота неизвестна иммуноопосредованная некротизирующая миопатия: поражения сухожилий, иногда с разрывами. Аллергические реакции: нечасто - кожный зуд, сыпь, крапивница: редко - реакции повышенной чувствительности, включая ангионевротический отек. Со стороны кожи и подкожных тканей: частота неизвестна - синдром Стивенса-Джонсона. Со стороны мочевыделительной системы: очень редко - гематурия. Со стороны половых органов и молочной железы: очень редко - гинекомастия. Лабораторные показатели: редко транзиторное повышение активности аспартатаминотрансферазы и аланинаминотрансферазы. Прочие: частота неизвестна - периферические отеки. 1 - Частота зависит от наличия факторов риска (концентрация глюкозы в крови натощак >:5,6 ммоль/л, индекс массы тела >:30 кг/м 2, повышенная концентрация ТГ, артериальная гипертензия в анамнезе). Как и при применении других ингибиторов ГМГ-КоА-редуктазы, частота возникновения побочных реакций носит дозозависимый характер, побочные эффекты обычно выражены незначительно и проходят самостоятельно. Влияние на функцию почек У пациентов, получавших розувастатин, в ходе анализа мочи тест-полосками была выявлена протеинурия, преимущественно канальцевая. Изменения количества белка в моче (от отсутствия или следовых количеств до + или больше) наблюдались у менее 1% пациентов, получающих 10-20 мг розувастатина, и у приблизительно 3% пациентов, получающих 40 мг розувастатина. Незначительное изменение количества белка в моче (от отсутствия или следовых количеств до +) отмечалось при приеме дозы 20 мг. В большинстве случаев протеинурия уменьшается или исчезает в процессе терапии и не означает возникновения острого или прогрессирования существующего заболевания почек. У пациентов, получающих розувастатин, наблюдалась гематурия, имеющиеся данные показали низкую частоту появления данной нежелательной реакции. Влияние на опорно-двигательный аппарат При применении всех доз розувастатина и, в особенности при приеме доз, превышающих 20 мг, сообщалось о развитии миалгии, миопатии, включая миозит, в редких случаях о рабдомиолизе с развитием острой почечной недостаточности или без неё. При приеме розувастатина наблюдалось дозозависимое повышение активности креатинфосфокиназы (КФК). В большинстве случаев оно было незначительным, бессимптомным и временным. В случае повышения активности КФК (более чем в 5 раз по сравнению с ВГН) терапия должна быть приостановлена (см. раздел Особые указания). Влияние на функцию печени У незначительного числа пациентов при применении розувастатина наблюдается дозозависимое повышение активности "печеночных" трансаминаз. В большинстве случаев оно невелико, бессимптомно и временно. При применении некоторых ингибиторов ГМГ-КоА-редуктазы наблюдались сексуальная дисфункция, были зафиксированы единичные случаи интерстициального заболевания легких (см. раздел Особые указания). Частота сообщений о развитии рабдомиолиза, серьезных нарушений функции почек и печени (выражающееся преимущественно в повышении активности "печеночных" трансаминаз) выше при приеме дозы розувастатина 40 мг. Передозировка: При одновременном приеме нескольких суточных доз фармакокинетические параметры розувастатина не меняются. Лечение: специфического лечения нет, проводится симптоматическая терапия и мероприятия, направленные на поддержание функции жизненно важных органов и систем под контролем функции печени и активности КФК. Маловероятно, что гемодиализ будет эффективен. Взаимодействие с другими ЛС: Ингибиторы транспортных белков Розувастатин является субстратом некоторых транспортных белков, включая мембранный переносчик ОАТР1В1, вовлеченный в процесс печеночного захвата, и транспортный белок BCRP. Одновременный прием розувастатина с лекарственными средствами, ингибирующими эти транспортные белки, может привести к увеличению концентрации розувастатина в плазме крови и повысить риск развития миопатии. Одновременное применение розувастатина и циклоспорина не влияет на плазменную концентрацию циклоспорина, однако усиливается эффект розувастатина (замедляется его выведение, увеличивается AUC в 7 раз, Сmах - в 11 раз). Одновременный прием циклоспорина и розувастатина противопоказан. Одновременный прием эритромицина и розувастатина приводит к уменьшению AUC розувастатина на 20% и увеличивает Сmах на 30%. Подобное взаимодействие может возникать в результате усиления моторики кишечника, вызываемого приемом эритромицина. У пациентов, получающих непрямые антикоагулянты (например, варфарин) рекомендуется мониторинг международного нормализованного отношения (MHO), поскольку начало терапии розувастатином или повышение его дозы может приводить к увеличению MHO, а отмена розувастатина или снижение его дозы может приводить к его уменьшению. Гемфиброзил и другие гиполипидемические средства: одновременный прием гемфиброзила и розувастатина увеличивает Сmах и AUC розувастатина в 2 раза (см. раздел Особые указания). Основываясь на данных по специфическому взаимодействию, не ожидается фармакокинетически значимого взаимодействия с фенофибратом, возможно фармакодинамическое взаимодействие. Гемфиброзил, фенофибрат, другие фибраты и гиполипидемические дозы никотиновой кислоты (не менее 1 г/сут) увеличивали риск возникновения миопатии при одновременном применении с другими ингибиторами ГМГ- КоА-редуктазы, возможно в связи с тем, что они могут вызывать миопатию и при применении в качестве монотерапии. При одновременном приеме розувастатина с одним из препаратов данной группы пациентам рекомендуется начальная доза розувастатина 5 мг, суточная доза розувастатина 40 мг в данном случае противопоказана. Одновременное применение розувастатина и антацидов, содержащих алюминия и магния гидроксид, приводит к снижению плазменной концентрации розувастатина примерно на 50%. Данный эффект выражен слабее, если антациды применяются через 2 ч после приема розувастатина. Клиническая значимость данного взаимодействия не изучалась. Одновременное применение розувастатина и пероралъных контрацептивов увеличивает AUC этинилэстрадиола и AUC норгестрела на 26% и 34% соответственно, что следует учитывать при подборе дозы пероральных контрацептивов. Фармакокинетические данные по одновременному применению розувастатина и гормонозаместительной терапии отсутствуют, следовательно, нельзя исключить аналогичного эффекта при их совместном применении. Однако, подобная комбинация широко применялась во время проведения клинических исследований розувастатина и хорошо переносилась пациентами. Результаты исследований in vivo и in vitro показали, что розувастатин не является ни ингибитором, ни индуктором изоферментов цитохрома Р450. Розувастатин является непрофильным субстратом для этих изоферментов. Не наблюдалось клинически значимого взаимодействия с такими препаратами, как флуконазол (ингибитор изоферментов CYP2C9 и CYP3A4), кетоконазол (ингибитор изоферментов CYP2A6 и CYP3A4), связанных метаболизмом с системой цитохрома Р450. Совместное применение 10 мг розувастатина и 10 мг эзетимиба у пациентов с гиперхолестеринемией приводило к увеличению AUC розувастатина в 1,2 раза. Однако,нельзя исключить фармакодинамического взаимодейcтвия между розувастатином и эзетимибом в отношении появления нежелательных явлений. Несмотря на то, что точный механизм взаимодействия неизвестен, применение ингибиторов ВИЧ-протеаз с розувастатином может привести к выраженному увеличению экспозиции розувастатина. Фармакокинетическое исследование одновременного применения 20 мг розувастатина с комбинированным препаратом, содержащим два ингибитора ВИЧ-протеаз (400 мг лопинавира/100 мг ритонавира) у здоровых добровольцев приводило к приблизительно двукратному и пятикратному увеличению AUC0-24 и Сmах розувастатина, соответственно. Таким образом, не рекомендуется совместное применение розувастатина с ингибиторами ВИЧ-протеаз у ВИЧ-инфицированных пациентов. Не отмечается клинически значимого взаимодействия розувастатина с дигоксином. В Таблице 1 перечислены различные виды взаимодействия, в том числе взаимодействия, требующие коррекции дозы розувастатина. Следует скорректировать дозу розувастатина при необходимости одновременного применения с другими лекарственными препаратами, повышающими системную концентрацию розувастатина. Если ожидаемое увеличение AUC составляет приблизительно в 2 раза или больше, то начальная доза розувастатина должна составлять 5 мг 1 раз в день. Суточная доза розувастатина должна быть скорректирована таким образом, чтобы его системная концентрация с учетом её повышения не превышала таковую при приеме дозы розувастатина 40 мг в монотерапии. Например, при приеме гемфиброзила доза розувастатина не должна превышать 20 мг (увеличение AUC в 1,9 раза) и 10 мг при приеме комбинации атазанавир/ритонавир (увеличение AUC в 3,1 раза). Таблица 1. Влияние одновременного приема препаратов на экспозицию розувастатина (AUC, в порядке снижения значимости) ТАБЛИЦЪ Фармакологическое действие и фармакокинетика Гиполипидемическое средство из группы статинов. Селективный конкурентный ингибитор 3-гидрокси-3-метилглутарил коэнзим А (ГМГ-КоА)-редуктазы - фермента, превращающего ГМГ-КоА в мевалонат, предшественник холестерина. Увеличивает число рецепторов липопротеинов низкой плотности (ЛПНП) на поверхности гепатоцитов, что приводит к усилению захвата и катаболизма ЛПНП, ингибированию синтеза липопротеинов очень низкой плотности (ЛПОНП), уменьшая общее количество ЛПНП и ЛПОНП. Снижает повышенную концентрацию холестерина-ЛПНП, холестерина-липопротеинов невысокой плотности (неЛПВП), холестерина-ЛПОНП, общего холестерина, триглицеридов (ТГ), ТГ-ЛПОНП, аполипопротеина В (АпоВ), снижает соотношения холестерин-ЛПНП/холестерин-ЛПВП, общий холестерин/холестерин-ЛПВП, холестерин-неЛПВП/холестерин-ЛПВП, АпоВ/аполипопротеина A-I (АпоА-1), повышает концентрацию холестерина-ЛПВП и АпоА-1. Гиполипидемическое действие прямо пропорционально величине назначенной дозы. Терапевтический эффект появляется в течение 1 недели после начала терапии, через 2 недели достигает 90% от максимального, к 4 неделе достигает максимума и после этого остается постоянным. Эффективен у взрослых пациентов с гиперхолестеринемией с или без гипертриглицеридемии (вне зависимости от расы, пола или возраста), в том числе у пациентов с сахарным диабетом и семейной гиперхолестеринемией. У 80% пациентов с гиперхолестеринемией IIа и IIb типа (классификация по Фредриксону) со средним исходным показателем холестерина-ЛПНП около 4,8 ммоль/л на фоне приема препарата в дозе 10 мг концентрация холестерина-ЛПНП достигает значений менее 3 ммоль/л. У пациентов с гомозиготной семейной гиперхолестеринемией, принимающих препарат в дозе 20 мг и 40 мг, среднее снижение концентрации холестерина-ЛПНП составляет 22%. Аддитивный эффект отмечается в комбинации с фенофибратом (в отношении снижения концентрации ТГ) и с никотиновой кислотой в липидснижающих дозах >: 1 г/сут (В отношении повышения концентрации холестерина-ЛПВП). Фармакокинетика: Всасывание Максимальная концентрация (Сmах) розувастатина в плазме крови достигается приблизительно через 5 ч после приема препарата. Абсолютная биодоступность - примерно 20%. Системная экспозиция розувастатина увеличивается пропорционально дозе. Фармакокинетические параметры не изменяются при ежедневном приеме. Распределение Проникает через плацентарный барьер. Розувастатин поглощается преимущественно печенью, которая является основным местом синтеза холестерина и метаболизма ХС-ЛПНП. Объем распределения - 134 л. Связывание с белками плазмы (преимущественно с альбумином) составляет приблизительно 90%. Метаболизм Биотрансформируется в печени в небольшой степени (около 10%), являясь непрофильным субстратом для изоферментов системы цитохрома Р450. Как и в случае других ингибиторов ГМГ-КоА-редуктазы, в процесс печеночного захвата препарата вовлечен специфический мембранный переносчик - полипептид, транспортирующий органический анион (ОАТР) 1В1, выполняющий важную роль в его печеночной элиминации. Основным изоферментом, участвующим в метаболизме розувастатина, является CYP2C9. Изоферменты CYP2C19, CYP3A4 и CYP2D6 вовлечены в метаболизм в меньшей степени. Основными метаболитами розувастатина являются N-десметил и лактоновые метаболиты. N- десметил примерно на 50% менее активен, чем розувастатин, лактоновые метаболиты фармакологически неактивны. Более 90% фармакологической активности по ингибированию циркулирующей ГМГ-КоА-редуктазы обеспечивается розувастатином, остальное - его метаболитами. Выведение Около 90% дозы розувастатина выводится в неизмененном виде через кишечник, оставшаяся часть - почками. Период полувыведения (Т1/2) - примерно 19 ч, не изменяется при увеличении дозы препарата. Среднее значение плазменного клиренса составляет приблизительно 50 л/ч (коэффициент вариации 21,7%). У пациентов с легкой и умеренно выраженной почечной недостаточностью плазменная концентрация розувастатина или N-десметила существенно не меняется. У пациентов с выраженной почечной недостаточностью (клиренс креатинина (КК) менее 30 мл/мин) концентрация розувастатина в плазме выше в 3 раза, а N-десметила - в 9 раз, чем у здоровых добровольцев. Концентрация розувастатина в плазме у пациентов, находящихся на гемодиализе, примерно на 50% выше, чем у здоровых добровольцев. У пациентов с различными стадиями печеночной недостаточности с баллом 7 и ниже по шкале Чайлд-Пью не выявлено увеличения Т1/2 розувастатина: у больных с баллами 8 и 9 по шкале Чайлд-Пью отмечено удлинение в 2 раза. Опыт применения препарата у пациентов с более выраженными нарушениями функции печени отсутствует. Пол и возраст не оказывают клинически значимого влияния на фармакокинетику розувастатина. Фармакокинетические параметры зависят от расовой принадлежности: площадь под кривой "концентрация-время" (AUC) у японцев и китайцев в 2 раза выше таковой у жителей Европы и Северной Америки. У представителей монголоидной расы и индийцев среднее значение AUC и Сmах увеличивается в 1,3 раза. Особые указания Влияние на функцию почек У пациентов, получавших высокие дозы розувастатина (в основном 40 мг), в ходе анализа мочи тест-полосками наблюдалась канальцевая протеинурия, которая в большинстве случаев была транзиторной. Такая протеинурия не свидетельствовала об остром заболевании почек или прогрессировании заболевания почек. Частота сообщений о развитии серьезных побочных реакций со стороны почек в постмаркетинговый период была выше у пациентов, принимавших розувастатин в дозе 40 мг. При применении препарата Розарт в дозе 40 мг рекомендуется контролировать показатели функции почек во время лечения. Влияние на опорно-двигательный аппарат При применении всех доз розувастатина и, в особенности при приеме доз, превышающих 20 мг, сообщалось о развитии миалгии, миопатии и в редких случаях о рабдомиолизе. В очень редких случаях сообщалось о развитии рабдомиолиза при одновременном приеме ингибиторов ГМГ-КоА-редуктазы и эзетимиба. В данном случае нельзя исключить фармакодинамического взаимодействия, поэтому следует соблюдать осторожность при их совместном приеме. Как при приеме других ингибиторов ГМГ-КоА-редуктазы частота сообщений в постмаркетинговый период наблюдения о развитии рабдомиолиза, связанного с приемом розувастатина, была выше при приеме дозы 40 мг. Определение креатинфосфокиназы Определение активности КФК не следует проводить после интенсивных физических нагрузок или при наличии других возможных причин увеличения ее активности, что может привести к неверной интерпретации полученных результатов. В случае, если исходная активность КФК существенно повышена, через 5-7 дней следует провести повторное измерение - не следует начинать терапию, если повторный тест подтверждает исходную активность КФК (в 5 раз выше нормы). До начала терапии Следует соблюдать осторожность при назначении препарата Розарт, также как и при назначении других ингибиторов ГМГ-КоА- редуктазы, пациентам с имеющимися факторами риска развития миопатии/рабдомиолиза (см. раздел С осторожностью). Необходимо рассмотреть соотношение ожидаемой пользы от терапии и потенциального риска и проводить клиническое наблюдение на протяжении всего курса лечения. В случае, если исходная активность КФК существенно повышена (в 5 раз выше ВГН), то не следует начинать лечение препаратом. Во время лечения Следует проинформировать пациента о необходимости немедленного сообщения врачу о случаях неожиданного появления мышечных болей, мышечной слабости или спазмах, особенно в сочетании с недомоганием и лихорадкой. У таких пациентов следует определять активность КФК. Терапию следует прекратить, если активность КФК значительно увеличен (более чем в 5 раз по сравнению с ВГН) или если мышечные симптомы резко выражены и вызывают ежедневный дискомфорт (даже, если активность КФК в 5 раз меньше по сравнению с ВГН). Если симптомы исчезают, и активность КФК возвращается к норме, следует рассмотреть вопрос о повторном назначении препарата Розарт или других ингибиторов ГМГ-КоА- редуктазы в меньших дозах при тщательном наблюдении за пациентом. Рутинный мониторинг активности КФК при отсутствии симптомов нецелесообразен. Отмечены очень редкие случаи иммуноопосредованной некротизирующей миопатии с клиническими проявлениями в виде стойкой слабости проксимальных мышц и повышения активности КФК в сыворотке крови во время лечения или прекращении приема статинов, в том числе розувастатина. Не отмечено признаков увеличения воздействия на скелетную мускулатуру при приеме розувастатина и сопутствующей терапии. Однако, сообщалось об увеличении числа случаев миозита и миопатии у пациентов, принимавших другие ингибиторы ГМГ-КоА-редуктазы в сочетании с производными фибриновой кислоты (включая гемфиброзил), циклоспорин, никотиновую кислоту в липидснижающих дозах >: 1 г/сут, азольные противогрибковые препараты, ингибиторы протеаз и макролидные антибиотики. Гемфиброзил увеличивает риск развития миопатии при одновременном приеме с некоторыми ингибиторами ГМГ-КоА-редуктазы, поэтому одновременное применение гемфиброзила и розувастатина не рекомендуется. Следует тщательно взвесить соотношение ожидаемой пользы и потенциального риска при совместном применении препарата Розарт и фибратов или никотиновой кислоты в липидснижающих дозах >: 1 г/сут. Противопоказан прием препарата Розарт в дозе 40 мг одновременно с фибратами (см. разделы Взаимодействие с другими лекарственными препаратами и Противопоказания). Во время лечения, особенно в период коррекции дозы препарата Розарт, каждые 2-4недели следует осуществлять мониторинг липидного профиля и согласно нему при необходимости изменять дозу препарата. Препарат Розарт не следует принимать пациентам при проявлении острых и выраженных симптомов миопатии или с наличием факторов риска, предрасполагающих к развитию нарушения функции почек и вторичного рабдомиолиза (например, сепсис, артериальная гипотензия, обширные хирургические вмешательства, травмы, выраженные нарушения метаболизма, выраженные эндокринные нарушения и тяжелые нарушения водно-электролитного баланса, неконтролируемые судороги). Влияние на функцию печени Как и другие ингибиторы ГМГ-КоА-редуктазы розувастатин следует применять с осторожностью у пациентов, злоупотребляющих алкоголем и/или с заболеванием печени в анамнезе. Рекомендуется проводить определение показателей функции печени до начала терапии и через 3 месяца после начала терапии. Прием препарата Розарт следует прекратить или уменьшить дозу препарата, если уровень активности "печеночных" трансаминаз в сыворотке крови в 3 раза превышает ВГН. У пациентов с гиперхолестеринемией вследствие гипотиреоза или нефротического синдрома терапия основных заболеваний должна проводиться до начала лечения препаратом Розарт. При постмаркетинговом наблюдении розувастатина частота сообщений о развитии серьезных нарушений функции печени (выражающихся преимущественно в повышении активности "печеночных" трансаминаз) была выше при приеме дозы 40 мг. Этнические группы В ходе фармакокинетических исследований среди пациентов монголоидной расы по сравнению с европеоидной отмечено увеличение системной концентрации розувастатина (см. раздел Способ применения и дозы и Фармакокинетика). Ингибиторы ВИЧ-протеаз В ходе совместного приема розувастатина и комбинации различных ингибиторов ВИЧ- протеаз с ритонавиром наблюдается увеличение системной концентрации розувастатина. Следует тщательно оценивать снижение концентрации липидов в крови, а также учитывать возможное повышение розувастатина в плазме крови в начале лечения и в период повышения дозы препарата Розарт у пациентов с ВИЧ, принимающих ингибиторы ВИЧ-протеаз. Одновременный прием ингибиторов ВИЧ- протеаз не рекомендуется без коррекции дозы розувастатина (см. раздел Способ применения и дозы и Взаимодействие с другими лекарственными препаратами). Интерстициальное заболевание легких При применении некоторых ингибиторов ГМГ-КоА-редуктазы, особенно в течение длительного времени, сообщалось о единичных случаях интерстициального заболевания легких. Проявлениями заболевания могут являться одышка, непродуктивный кашель и ухудшение общего самочувствия (слабость, снижение веса и лихорадка). При подозрении на интерстициальное заболевание легких следует прекратить терапию ингибиторами ГМГ-КоА-редуктазы. Сахарный диабет II типа Некоторые данные подтверждают то, что ингибиторы ГМГ-КоА-редуктазы повышают концентрацию глюкозы в крови и увеличивают у некоторых пациентов вероятность развития сахарного диабета II типа. Однако данный риск перевешивается способностью ингибиторов ГМГ-КоА-редуктазы снижать риск развития сосудистых осложнений, поэтому данный факт не является причиной для прерывания лечения розувастатином. Необходимо установить клиническое наблюдение и проводить биохимический анализ крови согласно национальным стандартам у пациентов с риском развития гипергликемии (концентрация глюкозы в крови 5,6-6,9 ммоль/л, индекс массы тела >: 30 кг/м 2, триглицеридемия, артериальная гипертензия). В одном из исследований розувастатина сообщалась общая частота развития сахарного диабета: 2,8% в группе розувастатина и 2,3% в плацебо группе в основном у пациентов с глюкозой натощак 5,6 - 6,9 ммоль/л. Непереносимость лактозы Препарат Розарт не следует принимать пациентам с непереносимостью лактозы, дефицитом лактазы и глюкозно-галактозной мальабсорбцией, поскольку в его состав входит лактозы моногидрат. Влияние на способность управлять транспортными средствами: Не проводилось исследований по изучению влияния розувастатина на способность управлять транспортными средствами и механизмами. При управлении транспортными средствами и занятии потенциально опасными видами деятельности пациентам следует соблюдать осторожность, так как во время терапии может возникать головокружение. Условия хранения и отпуска из аптек Условия хранения:При температуре не выше 30 °С. Хранить в недоступном для детей месте! Отпуск из аптек: По рецепту Регистрационные данные Торговое название Розарт Международное непатентованное название:Розувастатин. Форма выпуска:таблетки, покрытые плёночной оболочкой. Состав:1 таблетка, покрытая плёночной оболочкой, 5 мг содержит: активное вещество: розувастатин 5,00 мг (в виде розувастатина кальция 5,21 мг): вспомогательные вещества: целлюлоза микрокристаллическая, тип 102 11,55 мг, кросповидон, тип А 3,5 мг, кальция гидрофосфата дигидрат 17,15 мг, лактозы моногидрат 31,71 мг, магния стеарат 0,88 мг: плёночное покрытие: Опадрай белый II 33G28435 ~ 2,1 мг (гипромеллоза-2910 0,84 мг, титана диоксид 0,525 мг, лактозы моногидрат 0,441 мг, макрогол-3350 0,168 мг, триацетин 0,126 мг). 1 таблетка, покрытая плёночной оболочкой, 10 мг содержит: активное вещество: розувастатин 10 мг (в виде розувастатина кальция 10,42 мг): вспомогательные вещества: целлюлоза микрокристаллическая, тип 102 23,1 мг, кросповидон, тип А 7 мг, кальция гидрофосфата дигидрат 34,3 мг, лактозы моногидрат 63,42 мг, магния стеарат 1,76 мг: плёночное покрытие: Опадрай розовый II 33G240007 ~ 4,2 мг (гипромеллоза-2910 1,68 мг, титана диоксид 1,0441 мг, лактозы моногидрат 0,882 мг, макрогол-3350 0,336 мг, триацетин 0,252 мг, краситель кармин красный 0,0059 мг). 1 таблетка, покрытая плёночной оболочкой, 20 мг содержит: активное вещество: розувастатин 20 мг (в виде розувастатина кальция - 20,84 мг): вспомогательные вещества: целлюлоза микрокристаллическая, тип 102 46,2 мг, кросповидон, тип А 14 мг, кальция гидрофосфата дигидрат 68,6 мг, лактозы моногидрат 126,84 мг, магния стеарат 3,52 мг: плёночное покрытие: Опадрай розовый II 33G240007 ~ 8,4 мг (гипромеллоза-2910 3,36 мг, титана диоксид 2,0882 мг, лактозы моногидрат 1,764 мг, макрогол-3350 0,672 мг, триацетин 0,504 мг, краситель кармин красный 0,0118 мг). 1 таблетка, покрытая плёночной оболочкой, 40 мг содержит: активное вещество: розувастатин 40 мг (в виде розувастатина кальция 41,68 мг): вспомогательные вещества: целлюлоза микрокристаллическая, тип 102 92,4 мг, кросповидон, тип А 28 мг, кальция гидрофосфата дигидрат 137,2 мг, лактозы моногидрат 253,68 мг, магния стеарат 7,04 мг: плёночное покрытие: Опадрай розовый II 33G240007 ~ 16,8 мг (гипромеллоза-2910 6,72 мг, титана диоксид 4,1765 мг, лактозы моногидрат 3,528 мг, макрогол-3350 1,344 мг, триацетин 1,008 мг, краситель кармин красный 0,0235 мг). АТХ: Регистрация: Лекарственное средство ЛП-002213 Фармгруппа: Гиполипидемическое средство - ГМГ-КоА редуктазы ингибитор. Дата регистрации: 02.09.2013 / 07.03.2017. Окончание регстрации: . Описание:Таблетки 5 мг Круглые, двояковыпуклые таблетки, покрытые плёночной оболочкой белого цвета с гравировкой "ST 1" на одной стороне таблетки. Таблетки 10 мг Круглые, двояковыпуклые таблетки, покрытые плёночной оболочкой розового цвета с гравировкой "ST 2" на одной стороне таблетки. Таблетки 20 мг Круглые, двояковыпуклые таблетки, покрытые плёночной оболочкой розового цвета с гравировкой "ST 3" на одной стороне таблетки. Таблетки 40 мг. Овальные, двояковыпуклые таблетки, покрытые плёночной оболочкой розового цвета с гравировкой "ST 4" на одной стороне таблетки. Упаковка:Таблетки, покрытые плёночной оболочкой, 5 мг, 10 мг, 20 мг и 40 мг. По 7, 10 или 14 таблеток в блистер ПВХ/ПВДХ/Алюминиевая фольга или в блистер Алюминиевая фольга/Алюминиевая фольга. По 4 блистера по 7 таблеток, по 3 или 9 блистеров по 10 таблеток и по 2 или 6 блистеров по 14 таблеток с инструкцией по применению в картонную пачку. Срок годности:2 года. Не применять по истечении срока годности. Владелец рег.удостоверения:Актавис Групп ПТС ехф Производитель:ACTAVIS, Ltd. Представительство:Актавис, ООО

Модель:
RUR 1385
Показания ■ Первичный билиарный цирроз при отсутствии признаков декомпенсации (симптоматическое лечение) ■ Растворение холестериновых камней желчного пузыря ■ Билиарный рефлюкс-гастрит ■ Первичный склерозирующий холангит ■ Алкогольная болезнь печени ■ Неалкогольный стеатогепатит ■ Кистозный фиброз (муковисцидоз) ■ Хронические гепатиты различного генеза ■ Дискинезия желчевыводящих путей Противопоказания Противопоказания Рентгеноположительные (с высоким содержанием кальция) желчные камни, нефункционирующий желчный пузырь, острые инфекционно-воспалительные заболевания желчного пузыря, желчных протоков и кишечника, цирроз печени в стадии декомпенсации, выраженные нарушения функции почек, печени, поджелудочной железы, повышенная чувствительность к компонентам препарата. Урсодезоксихолевая кислота не имеет возрастных ограничений в применении, однако детям в возрасте до 3 лет не рекомендуется применять препарат в данной лекарственной форме. С осторожностью: С осторожностью применяют у детей в возрасте от 3 до 4 лет, так как возможно затруднение при проглатывании капсул. Беременность В экспериментальных исследованиях на животных не выявлено мутагенного и канцерогенного действия УДХК. Применение УДХК при беременности возможно только в том случае, когда ожидаемая польза для матери превышает потенциальный риск для плода (адекватных строго контролируемых исследований применения урсодезоксихолевой кислоты у беременных женщин не проводилось). При необходимости применения УДХК в период лактации следует решить вопрос о прекращении грудного вскармливания. Данные о выделении урсодезоксихолевой кислоты с грудным молоком в настоящее время отсутствуют. Применение и дозы Капсулы Урдокса® принимают внутрь, не разжевывая, запивая небольшим количеством воды. Симптоматическое лечение первичного билиарного цирроза Суточная доза зависит от массы тела и составляет от 3 до 7 капсул (примерно 14 ± 2 мг урсодезоксихолевой кислоты на 1 кг массы тела). В первые 3 месяца лечения прием препарата Урдокса® следует разделить на несколько приемов в течение дня. После улучшения печеночных показателей суточную дозу препарата можно принимать 1 раз, вечером. Рекомендуется следующий режим применения: ТАБЛИЦЪ Препарата Урдокса® необходимо принимать ежедневно вечером, перед сном. Длительность терапии составляет 6-12 месяцев. Для профилактики повторного холелитиаза рекомендован прием препарата в течение нескольких месяцев после растворения камней. Леченые билиарного рефлюкс-гастрита 1 капсула препарата Урдокса® ежедневно 1 раз в день перед сном. Курс лечения от 10-14 дней до 6 месяцев, при необходимости до 2 лет. Первичный склерозирующий холангит Суточная доза составляет 12-15 мг/кг: при необходимости доза может быть увеличена до 20-30 мг/кг в 2-3 приема. Длительность терапии составляет от 6 месяцев до нескольких лет. Алкогольная болезнь печени Средняя суточная доза составляет 10-15 мг/кг в 2-3 приема. Длительность терапии составляет от 6-12 месяцев и более. Неалкогольный стеатогепатит Средняя суточная доза составляет 10-15 мг/кг в 2-3 приема. Длительность терапии составляет от 6-12 месяцев и более. Кистозный фиброз (муковисцидоз) Суточная доза составляет 12-15 мг/кг: при необходимости доза может быть увеличена до 20-30 мг/кг в 2-3 приема. Длительность терапии составляет от 6 месяцев до нескольких лет или пожизненно. Хронические гепатиты различного генеза Суточная доза составляет 10-15 мг/кг в 2-3 приема. Длительность терапии составляет 6- 12 месяцев и более. Дискинезия желчевыводящих путей Средняя суточная доза составляет 10 мг/кг в 2 приема. Длительность терапии составляет от 2 недель до 2 месяцев. При необходимости курс лечения рекомендуется повторить. Детям старше 3 лет УДХК назначают индивидуально из расчета 10-20 мг/кг/сут. Побочные эффекты и передозировка Побочные эффекты: Частота нежелательных реакций приведена в соответствии со следующей шкалой: очень часто (>: 10 %): часто (>: 1 % и <:10 %): нечасто (>: 0,1 % и <: 1 %): редко (>: 0,01 % и <: 0,01 %): очень редко (<: 0,01 %). Со стороны желудочно-кишечного тракта: часто - диарея: редко - тошнота, рвота: очень редко - острые боли в правой верхней части живота. Со стороны печени и желчевыводящих путей: редко - преходящее повышение активности "печеночных" ферментов: очень редко - кальцинирование желчных камней. При лечении развитых стадий первичного билиарного цирроза очень редко - декомпенсация цирроза печени, которая исчезает после отмены препарата. Со стороны кожных покровов: очень редко - крапивница. Если любые из указанных в инструкции нежелательных явлений усугубляются, или Вы заметили любые другие нежелательные явления, не указанные в инструкции, сообщите об этом врачу. Передозировка: Случаи передозировки УДХК не известны. В случае передозировки проводят симптоматическое лечение. Взаимодействие с другими ЛС: Колестирамин, колестипол и антациды, содержащие алюминия гидроксид или смектит (алюминия оксид), снижают абсорбцию УДХК в кишечнике и таким образом уменьшают ее поглощение и эффективность. Если же применение препаратов, содержащих хотя бы одно из этих веществ, все же является необходимым, их следует принимать минимум за 2 часа до приема препарата Урдокса®. Урсодезоксихолевая кислота может усилить поглощение циклоспорина из кишечника. Поэтому у пациентов, принимающих циклоспорин, врач должен проверить концентрацию циклоспорина в крови и скорректировать дозу циклоспорина в случае необходимости. В отдельных случаях препарат Урдокса® может снижать всасывание ципрофлоксацина. Гиполипидемические лекарственные препараты (особенно клофибрат), эстрогены, неомицин или прогестины увеличивают насыщение желчи холестерином и могут снижать способность растворять холестериновые желчные конкременты. Следует сообщить врачу обо всех препаратах, которые вы принимаете. Фармакологическое действие и фармакокинетика Гепатопротекторное средство, оказывает также желчегонное, холелитолитическое, гипохолестеринемическое, гиполипидемическое, иммуномодулирующее действие. Встраивается в мембрану гепатоцита, стабилизирует ее структуру и защищает гепатоцит от повреждающего действия солей желчных кислот, снижая, таким образом, их цитотоксический эффект. При холестазе активирует Са 2-зависимую альфа-протеазу и стимулирует экзоцитоз, уменьшает концентрацию токсичных желчных кислот (хенодезоксихолевой, литохолевой, дезоксихолевой и др.), концентрации которых у больных с хроническими заболеваниями печени повышены. Конкурентно снижает всасывание липофильных желчных кислот в кишечнике, повышает их "фракционный" оборот при энтерогепатической циркуляции, индуцирует холерез, стимулирует пассаж желчи и выведение токсичных желчных кислот через кишечник. Экранирует неполярные желчные кислоты (хенодезоксихолевую), благодаря чему формируются смешанные (нетоксичные) мицеллы. Снижает насыщение желчи холестерином путем уменьшения синтеза и секреции холестерина в печени и ингибирования его всасывания в кишечнике. Повышает растворимость холестерина в желчевыводящей системе, стимулирует образование и выделение желчи. Уменьшает литогенность желчи, увеличивает в ней концентрацию желчных кислот, вызывает усиление желудочной и панкреатической секреции, усиливает активность липазы, оказывает гипогликемическое действие. Вызывает частичное или полное растворение холестериновых желчных камней, уменьшает насыщенность желчи холестерином, что способствует его мобилизации из желчных камней. Оказывает иммуномодулирующее действие, влияет на иммунологические реакции в печени: уменьшает экспрессию некоторых антигенов гистосовместимости - HLA-1 на мембране гепатоцитов и HLA-2 на холангиоцитах, влияет на количество Т-лимфоцитов, образование интерлейкина 2, уменьшает количество эозинофилов, подавляет иммунокомпетентные Ig (в первую очередь IgM). Фармакокинетика: Урсодезоксихолевая кислота (УДХК) абсорбируется в тонкой кишке за счет пассивной диффузии (около 90 %), а в подвздошной кишке посредством активного транспорта. Максимальная концентрация в плазме крови (Сmах) при приеме внутрь 50 мг через 30, 60, 90 мин 0 3,8 ммоль/л, 5,5 ммоль/л и 3,7 ммоль/л соответственно. Сmах достигается через 1-3 часа. Связь с белками плазмы высокая - до 96-99 %. Проникает через плацентарный барьер. При систематическом приеме препарата УДХК становится основной желчной кислотой в сыворотке крови и составляет около 48 % от общего количества желчных кислот в крови. Терапевтический эффект препарата зависит от концентрации УДХК в желчи. Метаболизируется в печени (клиренс при "первичном прохождении" через печень) в тауриновый и глициновый конъюгаты. Образующиеся конъюгаты секретируются в желчь. Около 50-70 % общей дозы препарата выводится с желчью. Незначительное количество невсосавшейся УДХК поступает в толстую кишку, где подвергается расщеплению бактериями (7-дегидроксилирование): образующаяся литохолевая кислота частично всасывается из толстой кишки, но сульфатируется в печени и быстро выводится в виде сульфолитохолилглицинового или сульфолитохолилтауринового конъюгата. Особые указания Прием препарата Урдокса® должен осуществляться под наблюдением врача. При приеме препарата с целью растворения желчных камней необходимо соблюдение следующих условий: камни должны быть холестериновыми (рентгенонегативными), их размер не должен превышать 15-20 мм, желчный пузырь должен оставаться функциональным и должен быть наполнен камнями не более чем на половину, проходимость пузырного и общего желчного протока должна быть сохранена. При длительном (более 1 месяца) приеме препарата, каждые 4 недели в первые 3 месяца лечения, в дальнейшем - каждые 3 месяца необходимо проводить биохимический анализ крови для определения активности печеночных трансаминаз. Контроль эффективности лечения следует проводить каждые 6 месяцев по данным ультразвукового исследования желчевыводящих путей. После полного растворения камней рекомендуется продолжать применение препарата в течение, по крайней мере, 3 месяцев, для того, чтобы способствовать растворению остатков камней, размеры которых слишком малы для их обнаружения и для профилактики рецидива камнеобразования. У пациентов с первичным билиарным циррозом в редких случаях клинические симптомы могут ухудшиться в начале лечения, например, может участиться зуд. В этом случае лечение следует продолжить, принимая по 1 капсуле ежедневно, далее следует повышать дозировку (увеличивая суточную дозу еженедельно на 1 капсулу) до тех пор, пока вновь не будет достигнут рекомендованный режим дозирования. В случае развития нежелательных или тяжелых реакций пациенту необходимо сразу же информировать о них лечащего врача и, ни в коем случае не продолжать прием препарата без его рекомендации. Влияние на способность управлять транспортными средствами: Влияния на способность к управлению транспортными средствами и работу с механизмами выявлено не было. Условия хранения и отпуска из аптек Условия хранения:В сухом, защищенном от света месте при температуре не выше 25 °С. Хранить в недоступном для детей месте. Отпуск из аптек: По рецепту Регистрационные данные Торговое название Урдокса® Международное непатентованное название:Урсодезоксихолевая кислота. Форма выпуска:капсулы. Состав:Состав на одну капсулу Активное вещество: урсодезоксихолевая кислота - 250 мг. Вспомогательные вещества: крахмал кукурузный - 73,0 мг, кремния диоксид коллоидный безводный - 5,0 мг, магния стеарат - 2,0 мг. Капсула твердая желатиновая: желатин - 98 %, титана диоксид [Е 171] - 2%. АТХ: Регистрация: Лекарственное средство ЛСР-001873/09 Фармгруппа: Гепатопротекторное средство. Дата регистрации: 13.03.2009 / 16.12.2015. Окончание регстрации: . Описание:Белые или почти белые твердые непрозрачные желатиновые капсулы № 0. Содержимое капсул: белый или почти белый порошок или гранулят. Упаковка:Капсулы 250 мг. По 10 капсул в контурную ячейковую упаковку из пленки поливинилхлоридной и фольги алюминиевой печатной лакированной. По 50 или 100 капсул в банки полимерные или банки полимерные с крышками для лекарственных средств. Крышка банки может быть выполнена из пластика желтого цвета. На каждую банку наклеивают этикетку из бумаги писчей или этикеточной или этикетку самоклеящуюся. По одной банке или по 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 контурных ячейковых упаковок вместе с инструкцией по применению помещают в картонную пачку. Срок годности:4 года. Не применять по истечении срока годности, указанного на упаковке. При уничтожении неиспользованных упаковок препарата специальных мер предосторожностей не требуется. Владелец рег.удостоверения:ОБОЛЕНСКОЕ ФАРМАЦЕВТИЧЕСКОЕ ПРЕДПРИЯТИЕ, ЗАО Производитель:ОБОЛЕНСКОЕ ФАРМАЦЕВТИЧЕСКОЕ ПРЕДПРИЯТИЕ, ЗАО. Представительство
Модель:
RUR 998
Показания — первичная гиперхолестеринемия, включая гетерозиготную семейную гиперхолестеринемию (гиперлипидемия IIа типа по классификации Фредриксона) или смешанная гиперхолестеринемия (гиперлипидемия IIb типа по классификации Фредриксона), гипертриглицеридемия (гиперлипидемия IV типа по классификации Фредриксона) в качестве дополнения к диете, когда диета и другие немедикаментозные методы лечения (например, физические упражнения, снижение массы тела) оказываются недостаточными. Противопоказания повышенная чувствительность к питавастатину, вспомогательным компонентам препарата и другим ингибиторам ГМГ-КоА-редуктазы (статинам); тяжелая печеночная недостаточность (более 9 баллов по шкале Чайлд-Пью) или класс С по классификации Чайлд-Пью, заболевания печени и активной фазе, включая стойкое повышение активности печеночных трансаминаз в сыворотке крови (более чем в 3 раза по сравнению с ВГН); миопатия; одновременный прием циклоспорина; беременность; период грудного вскармливания; отсутствие адекватных методов контрацепции у женщин детородного возраста; возраст до 18 лет (эффективность и безопасность не установлены). непереносимость лактозы, дефицит лактазы или глюкозо-галактозная мальабсорбция. С осторожностью При наличии риска развития миопатии/рабдомиолиза - почечная недостаточность, гипотиреоз, личный или семейный анамнез наследственных мышечных заболеваний и предшествующий анамнез мышечной токсичности при применении других ингибиторов ГМГ-КоА-редуктазы или фибратов, заболевания печени в анамнезе, злоупотребление алкоголем, возраст старше 70 лет. Применение при беременности и кормлении грудью Беременность Применение препарата Ливазо при беременности противопоказано. Женщинам детородного возраста при лечении Ливазо следует использовать надежные методы контрацепции. Т.к. холестерин и другие продукты биосинтеза холестерина необходимы для развития плода, потенциальный риск ингибировання ГМГ-КоА редуктазы превышает пользу oт лечения препаратом во время беременности. Исследования на животных показали, что питавастатин обладает репродуктивной токсичностью, но без тератогенного потенциала. Если пациентка планирует беременность, следует прекратить лечение как минимум за один месяц до зачатия. При наступлении беременности во время применения Ливазо. лечение следует немедленно прекратить. Период грудного вскармливания Применение препарата Ливазо в период грудного вскармливания противопоказано. Питавастатин выводится с молоком лактирующих крыс. Данные о выделении питавастатина с грудным молоком отсутствуют. При необходимости применения препарата Ливазо в период лактации грудное вскармливание необходимо прекратить. Применение при нарушениях функции печени Пациентам с легкими и умеренными нарушениями функции печени рекомендована максимальная суточная доза 2 мг. Запрещено применение препарата с тяжелой печеночной недостаточностью (более 9 баллов по шкале Чайлд-Пыо) или класс С по классификации Чайлд-Пыо, заболеваниями печени в активной фазе, включая стойкое повышение активности "печеночных" грансамнназ в сыворотке крови (более чем в 3 раза по сравнению с верхней границей нормы (ВГН)). Применение при нарушениях функции почек С осторожностью следует применять препарат при почечной недостаточности. Данные по применению максимальной суточной дозы препарата 4 мг при нарушениях функции почек любой степени тяжести ограничены, поэтому назначать максимальную суточную дозу 4 мг необходимо только при тщательном контроле функции почек после постепенного повышения дозы. Не рекомендуется пациентам с тяжелыми нарушениями функции почек назначать максимальную суточную дозу в 4 мг; рекомендуется рассмотреть ограничение максимальной суточной дозы до 2 мг при тяжелой почечной недостаточности. Применение у детей Запрещено применение препарата пациентам в возрасте до 18 лет (т.к. эффективность и безопасность не установлены). Применение у пожилых пациентов Пациентам пожилого возраста коррекция дозы не требуется. Применение и дозы Внутрь, таблетки необходимо проглатывать целиком. Предпочтителен прием таблетки в одно и то же время суток, лучше вечером, в соответствии с циркадным ритмом липидного обмена. До начала лечения и в процессе пациенты должны придерживаться гипохолестеринемической диеты. Начальная доза препарата 1 мг/сут однократно. При необходимости дозу препарата увеличивают с интервалами не менее 4 недель до 2 мг/сут. Дозу следует подбирать индивидуально в соответствии с концентрациями ХС ЛПНП, целью лечения и ответом пациента на лечение. Большинству пациентов требуется доза 2 мг. Максимальная суточная доза - 4 мг. Пациенты с легкими и умеренными нарушениями функции печени: рекомендована максимальная суточная доза 2 мг. Пациенты с нарушением функции почек: при нарушении функции почек легкой степени тяжести (желательно объективно оценить данную степень с отражением КК или СКФ), препарат Ливазо следует применять с осторожностью. Данные по применению максимальной суточной дозы препарата 4 мг при нарушениях функции почек любой степени тяжести ограничены, поэтому назначать максимальную суточную дозу 4 мг необходимо только при тщательном контроле функции почек после постепенного повышения дозы. Не рекомендуется пациентам с тяжелыми нарушениями функции почек назначать максимальную суточную дозу в 4 мг; рекомендуется рассмотреть ограничение максимальной суточной дозы до 2 мг при тяжелой почечной недостаточности. Пациенты пожилого возраста: коррекция дозы не требуется. Побочные эффекты и передозировка В контролируемых клинических исследованиях при приеме рекомендованных доз менее 4% пациентов, получавших лечение препаратом Лнвазо. было исключено из исследования в связи с развитием нежелательных реакций. Наиболее распространенной была миалгия. В зависимости от частоты возникновения выделяют следующие нежелательные реакции в соответствии с классификацией ВОЗ: очень часто ( 10), часто (от 1/100 до < 1/10), нечасто (от 1/1000 до < ь 1/100), редко (от 1/10 000 до < 1/10 000), очень редко (< 1/10 000) и частота неизвестна (имеющиеся данные не позволяют определить частоту). Со стороны органов кроветворения: нечасто - анемия. Со стороны обмена веществ: нечасто - анорексия. Нарушение психики: часто - бессонница. Со стороны нервной системы: часто - головная боль; нечасто - головокружение, нарушение вкуса, сонливость. Со стороны органов чувств: нечасто - звон в ушах; редко - снижение остроты зрения. Со стороны кожных покровов: нечасто - кожный зуд, супь; редко - крапивница, эритема. Со стороны костно-мышечной системы: часто - миалгия, артралгия; нечасто - мышечные спазмы. Со стороны мочевыделительной системы: нечасто - поллакиурия. Со стороны пищеварительной системы: часто - запор, диарея, диспепсия, тошнота; нечасто - боли в животе, сухость слизистой оболочки полости рта, рвота; редко - глоссодиния, острый панкреатит, холестатическая желтуха. Нежелательные явления при применении других статинов: нарушение сна, включая кошмарные сновидения; сексуальная дисфункция; депрессия; интерстициальное заболевание легких; сахарный диабет: частота возникновения зависит от наличия или отсутствия факторов риска (концентрация глюкозы в крови натощак 5 ммоль/л, ИМТ>30 кг/м 2, повышенная концентрация ТГ, артериальная гипертензия в анамнезе); повышение гликозилированного гемоглобина. Фармакологическое действие и фармакокинетика Всасывание Питавастатин быстро всасывается в верхних отделах ЖКТ, Сmax в плазме крови достигается в течение 1 ч после приема препарата. Прием пищи не влияет на абсорбцию. Сmax питавастатина в плазме крови снижается на 43% при совместном приеме с жирной пищей, но AUC остается неизменной. Неизменный препарат подвергается кишечно-печеночной рециркуляции и хорошо абсорбируется из тощей и подвздошной кишки. Абсолютная биодоступность питавастатина составляет 51%. Распределение Более 99% питавастатина связывается с белками плазмы крови, в основном с альбумином и альфа-1 кислым гликопротеином. Средний Vd 133 л. Питавастатин активно проникает в гепатоциты при помощи транспортных белков OATP1B1 и OATP1B3. AUC варьирует в пределах 4-кратного увеличения от минимального до максимального значения. Питавастатин не является субстратом для Р-гликопротеина. Метаболизм В плазме содержится в основном неизмененный питавастатин. Основным метаболитом является неактивный лактон, который образуется из конъюгата питавастатин глюкуронида эфирного типа с участием УДФ-глюкуронозилтрансфераз (UGT1A3 и 2В7). Цитохром Р450 влияет на метаболизм питавастатина минимально. Изофермент CYP2C9 (и в меньшей степени изофермент CYP2C8) участвуют в метаболизме питавастатина до второстепенных метаболитов. Выведение Питавастатин в неизмененном виде быстро выводится из печени с желчью, но подвергается кишечно-печеночной рециркуляции, обеспечивающей его длительный эффект. Менее 5% питавастатина выводится почками. T1/2 из плазмы варьирует от 5.7 ч (однократный прием) до 8.9 ч (в равновесном состоянии), среднее значение клиренса - 43.4 л/ч после однократного приема внутрь. Фармакокинетика у различных групп пациентов Пациенты пожилого возраста: при оценке фармакокинетики питавастатнна у пациентов пожилого возраста старше 65 лет AUC питавастатина была в 1.3 раза выше. Это не повлияло на эффективность или безопасность. Печеночная недостаточность: у пациентов с легкими нарушениями функции печени (класс А по классификации Чайлд-Пью) AUC была в 1.6 раз выше чем у здоровых добровольцев, в то время как у пациентов с умеренным нарушением функции печени (класс В по классификации Чайлд-Пью) AUC была в 3.9 раз выше. При выраженном нарушении функции печени применение питавастатина противопоказано. Почечная недостаточность: у пациентов с умеренной почечной недостаточностью и находящихся на гемодиализе, отмечалось увеличение AUC и 1.8 раз и 1.7 раз соответственно. Половые различия: отмечено увеличение AUC у женщин по сравнению с мужчинами в 1.6 раз в исследовании здоровых добровольцев, что никак не сказывалось на эффективности и безопасности препарата Ливазо. Расовая принадлежность: по результатам фармакокинетического анализа данных, полученных у здоровых добровольцев разной расовой принадлежности (японская и европеоидная популяции), такие факторы как пол и возраст не влияли на фармакокинетику питавастатина. Особые указания Воздействие на мышечную ткань Как и при применении других ингибиторов ГМГ-КоА редуктазы (статинов), существует вероятность развития миалгии, миопатии и, в редких случаях, рабдомиолиза. Следует предупредить пациентов о необходимости сообщать о любых мышечных симптомах. Активность КФК следует определять у любого пациента, сообщающего о мышечной боли, болезненности мышц при пальпации или слабости, особенно если это сопровождаются недомоганием или лихорадкой. Активность КФК не следует определять после физических нагрузок или при наличии каких-либо других возможных причин повышения КФК, которые могут исказить результат. При повышении активности КФК (в 5 раз выше ВГН), в течение 5-7 дней следует выполнить контрольный анализ. Отмечены очень редкие случаи иммуноопосредованной некротизирующей миопатии (ИОНМ) во время лечения или при прекращении приема статинов. ИОНМ клинически проявляется в виде стойкой слабости проксимальных мышц и повышения активности КФК в сыворотке крови, которые сохраняются несмотря на отмену статинов. До лечения Как и все статины Ливазо следует с осторожностью назначать пациентам, имеющим предрасполагающие факторы развития рабдомиолиза. Следует определить активность КФК для установления контрольного исходного значения в следующих случаях: почечная недостаточность; гипотиреоз; личный или семейный анамнез наследственных мышечных заболеваний; предшествующий анамнез мышечной токсичности при лечении фибратами или другими статинами; наличие в анамнезе заболеваний печени или злоупотребления алкоголем; пациентам пожилого возраста (старше 70 лет) с другими предрасполагающими факторами риска развития рабдомиолиза. В таких случаях рекомендован клинический мониторинг, и риск лечения следует рассматривать в зависимости от возможной пользы. Лечение Ливазо нельзя начинать, если показатели КФК в 5 раз превышают ВГН. Во время течения Следует рекомендовать пациенту немедленно сообщать врачу о мышечной боли, слабости или судорогах. Следует определить активность КФК, и лечение прекратить, если активность КФК повышена (в 5 раз выше ВГН). Следует рассмотреть, вопрос о прекращении лечения при возникновении тяжелых мышечных симптомов, даже если активность КФК не превышает ВГН в 5 раз. При разрешении симптомов и возвращении активности КФК к норме, может быть рассмотрен вопрос о повторном назначении Ливазо в дозе 1 мг при соблюдении тщательного контроля. Воздействие на печень Как и все статины, Ливазо следует с осторожностью назначать пациентам, имеющим в анамнезе заболевания печени, или пациентам, регулярно употребляющим избыточное количество алкоголя. Перед началом лечения Ливазо и затем периодически во время лечения следует проводить функциональные печеночные пробы. Пациентам со стойким повышением активности печеночных трансаминаз (AЛT и ACT), превышающим ВГН в 3 раза, следует прекратить лечение Ливазо. Воздействие на почки Ливазо следует с осторожностью назначать пациентам с почечной недостаточностью умеренной или тяжелой степени. Повышать дозу следует только при тщательном контроле. Доза 4 мг не рекомендована пациентам с тяжелой почечной недостаточностью. Сахарный диабет Некоторые данные свидетельствуют о том, что статины, как класс, вызывают увеличение концентрации глюкозы в крови, повышая риск развития сахарного диабета в будущем, а у некоторых пациентов с высоким риском развития сахарного диабета могут привести к уровню гилергликемии, при котором необходимо соответствующее лечение сахарного диабета. Тем не менее, эта опасность перевешивается снижением сосудистого риска при лечении статинами, и поэтому не должна являться причиной для прекращения лечения статинами. За пациентами, имеющими риск развития гипергликемии (концентрация глюкозы натощак от 5.6 до 6.9 ммоль/л, ИМТ>30 кг/м 2, повышенную концентрацию ТГ, артериальную гипертензию), необходим клинический и биохимический контроль в соответствии с национальными рекомендациями. Вместе с тем, по результатам как постмаркетинговых наблюдений для оценки безопасности, так и проспективных исследований не было выявлено никаких подтвержденных сигналов о риске сахарного диабета при применении питавастатина. Интерстициальное заболевание легких Редкие случаи интерстициального заболевания легких регистрировали при применении некоторых статинов, особенно при длительной терапии. Наблюдаемые клинические признаки включают одышку, непродуктивный кашель и ухудшение общего состояния здоровья (повышенная утомляемость, потеря массы тела и лихорадка). При подозрении на развитие интерстициального заболевания легких, терапию статинами следует прекратить. Влияние на способность к управлению транспортными средствами и механизмов Необходимо соблюдать осторожность при управлении транспортными средствами или выполнении другой работы, требующей повышенного внимания, поскольку возможно развитие таких нежелательных реакций как головокружение и сонливость. Передозировка Специфического лечения при передозировке нет. Необходимо провести симптоматическую терапию, контролировать активность КФК и функцию печени. Гемодиализ неэффективен. Лекарственное взаимодействие Питавастатин активно транспортируется в гепатоциты человека многочисленными печеночными транспортерами (включая транспортный полипептид органических анионов (OATP)), которые могут быть включены во взаимодействие с некоторыми из следующих препаратов. Циклоспорин: одновременный прием однократной дозы циклоспорина с питавастатином в равновесном состоянии приводит к 4.6-кратному увеличению AUC питавастатина. Влияние равновесного состояния на равновесное состояние питавастатина неизвестно. Препарат Ливазо противопоказан пациентам, получающим лечение циклоспорином. Эритромицин: одновременный прием эритромицина с питавастатином приводит к 2.8-кратному увеличению AUC питавастатина. Рекомендовано временное прекращение приема питавастатина во время лечения эритромицином или другими антибиотиками группы макролидов. Гемфиброзил и другие фибраты: в редких случаях монотерапию фибратами связывали с развитием миопатии. Одновременное применение фибратов со статинами связывали с увеличением частоты возникновения миопатии и рабдомиолиза. Следует соблюдать осторожность при одновременном применении питавастатина с фибратами. В исследованиях фармакокинетики одновременное применение питавастатина с гемфиброзилом приводило к 1.4-кратному увеличению AUC питавастатина и увеличению AUC фенофибрата в 1.2 раза. Никотиновая кислота (в липидснижающих дозах): исследование взаимодействия при лечении питавастатином и никотиновой кислоты в липидснижающих дозах (более 1 г/сут) не проводилось. Применение никотиновой кислоты в монотерапии связывали с развитием миопатии и рабдомиолиза. Поэтому при одновременном применении с никотиновой кислотой в липидснижающих дозах (более 1 г/сут) препарат Ливазо следует назначать с осторожностью. Фузидовая кислота: были зарегистрированы тяжелые мышечные нарушения, такие как рабдомиолиз, которые приписывали взаимодействию между фузидовой кислотой и статинами. Во время лечения фузидовой кислотой рекомендовано временно прекратить применение Ливазо. Рифампицин: одновременное назначение с питавастатином привело к 1.3-кратному увеличению AUC питавастатина. Ингибиторы протеазы ВИЧ: одновременное назначение с питавастатином привело к незначительным изменениям AUC питавастатина. Условия хранения и отпуска из аптек Препарат отпускается по рецепту. Регистрационные данные Международное непатентованное название питавастатин Форма выпуска. Таблетки Состав. Таблетки, покрытые пленочной оболочкой белого цвета, круглые, двояковыпуклые, на поперечном срезе ядро белого цвета; на одной стороне таблетки - гравировка "KC", на другой - гравировка "1". 1 таб. питавастатин кальция 1.045 мг, что соответствует содержанию питавастатина 1 мг Вспомогательные вещества: лактозы моногидрат - 63.085 мг, гипролоза низкозамещенная - 12.54 мг, гипромеллоза - 1.33 мг, магния алюмометасиликат - 1.6 мг, магния стеарат - 0.4 мг. Состав пленочной оболочки: Опадрай белый - 3 мг (гипромеллоза - 1.98 мг, титана диоксид - 0.8 мг, триэтилацетат - 0.2 мг, кремния диоксид коллоидный - 0.02 мг). АТХ:C10AA08 Питавастатин Регистрация Лекарственное средство ЛП-002855 от 09.02.15 Владелец рег.удостоверения:Рекордати . Производитель:PIERRE FABRE MEDICAMENT PRODUCTION Представительство: Фармгруппа: Гиполипидемическое средство

Модель:
RUR 294
Показания Дисульфирам используется в качестве вспомогательной терапии хронического алкоголизма у пациентов, проходящих лечение по поводу алкогольной зависимости, которые намерены находиться в состоянии воздержания от алкоголя с целью достижения наилучшего эффекта поддерживающей и психотерапии. Дисульфирам не излечивает алкоголизм. При использовании в качестве монотерапии, без соответствующей мотивации и поддерживающего лечения не оказывает значимого влияния на алкогольное поведение у лиц с хроническим алкоголизмом. Противопоказания Противопоказания Гиперчувствительность, тиреотоксикоз, заболевания сердечно - сосудистой системы (в т.ч, резко выраженный кардиосклероз, атеросклероз мозговых сосудов, тяжелое поражение миокарда, пред- и постинфарктные состояния, аневризма аорты, окклюзия коронарных сосудов, артериальная гипертензия II-III стадии и другие заболевания сердечно - сосудистой системы в стадии декомпенсации), хроническая обструктивная болезнь легких, туберкулез легких с кровохарканьем, бронхиальная астма, выраженная эмфизема легких, эрозивные поражения слизистой желудочно - кишечного тракта, язвенная болезнь желудка и двенадцатиперстной кишки (в стадии обострения), кровотечение из желудочно - кишечного тракта, болезни почек, печеночная недостаточность, сахарный диабет, эпилепсия, инфекционные заболевания центральной нервной системы, полинейропатия, неврит слухового и глазного нервов, глаукома, злокачественные опухоли, беременность, период лактации. В отдельных случаях, при длительном приеме тетурама могут наблюдаться острые психозы, напоминающие острый алкогольный параноид, острый алкогольный галлюциноз или алкогольный делирий. Возможен переход галлюцинаторного синдрома в параноидный, параноидного - в шизофреноподобный и т. д. Одновременный (или в недавнем прошлом) прием метронидазола, паральдегида, этанола или этанолсодержащих лекарственных средств и продуктов. Детский возраст до 18 лет. С осторожностью: Пациенты в возрасте старше 60 лет, язвенная болезнь желудка и двенадцатиперстной кишки (в стадии ремиссии), эндартериит, остаточные явления нарушения мозгового кровообращения, психозы на фоне приема дисульфирама в анамнезе. Беременность Противопоказано применять препарат при беременности и в период кормления грудью. Применение и дозы Перед началом лечения длительность воздержания от приема алкоголя должна составлять не менее 12 часов. Режим дозирования в начале терапии В течение 1 -2 первых недель лечения разовая доза дисульфирама должна составлять не более 500 мг/сутки. Препарат принимают утром натощак, перед завтраком. Обычно дисульфирам принимают в утренние часы, однако в случае появления седативного эффекта, препарат может назначаться на ночь. Чтобы минимизировать или устранить седативный эффект, доза может быть скорректирована в сторону понижения. Поддерживающая терапия Средняя поддерживающая доза составляет 250 мг/с (диапазон от 125 до 500 мг), максимальная суточная доза 500 мг. Продолжительность терапии Ежедневный регулярный прием дисульфирама должен продолжаться до полного выздоровления пациента, когда он может осуществлять самоконтроль за употреблением алкоголя. Прием препарата должен продолжаться до достижения устойчивой ремиссии. Побочные эффекты и передозировка Побочные эффекты: "Металлический" привкус во рту, неприятный запах (обусловленный сероуглеродом) у больных с колостомой, гепатит, неврит зрительного нерва, периферический неврит, полиневропатия нижних конечностей, нервно-психические расстройства, снижение памяти, дезориентация во времени и пространстве, астенический синдром, головная боль, кожные аллергические реакции. Побочные эффекты, обусловленные ассоциацией дисульфирамэтанол: коллапс, аритмия, стенокардия, инфаркт миокарда, отек мозга, кровоизлияние в мозг. Передозировка: Симптомы: спутанность сознания, коллапс, коматозное состояние, неврологические осложнения. Специфического лечения передозировки Дисульфирама нет. При тяжелой дисульфирам-алкогольной реакции продолжительностью 1,5 ч применяют оксигенотерапию, вдыхание карбогена (смесь 95 % кислорода и 5 % углекислого газа), в/в вводят высокие дозы аскорбиновой кислоты (до 1 г), эфедрина сульфат и антигистаминные препараты. Необходимо мониторировать концентрацию калия в сыворотке крови, особенно в тех случаях, если пациент принимает препараты наперстянки. Взаимодействие с другими ЛС: Дисульфирам следует назначать с осторожностью пациентам, принимающим фенитоин и его производные, так как одновременный прием препаратов может привести к интоксикации фенитоином. Перед назначением дисульфирама, больным, принимающим фенитоин, следует определять базовый уровень фенитоина в сыворотке крови и в последующем осуществлять контроль содержания фенитоина в крови с целью коррекции дозы препарата. Дисульфирам усиливает эффект непрямых антикоагулянтов и увеличивает риск кровотечений. В случае одновременного назначения с пероральными антикоагулянтами, необходимо осуществлять более частый контроль содержания протромбина и коррекцию доз антикоагулянтов. Необходимо также корректировать дозу дисульфирама в начале и после окончания курса терапии, так как дисульфирам может удлинять протромбиновое время. Эффекты дисульфирама, в т.ч. нейротоксические, усиливают трициклические антидепрессанты (амитриптилин), метронидазол, изониазид. Метронидазол повышает риск развития нарушений психики, возникновение бреда. При одновременном назначении с изониазидом повышается риск возникновения нарушений поведения и координации движений. При выявлении этих признаков прием дисульфирами должен быть прекращен. Дисульфирам повышает концентрацию в плазме препаратов, метаболизи-рующихся в печени, вследствие ингибирования микросомальных ферментов печени. Усиливает токсические эффекты феназона, хлордиазепоксида и диазепама путем ингибирования их метаболизма. Аскорбиновая кислота снижает реакцию на этанол. Фармакологическое действие и фармакокинетика Дисульфирам ингибирует фермент ацетальдегиддегидрогеназу участвующий в метаболизме этанола, что приводит к увеличению концентрации ацетальдегида, являющегося метаболитом этанола, в 5-10 раз. Ацетальдегид вызывает ряд неприятных ощущений: "приливы" крови к коже лица, тошноту, рвоту, чувство недомогания, тахикардию, понижение артериального давления. В результате происходит выработка условно-рефлекторной реакции отвращения к вкусу и запаху спиртных напитков. Сила реакций вызванных препаратом пропорциональна принятой дозе. Максимальный терапевтический эффект достигается через 12 часов после перорального приема и может продолжаться в течение 10-14 дней после прекращения лечения. Чем длительнее курс терапии, тем более выражены эффекты препарата. Фармакокинетика: Абсорбция после перорального приема - 70-90 %. Быстро метаболизируется в печени путем восстановления в диэтилдитиокарбамат, выделяемый в виде глюкуронида почками, или трансформируется в диэтиламин и сероуглерод, пропорция которого варьирует от 4 до 53 %. Последний выделяется через легкие. Минимальное содержание дисульфирама в крови - около 20 нг/мл. Особые указания Препарат ни в коем случае нельзя принимать в состоянии алкогольной интоксикации. Недопустимо назначение препарата без уведомления пациента. Родственники пациента должны быть проинструктированы врачом об особенностях применения препарата. Дисульфирам с особой осторожностью следует применять при следующих сопутствующих заболеваниях: сахарный диабет, гипотиреоз, эпилепсия, хронический и острый нефрит, а также у пациентов в возрасте старше 65 лет. Зарегистрированы данные о гепатотоксичности препарата, включая печеночную недостаточность, требующую трансплантации печени или заканчивающуюся смертельным исходом. Тяжелые, а иногда летальные гепатиты, вызванные терапией дисульфирамом, могут развиться спустя много месяцев после завершения лечения препаратом. Пациента необходимо предупредить о необходимости сообщать врачу обо всех ранних симптомах проявления гепатита, таких как быстрая утомляемость, слабость, недомогание, снижение аппетита, тошнота, рвота, желтуха, появление мочи темного цвета. Каждые 10-14 дней с момента начала терапии дисульфирамом пациенту следует проводить контрольное исследование параметров функции печени, включая общий и биохимический анализ крови. Пациенты, принимающие дисульфирам не должны подвергаться воздействию этилендибромида и его паров. Результаты исследований на крысах продемонстрировали, что ингаляционное введение этилендибромида при применении дисульфирама повышает развитие опухолей и смертность у крыс. Аналогичных данных о действии паров диэтилбромида на пациентов нет. Реакция взаимодействия алкоголя и дисульфирама:Пациент должен быть проинформирован обо всех последствиях употребления алкоголя во время лечения дисульфирамом. Пациент должен быть предупрежден о недопустимости тайного употребления алкоголя, а также алкоголя в составе пищевых продуктов (соусы), лекарственных препаратов (спир-тсодержащие лекарственные средства), парфюмерии. Употребление алкоголя одновременно с дисульфирамом, даже в небольших количествах вызывает покраснение лица, пульсацию в области головы и шеи, пульсирующую головную боль, затруднение дыхания, тошноту, обильную рвоту, потливость, жажду, боль за грудиной, учащение сердцебиения, одышку, снижение артериального давления, слабость, спутанность и потерю сознания, выраженное беспокойство, головокружение, нарушение зрения. В тяжелых случаях может развиться угнетение дыхания, сердечнососудистая недостаточность, судороги и смерть. Интенсивность реакции индивидуальна, но, как правило, пропорциональна принятому внутрь количеству алкоголя и дисульфирама. Начальные проявления реакции могут отмечаться у лиц с повышенной чувствительностью при увеличении концентрации алкоголя всего до 5-10 мг в 100 мл крови. Полное развитие симптомов развивается при концентрации алкоголя 50 мг в 100 мл. крови. При уровне алкоголя в крови от 125 мг до 150 мг на 100 мл отмечается потеря сознания. Продолжительность реакции варьирует от 30 - 60 мин до нескольких часов: в более тяжелых случаях - до тех пор, пока алкоголь определяется в крови. Влияние на способность управлять транспортными средствами: Препарат влияет на способность управлять транспортными средствами или работу с другими механизмами. Условия хранения и отпуска из аптек Условия хранения:Хранить в защищенном от влаги и света месте при температуре не выше 25 °С. Хранить в недоступном для детей месте. Отпуск из аптек: По рецепту Регистрационные данные Торговое название Тетурам Международное непатентованное название:Дисульфирам. Форма выпуска:Таблетки. Состав:В одной таблетке содержится:Активное вещество: дисульфирам - 150 мг. Вспомогательные вещества: крахмал картофельный - 2,70 мг, целлюлоза микрокристаллическая - 23,80 мг, кремния диоксид коллоидный - 0,85 мг, кроскармеллоза натрия - 0,85 мг, стеариновая кислота - 0,36 мг, магния стеарат - 1,44 мг. АТХ: Регистрация: Лекарственное средство ЛС-000545 Фармгруппа: Средство для лечения алкоголизма. Дата регистрации: 29.06.2010/26.07.2013. Окончание регстрации: . Описание:Круглые, плоскоцилиндрические таблетки белого или белого со слегка желтовато-зеленоватым оттенком цвета, с фаской. Упаковка:Таблетки по 150 мг. По 10 таблеток в контурную ячейковую упаковку из пленки поливинилхлоридной и фольги алюминиевой печатной лакированной. По 3 или 5 контурных ячейковых упаковок вместе с инструкцией по применению помещают в пачку из картона. Срок годности:4 года. Не использовать препарат после даты, указанной на упаковке. Владелец рег.удостоверения:АВВА РУС, ОАО Производитель:АВВА РУС, ОАО. Представительство
Модель:
RUR 1681
Показания — первичная гиперхолестеринемия, включая гетерозиготную семейную гиперхолестеринемию (гиперлипидемия IIа типа по классификации Фредриксона) или смешанная гиперхолестеринемия (гиперлипидемия IIb типа по классификации Фредриксона), гипертриглицеридемия (гиперлипидемия IV типа по классификации Фредриксона) в качестве дополнения к диете, когда диета и другие немедикаментозные методы лечения (например, физические упражнения, снижение массы тела) оказываются недостаточными. Противопоказания повышенная чувствительность к питавастатину, вспомогательным компонентам препарата и другим ингибиторам ГМГ-КоА-редуктазы (статинам); тяжелая печеночная недостаточность (более 9 баллов по шкале Чайлд-Пью) или класс С по классификации Чайлд-Пью, заболевания печени и активной фазе, включая стойкое повышение активности печеночных трансаминаз в сыворотке крови (более чем в 3 раза по сравнению с ВГН); миопатия; одновременный прием циклоспорина; беременность; период грудного вскармливания; отсутствие адекватных методов контрацепции у женщин детородного возраста; возраст до 18 лет (эффективность и безопасность не установлены). непереносимость лактозы, дефицит лактазы или глюкозо-галактозная мальабсорбция. С осторожностью При наличии риска развития миопатии/рабдомиолиза - почечная недостаточность, гипотиреоз, личный или семейный анамнез наследственных мышечных заболеваний и предшествующий анамнез мышечной токсичности при применении других ингибиторов ГМГ-КоА-редуктазы или фибратов, заболевания печени в анамнезе, злоупотребление алкоголем, возраст старше 70 лет. Применение при беременности и кормлении грудью Беременность Применение препарата Ливазо при беременности противопоказано. Женщинам детородного возраста при лечении Ливазо следует использовать надежные методы контрацепции. Т.к. холестерин и другие продукты биосинтеза холестерина необходимы для развития плода, потенциальный риск ингибировання ГМГ-КоА редуктазы превышает пользу oт лечения препаратом во время беременности. Исследования на животных показали, что питавастатин обладает репродуктивной токсичностью, но без тератогенного потенциала. Если пациентка планирует беременность, следует прекратить лечение как минимум за один месяц до зачатия. При наступлении беременности во время применения Ливазо. лечение следует немедленно прекратить. Период грудного вскармливания Применение препарата Ливазо в период грудного вскармливания противопоказано. Питавастатин выводится с молоком лактирующих крыс. Данные о выделении питавастатина с грудным молоком отсутствуют. При необходимости применения препарата Ливазо в период лактации грудное вскармливание необходимо прекратить. Применение при нарушениях функции печени Пациентам с легкими и умеренными нарушениями функции печени рекомендована максимальная суточная доза 2 мг. Запрещено применение препарата с тяжелой печеночной недостаточностью (более 9 баллов по шкале Чайлд-Пыо) или класс С по классификации Чайлд-Пыо, заболеваниями печени в активной фазе, включая стойкое повышение активности "печеночных" грансамнназ в сыворотке крови (более чем в 3 раза по сравнению с верхней границей нормы (ВГН)). Применение при нарушениях функции почек С осторожностью следует применять препарат при почечной недостаточности. Данные по применению максимальной суточной дозы препарата 4 мг при нарушениях функции почек любой степени тяжести ограничены, поэтому назначать максимальную суточную дозу 4 мг необходимо только при тщательном контроле функции почек после постепенного повышения дозы. Не рекомендуется пациентам с тяжелыми нарушениями функции почек назначать максимальную суточную дозу в 4 мг; рекомендуется рассмотреть ограничение максимальной суточной дозы до 2 мг при тяжелой почечной недостаточности. Применение у детей Запрещено применение препарата пациентам в возрасте до 18 лет (т.к. эффективность и безопасность не установлены). Применение у пожилых пациентов Пациентам пожилого возраста коррекция дозы не требуется. Применение и дозы Внутрь, таблетки необходимо проглатывать целиком. Предпочтителен прием таблетки в одно и то же время суток, лучше вечером, в соответствии с циркадным ритмом липидного обмена. До начала лечения и в процессе пациенты должны придерживаться гипохолестеринемической диеты. Начальная доза препарата 1 мг/сут однократно. При необходимости дозу препарата увеличивают с интервалами не менее 4 недель до 2 мг/сут. Дозу следует подбирать индивидуально в соответствии с концентрациями ХС ЛПНП, целью лечения и ответом пациента на лечение. Большинству пациентов требуется доза 2 мг. Максимальная суточная доза - 4 мг. Пациенты с легкими и умеренными нарушениями функции печени: рекомендована максимальная суточная доза 2 мг. Пациенты с нарушением функции почек: при нарушении функции почек легкой степени тяжести (желательно объективно оценить данную степень с отражением КК или СКФ), препарат Ливазо следует применять с осторожностью. Данные по применению максимальной суточной дозы препарата 4 мг при нарушениях функции почек любой степени тяжести ограничены, поэтому назначать максимальную суточную дозу 4 мг необходимо только при тщательном контроле функции почек после постепенного повышения дозы. Не рекомендуется пациентам с тяжелыми нарушениями функции почек назначать максимальную суточную дозу в 4 мг; рекомендуется рассмотреть ограничение максимальной суточной дозы до 2 мг при тяжелой почечной недостаточности. Пациенты пожилого возраста: коррекция дозы не требуется. Побочные эффекты и передозировка В контролируемых клинических исследованиях при приеме рекомендованных доз менее 4% пациентов, получавших лечение препаратом Лнвазо. было исключено из исследования в связи с развитием нежелательных реакций. Наиболее распространенной была миалгия. В зависимости от частоты возникновения выделяют следующие нежелательные реакции в соответствии с классификацией ВОЗ: очень часто ( 10), часто (от 1/100 до < 1/10), нечасто (от 1/1000 до < ь 1/100), редко (от 1/10 000 до < 1/10 000), очень редко (< 1/10 000) и частота неизвестна (имеющиеся данные не позволяют определить частоту). Со стороны органов кроветворения: нечасто - анемия. Со стороны обмена веществ: нечасто - анорексия. Нарушение психики: часто - бессонница. Со стороны нервной системы: часто - головная боль; нечасто - головокружение, нарушение вкуса, сонливость. Со стороны органов чувств: нечасто - звон в ушах; редко - снижение остроты зрения. Со стороны кожных покровов: нечасто - кожный зуд, супь; редко - крапивница, эритема. Со стороны костно-мышечной системы: часто - миалгия, артралгия; нечасто - мышечные спазмы. Со стороны мочевыделительной системы: нечасто - поллакиурия. Со стороны пищеварительной системы: часто - запор, диарея, диспепсия, тошнота; нечасто - боли в животе, сухость слизистой оболочки полости рта, рвота; редко - глоссодиния, острый панкреатит, холестатическая желтуха. Нежелательные явления при применении других статинов: нарушение сна, включая кошмарные сновидения; сексуальная дисфункция; депрессия; интерстициальное заболевание легких; сахарный диабет: частота возникновения зависит от наличия или отсутствия факторов риска (концентрация глюкозы в крови натощак 5 ммоль/л, ИМТ>30 кг/м 2, повышенная концентрация ТГ, артериальная гипертензия в анамнезе); повышение гликозилированного гемоглобина. Фармакологическое действие и фармакокинетика Всасывание Питавастатин быстро всасывается в верхних отделах ЖКТ, Сmax в плазме крови достигается в течение 1 ч после приема препарата. Прием пищи не влияет на абсорбцию. Сmax питавастатина в плазме крови снижается на 43% при совместном приеме с жирной пищей, но AUC остается неизменной. Неизменный препарат подвергается кишечно-печеночной рециркуляции и хорошо абсорбируется из тощей и подвздошной кишки. Абсолютная биодоступность питавастатина составляет 51%. Распределение Более 99% питавастатина связывается с белками плазмы крови, в основном с альбумином и альфа-1 кислым гликопротеином. Средний Vd 133 л. Питавастатин активно проникает в гепатоциты при помощи транспортных белков OATP1B1 и OATP1B3. AUC варьирует в пределах 4-кратного увеличения от минимального до максимального значения. Питавастатин не является субстратом для Р-гликопротеина. Метаболизм В плазме содержится в основном неизмененный питавастатин. Основным метаболитом является неактивный лактон, который образуется из конъюгата питавастатин глюкуронида эфирного типа с участием УДФ-глюкуронозилтрансфераз (UGT1A3 и 2В7). Цитохром Р450 влияет на метаболизм питавастатина минимально. Изофермент CYP2C9 (и в меньшей степени изофермент CYP2C8) участвуют в метаболизме питавастатина до второстепенных метаболитов. Выведение Питавастатин в неизмененном виде быстро выводится из печени с желчью, но подвергается кишечно-печеночной рециркуляции, обеспечивающей его длительный эффект. Менее 5% питавастатина выводится почками. T1/2 из плазмы варьирует от 5.7 ч (однократный прием) до 8.9 ч (в равновесном состоянии), среднее значение клиренса - 43.4 л/ч после однократного приема внутрь. Фармакокинетика у различных групп пациентов Пациенты пожилого возраста: при оценке фармакокинетики питавастатнна у пациентов пожилого возраста старше 65 лет AUC питавастатина была в 1.3 раза выше. Это не повлияло на эффективность или безопасность. Печеночная недостаточность: у пациентов с легкими нарушениями функции печени (класс А по классификации Чайлд-Пью) AUC была в 1.6 раз выше чем у здоровых добровольцев, в то время как у пациентов с умеренным нарушением функции печени (класс В по классификации Чайлд-Пью) AUC была в 3.9 раз выше. При выраженном нарушении функции печени применение питавастатина противопоказано. Почечная недостаточность: у пациентов с умеренной почечной недостаточностью и находящихся на гемодиализе, отмечалось увеличение AUC и 1.8 раз и 1.7 раз соответственно. Половые различия: отмечено увеличение AUC у женщин по сравнению с мужчинами в 1.6 раз в исследовании здоровых добровольцев, что никак не сказывалось на эффективности и безопасности препарата Ливазо. Расовая принадлежность: по результатам фармакокинетического анализа данных, полученных у здоровых добровольцев разной расовой принадлежности (японская и европеоидная популяции), такие факторы как пол и возраст не влияли на фармакокинетику питавастатина. Особые указания Воздействие на мышечную ткань Как и при применении других ингибиторов ГМГ-КоА редуктазы (статинов), существует вероятность развития миалгии, миопатии и, в редких случаях, рабдомиолиза. Следует предупредить пациентов о необходимости сообщать о любых мышечных симптомах. Активность КФК следует определять у любого пациента, сообщающего о мышечной боли, болезненности мышц при пальпации или слабости, особенно если это сопровождаются недомоганием или лихорадкой. Активность КФК не следует определять после физических нагрузок или при наличии каких-либо других возможных причин повышения КФК, которые могут исказить результат. При повышении активности КФК (в 5 раз выше ВГН), в течение 5-7 дней следует выполнить контрольный анализ. Отмечены очень редкие случаи иммуноопосредованной некротизирующей миопатии (ИОНМ) во время лечения или при прекращении приема статинов. ИОНМ клинически проявляется в виде стойкой слабости проксимальных мышц и повышения активности КФК в сыворотке крови, которые сохраняются несмотря на отмену статинов. До лечения Как и все статины Ливазо следует с осторожностью назначать пациентам, имеющим предрасполагающие факторы развития рабдомиолиза. Следует определить активность КФК для установления контрольного исходного значения в следующих случаях: почечная недостаточность; гипотиреоз; личный или семейный анамнез наследственных мышечных заболеваний; предшествующий анамнез мышечной токсичности при лечении фибратами или другими статинами; наличие в анамнезе заболеваний печени или злоупотребления алкоголем; пациентам пожилого возраста (старше 70 лет) с другими предрасполагающими факторами риска развития рабдомиолиза. В таких случаях рекомендован клинический мониторинг, и риск лечения следует рассматривать в зависимости от возможной пользы. Лечение Ливазо нельзя начинать, если показатели КФК в 5 раз превышают ВГН. Во время течения Следует рекомендовать пациенту немедленно сообщать врачу о мышечной боли, слабости или судорогах. Следует определить активность КФК, и лечение прекратить, если активность КФК повышена (в 5 раз выше ВГН). Следует рассмотреть, вопрос о прекращении лечения при возникновении тяжелых мышечных симптомов, даже если активность КФК не превышает ВГН в 5 раз. При разрешении симптомов и возвращении активности КФК к норме, может быть рассмотрен вопрос о повторном назначении Ливазо в дозе 1 мг при соблюдении тщательного контроля. Воздействие на печень Как и все статины, Ливазо следует с осторожностью назначать пациентам, имеющим в анамнезе заболевания печени, или пациентам, регулярно употребляющим избыточное количество алкоголя. Перед началом лечения Ливазо и затем периодически во время лечения следует проводить функциональные печеночные пробы. Пациентам со стойким повышением активности печеночных трансаминаз (AЛT и ACT), превышающим ВГН в 3 раза, следует прекратить лечение Ливазо. Воздействие на почки Ливазо следует с осторожностью назначать пациентам с почечной недостаточностью умеренной или тяжелой степени. Повышать дозу следует только при тщательном контроле. Доза 4 мг не рекомендована пациентам с тяжелой почечной недостаточностью. Сахарный диабет Некоторые данные свидетельствуют о том, что статины, как класс, вызывают увеличение концентрации глюкозы в крови, повышая риск развития сахарного диабета в будущем, а у некоторых пациентов с высоким риском развития сахарного диабета могут привести к уровню гилергликемии, при котором необходимо соответствующее лечение сахарного диабета. Тем не менее, эта опасность перевешивается снижением сосудистого риска при лечении статинами, и поэтому не должна являться причиной для прекращения лечения статинами. За пациентами, имеющими риск развития гипергликемии (концентрация глюкозы натощак от 5.6 до 6.9 ммоль/л, ИМТ>30 кг/м 2, повышенную концентрацию ТГ, артериальную гипертензию), необходим клинический и биохимический контроль в соответствии с национальными рекомендациями. Вместе с тем, по результатам как постмаркетинговых наблюдений для оценки безопасности, так и проспективных исследований не было выявлено никаких подтвержденных сигналов о риске сахарного диабета при применении питавастатина. Интерстициальное заболевание легких Редкие случаи интерстициального заболевания легких регистрировали при применении некоторых статинов, особенно при длительной терапии. Наблюдаемые клинические признаки включают одышку, непродуктивный кашель и ухудшение общего состояния здоровья (повышенная утомляемость, потеря массы тела и лихорадка). При подозрении на развитие интерстициального заболевания легких, терапию статинами следует прекратить. Влияние на способность к управлению транспортными средствами и механизмов Необходимо соблюдать осторожность при управлении транспортными средствами или выполнении другой работы, требующей повышенного внимания, поскольку возможно развитие таких нежелательных реакций как головокружение и сонливость. Передозировка Специфического лечения при передозировке нет. Необходимо провести симптоматическую терапию, контролировать активность КФК и функцию печени. Гемодиализ неэффективен. Лекарственное взаимодействие Питавастатин активно транспортируется в гепатоциты человека многочисленными печеночными транспортерами (включая транспортный полипептид органических анионов (OATP)), которые могут быть включены во взаимодействие с некоторыми из следующих препаратов. Циклоспорин: одновременный прием однократной дозы циклоспорина с питавастатином в равновесном состоянии приводит к 4.6-кратному увеличению AUC питавастатина. Влияние равновесного состояния на равновесное состояние питавастатина неизвестно. Препарат Ливазо противопоказан пациентам, получающим лечение циклоспорином. Эритромицин: одновременный прием эритромицина с питавастатином приводит к 2.8-кратному увеличению AUC питавастатина. Рекомендовано временное прекращение приема питавастатина во время лечения эритромицином или другими антибиотиками группы макролидов. Гемфиброзил и другие фибраты: в редких случаях монотерапию фибратами связывали с развитием миопатии. Одновременное применение фибратов со статинами связывали с увеличением частоты возникновения миопатии и рабдомиолиза. Следует соблюдать осторожность при одновременном применении питавастатина с фибратами. В исследованиях фармакокинетики одновременное применение питавастатина с гемфиброзилом приводило к 1.4-кратному увеличению AUC питавастатина и увеличению AUC фенофибрата в 1.2 раза. Никотиновая кислота (в липидснижающих дозах): исследование взаимодействия при лечении питавастатином и никотиновой кислоты в липидснижающих дозах (более 1 г/сут) не проводилось. Применение никотиновой кислоты в монотерапии связывали с развитием миопатии и рабдомиолиза. Поэтому при одновременном применении с никотиновой кислотой в липидснижающих дозах (более 1 г/сут) препарат Ливазо следует назначать с осторожностью. Фузидовая кислота: были зарегистрированы тяжелые мышечные нарушения, такие как рабдомиолиз, которые приписывали взаимодействию между фузидовой кислотой и статинами. Во время лечения фузидовой кислотой рекомендовано временно прекратить применение Ливазо. Рифампицин: одновременное назначение с питавастатином привело к 1.3-кратному увеличению AUC питавастатина. Ингибиторы протеазы ВИЧ: одновременное назначение с питавастатином привело к незначительным изменениям AUC питавастатина. Условия хранения и отпуска из аптек Препарат отпускается по рецепту. Регистрационные данные Международное непатентованное название питавастатин Форма выпуска. Таблетки Состав. Таблетки, покрытые пленочной оболочкой белого цвета, круглые, двояковыпуклые, на поперечном срезе ядро белого цвета; на одной стороне таблетки - гравировка "KC", на другой - гравировка "1". 1 таб. питавастатин кальция 1.045 мг, что соответствует содержанию питавастатина 1 мг Вспомогательные вещества: лактозы моногидрат - 63.085 мг, гипролоза низкозамещенная - 12.54 мг, гипромеллоза - 1.33 мг, магния алюмометасиликат - 1.6 мг, магния стеарат - 0.4 мг. Состав пленочной оболочки: Опадрай белый - 3 мг (гипромеллоза - 1.98 мг, титана диоксид - 0.8 мг, триэтилацетат - 0.2 мг, кремния диоксид коллоидный - 0.02 мг). АТХ:C10AA08 Питавастатин Регистрация Лекарственное средство ЛП-002855 от 09.02.15 Владелец рег.удостоверения:Рекордати . Производитель:PIERRE FABRE MEDICAMENT PRODUCTION Представительство: Фармгруппа: Гиполипидемическое средство
Модель:
RUR 1626
Показания Первичная гиперхолестеринемия (тип IIа по классификации Фредриксона), включая гетерозиготную наследственную гиперхолестеринемию или смешанная (комбинированная) гиперлипидемия (типа IIb по классификации Фредриксона), в качестве дополнения к диете и другимнемедикаментозным мероприятиям (физическая нагрузка и снижение массы тела)- Гомозиготная форма наследственной гиперхолестеринемии при недостаточной эффективности диетотерапии и других видов лечения, направленных на снижение концентрации липидов (например, ЛПНП-аферез) или, если такие виды лечения не подходят пациенту- Гипертриглицеридемия (тип IV по классификации Фредриксона) в качестве дополнения к диете- Для замедления прогрессирования атеросклероза в качестве дополнения к диете у пациентов, которым показана терапия для снижения концентрации общего холестерина и холестерина-ЛПНП- Первичная профилактика основных сердечно-сосудистых осложнений (инсульта, инфаркта, артериальной реваскуляризации) у взрослых пациентов без клинических признаков ишемической болезни сердца (ИБС), но с повышенным риском ее развития (возраст старше 50 лет для мужчин и старше 60 лет для женщин, повышенная концентрация С-реактивного белка ( 2 мг/л) при наличии, как минимум одного из дополнительных факторов риска, таких как артериальная гипертензия, низкая концентрация холестерина-ЛПВП, курение, семейный анамнез раннего начала ИБС). Противопоказания Противопоказания Противопоказания для препарата Розарт в суточной дозе 5, 10 и 20 мг: - Повышенная чувствительность к розувастатину или другим компонентам препарата: - Заболевания печени в активной фазе, включая стойкое повышение сывороточной активности "печеночных" трансаминаз (более чем в 3 раза по сравнению с верхней границей нормы (ВГН)): - Тяжелые нарушения функции почек (КК менее 30 мл/мин): - Миопатия: - Одновременный прием циклоспорина: - Применение у женщин репродуктивного возраста, не пользующихся адекватными методами контрацепции: - Беременность и период грудного вскармливания: - Возраст до 18 лет (эффективность и безопасность не установлены): - Непереносимость лактозы, дефицит лактазы, глюкозо-галактозная мальабсорбция (препарат содержит лактозы моногидрат). Противопоказания для препарата Розарт в суточной дозе 40 мг: - Повышенная чувствительность к розувастатину или другим компонентам препарата: - Заболевания печени в активной фазе, включая стойкое повышение сывороточной активности "печеночных" трансаминаз (более чем в 3 раза по сравнению с ВГН): - Миопатия: - Одновременный прием циклоспорина: - Применение у женщин репродуктивного возраста, не пользующихся адекватными методами контрацепции: - Беременность и период грудного вскармливания: - Возраст до 18 лет (эффективность и безопасность не установлены): - Непереносимость лактозы, дефицит лактазы, глюкозо-галактозная мальабсорбция (препарат содержит лактозы моногидрат): - Миотоксичность на фоне приема других ингибиторов ГМГ-КоА-редуктазы или фибратов в анамнезе: - Гипотиреоз: - Почечная недостаточность тяжелой и средней степени тяжести (КК менее 60 мл/мин): - Чрезмерное употребление алкоголя: - Состояния, которые могут приводить к повышению плазменной концентрации розувастатина: - Одновременный прием фибратов: - Применение у пациентов монголоидной расы: - Семейный или личный анамнез наследственных мышечных заболеваний. С осторожностью: Для препарата Розарт в суточной дозе 5, 10 и 20 мг: Наличие факторов риска развития миопатии и/или рабдомиолиза - почечная недостаточность (КК более 30 мл/мин), гипотиреоз, личный или семейный анамнез наследственных мышечных заболеваний и предшествующий анамнез миотоксичности при применении других ингибиторов ГМГ-КоА-редуктазы или фибратов: чрезмерное употребление алкоголя, возраст старше 70 лет: состояния, при которых отмечено повышение плазменной концентрации розувастатина: расовая принадлежность (монголоидная раса), одновременное применение с фибратами, заболевания печени в анамнезе, сепсис, артериальная гипотензия, обширные хирургические вмешательства, травмы, тяжелые метаболические, эндокринные или водно-электролитные нарушения или неконтролируемая эпилепсия. Для препарата Розарт в суточной дозе 40 мг: Наличие факторов риска развития миопатии и/или рабдомиолиза - почечная недостаточность (КК более 60 мл/мин), возраст старше 70 лет, заболевания печени в анамнезе, сепсис, артериальная гипотензия, обширные хирургические вмешательства, травмы, тяжелые метаболические, эндокринные или водно-электролитные нарушения или неконтролируемая эпилепсия. Беременность Препарат Розарт противопоказан при беременности и в период лактации. Применение препарата Розарт у женщин репродуктивного возраста возможно только в случае использования надежных методов контрацепции и если пациентка информирована о возможном риске лечения для плода. Поскольку холестерин и вещества, синтезируемые из холестерина важны для развития плода, потенциальный риск ингибирования ГМГ-КоА-редуктазы превышает пользу от применения препарата во время беременности. В случае диагностирования беременности в процессе терапии препаратом Розарт, прием препарата должен быть немедленно прекращен, а пациентки предупреждены о потенциальном риске для плода. Данные в отношении выделения розувастатина с грудным молоком отсутствуют, поэтому при необходимости применения препарата в период лактации, учитывая возможность нежелательных явлений у грудных детей, следует решить вопрос о прекращении грудного вскармливания. Применение и дозы Внутрь, не разжевывая, не измельчая, проглатывая целиком, запивая водой, независимо от времени суток и приема пищи. До начала терапии препаратом Розарт пациент должен начать соблюдать стандартную гиполипидемическую диету и продолжать соблюдать ее во время лечения. Дозу препарата следует подбирать индивидуально в зависимости от показаний и терапевтического ответа, принимая во внимание текущие общепринятые рекомендации по целевым концентрациям липидов. Рекомендуемая начальная доза препарата Розарт для пациентов, начинающих принимать препарат, или для пациентов, переведенных с приема других ингибиторов ГМГ-КоА-редуктазы, составляет 5 или 10 мг 1 раз/сут. При выборе начальной дозы следует руководствоваться концентрацией холестерина у пациента и принимать во внимание риск развития сердечно-сосудистых осложнений, а также необходимо оценивать потенциальный риск развития побочных реакций. В случае необходимости через 4 недели доза препарата может быть увеличена. В связи с возможным развитием побочных эффектов при приеме дозы 40 мг по сравнению с более низкими дозами препарата (см. раздел "Побочное действие"), окончательное титрование до максимальной дозы 40 мг следует проводить только у пациентов с тяжелой формой гиперхолестеринемии и высоким риском сердечно-сосудистых осложнений (особенно у пациентов с наследственной гиперхолестеринемией), у которых при приеме дозы 20 мг не была достигнута целевая концентрация холестерина, и которые будут находиться под врачебным наблюдением. Рекомендуется особенно тщательное наблюдение за пациентами, получающими препарат в дозе 40 мг. После 2-4-х недель терапии и/или повышения дозы препарата необходим контроль показателей липидного обмена. У пожилых пациентов старше 70 лет рекомендуемая начальная доза препарата Розарт составляет 5 мг, иной коррекции дозы не требуется. У пациентов с печеночной недостаточностью по шкале Чайлд-Пью ниже 7 баллов коррекции дозы препарата не требуется. У пациентов со значениями 8 и 9 баллов по шкале Чайлд-Пью должна быть проведена предварительная оценка функции почек. Опыт применения розувастатина у пациентов с печеночной недостаточностью выше 9 баллов по шкале Чайлд-Пью отсутствует. Розувастатин противопоказан у пациентов с заболеванием печени в активной фазе. При почечной недостаточности легкой или средней степени тяжести коррекции дозы не требуется. Рекомендуется начальная доза препарата 5 мг для пациентов с почечной недостаточностью средней степени тяжести (КК менее 60 мл/мин). Пациентам с почечной недостаточностью средней степени тяжести (КК менее 30-60 мл/мин) назначение препарата в дозе 40 мг противопоказано. Прием препарата Розарт противопоказан в любых дозах пациентам с тяжелой степенью почечной недостаточности (КК менее 30 мл/мин). Этнические группы У пациентов монголоидной расы возможно повышение системной концентрации розувастатина. Начальная рекомендуемая доза препарата для пациентов монголоидной расы составляет 5 мг. Применение препарата в дозе 40 мг таким пациентам противопоказано. Генетический полиморфизм Известны разновидности генетического полиморфизма, который может привести к увеличению системной концентрации розувастатина. У пациентов с выявленным специфическим полиморфизмом рекомендуются более низкие суточные дозы розувастатина. Пациенты, предрасположенные к развитию миопатии Начальная рекомендуемая доза для таких пациентов составляет 5 мг. Применение препарата в дозе 40 мг у таких пациентов противопоказано. Комбинированная терапия Розувастатин является субстратом для различных транспортных белков (например, ОАТР1В1 и BCRP). Повышается риск развития миопатии, включая рабдомиолиз, при одновременном приеме розувастатина с лекарственными препаратами, повышающими концентрацию розувастатина в плазме крови за счет их взаимодействия с транспортными белками. К данной группе веществ относятся циклоспорин, ингибиторы ВИЧ-протеаз, включая комбинацию ритонавира с атазанавиром, лопинавир и/или типранавир: см. раздел Особые указания и Взаимодействие с другими лекарственными препаратами). В случае, когда это возможно, следует принять решение о назначении альтернативной терапии и, в случае необходимости, временно прекратить прием розувастатина. В случае, когда одновременного приема избежать нельзя, следует тщательно оценить возможный риск взаимодействия и потенциальную пользу от совместного лечения (см. раздел Взаимодействие с другими лекарственными препаратами). Побочные эффекты и передозировка Побочные эффекты: Согласно данным клинических исследований розувастатина, а также данным его постмаркетингового применения, у пациентов наблюдались перечисленные ниже побочные реакции. Частота побочных реакций распределяется следующим образом: очень часто - более 1/10: часто - от более 1/100 до менее 1/10: нечасто - от более 1/1000 до менее 1/100: редко - от более 1/10000 до менее 1/1000: очень редко - от менее 1/10000: частота неизвестна - по имеющимся данным установить частоту возникновения не представляется возможным. Со стороны крови и лимфатической системы: редко - тромбоцитопения. Со стороны нервной системы: часто - головная боль, головокружение, астенический синдром: очень редко - полинейропатия, снижение памяти: частота неизвестна - депрессия, периферическая нейропатия, нарушения сна, включая бессонницу и кошмарные сновидения. Со стороны пищеварительной системы: часто - запор, тошнота, боль в животе: редко - панкреатит: очень редко - гепатит, желтуха: частота неизвестна - диарея. Со стороны дыхательной системы: частота неизвестна - кашель, одышка, интерстициальное заболевание легких. Со стороны эндокринной системы: часто - сахарный диабет 1. Со стороны опорно-двигательного аппарата: часто - миалгия: редко - миопатия (включая миозиты), рабдомиолиз: очень редко артралгия: частота неизвестна иммуноопосредованная некротизирующая миопатия: поражения сухожилий, иногда с разрывами. Аллергические реакции: нечасто - кожный зуд, сыпь, крапивница: редко - реакции повышенной чувствительности, включая ангионевротический отек. Со стороны кожи и подкожных тканей: частота неизвестна - синдром Стивенса-Джонсона. Со стороны мочевыделительной системы: очень редко - гематурия. Со стороны половых органов и молочной железы: очень редко - гинекомастия. Лабораторные показатели: редко транзиторное повышение активности аспартатаминотрансферазы и аланинаминотрансферазы. Прочие: частота неизвестна - периферические отеки. 1 - Частота зависит от наличия факторов риска (концентрация глюкозы в крови натощак >:5,6 ммоль/л, индекс массы тела >:30 кг/м 2, повышенная концентрация ТГ, артериальная гипертензия в анамнезе). Как и при применении других ингибиторов ГМГ-КоА-редуктазы, частота возникновения побочных реакций носит дозозависимый характер, побочные эффекты обычно выражены незначительно и проходят самостоятельно. Влияние на функцию почек У пациентов, получавших розувастатин, в ходе анализа мочи тест-полосками была выявлена протеинурия, преимущественно канальцевая. Изменения количества белка в моче (от отсутствия или следовых количеств до + или больше) наблюдались у менее 1% пациентов, получающих 10-20 мг розувастатина, и у приблизительно 3% пациентов, получающих 40 мг розувастатина. Незначительное изменение количества белка в моче (от отсутствия или следовых количеств до +) отмечалось при приеме дозы 20 мг. В большинстве случаев протеинурия уменьшается или исчезает в процессе терапии и не означает возникновения острого или прогрессирования существующего заболевания почек. У пациентов, получающих розувастатин, наблюдалась гематурия, имеющиеся данные показали низкую частоту появления данной нежелательной реакции. Влияние на опорно-двигательный аппарат При применении всех доз розувастатина и, в особенности при приеме доз, превышающих 20 мг, сообщалось о развитии миалгии, миопатии, включая миозит, в редких случаях о рабдомиолизе с развитием острой почечной недостаточности или без неё. При приеме розувастатина наблюдалось дозозависимое повышение активности креатинфосфокиназы (КФК). В большинстве случаев оно было незначительным, бессимптомным и временным. В случае повышения активности КФК (более чем в 5 раз по сравнению с ВГН) терапия должна быть приостановлена (см. раздел Особые указания). Влияние на функцию печени У незначительного числа пациентов при применении розувастатина наблюдается дозозависимое повышение активности "печеночных" трансаминаз. В большинстве случаев оно невелико, бессимптомно и временно. При применении некоторых ингибиторов ГМГ-КоА-редуктазы наблюдались сексуальная дисфункция, были зафиксированы единичные случаи интерстициального заболевания легких (см. раздел Особые указания). Частота сообщений о развитии рабдомиолиза, серьезных нарушений функции почек и печени (выражающееся преимущественно в повышении активности "печеночных" трансаминаз) выше при приеме дозы розувастатина 40 мг. Передозировка: При одновременном приеме нескольких суточных доз фармакокинетические параметры розувастатина не меняются. Лечение: специфического лечения нет, проводится симптоматическая терапия и мероприятия, направленные на поддержание функции жизненно важных органов и систем под контролем функции печени и активности КФК. Маловероятно, что гемодиализ будет эффективен. Взаимодействие с другими ЛС: Ингибиторы транспортных белков Розувастатин является субстратом некоторых транспортных белков, включая мембранный переносчик ОАТР1В1, вовлеченный в процесс печеночного захвата, и транспортный белок BCRP. Одновременный прием розувастатина с лекарственными средствами, ингибирующими эти транспортные белки, может привести к увеличению концентрации розувастатина в плазме крови и повысить риск развития миопатии. Одновременное применение розувастатина и циклоспорина не влияет на плазменную концентрацию циклоспорина, однако усиливается эффект розувастатина (замедляется его выведение, увеличивается AUC в 7 раз, Сmах - в 11 раз). Одновременный прием циклоспорина и розувастатина противопоказан. Одновременный прием эритромицина и розувастатина приводит к уменьшению AUC розувастатина на 20% и увеличивает Сmах на 30%. Подобное взаимодействие может возникать в результате усиления моторики кишечника, вызываемого приемом эритромицина. У пациентов, получающих непрямые антикоагулянты (например, варфарин) рекомендуется мониторинг международного нормализованного отношения (MHO), поскольку начало терапии розувастатином или повышение его дозы может приводить к увеличению MHO, а отмена розувастатина или снижение его дозы может приводить к его уменьшению. Гемфиброзил и другие гиполипидемические средства: одновременный прием гемфиброзила и розувастатина увеличивает Сmах и AUC розувастатина в 2 раза (см. раздел Особые указания). Основываясь на данных по специфическому взаимодействию, не ожидается фармакокинетически значимого взаимодействия с фенофибратом, возможно фармакодинамическое взаимодействие. Гемфиброзил, фенофибрат, другие фибраты и гиполипидемические дозы никотиновой кислоты (не менее 1 г/сут) увеличивали риск возникновения миопатии при одновременном применении с другими ингибиторами ГМГ- КоА-редуктазы, возможно в связи с тем, что они могут вызывать миопатию и при применении в качестве монотерапии. При одновременном приеме розувастатина с одним из препаратов данной группы пациентам рекомендуется начальная доза розувастатина 5 мг, суточная доза розувастатина 40 мг в данном случае противопоказана. Одновременное применение розувастатина и антацидов, содержащих алюминия и магния гидроксид, приводит к снижению плазменной концентрации розувастатина примерно на 50%. Данный эффект выражен слабее, если антациды применяются через 2 ч после приема розувастатина. Клиническая значимость данного взаимодействия не изучалась. Одновременное применение розувастатина и пероралъных контрацептивов увеличивает AUC этинилэстрадиола и AUC норгестрела на 26% и 34% соответственно, что следует учитывать при подборе дозы пероральных контрацептивов. Фармакокинетические данные по одновременному применению розувастатина и гормонозаместительной терапии отсутствуют, следовательно, нельзя исключить аналогичного эффекта при их совместном применении. Однако, подобная комбинация широко применялась во время проведения клинических исследований розувастатина и хорошо переносилась пациентами. Результаты исследований in vivo и in vitro показали, что розувастатин не является ни ингибитором, ни индуктором изоферментов цитохрома Р450. Розувастатин является непрофильным субстратом для этих изоферментов. Не наблюдалось клинически значимого взаимодействия с такими препаратами, как флуконазол (ингибитор изоферментов CYP2C9 и CYP3A4), кетоконазол (ингибитор изоферментов CYP2A6 и CYP3A4), связанных метаболизмом с системой цитохрома Р450. Совместное применение 10 мг розувастатина и 10 мг эзетимиба у пациентов с гиперхолестеринемией приводило к увеличению AUC розувастатина в 1,2 раза. Однако,нельзя исключить фармакодинамического взаимодейcтвия между розувастатином и эзетимибом в отношении появления нежелательных явлений. Несмотря на то, что точный механизм взаимодействия неизвестен, применение ингибиторов ВИЧ-протеаз с розувастатином может привести к выраженному увеличению экспозиции розувастатина. Фармакокинетическое исследование одновременного применения 20 мг розувастатина с комбинированным препаратом, содержащим два ингибитора ВИЧ-протеаз (400 мг лопинавира/100 мг ритонавира) у здоровых добровольцев приводило к приблизительно двукратному и пятикратному увеличению AUC0-24 и Сmах розувастатина, соответственно. Таким образом, не рекомендуется совместное применение розувастатина с ингибиторами ВИЧ-протеаз у ВИЧ-инфицированных пациентов. Не отмечается клинически значимого взаимодействия розувастатина с дигоксином. В Таблице 1 перечислены различные виды взаимодействия, в том числе взаимодействия, требующие коррекции дозы розувастатина. Следует скорректировать дозу розувастатина при необходимости одновременного применения с другими лекарственными препаратами, повышающими системную концентрацию розувастатина. Если ожидаемое увеличение AUC составляет приблизительно в 2 раза или больше, то начальная доза розувастатина должна составлять 5 мг 1 раз в день. Суточная доза розувастатина должна быть скорректирована таким образом, чтобы его системная концентрация с учетом её повышения не превышала таковую при приеме дозы розувастатина 40 мг в монотерапии. Например, при приеме гемфиброзила доза розувастатина не должна превышать 20 мг (увеличение AUC в 1,9 раза) и 10 мг при приеме комбинации атазанавир/ритонавир (увеличение AUC в 3,1 раза). Таблица 1. Влияние одновременного приема препаратов на экспозицию розувастатина (AUC, в порядке снижения значимости) ТАБЛИЦЪ Фармакологическое действие и фармакокинетика Гиполипидемическое средство из группы статинов. Селективный конкурентный ингибитор 3-гидрокси-3-метилглутарил коэнзим А (ГМГ-КоА)-редуктазы - фермента, превращающего ГМГ-КоА в мевалонат, предшественник холестерина. Увеличивает число рецепторов липопротеинов низкой плотности (ЛПНП) на поверхности гепатоцитов, что приводит к усилению захвата и катаболизма ЛПНП, ингибированию синтеза липопротеинов очень низкой плотности (ЛПОНП), уменьшая общее количество ЛПНП и ЛПОНП. Снижает повышенную концентрацию холестерина-ЛПНП, холестерина-липопротеинов невысокой плотности (неЛПВП), холестерина-ЛПОНП, общего холестерина, триглицеридов (ТГ), ТГ-ЛПОНП, аполипопротеина В (АпоВ), снижает соотношения холестерин-ЛПНП/холестерин-ЛПВП, общий холестерин/холестерин-ЛПВП, холестерин-неЛПВП/холестерин-ЛПВП, АпоВ/аполипопротеина A-I (АпоА-1), повышает концентрацию холестерина-ЛПВП и АпоА-1. Гиполипидемическое действие прямо пропорционально величине назначенной дозы. Терапевтический эффект появляется в течение 1 недели после начала терапии, через 2 недели достигает 90% от максимального, к 4 неделе достигает максимума и после этого остается постоянным. Эффективен у взрослых пациентов с гиперхолестеринемией с или без гипертриглицеридемии (вне зависимости от расы, пола или возраста), в том числе у пациентов с сахарным диабетом и семейной гиперхолестеринемией. У 80% пациентов с гиперхолестеринемией IIа и IIb типа (классификация по Фредриксону) со средним исходным показателем холестерина-ЛПНП около 4,8 ммоль/л на фоне приема препарата в дозе 10 мг концентрация холестерина-ЛПНП достигает значений менее 3 ммоль/л. У пациентов с гомозиготной семейной гиперхолестеринемией, принимающих препарат в дозе 20 мг и 40 мг, среднее снижение концентрации холестерина-ЛПНП составляет 22%. Аддитивный эффект отмечается в комбинации с фенофибратом (в отношении снижения концентрации ТГ) и с никотиновой кислотой в липидснижающих дозах >: 1 г/сут (В отношении повышения концентрации холестерина-ЛПВП). Фармакокинетика: Всасывание Максимальная концентрация (Сmах) розувастатина в плазме крови достигается приблизительно через 5 ч после приема препарата. Абсолютная биодоступность - примерно 20%. Системная экспозиция розувастатина увеличивается пропорционально дозе. Фармакокинетические параметры не изменяются при ежедневном приеме. Распределение Проникает через плацентарный барьер. Розувастатин поглощается преимущественно печенью, которая является основным местом синтеза холестерина и метаболизма ХС-ЛПНП. Объем распределения - 134 л. Связывание с белками плазмы (преимущественно с альбумином) составляет приблизительно 90%. Метаболизм Биотрансформируется в печени в небольшой степени (около 10%), являясь непрофильным субстратом для изоферментов системы цитохрома Р450. Как и в случае других ингибиторов ГМГ-КоА-редуктазы, в процесс печеночного захвата препарата вовлечен специфический мембранный переносчик - полипептид, транспортирующий органический анион (ОАТР) 1В1, выполняющий важную роль в его печеночной элиминации. Основным изоферментом, участвующим в метаболизме розувастатина, является CYP2C9. Изоферменты CYP2C19, CYP3A4 и CYP2D6 вовлечены в метаболизм в меньшей степени. Основными метаболитами розувастатина являются N-десметил и лактоновые метаболиты. N- десметил примерно на 50% менее активен, чем розувастатин, лактоновые метаболиты фармакологически неактивны. Более 90% фармакологической активности по ингибированию циркулирующей ГМГ-КоА-редуктазы обеспечивается розувастатином, остальное - его метаболитами. Выведение Около 90% дозы розувастатина выводится в неизмененном виде через кишечник, оставшаяся часть - почками. Период полувыведения (Т1/2) - примерно 19 ч, не изменяется при увеличении дозы препарата. Среднее значение плазменного клиренса составляет приблизительно 50 л/ч (коэффициент вариации 21,7%). У пациентов с легкой и умеренно выраженной почечной недостаточностью плазменная концентрация розувастатина или N-десметила существенно не меняется. У пациентов с выраженной почечной недостаточностью (клиренс креатинина (КК) менее 30 мл/мин) концентрация розувастатина в плазме выше в 3 раза, а N-десметила - в 9 раз, чем у здоровых добровольцев. Концентрация розувастатина в плазме у пациентов, находящихся на гемодиализе, примерно на 50% выше, чем у здоровых добровольцев. У пациентов с различными стадиями печеночной недостаточности с баллом 7 и ниже по шкале Чайлд-Пью не выявлено увеличения Т1/2 розувастатина: у больных с баллами 8 и 9 по шкале Чайлд-Пью отмечено удлинение в 2 раза. Опыт применения препарата у пациентов с более выраженными нарушениями функции печени отсутствует. Пол и возраст не оказывают клинически значимого влияния на фармакокинетику розувастатина. Фармакокинетические параметры зависят от расовой принадлежности: площадь под кривой "концентрация-время" (AUC) у японцев и китайцев в 2 раза выше таковой у жителей Европы и Северной Америки. У представителей монголоидной расы и индийцев среднее значение AUC и Сmах увеличивается в 1,3 раза. Особые указания Влияние на функцию почек У пациентов, получавших высокие дозы розувастатина (в основном 40 мг), в ходе анализа мочи тест-полосками наблюдалась канальцевая протеинурия, которая в большинстве случаев была транзиторной. Такая протеинурия не свидетельствовала об остром заболевании почек или прогрессировании заболевания почек. Частота сообщений о развитии серьезных побочных реакций со стороны почек в постмаркетинговый период была выше у пациентов, принимавших розувастатин в дозе 40 мг. При применении препарата Розарт в дозе 40 мг рекомендуется контролировать показатели функции почек во время лечения. Влияние на опорно-двигательный аппарат При применении всех доз розувастатина и, в особенности при приеме доз, превышающих 20 мг, сообщалось о развитии миалгии, миопатии и в редких случаях о рабдомиолизе. В очень редких случаях сообщалось о развитии рабдомиолиза при одновременном приеме ингибиторов ГМГ-КоА-редуктазы и эзетимиба. В данном случае нельзя исключить фармакодинамического взаимодействия, поэтому следует соблюдать осторожность при их совместном приеме. Как при приеме других ингибиторов ГМГ-КоА-редуктазы частота сообщений в постмаркетинговый период наблюдения о развитии рабдомиолиза, связанного с приемом розувастатина, была выше при приеме дозы 40 мг. Определение креатинфосфокиназы Определение активности КФК не следует проводить после интенсивных физических нагрузок или при наличии других возможных причин увеличения ее активности, что может привести к неверной интерпретации полученных результатов. В случае, если исходная активность КФК существенно повышена, через 5-7 дней следует провести повторное измерение - не следует начинать терапию, если повторный тест подтверждает исходную активность КФК (в 5 раз выше нормы). До начала терапии Следует соблюдать осторожность при назначении препарата Розарт, также как и при назначении других ингибиторов ГМГ-КоА- редуктазы, пациентам с имеющимися факторами риска развития миопатии/рабдомиолиза (см. раздел С осторожностью). Необходимо рассмотреть соотношение ожидаемой пользы от терапии и потенциального риска и проводить клиническое наблюдение на протяжении всего курса лечения. В случае, если исходная активность КФК существенно повышена (в 5 раз выше ВГН), то не следует начинать лечение препаратом. Во время лечения Следует проинформировать пациента о необходимости немедленного сообщения врачу о случаях неожиданного появления мышечных болей, мышечной слабости или спазмах, особенно в сочетании с недомоганием и лихорадкой. У таких пациентов следует определять активность КФК. Терапию следует прекратить, если активность КФК значительно увеличен (более чем в 5 раз по сравнению с ВГН) или если мышечные симптомы резко выражены и вызывают ежедневный дискомфорт (даже, если активность КФК в 5 раз меньше по сравнению с ВГН). Если симптомы исчезают, и активность КФК возвращается к норме, следует рассмотреть вопрос о повторном назначении препарата Розарт или других ингибиторов ГМГ-КоА- редуктазы в меньших дозах при тщательном наблюдении за пациентом. Рутинный мониторинг активности КФК при отсутствии симптомов нецелесообразен. Отмечены очень редкие случаи иммуноопосредованной некротизирующей миопатии с клиническими проявлениями в виде стойкой слабости проксимальных мышц и повышения активности КФК в сыворотке крови во время лечения или прекращении приема статинов, в том числе розувастатина. Не отмечено признаков увеличения воздействия на скелетную мускулатуру при приеме розувастатина и сопутствующей терапии. Однако, сообщалось об увеличении числа случаев миозита и миопатии у пациентов, принимавших другие ингибиторы ГМГ-КоА-редуктазы в сочетании с производными фибриновой кислоты (включая гемфиброзил), циклоспорин, никотиновую кислоту в липидснижающих дозах >: 1 г/сут, азольные противогрибковые препараты, ингибиторы протеаз и макролидные антибиотики. Гемфиброзил увеличивает риск развития миопатии при одновременном приеме с некоторыми ингибиторами ГМГ-КоА-редуктазы, поэтому одновременное применение гемфиброзила и розувастатина не рекомендуется. Следует тщательно взвесить соотношение ожидаемой пользы и потенциального риска при совместном применении препарата Розарт и фибратов или никотиновой кислоты в липидснижающих дозах >: 1 г/сут. Противопоказан прием препарата Розарт в дозе 40 мг одновременно с фибратами (см. разделы Взаимодействие с другими лекарственными препаратами и Противопоказания). Во время лечения, особенно в период коррекции дозы препарата Розарт, каждые 2-4недели следует осуществлять мониторинг липидного профиля и согласно нему при необходимости изменять дозу препарата. Препарат Розарт не следует принимать пациентам при проявлении острых и выраженных симптомов миопатии или с наличием факторов риска, предрасполагающих к развитию нарушения функции почек и вторичного рабдомиолиза (например, сепсис, артериальная гипотензия, обширные хирургические вмешательства, травмы, выраженные нарушения метаболизма, выраженные эндокринные нарушения и тяжелые нарушения водно-электролитного баланса, неконтролируемые судороги). Влияние на функцию печени Как и другие ингибиторы ГМГ-КоА-редуктазы розувастатин следует применять с осторожностью у пациентов, злоупотребляющих алкоголем и/или с заболеванием печени в анамнезе. Рекомендуется проводить определение показателей функции печени до начала терапии и через 3 месяца после начала терапии. Прием препарата Розарт следует прекратить или уменьшить дозу препарата, если уровень активности "печеночных" трансаминаз в сыворотке крови в 3 раза превышает ВГН. У пациентов с гиперхолестеринемией вследствие гипотиреоза или нефротического синдрома терапия основных заболеваний должна проводиться до начала лечения препаратом Розарт. При постмаркетинговом наблюдении розувастатина частота сообщений о развитии серьезных нарушений функции печени (выражающихся преимущественно в повышении активности "печеночных" трансаминаз) была выше при приеме дозы 40 мг. Этнические группы В ходе фармакокинетических исследований среди пациентов монголоидной расы по сравнению с европеоидной отмечено увеличение системной концентрации розувастатина (см. раздел Способ применения и дозы и Фармакокинетика). Ингибиторы ВИЧ-протеаз В ходе совместного приема розувастатина и комбинации различных ингибиторов ВИЧ- протеаз с ритонавиром наблюдается увеличение системной концентрации розувастатина. Следует тщательно оценивать снижение концентрации липидов в крови, а также учитывать возможное повышение розувастатина в плазме крови в начале лечения и в период повышения дозы препарата Розарт у пациентов с ВИЧ, принимающих ингибиторы ВИЧ-протеаз. Одновременный прием ингибиторов ВИЧ- протеаз не рекомендуется без коррекции дозы розувастатина (см. раздел Способ применения и дозы и Взаимодействие с другими лекарственными препаратами). Интерстициальное заболевание легких При применении некоторых ингибиторов ГМГ-КоА-редуктазы, особенно в течение длительного времени, сообщалось о единичных случаях интерстициального заболевания легких. Проявлениями заболевания могут являться одышка, непродуктивный кашель и ухудшение общего самочувствия (слабость, снижение веса и лихорадка). При подозрении на интерстициальное заболевание легких следует прекратить терапию ингибиторами ГМГ-КоА-редуктазы. Сахарный диабет II типа Некоторые данные подтверждают то, что ингибиторы ГМГ-КоА-редуктазы повышают концентрацию глюкозы в крови и увеличивают у некоторых пациентов вероятность развития сахарного диабета II типа. Однако данный риск перевешивается способностью ингибиторов ГМГ-КоА-редуктазы снижать риск развития сосудистых осложнений, поэтому данный факт не является причиной для прерывания лечения розувастатином. Необходимо установить клиническое наблюдение и проводить биохимический анализ крови согласно национальным стандартам у пациентов с риском развития гипергликемии (концентрация глюкозы в крови 5,6-6,9 ммоль/л, индекс массы тела >: 30 кг/м 2, триглицеридемия, артериальная гипертензия). В одном из исследований розувастатина сообщалась общая частота развития сахарного диабета: 2,8% в группе розувастатина и 2,3% в плацебо группе в основном у пациентов с глюкозой натощак 5,6 - 6,9 ммоль/л. Непереносимость лактозы Препарат Розарт не следует принимать пациентам с непереносимостью лактозы, дефицитом лактазы и глюкозно-галактозной мальабсорбцией, поскольку в его состав входит лактозы моногидрат. Влияние на способность управлять транспортными средствами: Не проводилось исследований по изучению влияния розувастатина на способность управлять транспортными средствами и механизмами. При управлении транспортными средствами и занятии потенциально опасными видами деятельности пациентам следует соблюдать осторожность, так как во время терапии может возникать головокружение. Условия хранения и отпуска из аптек Условия хранения:При температуре не выше 30 °С. Хранить в недоступном для детей месте! Отпуск из аптек: По рецепту Регистрационные данные Торговое название Розарт Международное непатентованное название:Розувастатин. Форма выпуска:таблетки, покрытые плёночной оболочкой. Состав:1 таблетка, покрытая плёночной оболочкой, 5 мг содержит: активное вещество: розувастатин 5,00 мг (в виде розувастатина кальция 5,21 мг): вспомогательные вещества: целлюлоза микрокристаллическая, тип 102 11,55 мг, кросповидон, тип А 3,5 мг, кальция гидрофосфата дигидрат 17,15 мг, лактозы моногидрат 31,71 мг, магния стеарат 0,88 мг: плёночное покрытие: Опадрай белый II 33G28435 ~ 2,1 мг (гипромеллоза-2910 0,84 мг, титана диоксид 0,525 мг, лактозы моногидрат 0,441 мг, макрогол-3350 0,168 мг, триацетин 0,126 мг). 1 таблетка, покрытая плёночной оболочкой, 10 мг содержит: активное вещество: розувастатин 10 мг (в виде розувастатина кальция 10,42 мг): вспомогательные вещества: целлюлоза микрокристаллическая, тип 102 23,1 мг, кросповидон, тип А 7 мг, кальция гидрофосфата дигидрат 34,3 мг, лактозы моногидрат 63,42 мг, магния стеарат 1,76 мг: плёночное покрытие: Опадрай розовый II 33G240007 ~ 4,2 мг (гипромеллоза-2910 1,68 мг, титана диоксид 1,0441 мг, лактозы моногидрат 0,882 мг, макрогол-3350 0,336 мг, триацетин 0,252 мг, краситель кармин красный 0,0059 мг). 1 таблетка, покрытая плёночной оболочкой, 20 мг содержит: активное вещество: розувастатин 20 мг (в виде розувастатина кальция - 20,84 мг): вспомогательные вещества: целлюлоза микрокристаллическая, тип 102 46,2 мг, кросповидон, тип А 14 мг, кальция гидрофосфата дигидрат 68,6 мг, лактозы моногидрат 126,84 мг, магния стеарат 3,52 мг: плёночное покрытие: Опадрай розовый II 33G240007 ~ 8,4 мг (гипромеллоза-2910 3,36 мг, титана диоксид 2,0882 мг, лактозы моногидрат 1,764 мг, макрогол-3350 0,672 мг, триацетин 0,504 мг, краситель кармин красный 0,0118 мг). 1 таблетка, покрытая плёночной оболочкой, 40 мг содержит: активное вещество: розувастатин 40 мг (в виде розувастатина кальция 41,68 мг): вспомогательные вещества: целлюлоза микрокристаллическая, тип 102 92,4 мг, кросповидон, тип А 28 мг, кальция гидрофосфата дигидрат 137,2 мг, лактозы моногидрат 253,68 мг, магния стеарат 7,04 мг: плёночное покрытие: Опадрай розовый II 33G240007 ~ 16,8 мг (гипромеллоза-2910 6,72 мг, титана диоксид 4,1765 мг, лактозы моногидрат 3,528 мг, макрогол-3350 1,344 мг, триацетин 1,008 мг, краситель кармин красный 0,0235 мг). АТХ: Регистрация: Лекарственное средство ЛП-002213 Фармгруппа: Гиполипидемическое средство - ГМГ-КоА редуктазы ингибитор. Дата регистрации: 02.09.2013 / 07.03.2017. Окончание регстрации: . Описание:Таблетки 5 мг Круглые, двояковыпуклые таблетки, покрытые плёночной оболочкой белого цвета с гравировкой "ST 1" на одной стороне таблетки. Таблетки 10 мг Круглые, двояковыпуклые таблетки, покрытые плёночной оболочкой розового цвета с гравировкой "ST 2" на одной стороне таблетки. Таблетки 20 мг Круглые, двояковыпуклые таблетки, покрытые плёночной оболочкой розового цвета с гравировкой "ST 3" на одной стороне таблетки. Таблетки 40 мг. Овальные, двояковыпуклые таблетки, покрытые плёночной оболочкой розового цвета с гравировкой "ST 4" на одной стороне таблетки. Упаковка:Таблетки, покрытые плёночной оболочкой, 5 мг, 10 мг, 20 мг и 40 мг. По 7, 10 или 14 таблеток в блистер ПВХ/ПВДХ/Алюминиевая фольга или в блистер Алюминиевая фольга/Алюминиевая фольга. По 4 блистера по 7 таблеток, по 3 или 9 блистеров по 10 таблеток и по 2 или 6 блистеров по 14 таблеток с инструкцией по применению в картонную пачку. Срок годности:2 года. Не применять по истечении срока годности. Владелец рег.удостоверения:Актавис Групп ПТС ехф Производитель:ACTAVIS, Ltd. Представительство:Актавис, ООО

Модель:
RUR 0
Показания Симптоматическое лечение ревматоидного артрита, остеоартроза, анкилозирующего спондилита. Купирование воспаления и болевого синдрома при люмбаго, зубной боли, плечелопаточном периартрите, ревматическом поражении мягких тканей. Препарат предназначен для симптоматической терапии, уменьшения боли и воспаления на момент использовании, на прогрессирование заболевания не влияет. Противопоказания Противопоказания - Эрозивно-язвенные поражения желудочно-кишечного тракта в фазе обострения, желудочно-кишечное кровотечение или подозрение на него: - полное или неполное сочетание бронхиальной астмы, рецидивирующего полипоза носа и околоносовых пазух и непереносимости ацетилсалициловой кислоты или др. нестероидных противовоспалительных препаратов (в т.ч. в анамнезе): - повышенная чувствительность к ацеклофенаку или компонентам препарата: - период после проведения аортокоронарного шунтирования: - выраженная печеночная недостаточность или активное заболевание печени: - выраженная почечная недостаточность (клиренс креатинина менее 30 мл/.мин), прогрессирующие заболевания почек, гиперкалиемия: - воспалительные заболевания кишечника (болезнь Крона, язвенный колит) в фазе обострения: - декомпенсированная сердечная недостаточность: - нарушения кроветворения и коагуляции: - беременность и период грудного вскармливания: - дефицит лактозы, непереносимость лактозы, глюкозо-галактозная мальабсорбция: - детский возраст до 18 лет. С осторожностью: Заболевания печени, почек и желудочно-кишечного тракта в анамнезе, бронхиальная астма, артериальная гипертензия, снижение объема циркулирующей крови (в т.ч. после оперативных вмешательств), ишемическая болезнь сердца, хроническая почечная недостаточность легкой и средней степени тяжести (КК от 30 до 60 мл/мин), печеночная недостаточность легкой и средней степени тяжести, хроническая сердечная недостаточность, цереброваскулярные заболевания, дислипидемия/гиперлипидемия. сахарный диабет, заболевания периферических артерий, курение, пожилой возраст, длительное использование НПВП в анамнезе, наличие инфекции Helicobacter pylori, частое употребление алкоголя, сопутствующая терапия следующими препаратами: - антикоагулянты (например, варфарин): - антиагреганты (например, ацетилсалициловая кислота, клопидогрел): - пероральные глюкокортикостероиды (например, преднизолон): - селективные ингибиторы обратного захвата серотонина (например, циталопрам, флуоксетин, пароксетин, сертралин). Беременность Применение препарата при беременности и в период грудного вскармливания противопоказано. Применение и дозы Препарат следует принимать в минимально эффективной дозе, в течение как можно более короткого периода времени. Внутрь. Таблетки проглатывают целиком, запивая достаточным количеством жидкости. Доза препарата по всем показаниям: Взрослым назначают по 100 мг 2 раза в сутки, 1 таблетка утром, и 1 - вечером. Курс лечения назначается врачом индивидуально. Печеночная недостаточность. Пациентам с печеночной недостаточностью средней степени тяжести необходимо снижать дозу ацеклофенака. Рекомендуемая первоначальная доза составляет 100 мг ежедневно. Почечная недостаточность Нет доказательств, что дозу ацеклофенака необходимо снижать больным с почечной недостаточностью легкой степени тяжести, но рекомендуется прием с осторожностью. Побочные эффекты и передозировка Побочные эффекты: Наиболее часто выявляемые в ходе клинических исследований побочные реакции были со стороны желудочно-кишечного тракта (диспепсия - 7,5 %: боли в животе - 6,2 %: тошнота - 1,5 %: диарея - 1,5 %): иногда - головокружение. Также отмечались зуд, сыпь и изменения активности "печеночных" ферментов и концентрации креатинина крови. Нежелательные эффекты, перечисленные ниже, представлены по системно-органным классам в соответствии с классификацией MedDRA со следующей частотой: часто: 1/100 до <:1/10: нечасто: 1/1000 до <:1/100: редко: 1/10000 до <:1/1000: очень редко: <:1/10000. Аллергические реакции: кожная сыпь, крапивница, экзема, эритродермия, системные анафилактоидные реакции, бронхиальная астма, в отдельных случаях - васкулит, пневмонит, полиморфная экссудативная эритема (в т.ч. синдром Стивенса-Джонсона), токсический эпидермальный некролиз (синдром Лайелла). Со стороны иммунной системы: редко - анафилактическая реакция (включая шок), гиперчувствительность. Со стороны желудочно-кишечного тракта: часто - диспепсия, боли в животе, тошнота, диарея: нечасто - метеоризм, гастрит, запор, рвота, изъязвление слизистой оболочки полости рта: редко - мелена, изъязвление желудочно-кишечного тракта, диарея с кровью, желудочно-кишечное кровотечение: очень редко - стоматит, рвота кровью, язва желудка, перфорация тонкой кишки, ухудшение течения болезни Крона и язвенного колита, панкреатит. Со стороны сердечно-сосудистой системы: редко - сердечная недостаточность, повышение артериального давления: очень редко - тахикардия, "приливы", васкулит. Со стороны печени и желчевыводящих путей: часто - увеличение активности "печеночных" ферментов: очень редко - повреждение печени (включая гепатит), увеличение активности щелочной фосфатазы крови. Со стороны нервной системы: часто - головокружение: очень редко - парестезии, тремор, сонливость, головная боль, повышенная утомляемость, дисгевзия. Нарушения психики: очень редко - депрессия, нетипичные сновидения, бессонница. Со стороны кожи и подкожной клетчатки: нечасто - зуд, сыпь, дерматит, уртикарная сыпь: редко - ангионевротический отек: очень редко - пурпура, реакции со стороны кожи и слизистых оболочек, буллезные кожные реакции. Со стороны органов кроветворения: тромбоцитопения, лейкопения, агранулоцитоз, гемолитическая анемия, апластическая анемия. Со стороны крови и лимфатической системы: редко - анемия: очень редко - угнетение костного мозга, гранулоцитопения, нейтропения, гемолитическая анемия. Со стороны почек и мочевыводящих путей: нечасто - повышение концентрации мочевины крови, повышение концентрации креатинина крови: очень редко - интерстициальный нефрит, нефротический синдром, почечная недостаточность. Со стороны дыхательной системы, органов грудной клетки и средостения: редко - одышка: очень редко - бронхоспазм. Со стороны органа зрения: редко - нарушения зрения. Со стороны органа слуха и лабиринта: очень редко - вертиго, звон в ушах. Со стороны обмена веществ и питания: очень редко - гиперкалиемия, увеличение массы тела. Системные нарушения: очень редко - спазмы мышц нижних конечностей. Передозировка: Симптомы: головокружение, головная боль, гипервентиляция легких с повышенной судорожной готовностью, тошнота, рвота, боли в области живота. Лечение: промывание желудка, введение активированного угля, симптоматическая терапия. Специфического антидота нет. Форсированный диурез, гемодиализ, переливание крови мало эффективны. Взаимодействие с другими ЛС: Исследования лекарственных взаимодействий не проводились, за исключением варфарина. Ацеклофенак метаболизируется системой цитохрома Р450 - CYP2C9, и данные in vitro указывают на то, что ацеклофенак может являться ингибитором данного энзима. Поэтому возможен риск фармакокинетического взаимодействия с фенитоином, циметидином, толбутамидом, фенилбутазоном, амиодароном, миконазолом и сульфафеназолом. Как и в случае других НПВП, существует риск фармакокинетического взаимодействия с лекарственными средствами, метаболизм которых протекает в печени, такими как метотрексат и препараты лития. Ацеклофенак почти полностью связывается с белками плазмы, и, следовательно, необходимо учитывать возможность замещения другими препаратами, в сильной степени связывающимися с белками плазмы. Ввиду отсутствия исследований фармакокинетического взаимодействия, следующие сведения основываются на информации, полученной но другим НПВП: Следует избегать следующих сочетаний НПВП подавляют тубулярную секрецию метотрексата, и при этом также может наблюдаться метаболическое взаимодействие, приводящее к снижению клиренса метотрексата. Поэтому во время лечения большими дозами метотрексата (более 20 мг/неделю) всегда следует избегать назначения НПВП. Некоторые НПВП подавляют выведение лития почками, что приводит к повышенным концентрациям лития в сыворотке крови. Следует не допускать данное сочетание, если нельзя проводить частый контроль концентрации лития в сыворотке крови. НПВП подавляют агрегацию тромбоцитов и повреждают слизистую оболочку желудочно-кишечного тракта, что может повысить активность антикоагулянтов и увеличить риск кровотечений из слизистой оболочки желудочно-кишечного тракта у пациентов, принимающих антикоагулянты. Следует избегать сочетания ацеклофенака с пероральными антикоагулянтами группы кумарина, тиклопидином, тромболитиками и гепарином при отсутствии тщательного контроля. При следующих сочетаниях может потребоваться коррекция дозы и соблюдение мер предосторожности: Необходимо учитывать возможное взаимодействие НПВП и метотрексата, особенно больным с почечной недостаточностью. При приеме обоих препаратов необходим контроль функции почек. Следует принимать меры предосторожности при одновременном приеме НПВП и метотрексата в течение 24 ч, т.к. концентрация метотрексата может увеличиться, приводя к повышенной токсичности метотрексата. Предполагается, что прием НПВП вместе с циклоспорином или такролимусом увеличивает риск нефротоксичности ввиду снижения синтеза простациклина в почках. Поэтому при одновременном приеме препаратов важно контролировать функцию почек. Одновременный прием ацетилсалициловой кислоты и других НПВП может увеличить частоту развития побочных реакций, и, следовательно, требуется осторожность при их совместном приеме. НПВП могут снижать мочегонное действие фуросемида, буметанида и гипотензивное действие тиазидных диуретиков. Одновременное лечение калийсберегающими диуретиками может быть связано с повышением концентрации калия в сыворотке крови, поэтому необходим контроль содержания калия в крови. НПВП также могут снижать действие некоторых гипотензивных лекарственных препаратов. Ингибиторы ангиотензинпревращающего фермента или антагонисты рецепторов ангиотензина II в сочетании с НПВП могуч приводить к возникновению почечной недостаточности. Риск развития острой почечной недостаточности, которая обычно носит обратимый характер, может увеличиваться у некоторых пациентов с нарушением функции ночек, например у пожилых пациентов или пациентов, испытывающих дефицит жидкости. Поэтому сочетание таких препаратов с НПВП должно применяться с осторожностью, пациенты должны получать достаточное количество жидкости с пищей, и следует проводить контроль функции почек. Не было выявлено влияние ацеклофенака на артериальное давление, когда он принимался одновременно с бендрофлуметиазидом, хотя нельзя исключить взаимодействие с другими гипотензивными препаратами, такими как бета-адреноблокаторы. Другие возможные взаимодействия Сообщалось об отдельных случаях гипогликемии и гипергликемии. Поэтому для ацеклофенака необходимо корректировать дозу препаратов, вызывающих гипогликемию. При одновременном применении с препаратом Ацеклофенак: - дигоксина, фенитоина или препаратов лития - может повышаться концентрация в плазме этих лекарственных средств- диуретиков и гипотензивных средств - может ослабляться действие этих лекарственных средств- калийсберегающих диуретиков - может приводить к развитию гипергликемии и гиперкалиемии: - других НПВП или глюкокортикостероидов - повышается риск возникновения побочных явлений со стороны желудочно-кишечного тракта: - селективных ингибиторов обратного захвата серотонина (циталопрам, флуоксетин, пароксетин, сертралин) - повышается риск развития желудочно-кишечных кровотечений: - циклоспорина - может повышаться токсическое воздействие последнего на почки: - гипогликемических средств - может вызвать как гипо, так и гипергликемию. При этой комбит 1ации средств необходим контроль содержания сахара в крови: - ацетилсалициловой кислоты - снижается концентрация ацеклофенака в крови: - антиагрегантов и антикоагулянтов - повышается риск кровотечений (необходим регулярный контроль показателей свертываемости крови): - зидовудина - повышается риск гематологической токсичности. Фармакологическое действие и фармакокинетика Ацеклофенак является производным фенилуксусной кислоты, ингибирует циклооксигеназу I и II типов. Обладает противовоспалительным, обезболивающим и жаропонижающим действием. Угнетает синтез простагландинов и, таким образом, влияет на патогенез воспаления, возникновения боли и лихорадки. При ревматических заболеваниях противовоспалительное и анальгезирующее действие ацеклофенака способствует значительному уменьшению выраженности боли, утренней скованности, припухлости суставов, что улучшает функциональное состояние пациента. Фармакокинетика: Ацеклофенак быстро и полностью всасывается после приема внутрь. Время достижения максимальной концентрации - 1,25-3 ч. Проникает в синовиальную жидкость, где его концентрация достигает 57 % от уровня концентрации в плазме и время достижения максимальной концентрации на 2-4 ч позже, чем в плазме. Объем распределения - 25 л. Связь c белками плазмы (альбуминами) - 99 %. Ацеклофенак циркулирует главным образом в неизмененном виде, основным его метаболитом является 4'- гидроксиацеклофенак. Период полувыведения - 4 ч. Выводится почками, преимущественно в виде гидроксипроизводных (около 2/3 введенной дозы). Особые указания Выраженность побочных реакций можно скорректировать путем снижения эффективной однократной дозы, необходимой для контроля симптомов. Пациентам с артериальной гипертензией и/или хронической сердечной недостаточностью I-II функционального класса по NYMA в анамнезе требуется надлежащий контроль и консультации врача, т.к. сообщалось о задержке жидкости и отеках при лечении НПВП. Данные клинических и эпидемиологических исследований дают основание предполагать, что использование некоторых НПВП (особенно в больших дозах и при длительном приеме) может увеличивать риск тромбозов артерий (например, инфаркт миокарда или инсульт). Нет достаточных данных, позволяющих исключить такой риск для ацеклофенака. Пациенты с неконтролируемой артериальной гипертензией, застойной сердечной недостаточностью, ишемической болезнью сердца, патологией периферических артерий и/или цереброваскулярными заболеваниями должны принимать ацеклофенак только после тщательного анализа клинической ситуации. С такой же осторожностью нужно принимать решение перед началом длительного лечения пациентов с риском сердечно-сосудистого заболевания (например, с артериальной гипертензией, гиперлипидемией, сахарным диабетом и курящих). Ацеклофенак необходимо принимать с осторожностью и под пристальным медицинским контролем пациентам, с заболеваниями желудочно-кишечного тракта, пептической язвой в анамнезе, после острого нарушения мозгового кровообращения, системной красной волчанкой, порфирией, нарушениями со стороны системы кроветворения и нарушениями свертываемости крови. Ацеклофенак может вызывать обратимое угнетение агрегации тромбоцитов. Пациентам с болезнью Крона, язвенным колитом препарат назначать не рекомендуется. Необходимо проявлять осторожность пациентам с печеночной, почечной, сердечной недостаточностью, а также пациентам с другими заболеваниями, предрасположенными к развитию отеков. Прием НПВП этой категорией пациентов может привести к ухудшению почечной экскреции и возникновению отеков. Пациентам, принимающим мочегонные препараты, или с повышенным риском развития гиповолемии, также необходимо проявлять осторожность при приеме препарата Ацеклофенак. Необходимо проявлять осторожность пожилым пациентам, т.к. у них чаще наблюдаются побочные явления. Кровотечения из желудочно-кишечного тракта и/или прободение могут быть во время лечения, особенно если в анамнезе есть заболевания желудочно-кишечного тракта. Кроме того, у пожилых пациентов больше вероятность возникновения нарушения работы печени, почек, сердечно-сосудистой системы. Всем пациентам, получающим длительное лечение НПВП, необходим мониторинг с целью снижения риска развития побочных реакций (например, общий анализ мочи, общий и биохимический анализ крови). Одновременный прием препарата Ацеклофенак с любым лекарственным препаратом, подавляющим синтез циклооксигеназы/простагландина, может снизить фертильность и не рекомендуется женщинам, планирующим беременность. Женщинам с бесплодием в анамнезе следует прекратить прием препарата Ацеклофенак. Влияние на способность управлять транспортными средствами: В период лечения необходимо соблюдать осторожность при управлении транспортными средствами и занятии другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций. Условия хранения и отпуска из аптек Условия хранения:В защищенном от света месте при температуре не выше 25 °С. Хранить в местах, недоступных для детей. Отпуск из аптек: По рецепту Регистрационные данные Торговое название Ацеклофенак Международное непатентованное название:Ацеклофенак. Форма выпуска:таблетки покрытые пленочной оболочкой. Состав:Состав на одну таблетку: ТАБЛИЦЪ АТХ: Регистрация: Лекарственное средство ЛП-002871 Фармгруппа: Нестероидный противовоспалительный препарат (НПВП)Дата регистрации: 24.02.2015 / 05.11.2015. Окончание регстрации: . Описание:Круглые таблетки двояковыпуклой формы, покрытые плёночной оболочкой белого или почти белого цвета. На поперечном разрезе - ядро белого или почти белого цвета. Упаковка:Таблетки, покрытые плёночной оболочкой 100 мг. По 10, 20 таблеток помещают в контурную ячейковую упаковку из пленки поливинилхлоридной и фольги алюминиевой печатной лакированной. По 10, 20, 30, 40, 60, 90, 100, 200 таблеток помещают в банки полимерные. При отсутствии уплотнителя пробки свободное пространство в банке заполняют ватой медицинской гигроскопической или амортизатором. Каждую банку, 1, 2, 3, 4, 6, 9, 10 контурных ячейковых упаковок вместе с инструкцией по применению помещают в пачку из картона. Срок годности:3 года. Не использовать по истечении срока годности, указанного на упаковке. Владелец рег.удостоверения:ВЕЛФАРМ, ООО Производитель:СИНТЕЗ, ОАО. Представительство

Модель:
RUR 596
Показания Первичная гиперхолестеринемия (тип IIа по классификации Фредриксона), включая гетерозиготную наследственную гиперхолестеринемию или смешанная (комбинированная) гиперлипидемия (типа IIb по классификации Фредриксона), в качестве дополнения к диете и другимнемедикаментозным мероприятиям (физическая нагрузка и снижение массы тела)- Гомозиготная форма наследственной гиперхолестеринемии при недостаточной эффективности диетотерапии и других видов лечения, направленных на снижение концентрации липидов (например, ЛПНП-аферез) или, если такие виды лечения не подходят пациенту- Гипертриглицеридемия (тип IV по классификации Фредриксона) в качестве дополнения к диете- Для замедления прогрессирования атеросклероза в качестве дополнения к диете у пациентов, которым показана терапия для снижения концентрации общего холестерина и холестерина-ЛПНП- Первичная профилактика основных сердечно-сосудистых осложнений (инсульта, инфаркта, артериальной реваскуляризации) у взрослых пациентов без клинических признаков ишемической болезни сердца (ИБС), но с повышенным риском ее развития (возраст старше 50 лет для мужчин и старше 60 лет для женщин, повышенная концентрация С-реактивного белка ( 2 мг/л) при наличии, как минимум одного из дополнительных факторов риска, таких как артериальная гипертензия, низкая концентрация холестерина-ЛПВП, курение, семейный анамнез раннего начала ИБС). Противопоказания Противопоказания Противопоказания для препарата Розарт в суточной дозе 5, 10 и 20 мг: - Повышенная чувствительность к розувастатину или другим компонентам препарата: - Заболевания печени в активной фазе, включая стойкое повышение сывороточной активности "печеночных" трансаминаз (более чем в 3 раза по сравнению с верхней границей нормы (ВГН)): - Тяжелые нарушения функции почек (КК менее 30 мл/мин): - Миопатия: - Одновременный прием циклоспорина: - Применение у женщин репродуктивного возраста, не пользующихся адекватными методами контрацепции: - Беременность и период грудного вскармливания: - Возраст до 18 лет (эффективность и безопасность не установлены): - Непереносимость лактозы, дефицит лактазы, глюкозо-галактозная мальабсорбция (препарат содержит лактозы моногидрат). Противопоказания для препарата Розарт в суточной дозе 40 мг: - Повышенная чувствительность к розувастатину или другим компонентам препарата: - Заболевания печени в активной фазе, включая стойкое повышение сывороточной активности "печеночных" трансаминаз (более чем в 3 раза по сравнению с ВГН): - Миопатия: - Одновременный прием циклоспорина: - Применение у женщин репродуктивного возраста, не пользующихся адекватными методами контрацепции: - Беременность и период грудного вскармливания: - Возраст до 18 лет (эффективность и безопасность не установлены): - Непереносимость лактозы, дефицит лактазы, глюкозо-галактозная мальабсорбция (препарат содержит лактозы моногидрат): - Миотоксичность на фоне приема других ингибиторов ГМГ-КоА-редуктазы или фибратов в анамнезе: - Гипотиреоз: - Почечная недостаточность тяжелой и средней степени тяжести (КК менее 60 мл/мин): - Чрезмерное употребление алкоголя: - Состояния, которые могут приводить к повышению плазменной концентрации розувастатина: - Одновременный прием фибратов: - Применение у пациентов монголоидной расы: - Семейный или личный анамнез наследственных мышечных заболеваний. С осторожностью: Для препарата Розарт в суточной дозе 5, 10 и 20 мг: Наличие факторов риска развития миопатии и/или рабдомиолиза - почечная недостаточность (КК более 30 мл/мин), гипотиреоз, личный или семейный анамнез наследственных мышечных заболеваний и предшествующий анамнез миотоксичности при применении других ингибиторов ГМГ-КоА-редуктазы или фибратов: чрезмерное употребление алкоголя, возраст старше 70 лет: состояния, при которых отмечено повышение плазменной концентрации розувастатина: расовая принадлежность (монголоидная раса), одновременное применение с фибратами, заболевания печени в анамнезе, сепсис, артериальная гипотензия, обширные хирургические вмешательства, травмы, тяжелые метаболические, эндокринные или водно-электролитные нарушения или неконтролируемая эпилепсия. Для препарата Розарт в суточной дозе 40 мг: Наличие факторов риска развития миопатии и/или рабдомиолиза - почечная недостаточность (КК более 60 мл/мин), возраст старше 70 лет, заболевания печени в анамнезе, сепсис, артериальная гипотензия, обширные хирургические вмешательства, травмы, тяжелые метаболические, эндокринные или водно-электролитные нарушения или неконтролируемая эпилепсия. Беременность Препарат Розарт противопоказан при беременности и в период лактации. Применение препарата Розарт у женщин репродуктивного возраста возможно только в случае использования надежных методов контрацепции и если пациентка информирована о возможном риске лечения для плода. Поскольку холестерин и вещества, синтезируемые из холестерина важны для развития плода, потенциальный риск ингибирования ГМГ-КоА-редуктазы превышает пользу от применения препарата во время беременности. В случае диагностирования беременности в процессе терапии препаратом Розарт, прием препарата должен быть немедленно прекращен, а пациентки предупреждены о потенциальном риске для плода. Данные в отношении выделения розувастатина с грудным молоком отсутствуют, поэтому при необходимости применения препарата в период лактации, учитывая возможность нежелательных явлений у грудных детей, следует решить вопрос о прекращении грудного вскармливания. Применение и дозы Внутрь, не разжевывая, не измельчая, проглатывая целиком, запивая водой, независимо от времени суток и приема пищи. До начала терапии препаратом Розарт пациент должен начать соблюдать стандартную гиполипидемическую диету и продолжать соблюдать ее во время лечения. Дозу препарата следует подбирать индивидуально в зависимости от показаний и терапевтического ответа, принимая во внимание текущие общепринятые рекомендации по целевым концентрациям липидов. Рекомендуемая начальная доза препарата Розарт для пациентов, начинающих принимать препарат, или для пациентов, переведенных с приема других ингибиторов ГМГ-КоА-редуктазы, составляет 5 или 10 мг 1 раз/сут. При выборе начальной дозы следует руководствоваться концентрацией холестерина у пациента и принимать во внимание риск развития сердечно-сосудистых осложнений, а также необходимо оценивать потенциальный риск развития побочных реакций. В случае необходимости через 4 недели доза препарата может быть увеличена. В связи с возможным развитием побочных эффектов при приеме дозы 40 мг по сравнению с более низкими дозами препарата (см. раздел "Побочное действие"), окончательное титрование до максимальной дозы 40 мг следует проводить только у пациентов с тяжелой формой гиперхолестеринемии и высоким риском сердечно-сосудистых осложнений (особенно у пациентов с наследственной гиперхолестеринемией), у которых при приеме дозы 20 мг не была достигнута целевая концентрация холестерина, и которые будут находиться под врачебным наблюдением. Рекомендуется особенно тщательное наблюдение за пациентами, получающими препарат в дозе 40 мг. После 2-4-х недель терапии и/или повышения дозы препарата необходим контроль показателей липидного обмена. У пожилых пациентов старше 70 лет рекомендуемая начальная доза препарата Розарт составляет 5 мг, иной коррекции дозы не требуется. У пациентов с печеночной недостаточностью по шкале Чайлд-Пью ниже 7 баллов коррекции дозы препарата не требуется. У пациентов со значениями 8 и 9 баллов по шкале Чайлд-Пью должна быть проведена предварительная оценка функции почек. Опыт применения розувастатина у пациентов с печеночной недостаточностью выше 9 баллов по шкале Чайлд-Пью отсутствует. Розувастатин противопоказан у пациентов с заболеванием печени в активной фазе. При почечной недостаточности легкой или средней степени тяжести коррекции дозы не требуется. Рекомендуется начальная доза препарата 5 мг для пациентов с почечной недостаточностью средней степени тяжести (КК менее 60 мл/мин). Пациентам с почечной недостаточностью средней степени тяжести (КК менее 30-60 мл/мин) назначение препарата в дозе 40 мг противопоказано. Прием препарата Розарт противопоказан в любых дозах пациентам с тяжелой степенью почечной недостаточности (КК менее 30 мл/мин). Этнические группы У пациентов монголоидной расы возможно повышение системной концентрации розувастатина. Начальная рекомендуемая доза препарата для пациентов монголоидной расы составляет 5 мг. Применение препарата в дозе 40 мг таким пациентам противопоказано. Генетический полиморфизм Известны разновидности генетического полиморфизма, который может привести к увеличению системной концентрации розувастатина. У пациентов с выявленным специфическим полиморфизмом рекомендуются более низкие суточные дозы розувастатина. Пациенты, предрасположенные к развитию миопатии Начальная рекомендуемая доза для таких пациентов составляет 5 мг. Применение препарата в дозе 40 мг у таких пациентов противопоказано. Комбинированная терапия Розувастатин является субстратом для различных транспортных белков (например, ОАТР1В1 и BCRP). Повышается риск развития миопатии, включая рабдомиолиз, при одновременном приеме розувастатина с лекарственными препаратами, повышающими концентрацию розувастатина в плазме крови за счет их взаимодействия с транспортными белками. К данной группе веществ относятся циклоспорин, ингибиторы ВИЧ-протеаз, включая комбинацию ритонавира с атазанавиром, лопинавир и/или типранавир: см. раздел Особые указания и Взаимодействие с другими лекарственными препаратами). В случае, когда это возможно, следует принять решение о назначении альтернативной терапии и, в случае необходимости, временно прекратить прием розувастатина. В случае, когда одновременного приема избежать нельзя, следует тщательно оценить возможный риск взаимодействия и потенциальную пользу от совместного лечения (см. раздел Взаимодействие с другими лекарственными препаратами). Побочные эффекты и передозировка Побочные эффекты: Согласно данным клинических исследований розувастатина, а также данным его постмаркетингового применения, у пациентов наблюдались перечисленные ниже побочные реакции. Частота побочных реакций распределяется следующим образом: очень часто - более 1/10: часто - от более 1/100 до менее 1/10: нечасто - от более 1/1000 до менее 1/100: редко - от более 1/10000 до менее 1/1000: очень редко - от менее 1/10000: частота неизвестна - по имеющимся данным установить частоту возникновения не представляется возможным. Со стороны крови и лимфатической системы: редко - тромбоцитопения. Со стороны нервной системы: часто - головная боль, головокружение, астенический синдром: очень редко - полинейропатия, снижение памяти: частота неизвестна - депрессия, периферическая нейропатия, нарушения сна, включая бессонницу и кошмарные сновидения. Со стороны пищеварительной системы: часто - запор, тошнота, боль в животе: редко - панкреатит: очень редко - гепатит, желтуха: частота неизвестна - диарея. Со стороны дыхательной системы: частота неизвестна - кашель, одышка, интерстициальное заболевание легких. Со стороны эндокринной системы: часто - сахарный диабет 1. Со стороны опорно-двигательного аппарата: часто - миалгия: редко - миопатия (включая миозиты), рабдомиолиз: очень редко артралгия: частота неизвестна иммуноопосредованная некротизирующая миопатия: поражения сухожилий, иногда с разрывами. Аллергические реакции: нечасто - кожный зуд, сыпь, крапивница: редко - реакции повышенной чувствительности, включая ангионевротический отек. Со стороны кожи и подкожных тканей: частота неизвестна - синдром Стивенса-Джонсона. Со стороны мочевыделительной системы: очень редко - гематурия. Со стороны половых органов и молочной железы: очень редко - гинекомастия. Лабораторные показатели: редко транзиторное повышение активности аспартатаминотрансферазы и аланинаминотрансферазы. Прочие: частота неизвестна - периферические отеки. 1 - Частота зависит от наличия факторов риска (концентрация глюкозы в крови натощак >:5,6 ммоль/л, индекс массы тела >:30 кг/м 2, повышенная концентрация ТГ, артериальная гипертензия в анамнезе). Как и при применении других ингибиторов ГМГ-КоА-редуктазы, частота возникновения побочных реакций носит дозозависимый характер, побочные эффекты обычно выражены незначительно и проходят самостоятельно. Влияние на функцию почек У пациентов, получавших розувастатин, в ходе анализа мочи тест-полосками была выявлена протеинурия, преимущественно канальцевая. Изменения количества белка в моче (от отсутствия или следовых количеств до + или больше) наблюдались у менее 1% пациентов, получающих 10-20 мг розувастатина, и у приблизительно 3% пациентов, получающих 40 мг розувастатина. Незначительное изменение количества белка в моче (от отсутствия или следовых количеств до +) отмечалось при приеме дозы 20 мг. В большинстве случаев протеинурия уменьшается или исчезает в процессе терапии и не означает возникновения острого или прогрессирования существующего заболевания почек. У пациентов, получающих розувастатин, наблюдалась гематурия, имеющиеся данные показали низкую частоту появления данной нежелательной реакции. Влияние на опорно-двигательный аппарат При применении всех доз розувастатина и, в особенности при приеме доз, превышающих 20 мг, сообщалось о развитии миалгии, миопатии, включая миозит, в редких случаях о рабдомиолизе с развитием острой почечной недостаточности или без неё. При приеме розувастатина наблюдалось дозозависимое повышение активности креатинфосфокиназы (КФК). В большинстве случаев оно было незначительным, бессимптомным и временным. В случае повышения активности КФК (более чем в 5 раз по сравнению с ВГН) терапия должна быть приостановлена (см. раздел Особые указания). Влияние на функцию печени У незначительного числа пациентов при применении розувастатина наблюдается дозозависимое повышение активности "печеночных" трансаминаз. В большинстве случаев оно невелико, бессимптомно и временно. При применении некоторых ингибиторов ГМГ-КоА-редуктазы наблюдались сексуальная дисфункция, были зафиксированы единичные случаи интерстициального заболевания легких (см. раздел Особые указания). Частота сообщений о развитии рабдомиолиза, серьезных нарушений функции почек и печени (выражающееся преимущественно в повышении активности "печеночных" трансаминаз) выше при приеме дозы розувастатина 40 мг. Передозировка: При одновременном приеме нескольких суточных доз фармакокинетические параметры розувастатина не меняются. Лечение: специфического лечения нет, проводится симптоматическая терапия и мероприятия, направленные на поддержание функции жизненно важных органов и систем под контролем функции печени и активности КФК. Маловероятно, что гемодиализ будет эффективен. Взаимодействие с другими ЛС: Ингибиторы транспортных белков Розувастатин является субстратом некоторых транспортных белков, включая мембранный переносчик ОАТР1В1, вовлеченный в процесс печеночного захвата, и транспортный белок BCRP. Одновременный прием розувастатина с лекарственными средствами, ингибирующими эти транспортные белки, может привести к увеличению концентрации розувастатина в плазме крови и повысить риск развития миопатии. Одновременное применение розувастатина и циклоспорина не влияет на плазменную концентрацию циклоспорина, однако усиливается эффект розувастатина (замедляется его выведение, увеличивается AUC в 7 раз, Сmах - в 11 раз). Одновременный прием циклоспорина и розувастатина противопоказан. Одновременный прием эритромицина и розувастатина приводит к уменьшению AUC розувастатина на 20% и увеличивает Сmах на 30%. Подобное взаимодействие может возникать в результате усиления моторики кишечника, вызываемого приемом эритромицина. У пациентов, получающих непрямые антикоагулянты (например, варфарин) рекомендуется мониторинг международного нормализованного отношения (MHO), поскольку начало терапии розувастатином или повышение его дозы может приводить к увеличению MHO, а отмена розувастатина или снижение его дозы может приводить к его уменьшению. Гемфиброзил и другие гиполипидемические средства: одновременный прием гемфиброзила и розувастатина увеличивает Сmах и AUC розувастатина в 2 раза (см. раздел Особые указания). Основываясь на данных по специфическому взаимодействию, не ожидается фармакокинетически значимого взаимодействия с фенофибратом, возможно фармакодинамическое взаимодействие. Гемфиброзил, фенофибрат, другие фибраты и гиполипидемические дозы никотиновой кислоты (не менее 1 г/сут) увеличивали риск возникновения миопатии при одновременном применении с другими ингибиторами ГМГ- КоА-редуктазы, возможно в связи с тем, что они могут вызывать миопатию и при применении в качестве монотерапии. При одновременном приеме розувастатина с одним из препаратов данной группы пациентам рекомендуется начальная доза розувастатина 5 мг, суточная доза розувастатина 40 мг в данном случае противопоказана. Одновременное применение розувастатина и антацидов, содержащих алюминия и магния гидроксид, приводит к снижению плазменной концентрации розувастатина примерно на 50%. Данный эффект выражен слабее, если антациды применяются через 2 ч после приема розувастатина. Клиническая значимость данного взаимодействия не изучалась. Одновременное применение розувастатина и пероралъных контрацептивов увеличивает AUC этинилэстрадиола и AUC норгестрела на 26% и 34% соответственно, что следует учитывать при подборе дозы пероральных контрацептивов. Фармакокинетические данные по одновременному применению розувастатина и гормонозаместительной терапии отсутствуют, следовательно, нельзя исключить аналогичного эффекта при их совместном применении. Однако, подобная комбинация широко применялась во время проведения клинических исследований розувастатина и хорошо переносилась пациентами. Результаты исследований in vivo и in vitro показали, что розувастатин не является ни ингибитором, ни индуктором изоферментов цитохрома Р450. Розувастатин является непрофильным субстратом для этих изоферментов. Не наблюдалось клинически значимого взаимодействия с такими препаратами, как флуконазол (ингибитор изоферментов CYP2C9 и CYP3A4), кетоконазол (ингибитор изоферментов CYP2A6 и CYP3A4), связанных метаболизмом с системой цитохрома Р450. Совместное применение 10 мг розувастатина и 10 мг эзетимиба у пациентов с гиперхолестеринемией приводило к увеличению AUC розувастатина в 1,2 раза. Однако,нельзя исключить фармакодинамического взаимодейcтвия между розувастатином и эзетимибом в отношении появления нежелательных явлений. Несмотря на то, что точный механизм взаимодействия неизвестен, применение ингибиторов ВИЧ-протеаз с розувастатином может привести к выраженному увеличению экспозиции розувастатина. Фармакокинетическое исследование одновременного применения 20 мг розувастатина с комбинированным препаратом, содержащим два ингибитора ВИЧ-протеаз (400 мг лопинавира/100 мг ритонавира) у здоровых добровольцев приводило к приблизительно двукратному и пятикратному увеличению AUC0-24 и Сmах розувастатина, соответственно. Таким образом, не рекомендуется совместное применение розувастатина с ингибиторами ВИЧ-протеаз у ВИЧ-инфицированных пациентов. Не отмечается клинически значимого взаимодействия розувастатина с дигоксином. В Таблице 1 перечислены различные виды взаимодействия, в том числе взаимодействия, требующие коррекции дозы розувастатина. Следует скорректировать дозу розувастатина при необходимости одновременного применения с другими лекарственными препаратами, повышающими системную концентрацию розувастатина. Если ожидаемое увеличение AUC составляет приблизительно в 2 раза или больше, то начальная доза розувастатина должна составлять 5 мг 1 раз в день. Суточная доза розувастатина должна быть скорректирована таким образом, чтобы его системная концентрация с учетом её повышения не превышала таковую при приеме дозы розувастатина 40 мг в монотерапии. Например, при приеме гемфиброзила доза розувастатина не должна превышать 20 мг (увеличение AUC в 1,9 раза) и 10 мг при приеме комбинации атазанавир/ритонавир (увеличение AUC в 3,1 раза). Таблица 1. Влияние одновременного приема препаратов на экспозицию розувастатина (AUC, в порядке снижения значимости) ТАБЛИЦЪ Фармакологическое действие и фармакокинетика Гиполипидемическое средство из группы статинов. Селективный конкурентный ингибитор 3-гидрокси-3-метилглутарил коэнзим А (ГМГ-КоА)-редуктазы - фермента, превращающего ГМГ-КоА в мевалонат, предшественник холестерина. Увеличивает число рецепторов липопротеинов низкой плотности (ЛПНП) на поверхности гепатоцитов, что приводит к усилению захвата и катаболизма ЛПНП, ингибированию синтеза липопротеинов очень низкой плотности (ЛПОНП), уменьшая общее количество ЛПНП и ЛПОНП. Снижает повышенную концентрацию холестерина-ЛПНП, холестерина-липопротеинов невысокой плотности (неЛПВП), холестерина-ЛПОНП, общего холестерина, триглицеридов (ТГ), ТГ-ЛПОНП, аполипопротеина В (АпоВ), снижает соотношения холестерин-ЛПНП/холестерин-ЛПВП, общий холестерин/холестерин-ЛПВП, холестерин-неЛПВП/холестерин-ЛПВП, АпоВ/аполипопротеина A-I (АпоА-1), повышает концентрацию холестерина-ЛПВП и АпоА-1. Гиполипидемическое действие прямо пропорционально величине назначенной дозы. Терапевтический эффект появляется в течение 1 недели после начала терапии, через 2 недели достигает 90% от максимального, к 4 неделе достигает максимума и после этого остается постоянным. Эффективен у взрослых пациентов с гиперхолестеринемией с или без гипертриглицеридемии (вне зависимости от расы, пола или возраста), в том числе у пациентов с сахарным диабетом и семейной гиперхолестеринемией. У 80% пациентов с гиперхолестеринемией IIа и IIb типа (классификация по Фредриксону) со средним исходным показателем холестерина-ЛПНП около 4,8 ммоль/л на фоне приема препарата в дозе 10 мг концентрация холестерина-ЛПНП достигает значений менее 3 ммоль/л. У пациентов с гомозиготной семейной гиперхолестеринемией, принимающих препарат в дозе 20 мг и 40 мг, среднее снижение концентрации холестерина-ЛПНП составляет 22%. Аддитивный эффект отмечается в комбинации с фенофибратом (в отношении снижения концентрации ТГ) и с никотиновой кислотой в липидснижающих дозах >: 1 г/сут (В отношении повышения концентрации холестерина-ЛПВП). Фармакокинетика: Всасывание Максимальная концентрация (Сmах) розувастатина в плазме крови достигается приблизительно через 5 ч после приема препарата. Абсолютная биодоступность - примерно 20%. Системная экспозиция розувастатина увеличивается пропорционально дозе. Фармакокинетические параметры не изменяются при ежедневном приеме. Распределение Проникает через плацентарный барьер. Розувастатин поглощается преимущественно печенью, которая является основным местом синтеза холестерина и метаболизма ХС-ЛПНП. Объем распределения - 134 л. Связывание с белками плазмы (преимущественно с альбумином) составляет приблизительно 90%. Метаболизм Биотрансформируется в печени в небольшой степени (около 10%), являясь непрофильным субстратом для изоферментов системы цитохрома Р450. Как и в случае других ингибиторов ГМГ-КоА-редуктазы, в процесс печеночного захвата препарата вовлечен специфический мембранный переносчик - полипептид, транспортирующий органический анион (ОАТР) 1В1, выполняющий важную роль в его печеночной элиминации. Основным изоферментом, участвующим в метаболизме розувастатина, является CYP2C9. Изоферменты CYP2C19, CYP3A4 и CYP2D6 вовлечены в метаболизм в меньшей степени. Основными метаболитами розувастатина являются N-десметил и лактоновые метаболиты. N- десметил примерно на 50% менее активен, чем розувастатин, лактоновые метаболиты фармакологически неактивны. Более 90% фармакологической активности по ингибированию циркулирующей ГМГ-КоА-редуктазы обеспечивается розувастатином, остальное - его метаболитами. Выведение Около 90% дозы розувастатина выводится в неизмененном виде через кишечник, оставшаяся часть - почками. Период полувыведения (Т1/2) - примерно 19 ч, не изменяется при увеличении дозы препарата. Среднее значение плазменного клиренса составляет приблизительно 50 л/ч (коэффициент вариации 21,7%). У пациентов с легкой и умеренно выраженной почечной недостаточностью плазменная концентрация розувастатина или N-десметила существенно не меняется. У пациентов с выраженной почечной недостаточностью (клиренс креатинина (КК) менее 30 мл/мин) концентрация розувастатина в плазме выше в 3 раза, а N-десметила - в 9 раз, чем у здоровых добровольцев. Концентрация розувастатина в плазме у пациентов, находящихся на гемодиализе, примерно на 50% выше, чем у здоровых добровольцев. У пациентов с различными стадиями печеночной недостаточности с баллом 7 и ниже по шкале Чайлд-Пью не выявлено увеличения Т1/2 розувастатина: у больных с баллами 8 и 9 по шкале Чайлд-Пью отмечено удлинение в 2 раза. Опыт применения препарата у пациентов с более выраженными нарушениями функции печени отсутствует. Пол и возраст не оказывают клинически значимого влияния на фармакокинетику розувастатина. Фармакокинетические параметры зависят от расовой принадлежности: площадь под кривой "концентрация-время" (AUC) у японцев и китайцев в 2 раза выше таковой у жителей Европы и Северной Америки. У представителей монголоидной расы и индийцев среднее значение AUC и Сmах увеличивается в 1,3 раза. Особые указания Влияние на функцию почек У пациентов, получавших высокие дозы розувастатина (в основном 40 мг), в ходе анализа мочи тест-полосками наблюдалась канальцевая протеинурия, которая в большинстве случаев была транзиторной. Такая протеинурия не свидетельствовала об остром заболевании почек или прогрессировании заболевания почек. Частота сообщений о развитии серьезных побочных реакций со стороны почек в постмаркетинговый период была выше у пациентов, принимавших розувастатин в дозе 40 мг. При применении препарата Розарт в дозе 40 мг рекомендуется контролировать показатели функции почек во время лечения. Влияние на опорно-двигательный аппарат При применении всех доз розувастатина и, в особенности при приеме доз, превышающих 20 мг, сообщалось о развитии миалгии, миопатии и в редких случаях о рабдомиолизе. В очень редких случаях сообщалось о развитии рабдомиолиза при одновременном приеме ингибиторов ГМГ-КоА-редуктазы и эзетимиба. В данном случае нельзя исключить фармакодинамического взаимодействия, поэтому следует соблюдать осторожность при их совместном приеме. Как при приеме других ингибиторов ГМГ-КоА-редуктазы частота сообщений в постмаркетинговый период наблюдения о развитии рабдомиолиза, связанного с приемом розувастатина, была выше при приеме дозы 40 мг. Определение креатинфосфокиназы Определение активности КФК не следует проводить после интенсивных физических нагрузок или при наличии других возможных причин увеличения ее активности, что может привести к неверной интерпретации полученных результатов. В случае, если исходная активность КФК существенно повышена, через 5-7 дней следует провести повторное измерение - не следует начинать терапию, если повторный тест подтверждает исходную активность КФК (в 5 раз выше нормы). До начала терапии Следует соблюдать осторожность при назначении препарата Розарт, также как и при назначении других ингибиторов ГМГ-КоА- редуктазы, пациентам с имеющимися факторами риска развития миопатии/рабдомиолиза (см. раздел С осторожностью). Необходимо рассмотреть соотношение ожидаемой пользы от терапии и потенциального риска и проводить клиническое наблюдение на протяжении всего курса лечения. В случае, если исходная активность КФК существенно повышена (в 5 раз выше ВГН), то не следует начинать лечение препаратом. Во время лечения Следует проинформировать пациента о необходимости немедленного сообщения врачу о случаях неожиданного появления мышечных болей, мышечной слабости или спазмах, особенно в сочетании с недомоганием и лихорадкой. У таких пациентов следует определять активность КФК. Терапию следует прекратить, если активность КФК значительно увеличен (более чем в 5 раз по сравнению с ВГН) или если мышечные симптомы резко выражены и вызывают ежедневный дискомфорт (даже, если активность КФК в 5 раз меньше по сравнению с ВГН). Если симптомы исчезают, и активность КФК возвращается к норме, следует рассмотреть вопрос о повторном назначении препарата Розарт или других ингибиторов ГМГ-КоА- редуктазы в меньших дозах при тщательном наблюдении за пациентом. Рутинный мониторинг активности КФК при отсутствии симптомов нецелесообразен. Отмечены очень редкие случаи иммуноопосредованной некротизирующей миопатии с клиническими проявлениями в виде стойкой слабости проксимальных мышц и повышения активности КФК в сыворотке крови во время лечения или прекращении приема статинов, в том числе розувастатина. Не отмечено признаков увеличения воздействия на скелетную мускулатуру при приеме розувастатина и сопутствующей терапии. Однако, сообщалось об увеличении числа случаев миозита и миопатии у пациентов, принимавших другие ингибиторы ГМГ-КоА-редуктазы в сочетании с производными фибриновой кислоты (включая гемфиброзил), циклоспорин, никотиновую кислоту в липидснижающих дозах >: 1 г/сут, азольные противогрибковые препараты, ингибиторы протеаз и макролидные антибиотики. Гемфиброзил увеличивает риск развития миопатии при одновременном приеме с некоторыми ингибиторами ГМГ-КоА-редуктазы, поэтому одновременное применение гемфиброзила и розувастатина не рекомендуется. Следует тщательно взвесить соотношение ожидаемой пользы и потенциального риска при совместном применении препарата Розарт и фибратов или никотиновой кислоты в липидснижающих дозах >: 1 г/сут. Противопоказан прием препарата Розарт в дозе 40 мг одновременно с фибратами (см. разделы Взаимодействие с другими лекарственными препаратами и Противопоказания). Во время лечения, особенно в период коррекции дозы препарата Розарт, каждые 2-4недели следует осуществлять мониторинг липидного профиля и согласно нему при необходимости изменять дозу препарата. Препарат Розарт не следует принимать пациентам при проявлении острых и выраженных симптомов миопатии или с наличием факторов риска, предрасполагающих к развитию нарушения функции почек и вторичного рабдомиолиза (например, сепсис, артериальная гипотензия, обширные хирургические вмешательства, травмы, выраженные нарушения метаболизма, выраженные эндокринные нарушения и тяжелые нарушения водно-электролитного баланса, неконтролируемые судороги). Влияние на функцию печени Как и другие ингибиторы ГМГ-КоА-редуктазы розувастатин следует применять с осторожностью у пациентов, злоупотребляющих алкоголем и/или с заболеванием печени в анамнезе. Рекомендуется проводить определение показателей функции печени до начала терапии и через 3 месяца после начала терапии. Прием препарата Розарт следует прекратить или уменьшить дозу препарата, если уровень активности "печеночных" трансаминаз в сыворотке крови в 3 раза превышает ВГН. У пациентов с гиперхолестеринемией вследствие гипотиреоза или нефротического синдрома терапия основных заболеваний должна проводиться до начала лечения препаратом Розарт. При постмаркетинговом наблюдении розувастатина частота сообщений о развитии серьезных нарушений функции печени (выражающихся преимущественно в повышении активности "печеночных" трансаминаз) была выше при приеме дозы 40 мг. Этнические группы В ходе фармакокинетических исследований среди пациентов монголоидной расы по сравнению с европеоидной отмечено увеличение системной концентрации розувастатина (см. раздел Способ применения и дозы и Фармакокинетика). Ингибиторы ВИЧ-протеаз В ходе совместного приема розувастатина и комбинации различных ингибиторов ВИЧ- протеаз с ритонавиром наблюдается увеличение системной концентрации розувастатина. Следует тщательно оценивать снижение концентрации липидов в крови, а также учитывать возможное повышение розувастатина в плазме крови в начале лечения и в период повышения дозы препарата Розарт у пациентов с ВИЧ, принимающих ингибиторы ВИЧ-протеаз. Одновременный прием ингибиторов ВИЧ- протеаз не рекомендуется без коррекции дозы розувастатина (см. раздел Способ применения и дозы и Взаимодействие с другими лекарственными препаратами). Интерстициальное заболевание легких При применении некоторых ингибиторов ГМГ-КоА-редуктазы, особенно в течение длительного времени, сообщалось о единичных случаях интерстициального заболевания легких. Проявлениями заболевания могут являться одышка, непродуктивный кашель и ухудшение общего самочувствия (слабость, снижение веса и лихорадка). При подозрении на интерстициальное заболевание легких следует прекратить терапию ингибиторами ГМГ-КоА-редуктазы. Сахарный диабет II типа Некоторые данные подтверждают то, что ингибиторы ГМГ-КоА-редуктазы повышают концентрацию глюкозы в крови и увеличивают у некоторых пациентов вероятность развития сахарного диабета II типа. Однако данный риск перевешивается способностью ингибиторов ГМГ-КоА-редуктазы снижать риск развития сосудистых осложнений, поэтому данный факт не является причиной для прерывания лечения розувастатином. Необходимо установить клиническое наблюдение и проводить биохимический анализ крови согласно национальным стандартам у пациентов с риском развития гипергликемии (концентрация глюкозы в крови 5,6-6,9 ммоль/л, индекс массы тела >: 30 кг/м 2, триглицеридемия, артериальная гипертензия). В одном из исследований розувастатина сообщалась общая частота развития сахарного диабета: 2,8% в группе розувастатина и 2,3% в плацебо группе в основном у пациентов с глюкозой натощак 5,6 - 6,9 ммоль/л. Непереносимость лактозы Препарат Розарт не следует принимать пациентам с непереносимостью лактозы, дефицитом лактазы и глюкозно-галактозной мальабсорбцией, поскольку в его состав входит лактозы моногидрат. Влияние на способность управлять транспортными средствами: Не проводилось исследований по изучению влияния розувастатина на способность управлять транспортными средствами и механизмами. При управлении транспортными средствами и занятии потенциально опасными видами деятельности пациентам следует соблюдать осторожность, так как во время терапии может возникать головокружение. Условия хранения и отпуска из аптек Условия хранения:При температуре не выше 30 °С. Хранить в недоступном для детей месте! Отпуск из аптек: По рецепту Регистрационные данные Торговое название Розарт Международное непатентованное название:Розувастатин. Форма выпуска:таблетки, покрытые плёночной оболочкой. Состав:1 таблетка, покрытая плёночной оболочкой, 5 мг содержит: активное вещество: розувастатин 5,00 мг (в виде розувастатина кальция 5,21 мг): вспомогательные вещества: целлюлоза микрокристаллическая, тип 102 11,55 мг, кросповидон, тип А 3,5 мг, кальция гидрофосфата дигидрат 17,15 мг, лактозы моногидрат 31,71 мг, магния стеарат 0,88 мг: плёночное покрытие: Опадрай белый II 33G28435 ~ 2,1 мг (гипромеллоза-2910 0,84 мг, титана диоксид 0,525 мг, лактозы моногидрат 0,441 мг, макрогол-3350 0,168 мг, триацетин 0,126 мг). 1 таблетка, покрытая плёночной оболочкой, 10 мг содержит: активное вещество: розувастатин 10 мг (в виде розувастатина кальция 10,42 мг): вспомогательные вещества: целлюлоза микрокристаллическая, тип 102 23,1 мг, кросповидон, тип А 7 мг, кальция гидрофосфата дигидрат 34,3 мг, лактозы моногидрат 63,42 мг, магния стеарат 1,76 мг: плёночное покрытие: Опадрай розовый II 33G240007 ~ 4,2 мг (гипромеллоза-2910 1,68 мг, титана диоксид 1,0441 мг, лактозы моногидрат 0,882 мг, макрогол-3350 0,336 мг, триацетин 0,252 мг, краситель кармин красный 0,0059 мг). 1 таблетка, покрытая плёночной оболочкой, 20 мг содержит: активное вещество: розувастатин 20 мг (в виде розувастатина кальция - 20,84 мг): вспомогательные вещества: целлюлоза микрокристаллическая, тип 102 46,2 мг, кросповидон, тип А 14 мг, кальция гидрофосфата дигидрат 68,6 мг, лактозы моногидрат 126,84 мг, магния стеарат 3,52 мг: плёночное покрытие: Опадрай розовый II 33G240007 ~ 8,4 мг (гипромеллоза-2910 3,36 мг, титана диоксид 2,0882 мг, лактозы моногидрат 1,764 мг, макрогол-3350 0,672 мг, триацетин 0,504 мг, краситель кармин красный 0,0118 мг). 1 таблетка, покрытая плёночной оболочкой, 40 мг содержит: активное вещество: розувастатин 40 мг (в виде розувастатина кальция 41,68 мг): вспомогательные вещества: целлюлоза микрокристаллическая, тип 102 92,4 мг, кросповидон, тип А 28 мг, кальция гидрофосфата дигидрат 137,2 мг, лактозы моногидрат 253,68 мг, магния стеарат 7,04 мг: плёночное покрытие: Опадрай розовый II 33G240007 ~ 16,8 мг (гипромеллоза-2910 6,72 мг, титана диоксид 4,1765 мг, лактозы моногидрат 3,528 мг, макрогол-3350 1,344 мг, триацетин 1,008 мг, краситель кармин красный 0,0235 мг). АТХ: Регистрация: Лекарственное средство ЛП-002213 Фармгруппа: Гиполипидемическое средство - ГМГ-КоА редуктазы ингибитор. Дата регистрации: 02.09.2013 / 07.03.2017. Окончание регстрации: . Описание:Таблетки 5 мг Круглые, двояковыпуклые таблетки, покрытые плёночной оболочкой белого цвета с гравировкой "ST 1" на одной стороне таблетки. Таблетки 10 мг Круглые, двояковыпуклые таблетки, покрытые плёночной оболочкой розового цвета с гравировкой "ST 2" на одной стороне таблетки. Таблетки 20 мг Круглые, двояковыпуклые таблетки, покрытые плёночной оболочкой розового цвета с гравировкой "ST 3" на одной стороне таблетки. Таблетки 40 мг. Овальные, двояковыпуклые таблетки, покрытые плёночной оболочкой розового цвета с гравировкой "ST 4" на одной стороне таблетки. Упаковка:Таблетки, покрытые плёночной оболочкой, 5 мг, 10 мг, 20 мг и 40 мг. По 7, 10 или 14 таблеток в блистер ПВХ/ПВДХ/Алюминиевая фольга или в блистер Алюминиевая фольга/Алюминиевая фольга. По 4 блистера по 7 таблеток, по 3 или 9 блистеров по 10 таблеток и по 2 или 6 блистеров по 14 таблеток с инструкцией по применению в картонную пачку. Срок годности:2 года. Не применять по истечении срока годности. Владелец рег.удостоверения:Актавис Групп ПТС ехф Производитель:ACTAVIS, Ltd. Представительство:Актавис, ООО

Модель:
RUR 709
Показания ■ Первичный билиарный цирроз при отсутствии признаков декомпенсации (симптоматическое лечение) ■ Растворение холестериновых камней желчного пузыря ■ Билиарный рефлюкс-гастрит ■ Первичный склерозирующий холангит ■ Алкогольная болезнь печени ■ Неалкогольный стеатогепатит ■ Кистозный фиброз (муковисцидоз) ■ Хронические гепатиты различного генеза ■ Дискинезия желчевыводящих путей Противопоказания Противопоказания Рентгеноположительные (с высоким содержанием кальция) желчные камни, нефункционирующий желчный пузырь, острые инфекционно-воспалительные заболевания желчного пузыря, желчных протоков и кишечника, цирроз печени в стадии декомпенсации, выраженные нарушения функции почек, печени, поджелудочной железы, повышенная чувствительность к компонентам препарата. Урсодезоксихолевая кислота не имеет возрастных ограничений в применении, однако детям в возрасте до 3 лет не рекомендуется применять препарат в данной лекарственной форме. С осторожностью: С осторожностью применяют у детей в возрасте от 3 до 4 лет, так как возможно затруднение при проглатывании капсул. Беременность В экспериментальных исследованиях на животных не выявлено мутагенного и канцерогенного действия УДХК. Применение УДХК при беременности возможно только в том случае, когда ожидаемая польза для матери превышает потенциальный риск для плода (адекватных строго контролируемых исследований применения урсодезоксихолевой кислоты у беременных женщин не проводилось). При необходимости применения УДХК в период лактации следует решить вопрос о прекращении грудного вскармливания. Данные о выделении урсодезоксихолевой кислоты с грудным молоком в настоящее время отсутствуют. Применение и дозы Капсулы Урдокса® принимают внутрь, не разжевывая, запивая небольшим количеством воды. Симптоматическое лечение первичного билиарного цирроза Суточная доза зависит от массы тела и составляет от 3 до 7 капсул (примерно 14 ± 2 мг урсодезоксихолевой кислоты на 1 кг массы тела). В первые 3 месяца лечения прием препарата Урдокса® следует разделить на несколько приемов в течение дня. После улучшения печеночных показателей суточную дозу препарата можно принимать 1 раз, вечером. Рекомендуется следующий режим применения: ТАБЛИЦЪ Препарата Урдокса® необходимо принимать ежедневно вечером, перед сном. Длительность терапии составляет 6-12 месяцев. Для профилактики повторного холелитиаза рекомендован прием препарата в течение нескольких месяцев после растворения камней. Леченые билиарного рефлюкс-гастрита 1 капсула препарата Урдокса® ежедневно 1 раз в день перед сном. Курс лечения от 10-14 дней до 6 месяцев, при необходимости до 2 лет. Первичный склерозирующий холангит Суточная доза составляет 12-15 мг/кг: при необходимости доза может быть увеличена до 20-30 мг/кг в 2-3 приема. Длительность терапии составляет от 6 месяцев до нескольких лет. Алкогольная болезнь печени Средняя суточная доза составляет 10-15 мг/кг в 2-3 приема. Длительность терапии составляет от 6-12 месяцев и более. Неалкогольный стеатогепатит Средняя суточная доза составляет 10-15 мг/кг в 2-3 приема. Длительность терапии составляет от 6-12 месяцев и более. Кистозный фиброз (муковисцидоз) Суточная доза составляет 12-15 мг/кг: при необходимости доза может быть увеличена до 20-30 мг/кг в 2-3 приема. Длительность терапии составляет от 6 месяцев до нескольких лет или пожизненно. Хронические гепатиты различного генеза Суточная доза составляет 10-15 мг/кг в 2-3 приема. Длительность терапии составляет 6- 12 месяцев и более. Дискинезия желчевыводящих путей Средняя суточная доза составляет 10 мг/кг в 2 приема. Длительность терапии составляет от 2 недель до 2 месяцев. При необходимости курс лечения рекомендуется повторить. Детям старше 3 лет УДХК назначают индивидуально из расчета 10-20 мг/кг/сут. Побочные эффекты и передозировка Побочные эффекты: Частота нежелательных реакций приведена в соответствии со следующей шкалой: очень часто (>: 10 %): часто (>: 1 % и <:10 %): нечасто (>: 0,1 % и <: 1 %): редко (>: 0,01 % и <: 0,01 %): очень редко (<: 0,01 %). Со стороны желудочно-кишечного тракта: часто - диарея: редко - тошнота, рвота: очень редко - острые боли в правой верхней части живота. Со стороны печени и желчевыводящих путей: редко - преходящее повышение активности "печеночных" ферментов: очень редко - кальцинирование желчных камней. При лечении развитых стадий первичного билиарного цирроза очень редко - декомпенсация цирроза печени, которая исчезает после отмены препарата. Со стороны кожных покровов: очень редко - крапивница. Если любые из указанных в инструкции нежелательных явлений усугубляются, или Вы заметили любые другие нежелательные явления, не указанные в инструкции, сообщите об этом врачу. Передозировка: Случаи передозировки УДХК не известны. В случае передозировки проводят симптоматическое лечение. Взаимодействие с другими ЛС: Колестирамин, колестипол и антациды, содержащие алюминия гидроксид или смектит (алюминия оксид), снижают абсорбцию УДХК в кишечнике и таким образом уменьшают ее поглощение и эффективность. Если же применение препаратов, содержащих хотя бы одно из этих веществ, все же является необходимым, их следует принимать минимум за 2 часа до приема препарата Урдокса®. Урсодезоксихолевая кислота может усилить поглощение циклоспорина из кишечника. Поэтому у пациентов, принимающих циклоспорин, врач должен проверить концентрацию циклоспорина в крови и скорректировать дозу циклоспорина в случае необходимости. В отдельных случаях препарат Урдокса® может снижать всасывание ципрофлоксацина. Гиполипидемические лекарственные препараты (особенно клофибрат), эстрогены, неомицин или прогестины увеличивают насыщение желчи холестерином и могут снижать способность растворять холестериновые желчные конкременты. Следует сообщить врачу обо всех препаратах, которые вы принимаете. Фармакологическое действие и фармакокинетика Гепатопротекторное средство, оказывает также желчегонное, холелитолитическое, гипохолестеринемическое, гиполипидемическое, иммуномодулирующее действие. Встраивается в мембрану гепатоцита, стабилизирует ее структуру и защищает гепатоцит от повреждающего действия солей желчных кислот, снижая, таким образом, их цитотоксический эффект. При холестазе активирует Са 2-зависимую альфа-протеазу и стимулирует экзоцитоз, уменьшает концентрацию токсичных желчных кислот (хенодезоксихолевой, литохолевой, дезоксихолевой и др.), концентрации которых у больных с хроническими заболеваниями печени повышены. Конкурентно снижает всасывание липофильных желчных кислот в кишечнике, повышает их "фракционный" оборот при энтерогепатической циркуляции, индуцирует холерез, стимулирует пассаж желчи и выведение токсичных желчных кислот через кишечник. Экранирует неполярные желчные кислоты (хенодезоксихолевую), благодаря чему формируются смешанные (нетоксичные) мицеллы. Снижает насыщение желчи холестерином путем уменьшения синтеза и секреции холестерина в печени и ингибирования его всасывания в кишечнике. Повышает растворимость холестерина в желчевыводящей системе, стимулирует образование и выделение желчи. Уменьшает литогенность желчи, увеличивает в ней концентрацию желчных кислот, вызывает усиление желудочной и панкреатической секреции, усиливает активность липазы, оказывает гипогликемическое действие. Вызывает частичное или полное растворение холестериновых желчных камней, уменьшает насыщенность желчи холестерином, что способствует его мобилизации из желчных камней. Оказывает иммуномодулирующее действие, влияет на иммунологические реакции в печени: уменьшает экспрессию некоторых антигенов гистосовместимости - HLA-1 на мембране гепатоцитов и HLA-2 на холангиоцитах, влияет на количество Т-лимфоцитов, образование интерлейкина 2, уменьшает количество эозинофилов, подавляет иммунокомпетентные Ig (в первую очередь IgM). Фармакокинетика: Урсодезоксихолевая кислота (УДХК) абсорбируется в тонкой кишке за счет пассивной диффузии (около 90 %), а в подвздошной кишке посредством активного транспорта. Максимальная концентрация в плазме крови (Сmах) при приеме внутрь 50 мг через 30, 60, 90 мин 0 3,8 ммоль/л, 5,5 ммоль/л и 3,7 ммоль/л соответственно. Сmах достигается через 1-3 часа. Связь с белками плазмы высокая - до 96-99 %. Проникает через плацентарный барьер. При систематическом приеме препарата УДХК становится основной желчной кислотой в сыворотке крови и составляет около 48 % от общего количества желчных кислот в крови. Терапевтический эффект препарата зависит от концентрации УДХК в желчи. Метаболизируется в печени (клиренс при "первичном прохождении" через печень) в тауриновый и глициновый конъюгаты. Образующиеся конъюгаты секретируются в желчь. Около 50-70 % общей дозы препарата выводится с желчью. Незначительное количество невсосавшейся УДХК поступает в толстую кишку, где подвергается расщеплению бактериями (7-дегидроксилирование): образующаяся литохолевая кислота частично всасывается из толстой кишки, но сульфатируется в печени и быстро выводится в виде сульфолитохолилглицинового или сульфолитохолилтауринового конъюгата. Особые указания Прием препарата Урдокса® должен осуществляться под наблюдением врача. При приеме препарата с целью растворения желчных камней необходимо соблюдение следующих условий: камни должны быть холестериновыми (рентгенонегативными), их размер не должен превышать 15-20 мм, желчный пузырь должен оставаться функциональным и должен быть наполнен камнями не более чем на половину, проходимость пузырного и общего желчного протока должна быть сохранена. При длительном (более 1 месяца) приеме препарата, каждые 4 недели в первые 3 месяца лечения, в дальнейшем - каждые 3 месяца необходимо проводить биохимический анализ крови для определения активности печеночных трансаминаз. Контроль эффективности лечения следует проводить каждые 6 месяцев по данным ультразвукового исследования желчевыводящих путей. После полного растворения камней рекомендуется продолжать применение препарата в течение, по крайней мере, 3 месяцев, для того, чтобы способствовать растворению остатков камней, размеры которых слишком малы для их обнаружения и для профилактики рецидива камнеобразования. У пациентов с первичным билиарным циррозом в редких случаях клинические симптомы могут ухудшиться в начале лечения, например, может участиться зуд. В этом случае лечение следует продолжить, принимая по 1 капсуле ежедневно, далее следует повышать дозировку (увеличивая суточную дозу еженедельно на 1 капсулу) до тех пор, пока вновь не будет достигнут рекомендованный режим дозирования. В случае развития нежелательных или тяжелых реакций пациенту необходимо сразу же информировать о них лечащего врача и, ни в коем случае не продолжать прием препарата без его рекомендации. Влияние на способность управлять транспортными средствами: Влияния на способность к управлению транспортными средствами и работу с механизмами выявлено не было. Условия хранения и отпуска из аптек Условия хранения:В сухом, защищенном от света месте при температуре не выше 25 °С. Хранить в недоступном для детей месте. Отпуск из аптек: По рецепту Регистрационные данные Торговое название Урдокса® Международное непатентованное название:Урсодезоксихолевая кислота. Форма выпуска:капсулы. Состав:Состав на одну капсулу Активное вещество: урсодезоксихолевая кислота - 250 мг. Вспомогательные вещества: крахмал кукурузный - 73,0 мг, кремния диоксид коллоидный безводный - 5,0 мг, магния стеарат - 2,0 мг. Капсула твердая желатиновая: желатин - 98 %, титана диоксид [Е 171] - 2%. АТХ: Регистрация: Лекарственное средство ЛСР-001873/09 Фармгруппа: Гепатопротекторное средство. Дата регистрации: 13.03.2009 / 16.12.2015. Окончание регстрации: . Описание:Белые или почти белые твердые непрозрачные желатиновые капсулы № 0. Содержимое капсул: белый или почти белый порошок или гранулят. Упаковка:Капсулы 250 мг. По 10 капсул в контурную ячейковую упаковку из пленки поливинилхлоридной и фольги алюминиевой печатной лакированной. По 50 или 100 капсул в банки полимерные или банки полимерные с крышками для лекарственных средств. Крышка банки может быть выполнена из пластика желтого цвета. На каждую банку наклеивают этикетку из бумаги писчей или этикеточной или этикетку самоклеящуюся. По одной банке или по 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 контурных ячейковых упаковок вместе с инструкцией по применению помещают в картонную пачку. Срок годности:4 года. Не применять по истечении срока годности, указанного на упаковке. При уничтожении неиспользованных упаковок препарата специальных мер предосторожностей не требуется. Владелец рег.удостоверения:ОБОЛЕНСКОЕ ФАРМАЦЕВТИЧЕСКОЕ ПРЕДПРИЯТИЕ, ЗАО Производитель:ОБОЛЕНСКОЕ ФАРМАЦЕВТИЧЕСКОЕ ПРЕДПРИЯТИЕ, ЗАО. Представительство
Модель:
RUR 1055
Показания — первичная гиперхолестеринемия, включая гетерозиготную семейную гиперхолестеринемию (гиперлипидемия IIа типа по классификации Фредриксона) или смешанная гиперхолестеринемия (гиперлипидемия IIb типа по классификации Фредриксона), гипертриглицеридемия (гиперлипидемия IV типа по классификации Фредриксона) в качестве дополнения к диете, когда диета и другие немедикаментозные методы лечения (например, физические упражнения, снижение массы тела) оказываются недостаточными. Противопоказания повышенная чувствительность к питавастатину, вспомогательным компонентам препарата и другим ингибиторам ГМГ-КоА-редуктазы (статинам); тяжелая печеночная недостаточность (более 9 баллов по шкале Чайлд-Пью) или класс С по классификации Чайлд-Пью, заболевания печени и активной фазе, включая стойкое повышение активности печеночных трансаминаз в сыворотке крови (более чем в 3 раза по сравнению с ВГН); миопатия; одновременный прием циклоспорина; беременность; период грудного вскармливания; отсутствие адекватных методов контрацепции у женщин детородного возраста; возраст до 18 лет (эффективность и безопасность не установлены). непереносимость лактозы, дефицит лактазы или глюкозо-галактозная мальабсорбция. С осторожностью При наличии риска развития миопатии/рабдомиолиза - почечная недостаточность, гипотиреоз, личный или семейный анамнез наследственных мышечных заболеваний и предшествующий анамнез мышечной токсичности при применении других ингибиторов ГМГ-КоА-редуктазы или фибратов, заболевания печени в анамнезе, злоупотребление алкоголем, возраст старше 70 лет. Применение при беременности и кормлении грудью Беременность Применение препарата Ливазо при беременности противопоказано. Женщинам детородного возраста при лечении Ливазо следует использовать надежные методы контрацепции. Т.к. холестерин и другие продукты биосинтеза холестерина необходимы для развития плода, потенциальный риск ингибировання ГМГ-КоА редуктазы превышает пользу oт лечения препаратом во время беременности. Исследования на животных показали, что питавастатин обладает репродуктивной токсичностью, но без тератогенного потенциала. Если пациентка планирует беременность, следует прекратить лечение как минимум за один месяц до зачатия. При наступлении беременности во время применения Ливазо. лечение следует немедленно прекратить. Период грудного вскармливания Применение препарата Ливазо в период грудного вскармливания противопоказано. Питавастатин выводится с молоком лактирующих крыс. Данные о выделении питавастатина с грудным молоком отсутствуют. При необходимости применения препарата Ливазо в период лактации грудное вскармливание необходимо прекратить. Применение при нарушениях функции печени Пациентам с легкими и умеренными нарушениями функции печени рекомендована максимальная суточная доза 2 мг. Запрещено применение препарата с тяжелой печеночной недостаточностью (более 9 баллов по шкале Чайлд-Пыо) или класс С по классификации Чайлд-Пыо, заболеваниями печени в активной фазе, включая стойкое повышение активности "печеночных" грансамнназ в сыворотке крови (более чем в 3 раза по сравнению с верхней границей нормы (ВГН)). Применение при нарушениях функции почек С осторожностью следует применять препарат при почечной недостаточности. Данные по применению максимальной суточной дозы препарата 4 мг при нарушениях функции почек любой степени тяжести ограничены, поэтому назначать максимальную суточную дозу 4 мг необходимо только при тщательном контроле функции почек после постепенного повышения дозы. Не рекомендуется пациентам с тяжелыми нарушениями функции почек назначать максимальную суточную дозу в 4 мг; рекомендуется рассмотреть ограничение максимальной суточной дозы до 2 мг при тяжелой почечной недостаточности. Применение у детей Запрещено применение препарата пациентам в возрасте до 18 лет (т.к. эффективность и безопасность не установлены). Применение у пожилых пациентов Пациентам пожилого возраста коррекция дозы не требуется. Применение и дозы Внутрь, таблетки необходимо проглатывать целиком. Предпочтителен прием таблетки в одно и то же время суток, лучше вечером, в соответствии с циркадным ритмом липидного обмена. До начала лечения и в процессе пациенты должны придерживаться гипохолестеринемической диеты. Начальная доза препарата 1 мг/сут однократно. При необходимости дозу препарата увеличивают с интервалами не менее 4 недель до 2 мг/сут. Дозу следует подбирать индивидуально в соответствии с концентрациями ХС ЛПНП, целью лечения и ответом пациента на лечение. Большинству пациентов требуется доза 2 мг. Максимальная суточная доза - 4 мг. Пациенты с легкими и умеренными нарушениями функции печени: рекомендована максимальная суточная доза 2 мг. Пациенты с нарушением функции почек: при нарушении функции почек легкой степени тяжести (желательно объективно оценить данную степень с отражением КК или СКФ), препарат Ливазо следует применять с осторожностью. Данные по применению максимальной суточной дозы препарата 4 мг при нарушениях функции почек любой степени тяжести ограничены, поэтому назначать максимальную суточную дозу 4 мг необходимо только при тщательном контроле функции почек после постепенного повышения дозы. Не рекомендуется пациентам с тяжелыми нарушениями функции почек назначать максимальную суточную дозу в 4 мг; рекомендуется рассмотреть ограничение максимальной суточной дозы до 2 мг при тяжелой почечной недостаточности. Пациенты пожилого возраста: коррекция дозы не требуется. Побочные эффекты и передозировка В контролируемых клинических исследованиях при приеме рекомендованных доз менее 4% пациентов, получавших лечение препаратом Лнвазо. было исключено из исследования в связи с развитием нежелательных реакций. Наиболее распространенной была миалгия. В зависимости от частоты возникновения выделяют следующие нежелательные реакции в соответствии с классификацией ВОЗ: очень часто ( 10), часто (от 1/100 до < 1/10), нечасто (от 1/1000 до < ь 1/100), редко (от 1/10 000 до < 1/10 000), очень редко (< 1/10 000) и частота неизвестна (имеющиеся данные не позволяют определить частоту). Со стороны органов кроветворения: нечасто - анемия. Со стороны обмена веществ: нечасто - анорексия. Нарушение психики: часто - бессонница. Со стороны нервной системы: часто - головная боль; нечасто - головокружение, нарушение вкуса, сонливость. Со стороны органов чувств: нечасто - звон в ушах; редко - снижение остроты зрения. Со стороны кожных покровов: нечасто - кожный зуд, супь; редко - крапивница, эритема. Со стороны костно-мышечной системы: часто - миалгия, артралгия; нечасто - мышечные спазмы. Со стороны мочевыделительной системы: нечасто - поллакиурия. Со стороны пищеварительной системы: часто - запор, диарея, диспепсия, тошнота; нечасто - боли в животе, сухость слизистой оболочки полости рта, рвота; редко - глоссодиния, острый панкреатит, холестатическая желтуха. Нежелательные явления при применении других статинов: нарушение сна, включая кошмарные сновидения; сексуальная дисфункция; депрессия; интерстициальное заболевание легких; сахарный диабет: частота возникновения зависит от наличия или отсутствия факторов риска (концентрация глюкозы в крови натощак 5 ммоль/л, ИМТ>30 кг/м 2, повышенная концентрация ТГ, артериальная гипертензия в анамнезе); повышение гликозилированного гемоглобина. Фармакологическое действие и фармакокинетика Всасывание Питавастатин быстро всасывается в верхних отделах ЖКТ, Сmax в плазме крови достигается в течение 1 ч после приема препарата. Прием пищи не влияет на абсорбцию. Сmax питавастатина в плазме крови снижается на 43% при совместном приеме с жирной пищей, но AUC остается неизменной. Неизменный препарат подвергается кишечно-печеночной рециркуляции и хорошо абсорбируется из тощей и подвздошной кишки. Абсолютная биодоступность питавастатина составляет 51%. Распределение Более 99% питавастатина связывается с белками плазмы крови, в основном с альбумином и альфа-1 кислым гликопротеином. Средний Vd 133 л. Питавастатин активно проникает в гепатоциты при помощи транспортных белков OATP1B1 и OATP1B3. AUC варьирует в пределах 4-кратного увеличения от минимального до максимального значения. Питавастатин не является субстратом для Р-гликопротеина. Метаболизм В плазме содержится в основном неизмененный питавастатин. Основным метаболитом является неактивный лактон, который образуется из конъюгата питавастатин глюкуронида эфирного типа с участием УДФ-глюкуронозилтрансфераз (UGT1A3 и 2В7). Цитохром Р450 влияет на метаболизм питавастатина минимально. Изофермент CYP2C9 (и в меньшей степени изофермент CYP2C8) участвуют в метаболизме питавастатина до второстепенных метаболитов. Выведение Питавастатин в неизмененном виде быстро выводится из печени с желчью, но подвергается кишечно-печеночной рециркуляции, обеспечивающей его длительный эффект. Менее 5% питавастатина выводится почками. T1/2 из плазмы варьирует от 5.7 ч (однократный прием) до 8.9 ч (в равновесном состоянии), среднее значение клиренса - 43.4 л/ч после однократного приема внутрь. Фармакокинетика у различных групп пациентов Пациенты пожилого возраста: при оценке фармакокинетики питавастатнна у пациентов пожилого возраста старше 65 лет AUC питавастатина была в 1.3 раза выше. Это не повлияло на эффективность или безопасность. Печеночная недостаточность: у пациентов с легкими нарушениями функции печени (класс А по классификации Чайлд-Пью) AUC была в 1.6 раз выше чем у здоровых добровольцев, в то время как у пациентов с умеренным нарушением функции печени (класс В по классификации Чайлд-Пью) AUC была в 3.9 раз выше. При выраженном нарушении функции печени применение питавастатина противопоказано. Почечная недостаточность: у пациентов с умеренной почечной недостаточностью и находящихся на гемодиализе, отмечалось увеличение AUC и 1.8 раз и 1.7 раз соответственно. Половые различия: отмечено увеличение AUC у женщин по сравнению с мужчинами в 1.6 раз в исследовании здоровых добровольцев, что никак не сказывалось на эффективности и безопасности препарата Ливазо. Расовая принадлежность: по результатам фармакокинетического анализа данных, полученных у здоровых добровольцев разной расовой принадлежности (японская и европеоидная популяции), такие факторы как пол и возраст не влияли на фармакокинетику питавастатина. Особые указания Воздействие на мышечную ткань Как и при применении других ингибиторов ГМГ-КоА редуктазы (статинов), существует вероятность развития миалгии, миопатии и, в редких случаях, рабдомиолиза. Следует предупредить пациентов о необходимости сообщать о любых мышечных симптомах. Активность КФК следует определять у любого пациента, сообщающего о мышечной боли, болезненности мышц при пальпации или слабости, особенно если это сопровождаются недомоганием или лихорадкой. Активность КФК не следует определять после физических нагрузок или при наличии каких-либо других возможных причин повышения КФК, которые могут исказить результат. При повышении активности КФК (в 5 раз выше ВГН), в течение 5-7 дней следует выполнить контрольный анализ. Отмечены очень редкие случаи иммуноопосредованной некротизирующей миопатии (ИОНМ) во время лечения или при прекращении приема статинов. ИОНМ клинически проявляется в виде стойкой слабости проксимальных мышц и повышения активности КФК в сыворотке крови, которые сохраняются несмотря на отмену статинов. До лечения Как и все статины Ливазо следует с осторожностью назначать пациентам, имеющим предрасполагающие факторы развития рабдомиолиза. Следует определить активность КФК для установления контрольного исходного значения в следующих случаях: почечная недостаточность; гипотиреоз; личный или семейный анамнез наследственных мышечных заболеваний; предшествующий анамнез мышечной токсичности при лечении фибратами или другими статинами; наличие в анамнезе заболеваний печени или злоупотребления алкоголем; пациентам пожилого возраста (старше 70 лет) с другими предрасполагающими факторами риска развития рабдомиолиза. В таких случаях рекомендован клинический мониторинг, и риск лечения следует рассматривать в зависимости от возможной пользы. Лечение Ливазо нельзя начинать, если показатели КФК в 5 раз превышают ВГН. Во время течения Следует рекомендовать пациенту немедленно сообщать врачу о мышечной боли, слабости или судорогах. Следует определить активность КФК, и лечение прекратить, если активность КФК повышена (в 5 раз выше ВГН). Следует рассмотреть, вопрос о прекращении лечения при возникновении тяжелых мышечных симптомов, даже если активность КФК не превышает ВГН в 5 раз. При разрешении симптомов и возвращении активности КФК к норме, может быть рассмотрен вопрос о повторном назначении Ливазо в дозе 1 мг при соблюдении тщательного контроля. Воздействие на печень Как и все статины, Ливазо следует с осторожностью назначать пациентам, имеющим в анамнезе заболевания печени, или пациентам, регулярно употребляющим избыточное количество алкоголя. Перед началом лечения Ливазо и затем периодически во время лечения следует проводить функциональные печеночные пробы. Пациентам со стойким повышением активности печеночных трансаминаз (AЛT и ACT), превышающим ВГН в 3 раза, следует прекратить лечение Ливазо. Воздействие на почки Ливазо следует с осторожностью назначать пациентам с почечной недостаточностью умеренной или тяжелой степени. Повышать дозу следует только при тщательном контроле. Доза 4 мг не рекомендована пациентам с тяжелой почечной недостаточностью. Сахарный диабет Некоторые данные свидетельствуют о том, что статины, как класс, вызывают увеличение концентрации глюкозы в крови, повышая риск развития сахарного диабета в будущем, а у некоторых пациентов с высоким риском развития сахарного диабета могут привести к уровню гилергликемии, при котором необходимо соответствующее лечение сахарного диабета. Тем не менее, эта опасность перевешивается снижением сосудистого риска при лечении статинами, и поэтому не должна являться причиной для прекращения лечения статинами. За пациентами, имеющими риск развития гипергликемии (концентрация глюкозы натощак от 5.6 до 6.9 ммоль/л, ИМТ>30 кг/м 2, повышенную концентрацию ТГ, артериальную гипертензию), необходим клинический и биохимический контроль в соответствии с национальными рекомендациями. Вместе с тем, по результатам как постмаркетинговых наблюдений для оценки безопасности, так и проспективных исследований не было выявлено никаких подтвержденных сигналов о риске сахарного диабета при применении питавастатина. Интерстициальное заболевание легких Редкие случаи интерстициального заболевания легких регистрировали при применении некоторых статинов, особенно при длительной терапии. Наблюдаемые клинические признаки включают одышку, непродуктивный кашель и ухудшение общего состояния здоровья (повышенная утомляемость, потеря массы тела и лихорадка). При подозрении на развитие интерстициального заболевания легких, терапию статинами следует прекратить. Влияние на способность к управлению транспортными средствами и механизмов Необходимо соблюдать осторожность при управлении транспортными средствами или выполнении другой работы, требующей повышенного внимания, поскольку возможно развитие таких нежелательных реакций как головокружение и сонливость. Передозировка Специфического лечения при передозировке нет. Необходимо провести симптоматическую терапию, контролировать активность КФК и функцию печени. Гемодиализ неэффективен. Лекарственное взаимодействие Питавастатин активно транспортируется в гепатоциты человека многочисленными печеночными транспортерами (включая транспортный полипептид органических анионов (OATP)), которые могут быть включены во взаимодействие с некоторыми из следующих препаратов. Циклоспорин: одновременный прием однократной дозы циклоспорина с питавастатином в равновесном состоянии приводит к 4.6-кратному увеличению AUC питавастатина. Влияние равновесного состояния на равновесное состояние питавастатина неизвестно. Препарат Ливазо противопоказан пациентам, получающим лечение циклоспорином. Эритромицин: одновременный прием эритромицина с питавастатином приводит к 2.8-кратному увеличению AUC питавастатина. Рекомендовано временное прекращение приема питавастатина во время лечения эритромицином или другими антибиотиками группы макролидов. Гемфиброзил и другие фибраты: в редких случаях монотерапию фибратами связывали с развитием миопатии. Одновременное применение фибратов со статинами связывали с увеличением частоты возникновения миопатии и рабдомиолиза. Следует соблюдать осторожность при одновременном применении питавастатина с фибратами. В исследованиях фармакокинетики одновременное применение питавастатина с гемфиброзилом приводило к 1.4-кратному увеличению AUC питавастатина и увеличению AUC фенофибрата в 1.2 раза. Никотиновая кислота (в липидснижающих дозах): исследование взаимодействия при лечении питавастатином и никотиновой кислоты в липидснижающих дозах (более 1 г/сут) не проводилось. Применение никотиновой кислоты в монотерапии связывали с развитием миопатии и рабдомиолиза. Поэтому при одновременном применении с никотиновой кислотой в липидснижающих дозах (более 1 г/сут) препарат Ливазо следует назначать с осторожностью. Фузидовая кислота: были зарегистрированы тяжелые мышечные нарушения, такие как рабдомиолиз, которые приписывали взаимодействию между фузидовой кислотой и статинами. Во время лечения фузидовой кислотой рекомендовано временно прекратить применение Ливазо. Рифампицин: одновременное назначение с питавастатином привело к 1.3-кратному увеличению AUC питавастатина. Ингибиторы протеазы ВИЧ: одновременное назначение с питавастатином привело к незначительным изменениям AUC питавастатина. Условия хранения и отпуска из аптек Препарат отпускается по рецепту. Регистрационные данные Международное непатентованное название питавастатин Форма выпуска. Таблетки Состав. Таблетки, покрытые пленочной оболочкой белого цвета, круглые, двояковыпуклые, на поперечном срезе ядро белого цвета; на одной стороне таблетки - гравировка "KC", на другой - гравировка "1". 1 таб. питавастатин кальция 1.045 мг, что соответствует содержанию питавастатина 1 мг Вспомогательные вещества: лактозы моногидрат - 63.085 мг, гипролоза низкозамещенная - 12.54 мг, гипромеллоза - 1.33 мг, магния алюмометасиликат - 1.6 мг, магния стеарат - 0.4 мг. Состав пленочной оболочки: Опадрай белый - 3 мг (гипромеллоза - 1.98 мг, титана диоксид - 0.8 мг, триэтилацетат - 0.2 мг, кремния диоксид коллоидный - 0.02 мг). АТХ:C10AA08 Питавастатин Регистрация Лекарственное средство ЛП-002855 от 09.02.15 Владелец рег.удостоверения:Рекордати . Производитель:PIERRE FABRE MEDICAMENT PRODUCTION Представительство: Фармгруппа: Гиполипидемическое средство
Модель:
RUR 3564
Показания Первичная гиперхолестеринемия (тип IIа по классификации Фредриксона), включая гетерозиготную наследственную гиперхолестеринемию или смешанная (комбинированная) гиперлипидемия (типа IIb по классификации Фредриксона), в качестве дополнения к диете и другимнемедикаментозным мероприятиям (физическая нагрузка и снижение массы тела)- Гомозиготная форма наследственной гиперхолестеринемии при недостаточной эффективности диетотерапии и других видов лечения, направленных на снижение концентрации липидов (например, ЛПНП-аферез) или, если такие виды лечения не подходят пациенту- Гипертриглицеридемия (тип IV по классификации Фредриксона) в качестве дополнения к диете- Для замедления прогрессирования атеросклероза в качестве дополнения к диете у пациентов, которым показана терапия для снижения концентрации общего холестерина и холестерина-ЛПНП- Первичная профилактика основных сердечно-сосудистых осложнений (инсульта, инфаркта, артериальной реваскуляризации) у взрослых пациентов без клинических признаков ишемической болезни сердца (ИБС), но с повышенным риском ее развития (возраст старше 50 лет для мужчин и старше 60 лет для женщин, повышенная концентрация С-реактивного белка ( 2 мг/л) при наличии, как минимум одного из дополнительных факторов риска, таких как артериальная гипертензия, низкая концентрация холестерина-ЛПВП, курение, семейный анамнез раннего начала ИБС). Противопоказания Противопоказания Противопоказания для препарата Розарт в суточной дозе 5, 10 и 20 мг: - Повышенная чувствительность к розувастатину или другим компонентам препарата: - Заболевания печени в активной фазе, включая стойкое повышение сывороточной активности "печеночных" трансаминаз (более чем в 3 раза по сравнению с верхней границей нормы (ВГН)): - Тяжелые нарушения функции почек (КК менее 30 мл/мин): - Миопатия: - Одновременный прием циклоспорина: - Применение у женщин репродуктивного возраста, не пользующихся адекватными методами контрацепции: - Беременность и период грудного вскармливания: - Возраст до 18 лет (эффективность и безопасность не установлены): - Непереносимость лактозы, дефицит лактазы, глюкозо-галактозная мальабсорбция (препарат содержит лактозы моногидрат). Противопоказания для препарата Розарт в суточной дозе 40 мг: - Повышенная чувствительность к розувастатину или другим компонентам препарата: - Заболевания печени в активной фазе, включая стойкое повышение сывороточной активности "печеночных" трансаминаз (более чем в 3 раза по сравнению с ВГН): - Миопатия: - Одновременный прием циклоспорина: - Применение у женщин репродуктивного возраста, не пользующихся адекватными методами контрацепции: - Беременность и период грудного вскармливания: - Возраст до 18 лет (эффективность и безопасность не установлены): - Непереносимость лактозы, дефицит лактазы, глюкозо-галактозная мальабсорбция (препарат содержит лактозы моногидрат): - Миотоксичность на фоне приема других ингибиторов ГМГ-КоА-редуктазы или фибратов в анамнезе: - Гипотиреоз: - Почечная недостаточность тяжелой и средней степени тяжести (КК менее 60 мл/мин): - Чрезмерное употребление алкоголя: - Состояния, которые могут приводить к повышению плазменной концентрации розувастатина: - Одновременный прием фибратов: - Применение у пациентов монголоидной расы: - Семейный или личный анамнез наследственных мышечных заболеваний. С осторожностью: Для препарата Розарт в суточной дозе 5, 10 и 20 мг: Наличие факторов риска развития миопатии и/или рабдомиолиза - почечная недостаточность (КК более 30 мл/мин), гипотиреоз, личный или семейный анамнез наследственных мышечных заболеваний и предшествующий анамнез миотоксичности при применении других ингибиторов ГМГ-КоА-редуктазы или фибратов: чрезмерное употребление алкоголя, возраст старше 70 лет: состояния, при которых отмечено повышение плазменной концентрации розувастатина: расовая принадлежность (монголоидная раса), одновременное применение с фибратами, заболевания печени в анамнезе, сепсис, артериальная гипотензия, обширные хирургические вмешательства, травмы, тяжелые метаболические, эндокринные или водно-электролитные нарушения или неконтролируемая эпилепсия. Для препарата Розарт в суточной дозе 40 мг: Наличие факторов риска развития миопатии и/или рабдомиолиза - почечная недостаточность (КК более 60 мл/мин), возраст старше 70 лет, заболевания печени в анамнезе, сепсис, артериальная гипотензия, обширные хирургические вмешательства, травмы, тяжелые метаболические, эндокринные или водно-электролитные нарушения или неконтролируемая эпилепсия. Беременность Препарат Розарт противопоказан при беременности и в период лактации. Применение препарата Розарт у женщин репродуктивного возраста возможно только в случае использования надежных методов контрацепции и если пациентка информирована о возможном риске лечения для плода. Поскольку холестерин и вещества, синтезируемые из холестерина важны для развития плода, потенциальный риск ингибирования ГМГ-КоА-редуктазы превышает пользу от применения препарата во время беременности. В случае диагностирования беременности в процессе терапии препаратом Розарт, прием препарата должен быть немедленно прекращен, а пациентки предупреждены о потенциальном риске для плода. Данные в отношении выделения розувастатина с грудным молоком отсутствуют, поэтому при необходимости применения препарата в период лактации, учитывая возможность нежелательных явлений у грудных детей, следует решить вопрос о прекращении грудного вскармливания. Применение и дозы Внутрь, не разжевывая, не измельчая, проглатывая целиком, запивая водой, независимо от времени суток и приема пищи. До начала терапии препаратом Розарт пациент должен начать соблюдать стандартную гиполипидемическую диету и продолжать соблюдать ее во время лечения. Дозу препарата следует подбирать индивидуально в зависимости от показаний и терапевтического ответа, принимая во внимание текущие общепринятые рекомендации по целевым концентрациям липидов. Рекомендуемая начальная доза препарата Розарт для пациентов, начинающих принимать препарат, или для пациентов, переведенных с приема других ингибиторов ГМГ-КоА-редуктазы, составляет 5 или 10 мг 1 раз/сут. При выборе начальной дозы следует руководствоваться концентрацией холестерина у пациента и принимать во внимание риск развития сердечно-сосудистых осложнений, а также необходимо оценивать потенциальный риск развития побочных реакций. В случае необходимости через 4 недели доза препарата может быть увеличена. В связи с возможным развитием побочных эффектов при приеме дозы 40 мг по сравнению с более низкими дозами препарата (см. раздел "Побочное действие"), окончательное титрование до максимальной дозы 40 мг следует проводить только у пациентов с тяжелой формой гиперхолестеринемии и высоким риском сердечно-сосудистых осложнений (особенно у пациентов с наследственной гиперхолестеринемией), у которых при приеме дозы 20 мг не была достигнута целевая концентрация холестерина, и которые будут находиться под врачебным наблюдением. Рекомендуется особенно тщательное наблюдение за пациентами, получающими препарат в дозе 40 мг. После 2-4-х недель терапии и/или повышения дозы препарата необходим контроль показателей липидного обмена. У пожилых пациентов старше 70 лет рекомендуемая начальная доза препарата Розарт составляет 5 мг, иной коррекции дозы не требуется. У пациентов с печеночной недостаточностью по шкале Чайлд-Пью ниже 7 баллов коррекции дозы препарата не требуется. У пациентов со значениями 8 и 9 баллов по шкале Чайлд-Пью должна быть проведена предварительная оценка функции почек. Опыт применения розувастатина у пациентов с печеночной недостаточностью выше 9 баллов по шкале Чайлд-Пью отсутствует. Розувастатин противопоказан у пациентов с заболеванием печени в активной фазе. При почечной недостаточности легкой или средней степени тяжести коррекции дозы не требуется. Рекомендуется начальная доза препарата 5 мг для пациентов с почечной недостаточностью средней степени тяжести (КК менее 60 мл/мин). Пациентам с почечной недостаточностью средней степени тяжести (КК менее 30-60 мл/мин) назначение препарата в дозе 40 мг противопоказано. Прием препарата Розарт противопоказан в любых дозах пациентам с тяжелой степенью почечной недостаточности (КК менее 30 мл/мин). Этнические группы У пациентов монголоидной расы возможно повышение системной концентрации розувастатина. Начальная рекомендуемая доза препарата для пациентов монголоидной расы составляет 5 мг. Применение препарата в дозе 40 мг таким пациентам противопоказано. Генетический полиморфизм Известны разновидности генетического полиморфизма, который может привести к увеличению системной концентрации розувастатина. У пациентов с выявленным специфическим полиморфизмом рекомендуются более низкие суточные дозы розувастатина. Пациенты, предрасположенные к развитию миопатии Начальная рекомендуемая доза для таких пациентов составляет 5 мг. Применение препарата в дозе 40 мг у таких пациентов противопоказано. Комбинированная терапия Розувастатин является субстратом для различных транспортных белков (например, ОАТР1В1 и BCRP). Повышается риск развития миопатии, включая рабдомиолиз, при одновременном приеме розувастатина с лекарственными препаратами, повышающими концентрацию розувастатина в плазме крови за счет их взаимодействия с транспортными белками. К данной группе веществ относятся циклоспорин, ингибиторы ВИЧ-протеаз, включая комбинацию ритонавира с атазанавиром, лопинавир и/или типранавир: см. раздел Особые указания и Взаимодействие с другими лекарственными препаратами). В случае, когда это возможно, следует принять решение о назначении альтернативной терапии и, в случае необходимости, временно прекратить прием розувастатина. В случае, когда одновременного приема избежать нельзя, следует тщательно оценить возможный риск взаимодействия и потенциальную пользу от совместного лечения (см. раздел Взаимодействие с другими лекарственными препаратами). Побочные эффекты и передозировка Побочные эффекты: Согласно данным клинических исследований розувастатина, а также данным его постмаркетингового применения, у пациентов наблюдались перечисленные ниже побочные реакции. Частота побочных реакций распределяется следующим образом: очень часто - более 1/10: часто - от более 1/100 до менее 1/10: нечасто - от более 1/1000 до менее 1/100: редко - от более 1/10000 до менее 1/1000: очень редко - от менее 1/10000: частота неизвестна - по имеющимся данным установить частоту возникновения не представляется возможным. Со стороны крови и лимфатической системы: редко - тромбоцитопения. Со стороны нервной системы: часто - головная боль, головокружение, астенический синдром: очень редко - полинейропатия, снижение памяти: частота неизвестна - депрессия, периферическая нейропатия, нарушения сна, включая бессонницу и кошмарные сновидения. Со стороны пищеварительной системы: часто - запор, тошнота, боль в животе: редко - панкреатит: очень редко - гепатит, желтуха: частота неизвестна - диарея. Со стороны дыхательной системы: частота неизвестна - кашель, одышка, интерстициальное заболевание легких. Со стороны эндокринной системы: часто - сахарный диабет 1. Со стороны опорно-двигательного аппарата: часто - миалгия: редко - миопатия (включая миозиты), рабдомиолиз: очень редко артралгия: частота неизвестна иммуноопосредованная некротизирующая миопатия: поражения сухожилий, иногда с разрывами. Аллергические реакции: нечасто - кожный зуд, сыпь, крапивница: редко - реакции повышенной чувствительности, включая ангионевротический отек. Со стороны кожи и подкожных тканей: частота неизвестна - синдром Стивенса-Джонсона. Со стороны мочевыделительной системы: очень редко - гематурия. Со стороны половых органов и молочной железы: очень редко - гинекомастия. Лабораторные показатели: редко транзиторное повышение активности аспартатаминотрансферазы и аланинаминотрансферазы. Прочие: частота неизвестна - периферические отеки. 1 - Частота зависит от наличия факторов риска (концентрация глюкозы в крови натощак >:5,6 ммоль/л, индекс массы тела >:30 кг/м 2, повышенная концентрация ТГ, артериальная гипертензия в анамнезе). Как и при применении других ингибиторов ГМГ-КоА-редуктазы, частота возникновения побочных реакций носит дозозависимый характер, побочные эффекты обычно выражены незначительно и проходят самостоятельно. Влияние на функцию почек У пациентов, получавших розувастатин, в ходе анализа мочи тест-полосками была выявлена протеинурия, преимущественно канальцевая. Изменения количества белка в моче (от отсутствия или следовых количеств до + или больше) наблюдались у менее 1% пациентов, получающих 10-20 мг розувастатина, и у приблизительно 3% пациентов, получающих 40 мг розувастатина. Незначительное изменение количества белка в моче (от отсутствия или следовых количеств до +) отмечалось при приеме дозы 20 мг. В большинстве случаев протеинурия уменьшается или исчезает в процессе терапии и не означает возникновения острого или прогрессирования существующего заболевания почек. У пациентов, получающих розувастатин, наблюдалась гематурия, имеющиеся данные показали низкую частоту появления данной нежелательной реакции. Влияние на опорно-двигательный аппарат При применении всех доз розувастатина и, в особенности при приеме доз, превышающих 20 мг, сообщалось о развитии миалгии, миопатии, включая миозит, в редких случаях о рабдомиолизе с развитием острой почечной недостаточности или без неё. При приеме розувастатина наблюдалось дозозависимое повышение активности креатинфосфокиназы (КФК). В большинстве случаев оно было незначительным, бессимптомным и временным. В случае повышения активности КФК (более чем в 5 раз по сравнению с ВГН) терапия должна быть приостановлена (см. раздел Особые указания). Влияние на функцию печени У незначительного числа пациентов при применении розувастатина наблюдается дозозависимое повышение активности "печеночных" трансаминаз. В большинстве случаев оно невелико, бессимптомно и временно. При применении некоторых ингибиторов ГМГ-КоА-редуктазы наблюдались сексуальная дисфункция, были зафиксированы единичные случаи интерстициального заболевания легких (см. раздел Особые указания). Частота сообщений о развитии рабдомиолиза, серьезных нарушений функции почек и печени (выражающееся преимущественно в повышении активности "печеночных" трансаминаз) выше при приеме дозы розувастатина 40 мг. Передозировка: При одновременном приеме нескольких суточных доз фармакокинетические параметры розувастатина не меняются. Лечение: специфического лечения нет, проводится симптоматическая терапия и мероприятия, направленные на поддержание функции жизненно важных органов и систем под контролем функции печени и активности КФК. Маловероятно, что гемодиализ будет эффективен. Взаимодействие с другими ЛС: Ингибиторы транспортных белков Розувастатин является субстратом некоторых транспортных белков, включая мембранный переносчик ОАТР1В1, вовлеченный в процесс печеночного захвата, и транспортный белок BCRP. Одновременный прием розувастатина с лекарственными средствами, ингибирующими эти транспортные белки, может привести к увеличению концентрации розувастатина в плазме крови и повысить риск развития миопатии. Одновременное применение розувастатина и циклоспорина не влияет на плазменную концентрацию циклоспорина, однако усиливается эффект розувастатина (замедляется его выведение, увеличивается AUC в 7 раз, Сmах - в 11 раз). Одновременный прием циклоспорина и розувастатина противопоказан. Одновременный прием эритромицина и розувастатина приводит к уменьшению AUC розувастатина на 20% и увеличивает Сmах на 30%. Подобное взаимодействие может возникать в результате усиления моторики кишечника, вызываемого приемом эритромицина. У пациентов, получающих непрямые антикоагулянты (например, варфарин) рекомендуется мониторинг международного нормализованного отношения (MHO), поскольку начало терапии розувастатином или повышение его дозы может приводить к увеличению MHO, а отмена розувастатина или снижение его дозы может приводить к его уменьшению. Гемфиброзил и другие гиполипидемические средства: одновременный прием гемфиброзила и розувастатина увеличивает Сmах и AUC розувастатина в 2 раза (см. раздел Особые указания). Основываясь на данных по специфическому взаимодействию, не ожидается фармакокинетически значимого взаимодействия с фенофибратом, возможно фармакодинамическое взаимодействие. Гемфиброзил, фенофибрат, другие фибраты и гиполипидемические дозы никотиновой кислоты (не менее 1 г/сут) увеличивали риск возникновения миопатии при одновременном применении с другими ингибиторами ГМГ- КоА-редуктазы, возможно в связи с тем, что они могут вызывать миопатию и при применении в качестве монотерапии. При одновременном приеме розувастатина с одним из препаратов данной группы пациентам рекомендуется начальная доза розувастатина 5 мг, суточная доза розувастатина 40 мг в данном случае противопоказана. Одновременное применение розувастатина и антацидов, содержащих алюминия и магния гидроксид, приводит к снижению плазменной концентрации розувастатина примерно на 50%. Данный эффект выражен слабее, если антациды применяются через 2 ч после приема розувастатина. Клиническая значимость данного взаимодействия не изучалась. Одновременное применение розувастатина и пероралъных контрацептивов увеличивает AUC этинилэстрадиола и AUC норгестрела на 26% и 34% соответственно, что следует учитывать при подборе дозы пероральных контрацептивов. Фармакокинетические данные по одновременному применению розувастатина и гормонозаместительной терапии отсутствуют, следовательно, нельзя исключить аналогичного эффекта при их совместном применении. Однако, подобная комбинация широко применялась во время проведения клинических исследований розувастатина и хорошо переносилась пациентами. Результаты исследований in vivo и in vitro показали, что розувастатин не является ни ингибитором, ни индуктором изоферментов цитохрома Р450. Розувастатин является непрофильным субстратом для этих изоферментов. Не наблюдалось клинически значимого взаимодействия с такими препаратами, как флуконазол (ингибитор изоферментов CYP2C9 и CYP3A4), кетоконазол (ингибитор изоферментов CYP2A6 и CYP3A4), связанных метаболизмом с системой цитохрома Р450. Совместное применение 10 мг розувастатина и 10 мг эзетимиба у пациентов с гиперхолестеринемией приводило к увеличению AUC розувастатина в 1,2 раза. Однако,нельзя исключить фармакодинамического взаимодейcтвия между розувастатином и эзетимибом в отношении появления нежелательных явлений. Несмотря на то, что точный механизм взаимодействия неизвестен, применение ингибиторов ВИЧ-протеаз с розувастатином может привести к выраженному увеличению экспозиции розувастатина. Фармакокинетическое исследование одновременного применения 20 мг розувастатина с комбинированным препаратом, содержащим два ингибитора ВИЧ-протеаз (400 мг лопинавира/100 мг ритонавира) у здоровых добровольцев приводило к приблизительно двукратному и пятикратному увеличению AUC0-24 и Сmах розувастатина, соответственно. Таким образом, не рекомендуется совместное применение розувастатина с ингибиторами ВИЧ-протеаз у ВИЧ-инфицированных пациентов. Не отмечается клинически значимого взаимодействия розувастатина с дигоксином. В Таблице 1 перечислены различные виды взаимодействия, в том числе взаимодействия, требующие коррекции дозы розувастатина. Следует скорректировать дозу розувастатина при необходимости одновременного применения с другими лекарственными препаратами, повышающими системную концентрацию розувастатина. Если ожидаемое увеличение AUC составляет приблизительно в 2 раза или больше, то начальная доза розувастатина должна составлять 5 мг 1 раз в день. Суточная доза розувастатина должна быть скорректирована таким образом, чтобы его системная концентрация с учетом её повышения не превышала таковую при приеме дозы розувастатина 40 мг в монотерапии. Например, при приеме гемфиброзила доза розувастатина не должна превышать 20 мг (увеличение AUC в 1,9 раза) и 10 мг при приеме комбинации атазанавир/ритонавир (увеличение AUC в 3,1 раза). Таблица 1. Влияние одновременного приема препаратов на экспозицию розувастатина (AUC, в порядке снижения значимости) ТАБЛИЦЪ Фармакологическое действие и фармакокинетика Гиполипидемическое средство из группы статинов. Селективный конкурентный ингибитор 3-гидрокси-3-метилглутарил коэнзим А (ГМГ-КоА)-редуктазы - фермента, превращающего ГМГ-КоА в мевалонат, предшественник холестерина. Увеличивает число рецепторов липопротеинов низкой плотности (ЛПНП) на поверхности гепатоцитов, что приводит к усилению захвата и катаболизма ЛПНП, ингибированию синтеза липопротеинов очень низкой плотности (ЛПОНП), уменьшая общее количество ЛПНП и ЛПОНП. Снижает повышенную концентрацию холестерина-ЛПНП, холестерина-липопротеинов невысокой плотности (неЛПВП), холестерина-ЛПОНП, общего холестерина, триглицеридов (ТГ), ТГ-ЛПОНП, аполипопротеина В (АпоВ), снижает соотношения холестерин-ЛПНП/холестерин-ЛПВП, общий холестерин/холестерин-ЛПВП, холестерин-неЛПВП/холестерин-ЛПВП, АпоВ/аполипопротеина A-I (АпоА-1), повышает концентрацию холестерина-ЛПВП и АпоА-1. Гиполипидемическое действие прямо пропорционально величине назначенной дозы. Терапевтический эффект появляется в течение 1 недели после начала терапии, через 2 недели достигает 90% от максимального, к 4 неделе достигает максимума и после этого остается постоянным. Эффективен у взрослых пациентов с гиперхолестеринемией с или без гипертриглицеридемии (вне зависимости от расы, пола или возраста), в том числе у пациентов с сахарным диабетом и семейной гиперхолестеринемией. У 80% пациентов с гиперхолестеринемией IIа и IIb типа (классификация по Фредриксону) со средним исходным показателем холестерина-ЛПНП около 4,8 ммоль/л на фоне приема препарата в дозе 10 мг концентрация холестерина-ЛПНП достигает значений менее 3 ммоль/л. У пациентов с гомозиготной семейной гиперхолестеринемией, принимающих препарат в дозе 20 мг и 40 мг, среднее снижение концентрации холестерина-ЛПНП составляет 22%. Аддитивный эффект отмечается в комбинации с фенофибратом (в отношении снижения концентрации ТГ) и с никотиновой кислотой в липидснижающих дозах >: 1 г/сут (В отношении повышения концентрации холестерина-ЛПВП). Фармакокинетика: Всасывание Максимальная концентрация (Сmах) розувастатина в плазме крови достигается приблизительно через 5 ч после приема препарата. Абсолютная биодоступность - примерно 20%. Системная экспозиция розувастатина увеличивается пропорционально дозе. Фармакокинетические параметры не изменяются при ежедневном приеме. Распределение Проникает через плацентарный барьер. Розувастатин поглощается преимущественно печенью, которая является основным местом синтеза холестерина и метаболизма ХС-ЛПНП. Объем распределения - 134 л. Связывание с белками плазмы (преимущественно с альбумином) составляет приблизительно 90%. Метаболизм Биотрансформируется в печени в небольшой степени (около 10%), являясь непрофильным субстратом для изоферментов системы цитохрома Р450. Как и в случае других ингибиторов ГМГ-КоА-редуктазы, в процесс печеночного захвата препарата вовлечен специфический мембранный переносчик - полипептид, транспортирующий органический анион (ОАТР) 1В1, выполняющий важную роль в его печеночной элиминации. Основным изоферментом, участвующим в метаболизме розувастатина, является CYP2C9. Изоферменты CYP2C19, CYP3A4 и CYP2D6 вовлечены в метаболизм в меньшей степени. Основными метаболитами розувастатина являются N-десметил и лактоновые метаболиты. N- десметил примерно на 50% менее активен, чем розувастатин, лактоновые метаболиты фармакологически неактивны. Более 90% фармакологической активности по ингибированию циркулирующей ГМГ-КоА-редуктазы обеспечивается розувастатином, остальное - его метаболитами. Выведение Около 90% дозы розувастатина выводится в неизмененном виде через кишечник, оставшаяся часть - почками. Период полувыведения (Т1/2) - примерно 19 ч, не изменяется при увеличении дозы препарата. Среднее значение плазменного клиренса составляет приблизительно 50 л/ч (коэффициент вариации 21,7%). У пациентов с легкой и умеренно выраженной почечной недостаточностью плазменная концентрация розувастатина или N-десметила существенно не меняется. У пациентов с выраженной почечной недостаточностью (клиренс креатинина (КК) менее 30 мл/мин) концентрация розувастатина в плазме выше в 3 раза, а N-десметила - в 9 раз, чем у здоровых добровольцев. Концентрация розувастатина в плазме у пациентов, находящихся на гемодиализе, примерно на 50% выше, чем у здоровых добровольцев. У пациентов с различными стадиями печеночной недостаточности с баллом 7 и ниже по шкале Чайлд-Пью не выявлено увеличения Т1/2 розувастатина: у больных с баллами 8 и 9 по шкале Чайлд-Пью отмечено удлинение в 2 раза. Опыт применения препарата у пациентов с более выраженными нарушениями функции печени отсутствует. Пол и возраст не оказывают клинически значимого влияния на фармакокинетику розувастатина. Фармакокинетические параметры зависят от расовой принадлежности: площадь под кривой "концентрация-время" (AUC) у японцев и китайцев в 2 раза выше таковой у жителей Европы и Северной Америки. У представителей монголоидной расы и индийцев среднее значение AUC и Сmах увеличивается в 1,3 раза. Особые указания Влияние на функцию почек У пациентов, получавших высокие дозы розувастатина (в основном 40 мг), в ходе анализа мочи тест-полосками наблюдалась канальцевая протеинурия, которая в большинстве случаев была транзиторной. Такая протеинурия не свидетельствовала об остром заболевании почек или прогрессировании заболевания почек. Частота сообщений о развитии серьезных побочных реакций со стороны почек в постмаркетинговый период была выше у пациентов, принимавших розувастатин в дозе 40 мг. При применении препарата Розарт в дозе 40 мг рекомендуется контролировать показатели функции почек во время лечения. Влияние на опорно-двигательный аппарат При применении всех доз розувастатина и, в особенности при приеме доз, превышающих 20 мг, сообщалось о развитии миалгии, миопатии и в редких случаях о рабдомиолизе. В очень редких случаях сообщалось о развитии рабдомиолиза при одновременном приеме ингибиторов ГМГ-КоА-редуктазы и эзетимиба. В данном случае нельзя исключить фармакодинамического взаимодействия, поэтому следует соблюдать осторожность при их совместном приеме. Как при приеме других ингибиторов ГМГ-КоА-редуктазы частота сообщений в постмаркетинговый период наблюдения о развитии рабдомиолиза, связанного с приемом розувастатина, была выше при приеме дозы 40 мг. Определение креатинфосфокиназы Определение активности КФК не следует проводить после интенсивных физических нагрузок или при наличии других возможных причин увеличения ее активности, что может привести к неверной интерпретации полученных результатов. В случае, если исходная активность КФК существенно повышена, через 5-7 дней следует провести повторное измерение - не следует начинать терапию, если повторный тест подтверждает исходную активность КФК (в 5 раз выше нормы). До начала терапии Следует соблюдать осторожность при назначении препарата Розарт, также как и при назначении других ингибиторов ГМГ-КоА- редуктазы, пациентам с имеющимися факторами риска развития миопатии/рабдомиолиза (см. раздел С осторожностью). Необходимо рассмотреть соотношение ожидаемой пользы от терапии и потенциального риска и проводить клиническое наблюдение на протяжении всего курса лечения. В случае, если исходная активность КФК существенно повышена (в 5 раз выше ВГН), то не следует начинать лечение препаратом. Во время лечения Следует проинформировать пациента о необходимости немедленного сообщения врачу о случаях неожиданного появления мышечных болей, мышечной слабости или спазмах, особенно в сочетании с недомоганием и лихорадкой. У таких пациентов следует определять активность КФК. Терапию следует прекратить, если активность КФК значительно увеличен (более чем в 5 раз по сравнению с ВГН) или если мышечные симптомы резко выражены и вызывают ежедневный дискомфорт (даже, если активность КФК в 5 раз меньше по сравнению с ВГН). Если симптомы исчезают, и активность КФК возвращается к норме, следует рассмотреть вопрос о повторном назначении препарата Розарт или других ингибиторов ГМГ-КоА- редуктазы в меньших дозах при тщательном наблюдении за пациентом. Рутинный мониторинг активности КФК при отсутствии симптомов нецелесообразен. Отмечены очень редкие случаи иммуноопосредованной некротизирующей миопатии с клиническими проявлениями в виде стойкой слабости проксимальных мышц и повышения активности КФК в сыворотке крови во время лечения или прекращении приема статинов, в том числе розувастатина. Не отмечено признаков увеличения воздействия на скелетную мускулатуру при приеме розувастатина и сопутствующей терапии. Однако, сообщалось об увеличении числа случаев миозита и миопатии у пациентов, принимавших другие ингибиторы ГМГ-КоА-редуктазы в сочетании с производными фибриновой кислоты (включая гемфиброзил), циклоспорин, никотиновую кислоту в липидснижающих дозах >: 1 г/сут, азольные противогрибковые препараты, ингибиторы протеаз и макролидные антибиотики. Гемфиброзил увеличивает риск развития миопатии при одновременном приеме с некоторыми ингибиторами ГМГ-КоА-редуктазы, поэтому одновременное применение гемфиброзила и розувастатина не рекомендуется. Следует тщательно взвесить соотношение ожидаемой пользы и потенциального риска при совместном применении препарата Розарт и фибратов или никотиновой кислоты в липидснижающих дозах >: 1 г/сут. Противопоказан прием препарата Розарт в дозе 40 мг одновременно с фибратами (см. разделы Взаимодействие с другими лекарственными препаратами и Противопоказания). Во время лечения, особенно в период коррекции дозы препарата Розарт, каждые 2-4недели следует осуществлять мониторинг липидного профиля и согласно нему при необходимости изменять дозу препарата. Препарат Розарт не следует принимать пациентам при проявлении острых и выраженных симптомов миопатии или с наличием факторов риска, предрасполагающих к развитию нарушения функции почек и вторичного рабдомиолиза (например, сепсис, артериальная гипотензия, обширные хирургические вмешательства, травмы, выраженные нарушения метаболизма, выраженные эндокринные нарушения и тяжелые нарушения водно-электролитного баланса, неконтролируемые судороги). Влияние на функцию печени Как и другие ингибиторы ГМГ-КоА-редуктазы розувастатин следует применять с осторожностью у пациентов, злоупотребляющих алкоголем и/или с заболеванием печени в анамнезе. Рекомендуется проводить определение показателей функции печени до начала терапии и через 3 месяца после начала терапии. Прием препарата Розарт следует прекратить или уменьшить дозу препарата, если уровень активности "печеночных" трансаминаз в сыворотке крови в 3 раза превышает ВГН. У пациентов с гиперхолестеринемией вследствие гипотиреоза или нефротического синдрома терапия основных заболеваний должна проводиться до начала лечения препаратом Розарт. При постмаркетинговом наблюдении розувастатина частота сообщений о развитии серьезных нарушений функции печени (выражающихся преимущественно в повышении активности "печеночных" трансаминаз) была выше при приеме дозы 40 мг. Этнические группы В ходе фармакокинетических исследований среди пациентов монголоидной расы по сравнению с европеоидной отмечено увеличение системной концентрации розувастатина (см. раздел Способ применения и дозы и Фармакокинетика). Ингибиторы ВИЧ-протеаз В ходе совместного приема розувастатина и комбинации различных ингибиторов ВИЧ- протеаз с ритонавиром наблюдается увеличение системной концентрации розувастатина. Следует тщательно оценивать снижение концентрации липидов в крови, а также учитывать возможное повышение розувастатина в плазме крови в начале лечения и в период повышения дозы препарата Розарт у пациентов с ВИЧ, принимающих ингибиторы ВИЧ-протеаз. Одновременный прием ингибиторов ВИЧ- протеаз не рекомендуется без коррекции дозы розувастатина (см. раздел Способ применения и дозы и Взаимодействие с другими лекарственными препаратами). Интерстициальное заболевание легких При применении некоторых ингибиторов ГМГ-КоА-редуктазы, особенно в течение длительного времени, сообщалось о единичных случаях интерстициального заболевания легких. Проявлениями заболевания могут являться одышка, непродуктивный кашель и ухудшение общего самочувствия (слабость, снижение веса и лихорадка). При подозрении на интерстициальное заболевание легких следует прекратить терапию ингибиторами ГМГ-КоА-редуктазы. Сахарный диабет II типа Некоторые данные подтверждают то, что ингибиторы ГМГ-КоА-редуктазы повышают концентрацию глюкозы в крови и увеличивают у некоторых пациентов вероятность развития сахарного диабета II типа. Однако данный риск перевешивается способностью ингибиторов ГМГ-КоА-редуктазы снижать риск развития сосудистых осложнений, поэтому данный факт не является причиной для прерывания лечения розувастатином. Необходимо установить клиническое наблюдение и проводить биохимический анализ крови согласно национальным стандартам у пациентов с риском развития гипергликемии (концентрация глюкозы в крови 5,6-6,9 ммоль/л, индекс массы тела >: 30 кг/м 2, триглицеридемия, артериальная гипертензия). В одном из исследований розувастатина сообщалась общая частота развития сахарного диабета: 2,8% в группе розувастатина и 2,3% в плацебо группе в основном у пациентов с глюкозой натощак 5,6 - 6,9 ммоль/л. Непереносимость лактозы Препарат Розарт не следует принимать пациентам с непереносимостью лактозы, дефицитом лактазы и глюкозно-галактозной мальабсорбцией, поскольку в его состав входит лактозы моногидрат. Влияние на способность управлять транспортными средствами: Не проводилось исследований по изучению влияния розувастатина на способность управлять транспортными средствами и механизмами. При управлении транспортными средствами и занятии потенциально опасными видами деятельности пациентам следует соблюдать осторожность, так как во время терапии может возникать головокружение. Условия хранения и отпуска из аптек Условия хранения:При температуре не выше 30 °С. Хранить в недоступном для детей месте! Отпуск из аптек: По рецепту Регистрационные данные Торговое название Розарт Международное непатентованное название:Розувастатин. Форма выпуска:таблетки, покрытые плёночной оболочкой. Состав:1 таблетка, покрытая плёночной оболочкой, 5 мг содержит: активное вещество: розувастатин 5,00 мг (в виде розувастатина кальция 5,21 мг): вспомогательные вещества: целлюлоза микрокристаллическая, тип 102 11,55 мг, кросповидон, тип А 3,5 мг, кальция гидрофосфата дигидрат 17,15 мг, лактозы моногидрат 31,71 мг, магния стеарат 0,88 мг: плёночное покрытие: Опадрай белый II 33G28435 ~ 2,1 мг (гипромеллоза-2910 0,84 мг, титана диоксид 0,525 мг, лактозы моногидрат 0,441 мг, макрогол-3350 0,168 мг, триацетин 0,126 мг). 1 таблетка, покрытая плёночной оболочкой, 10 мг содержит: активное вещество: розувастатин 10 мг (в виде розувастатина кальция 10,42 мг): вспомогательные вещества: целлюлоза микрокристаллическая, тип 102 23,1 мг, кросповидон, тип А 7 мг, кальция гидрофосфата дигидрат 34,3 мг, лактозы моногидрат 63,42 мг, магния стеарат 1,76 мг: плёночное покрытие: Опадрай розовый II 33G240007 ~ 4,2 мг (гипромеллоза-2910 1,68 мг, титана диоксид 1,0441 мг, лактозы моногидрат 0,882 мг, макрогол-3350 0,336 мг, триацетин 0,252 мг, краситель кармин красный 0,0059 мг). 1 таблетка, покрытая плёночной оболочкой, 20 мг содержит: активное вещество: розувастатин 20 мг (в виде розувастатина кальция - 20,84 мг): вспомогательные вещества: целлюлоза микрокристаллическая, тип 102 46,2 мг, кросповидон, тип А 14 мг, кальция гидрофосфата дигидрат 68,6 мг, лактозы моногидрат 126,84 мг, магния стеарат 3,52 мг: плёночное покрытие: Опадрай розовый II 33G240007 ~ 8,4 мг (гипромеллоза-2910 3,36 мг, титана диоксид 2,0882 мг, лактозы моногидрат 1,764 мг, макрогол-3350 0,672 мг, триацетин 0,504 мг, краситель кармин красный 0,0118 мг). 1 таблетка, покрытая плёночной оболочкой, 40 мг содержит: активное вещество: розувастатин 40 мг (в виде розувастатина кальция 41,68 мг): вспомогательные вещества: целлюлоза микрокристаллическая, тип 102 92,4 мг, кросповидон, тип А 28 мг, кальция гидрофосфата дигидрат 137,2 мг, лактозы моногидрат 253,68 мг, магния стеарат 7,04 мг: плёночное покрытие: Опадрай розовый II 33G240007 ~ 16,8 мг (гипромеллоза-2910 6,72 мг, титана диоксид 4,1765 мг, лактозы моногидрат 3,528 мг, макрогол-3350 1,344 мг, триацетин 1,008 мг, краситель кармин красный 0,0235 мг). АТХ: Регистрация: Лекарственное средство ЛП-002213 Фармгруппа: Гиполипидемическое средство - ГМГ-КоА редуктазы ингибитор. Дата регистрации: 02.09.2013 / 07.03.2017. Окончание регстрации: . Описание:Таблетки 5 мг Круглые, двояковыпуклые таблетки, покрытые плёночной оболочкой белого цвета с гравировкой "ST 1" на одной стороне таблетки. Таблетки 10 мг Круглые, двояковыпуклые таблетки, покрытые плёночной оболочкой розового цвета с гравировкой "ST 2" на одной стороне таблетки. Таблетки 20 мг Круглые, двояковыпуклые таблетки, покрытые плёночной оболочкой розового цвета с гравировкой "ST 3" на одной стороне таблетки. Таблетки 40 мг. Овальные, двояковыпуклые таблетки, покрытые плёночной оболочкой розового цвета с гравировкой "ST 4" на одной стороне таблетки. Упаковка:Таблетки, покрытые плёночной оболочкой, 5 мг, 10 мг, 20 мг и 40 мг. По 7, 10 или 14 таблеток в блистер ПВХ/ПВДХ/Алюминиевая фольга или в блистер Алюминиевая фольга/Алюминиевая фольга. По 4 блистера по 7 таблеток, по 3 или 9 блистеров по 10 таблеток и по 2 или 6 блистеров по 14 таблеток с инструкцией по применению в картонную пачку. Срок годности:2 года. Не применять по истечении срока годности. Владелец рег.удостоверения:Актавис Групп ПТС ехф Производитель:ACTAVIS, Ltd. Представительство:Актавис, ООО
Модель:
RUR 0
Показания Симптоматическое лечение ревматоидного артрита, остеоартроза, анкилозирующего спондилита. Купирование воспаления и болевого синдрома при люмбаго, зубной боли, плечелопаточном периартрите, ревматическом поражении мягких тканей. Препарат предназначен для симптоматической терапии, уменьшения боли и воспаления на момент использовании, на прогрессирование заболевания не влияет. Противопоказания Противопоказания - Эрозивно-язвенные поражения желудочно-кишечного тракта в фазе обострения, желудочно-кишечное кровотечение или подозрение на него: - полное или неполное сочетание бронхиальной астмы, рецидивирующего полипоза носа и околоносовых пазух и непереносимости ацетилсалициловой кислоты или др. нестероидных противовоспалительных препаратов (в т.ч. в анамнезе): - повышенная чувствительность к ацеклофенаку или компонентам препарата: - период после проведения аортокоронарного шунтирования: - выраженная печеночная недостаточность или активное заболевание печени: - выраженная почечная недостаточность (клиренс креатинина менее 30 мл/.мин), прогрессирующие заболевания почек, гиперкалиемия: - воспалительные заболевания кишечника (болезнь Крона, язвенный колит) в фазе обострения: - декомпенсированная сердечная недостаточность: - нарушения кроветворения и коагуляции: - беременность и период грудного вскармливания: - дефицит лактозы, непереносимость лактозы, глюкозо-галактозная мальабсорбция: - детский возраст до 18 лет. С осторожностью: Заболевания печени, почек и желудочно-кишечного тракта в анамнезе, бронхиальная астма, артериальная гипертензия, снижение объема циркулирующей крови (в т.ч. после оперативных вмешательств), ишемическая болезнь сердца, хроническая почечная недостаточность легкой и средней степени тяжести (КК от 30 до 60 мл/мин), печеночная недостаточность легкой и средней степени тяжести, хроническая сердечная недостаточность, цереброваскулярные заболевания, дислипидемия/гиперлипидемия. сахарный диабет, заболевания периферических артерий, курение, пожилой возраст, длительное использование НПВП в анамнезе, наличие инфекции Helicobacter pylori, частое употребление алкоголя, сопутствующая терапия следующими препаратами: - антикоагулянты (например, варфарин): - антиагреганты (например, ацетилсалициловая кислота, клопидогрел): - пероральные глюкокортикостероиды (например, преднизолон): - селективные ингибиторы обратного захвата серотонина (например, циталопрам, флуоксетин, пароксетин, сертралин). Беременность Применение препарата при беременности и в период грудного вскармливания противопоказано. Применение и дозы Препарат следует принимать в минимально эффективной дозе, в течение как можно более короткого периода времени. Внутрь. Таблетки проглатывают целиком, запивая достаточным количеством жидкости. Доза препарата по всем показаниям: Взрослым назначают по 100 мг 2 раза в сутки, 1 таблетка утром, и 1 - вечером. Курс лечения назначается врачом индивидуально. Печеночная недостаточность. Пациентам с печеночной недостаточностью средней степени тяжести необходимо снижать дозу ацеклофенака. Рекомендуемая первоначальная доза составляет 100 мг ежедневно. Почечная недостаточность Нет доказательств, что дозу ацеклофенака необходимо снижать больным с почечной недостаточностью легкой степени тяжести, но рекомендуется прием с осторожностью. Побочные эффекты и передозировка Побочные эффекты: Наиболее часто выявляемые в ходе клинических исследований побочные реакции были со стороны желудочно-кишечного тракта (диспепсия - 7,5 %: боли в животе - 6,2 %: тошнота - 1,5 %: диарея - 1,5 %): иногда - головокружение. Также отмечались зуд, сыпь и изменения активности "печеночных" ферментов и концентрации креатинина крови. Нежелательные эффекты, перечисленные ниже, представлены по системно-органным классам в соответствии с классификацией MedDRA со следующей частотой: часто: 1/100 до <:1/10: нечасто: 1/1000 до <:1/100: редко: 1/10000 до <:1/1000: очень редко: <:1/10000. Аллергические реакции: кожная сыпь, крапивница, экзема, эритродермия, системные анафилактоидные реакции, бронхиальная астма, в отдельных случаях - васкулит, пневмонит, полиморфная экссудативная эритема (в т.ч. синдром Стивенса-Джонсона), токсический эпидермальный некролиз (синдром Лайелла). Со стороны иммунной системы: редко - анафилактическая реакция (включая шок), гиперчувствительность. Со стороны желудочно-кишечного тракта: часто - диспепсия, боли в животе, тошнота, диарея: нечасто - метеоризм, гастрит, запор, рвота, изъязвление слизистой оболочки полости рта: редко - мелена, изъязвление желудочно-кишечного тракта, диарея с кровью, желудочно-кишечное кровотечение: очень редко - стоматит, рвота кровью, язва желудка, перфорация тонкой кишки, ухудшение течения болезни Крона и язвенного колита, панкреатит. Со стороны сердечно-сосудистой системы: редко - сердечная недостаточность, повышение артериального давления: очень редко - тахикардия, "приливы", васкулит. Со стороны печени и желчевыводящих путей: часто - увеличение активности "печеночных" ферментов: очень редко - повреждение печени (включая гепатит), увеличение активности щелочной фосфатазы крови. Со стороны нервной системы: часто - головокружение: очень редко - парестезии, тремор, сонливость, головная боль, повышенная утомляемость, дисгевзия. Нарушения психики: очень редко - депрессия, нетипичные сновидения, бессонница. Со стороны кожи и подкожной клетчатки: нечасто - зуд, сыпь, дерматит, уртикарная сыпь: редко - ангионевротический отек: очень редко - пурпура, реакции со стороны кожи и слизистых оболочек, буллезные кожные реакции. Со стороны органов кроветворения: тромбоцитопения, лейкопения, агранулоцитоз, гемолитическая анемия, апластическая анемия. Со стороны крови и лимфатической системы: редко - анемия: очень редко - угнетение костного мозга, гранулоцитопения, нейтропения, гемолитическая анемия. Со стороны почек и мочевыводящих путей: нечасто - повышение концентрации мочевины крови, повышение концентрации креатинина крови: очень редко - интерстициальный нефрит, нефротический синдром, почечная недостаточность. Со стороны дыхательной системы, органов грудной клетки и средостения: редко - одышка: очень редко - бронхоспазм. Со стороны органа зрения: редко - нарушения зрения. Со стороны органа слуха и лабиринта: очень редко - вертиго, звон в ушах. Со стороны обмена веществ и питания: очень редко - гиперкалиемия, увеличение массы тела. Системные нарушения: очень редко - спазмы мышц нижних конечностей. Передозировка: Симптомы: головокружение, головная боль, гипервентиляция легких с повышенной судорожной готовностью, тошнота, рвота, боли в области живота. Лечение: промывание желудка, введение активированного угля, симптоматическая терапия. Специфического антидота нет. Форсированный диурез, гемодиализ, переливание крови мало эффективны. Взаимодействие с другими ЛС: Исследования лекарственных взаимодействий не проводились, за исключением варфарина. Ацеклофенак метаболизируется системой цитохрома Р450 - CYP2C9, и данные in vitro указывают на то, что ацеклофенак может являться ингибитором данного энзима. Поэтому возможен риск фармакокинетического взаимодействия с фенитоином, циметидином, толбутамидом, фенилбутазоном, амиодароном, миконазолом и сульфафеназолом. Как и в случае других НПВП, существует риск фармакокинетического взаимодействия с лекарственными средствами, метаболизм которых протекает в печени, такими как метотрексат и препараты лития. Ацеклофенак почти полностью связывается с белками плазмы, и, следовательно, необходимо учитывать возможность замещения другими препаратами, в сильной степени связывающимися с белками плазмы. Ввиду отсутствия исследований фармакокинетического взаимодействия, следующие сведения основываются на информации, полученной но другим НПВП: Следует избегать следующих сочетаний НПВП подавляют тубулярную секрецию метотрексата, и при этом также может наблюдаться метаболическое взаимодействие, приводящее к снижению клиренса метотрексата. Поэтому во время лечения большими дозами метотрексата (более 20 мг/неделю) всегда следует избегать назначения НПВП. Некоторые НПВП подавляют выведение лития почками, что приводит к повышенным концентрациям лития в сыворотке крови. Следует не допускать данное сочетание, если нельзя проводить частый контроль концентрации лития в сыворотке крови. НПВП подавляют агрегацию тромбоцитов и повреждают слизистую оболочку желудочно-кишечного тракта, что может повысить активность антикоагулянтов и увеличить риск кровотечений из слизистой оболочки желудочно-кишечного тракта у пациентов, принимающих антикоагулянты. Следует избегать сочетания ацеклофенака с пероральными антикоагулянтами группы кумарина, тиклопидином, тромболитиками и гепарином при отсутствии тщательного контроля. При следующих сочетаниях может потребоваться коррекция дозы и соблюдение мер предосторожности: Необходимо учитывать возможное взаимодействие НПВП и метотрексата, особенно больным с почечной недостаточностью. При приеме обоих препаратов необходим контроль функции почек. Следует принимать меры предосторожности при одновременном приеме НПВП и метотрексата в течение 24 ч, т.к. концентрация метотрексата может увеличиться, приводя к повышенной токсичности метотрексата. Предполагается, что прием НПВП вместе с циклоспорином или такролимусом увеличивает риск нефротоксичности ввиду снижения синтеза простациклина в почках. Поэтому при одновременном приеме препаратов важно контролировать функцию почек. Одновременный прием ацетилсалициловой кислоты и других НПВП может увеличить частоту развития побочных реакций, и, следовательно, требуется осторожность при их совместном приеме. НПВП могут снижать мочегонное действие фуросемида, буметанида и гипотензивное действие тиазидных диуретиков. Одновременное лечение калийсберегающими диуретиками может быть связано с повышением концентрации калия в сыворотке крови, поэтому необходим контроль содержания калия в крови. НПВП также могут снижать действие некоторых гипотензивных лекарственных препаратов. Ингибиторы ангиотензинпревращающего фермента или антагонисты рецепторов ангиотензина II в сочетании с НПВП могуч приводить к возникновению почечной недостаточности. Риск развития острой почечной недостаточности, которая обычно носит обратимый характер, может увеличиваться у некоторых пациентов с нарушением функции ночек, например у пожилых пациентов или пациентов, испытывающих дефицит жидкости. Поэтому сочетание таких препаратов с НПВП должно применяться с осторожностью, пациенты должны получать достаточное количество жидкости с пищей, и следует проводить контроль функции почек. Не было выявлено влияние ацеклофенака на артериальное давление, когда он принимался одновременно с бендрофлуметиазидом, хотя нельзя исключить взаимодействие с другими гипотензивными препаратами, такими как бета-адреноблокаторы. Другие возможные взаимодействия Сообщалось об отдельных случаях гипогликемии и гипергликемии. Поэтому для ацеклофенака необходимо корректировать дозу препаратов, вызывающих гипогликемию. При одновременном применении с препаратом Ацеклофенак: - дигоксина, фенитоина или препаратов лития - может повышаться концентрация в плазме этих лекарственных средств- диуретиков и гипотензивных средств - может ослабляться действие этих лекарственных средств- калийсберегающих диуретиков - может приводить к развитию гипергликемии и гиперкалиемии: - других НПВП или глюкокортикостероидов - повышается риск возникновения побочных явлений со стороны желудочно-кишечного тракта: - селективных ингибиторов обратного захвата серотонина (циталопрам, флуоксетин, пароксетин, сертралин) - повышается риск развития желудочно-кишечных кровотечений: - циклоспорина - может повышаться токсическое воздействие последнего на почки: - гипогликемических средств - может вызвать как гипо, так и гипергликемию. При этой комбит 1ации средств необходим контроль содержания сахара в крови: - ацетилсалициловой кислоты - снижается концентрация ацеклофенака в крови: - антиагрегантов и антикоагулянтов - повышается риск кровотечений (необходим регулярный контроль показателей свертываемости крови): - зидовудина - повышается риск гематологической токсичности. Фармакологическое действие и фармакокинетика Ацеклофенак является производным фенилуксусной кислоты, ингибирует циклооксигеназу I и II типов. Обладает противовоспалительным, обезболивающим и жаропонижающим действием. Угнетает синтез простагландинов и, таким образом, влияет на патогенез воспаления, возникновения боли и лихорадки. При ревматических заболеваниях противовоспалительное и анальгезирующее действие ацеклофенака способствует значительному уменьшению выраженности боли, утренней скованности, припухлости суставов, что улучшает функциональное состояние пациента. Фармакокинетика: Ацеклофенак быстро и полностью всасывается после приема внутрь. Время достижения максимальной концентрации - 1,25-3 ч. Проникает в синовиальную жидкость, где его концентрация достигает 57 % от уровня концентрации в плазме и время достижения максимальной концентрации на 2-4 ч позже, чем в плазме. Объем распределения - 25 л. Связь c белками плазмы (альбуминами) - 99 %. Ацеклофенак циркулирует главным образом в неизмененном виде, основным его метаболитом является 4'- гидроксиацеклофенак. Период полувыведения - 4 ч. Выводится почками, преимущественно в виде гидроксипроизводных (около 2/3 введенной дозы). Особые указания Выраженность побочных реакций можно скорректировать путем снижения эффективной однократной дозы, необходимой для контроля симптомов. Пациентам с артериальной гипертензией и/или хронической сердечной недостаточностью I-II функционального класса по NYMA в анамнезе требуется надлежащий контроль и консультации врача, т.к. сообщалось о задержке жидкости и отеках при лечении НПВП. Данные клинических и эпидемиологических исследований дают основание предполагать, что использование некоторых НПВП (особенно в больших дозах и при длительном приеме) может увеличивать риск тромбозов артерий (например, инфаркт миокарда или инсульт). Нет достаточных данных, позволяющих исключить такой риск для ацеклофенака. Пациенты с неконтролируемой артериальной гипертензией, застойной сердечной недостаточностью, ишемической болезнью сердца, патологией периферических артерий и/или цереброваскулярными заболеваниями должны принимать ацеклофенак только после тщательного анализа клинической ситуации. С такой же осторожностью нужно принимать решение перед началом длительного лечения пациентов с риском сердечно-сосудистого заболевания (например, с артериальной гипертензией, гиперлипидемией, сахарным диабетом и курящих). Ацеклофенак необходимо принимать с осторожностью и под пристальным медицинским контролем пациентам, с заболеваниями желудочно-кишечного тракта, пептической язвой в анамнезе, после острого нарушения мозгового кровообращения, системной красной волчанкой, порфирией, нарушениями со стороны системы кроветворения и нарушениями свертываемости крови. Ацеклофенак может вызывать обратимое угнетение агрегации тромбоцитов. Пациентам с болезнью Крона, язвенным колитом препарат назначать не рекомендуется. Необходимо проявлять осторожность пациентам с печеночной, почечной, сердечной недостаточностью, а также пациентам с другими заболеваниями, предрасположенными к развитию отеков. Прием НПВП этой категорией пациентов может привести к ухудшению почечной экскреции и возникновению отеков. Пациентам, принимающим мочегонные препараты, или с повышенным риском развития гиповолемии, также необходимо проявлять осторожность при приеме препарата Ацеклофенак. Необходимо проявлять осторожность пожилым пациентам, т.к. у них чаще наблюдаются побочные явления. Кровотечения из желудочно-кишечного тракта и/или прободение могут быть во время лечения, особенно если в анамнезе есть заболевания желудочно-кишечного тракта. Кроме того, у пожилых пациентов больше вероятность возникновения нарушения работы печени, почек, сердечно-сосудистой системы. Всем пациентам, получающим длительное лечение НПВП, необходим мониторинг с целью снижения риска развития побочных реакций (например, общий анализ мочи, общий и биохимический анализ крови). Одновременный прием препарата Ацеклофенак с любым лекарственным препаратом, подавляющим синтез циклооксигеназы/простагландина, может снизить фертильность и не рекомендуется женщинам, планирующим беременность. Женщинам с бесплодием в анамнезе следует прекратить прием препарата Ацеклофенак. Влияние на способность управлять транспортными средствами: В период лечения необходимо соблюдать осторожность при управлении транспортными средствами и занятии другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций. Условия хранения и отпуска из аптек Условия хранения:В защищенном от света месте при температуре не выше 25 °С. Хранить в местах, недоступных для детей. Отпуск из аптек: По рецепту Регистрационные данные Торговое название Ацеклофенак Международное непатентованное название:Ацеклофенак. Форма выпуска:таблетки покрытые пленочной оболочкой. Состав:Состав на одну таблетку: ТАБЛИЦЪ АТХ: Регистрация: Лекарственное средство ЛП-002871 Фармгруппа: Нестероидный противовоспалительный препарат (НПВП)Дата регистрации: 24.02.2015 / 05.11.2015. Окончание регстрации: . Описание:Круглые таблетки двояковыпуклой формы, покрытые плёночной оболочкой белого или почти белого цвета. На поперечном разрезе - ядро белого или почти белого цвета. Упаковка:Таблетки, покрытые плёночной оболочкой 100 мг. По 10, 20 таблеток помещают в контурную ячейковую упаковку из пленки поливинилхлоридной и фольги алюминиевой печатной лакированной. По 10, 20, 30, 40, 60, 90, 100, 200 таблеток помещают в банки полимерные. При отсутствии уплотнителя пробки свободное пространство в банке заполняют ватой медицинской гигроскопической или амортизатором. Каждую банку, 1, 2, 3, 4, 6, 9, 10 контурных ячейковых упаковок вместе с инструкцией по применению помещают в пачку из картона. Срок годности:3 года. Не использовать по истечении срока годности, указанного на упаковке. Владелец рег.удостоверения:ВЕЛФАРМ, ООО Производитель:СИНТЕЗ, ОАО. Представительство

Модель:
RUR 5420
Эксфолиация ороговевших клеток - обязательный этап в алгоритме ухода за кожей и залог его результативности. Энзимный пилинг-гель гель Enzyme Peel оптимально подходит для этих целей. В состав Skin Refining Enzyme Peel входит полученный биотехнологическим путем субтилизин. Этот фермент стабилизирован специальным запатентованным процессом (кристаллизация и упаковка). Поэтому он остается неактивным в увлажняющей основе геля. На поверхности кожи фермент активизируется: он растворяет связи между ороговевшими клетками подобно собственным ферментам кожи, тем самым фактически имитируя естественный метаболический процесс. Биохимический способ эксфолиации стимулирует регенерацию клеток, способствуя быстрому обновлению, выравниванию микрорельефа кожи и разглаживанию морщин. Ферментативный эксфолиант без абразивных частиц разглаживает, обновляет кожу; очищает и освежает; улучшает цвет лица; быстро впитывается; идеально подготавливает кожу к интенсивному уходу

Модель:
RUR 899
Скраб-сорбет для тела Health&Beauty деликатно очищает кожу, делает ее гладкой и идеально ровной. Входящая в состав грязь Мертвого моря содержит особый биохимический состав, который повышает тонус, выводит лишнюю жидкость, отшелушивает омертвевшие клетки, обеспечивает лифтинг-эффект и улучшает текстуру кожи. Формула на основе ароматических масел-антиоксидантов (миндаля, кокоса, авокадо, арганы, жожоба, ромашки) и витамина Е ускоряет кислородный обмен и восстанавливает тонус кожи, делая ее шелковистой и подтянутой. Все мечты о совершенстве тела в одной баночке!
